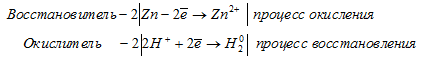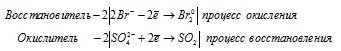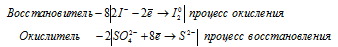Вычисление эквивалентной массы серной кислоты в химических реакциях
Задача 641.
Вычислить эквивалентную массу H2SO4 в следующих‚реакциях:
а) Zn + H2SO4(разб.) = ZnSO4 + H2;
б) 2HBr + H2SO4(конц.) = Br2 + SO2 + 2H2O;
в) HI + H2SO4(конц.) = 2I2 + H2S + 4H2O.
Решение:
M(H2SO4) = 98,66 г/моль.
а) Zn + H2SO4(разб.) = ZnSO4 + H2
Ионно-молекулярные уравнения процесса окисления-восстановления:
В данной реакции в процессе восстановления участвовало 2 электрона от молекулы H2SO4, значит, fЭ(H2SO4) = 1/2.
Тогда
МЭ(H2SO4) = М(H2SO4)/2 = 98,66/2 = 49,33 г/моль.
б) 2HBr + H2SO4(конц.) = Br2 + SO2 + 2H2O
Ионно-молекулярные уравнения процесса окисления-восстановления:
В данной реакции в процессе восстановления участвовало 2 электрона от молекулы H2SO4, значит, fЭ(H2SO4) = 1/2.
Тогда
МЭ(H2SO4) = М(H2SO4)/2 = 98,66/2 = 49,33 г/моль.
в) HI + H2SO4(конц.) = 2I2 + H2S + 4H2O
Ионно-молекулярные уравнения процесса окисления-восстановления:
В данной реакции в процессе восстановления участвовало 8 электрона от молекулы H2SO4, значит, fЭ(H2SO4) = 1/8.
Тогда
МЭ(H2SO4) = М(H2SO4)/8 = 98,66/8 = 12,3325 г/моль.
Задача 642.
Вычислить эквивалентные массы следующих восстановителей: хлорида олова (II); фосфора, если он окисляется до Н3РО4 и пероксида водорода, окисляющегося до молекулярного кислорода.
Решение:
М(SnCl2) = 189,596г/моль; M(P) = 30,973г/моль; M(H2O2) = 34г/моль.
а) Уравнение электронного баланса окисления олова (II):
Sn2+ – 2
Из уравнения следует, что атом олова в молекуле хлорида олова (II) окисляясь отдаёт 2 электрона, значит, fЭ(SnCl2) = 1/2.
Тогда эквивалентная масса хлорида олова (II) равна:
МЭ(SnCl2) = М(SnCl2)/2 = 189,596/2 = 94,798г/моль.
б) Уравнение электронного баланса окисления Р:
P0 – 5
Из уравнения следует, что атом фосфора окисляясь отдаёт 5 электронов, значит, fЭ(Р) = 1/5.
Тогда эквивалентная масса фосфора равна:
МЭ(Р) = М(Р)/5 = 30,973/5 = 6,195г/моль.
в) Уравнение электронного баланса окисления пероксида водорода:
2H2O2 -4

Из уравнения следует, что каждый атом кислорода в молекуле пероксида водорода окисляясь, отдаёт 1 электрон, т.е. молекула Н2О2 как восстановитель отдаёт 2 электрона, значит, fЭ(Н2О2) = 1/2.
Тогда эквивалентная масса Н2О2 равна:
МЭ(Н2О2) = М(Н2О2)/2 = 34/2 = 17г/моль.
Ученик
(149),
на голосовании
12 лет назад
Голосование за лучший ответ
Владимир Рогозин
Мудрец
(11728)
12 лет назад
Чтобы определить грамм-эквивалент кислоты необходимо молярную массу этой кислоты разделить на ее основность. Основность к-ты определяется количеством атомов водорода, входящих в состав к-ты.
М (H2SO4)=98г/моль
грамм-экв=98/2=49
При взаимодействии серной кислоты (H2SO4) со щелочью образуются соли гидросульфат калия (KHSO4) и сульфат калия (K2SO4). Вычислить эквивалент и молярные массы эквивалентов кислоты для каждого случая. Написать соответствующие уравнения реакций.
Решение задачи
Запишем уравнения реакций:
Фактор эквивалентности (fэкв) (эквивалент) – число, показывающее какая доля частицы (атома, молекулы) этого вещества равноценна одному иону водорода (H+) в реакциях обмена или одному электрону в окислительно-восстановительных реакциях.
Таким образом, эквивалент серной кислоты (H2SO4) в первой реакции равен 1 (f экв. (H2SO4) = 1), а во второй реакции эквивалент серной кислоты (H2SO4) равен 1/2 (f экв. (H2SO4) = 1/2).
Учитывая, что молярная масса серной кислоты (H2SO4) равна 98 г/моль, рассчитаем молярную массу эквивалента:
Напомню то, что молярная масса эквивалента – это масса одного моль эквивалента вещества, равная произведению фактора эквивалентности на молярную массу вещества.
Получаем:
Ответ:
эквивалент равен 1 и 1/2, молярные массы эквивалентов серной кислоты равны 98 г/моль и 49 г/моль.
Закон эквивалентов
Количественный подход к
изучению химических явлений и установление
закона постоянства состава показали,
что вещества вступают во взаимодействие
в определенных соотношениях масс, что
привело к введению такого важного
понятия, как “эквивалент”,
и установлению закона
эквивалентов.
Эквивалент
–
это
частица или часть частицы, которая
соединяется (взаимодействует) с одним
атомом водорода или с одним электроном.
Из
этого определения видно, что понятие
“эквивалент” относится к конкретной
химической реакции; если его относят к
атому в химическом соединении, то имеют
в виду реакцию образования этого
соединения из соответствующего простого
вещества и называют эквивалентом
элемента в соединении.
В
одной формульной единице вещества (В)
может содержаться Zв
эквивалентов этого вещества. Число Zв
называют показателем
эквивалентности.
Фактор
эквивалентности (f)
–
доля частицы, составляющая эквивалент;
f
£
1 и может быть равным 1, 1/2, 1/3 и т.д.
fВ
=
. (1.7)
Масса
1 моль эквивалентов, выраженная в граммах,
называется молярной
эквивалентной массой (Мэк)
(г/моль); численно она равна относительной
молекулярной массе эквивалента (кратко
ее называют эквивалентной массой).
Мэк
=
fВ·М. (1.8)
Закон
эквивалентов: массы
взаимодействующих без остатка веществ
соотносятся как их эквивалентные массы.
Математическое выражение закона
эквивалентов:
, (1.9)
где Мэк,1
и Мэк,2
–
эквивалентные массы.
Пример
8. Определить эквивалент
и эквивалентную массу кислорода в Н2О.
Решение.
Такая формулировка вопроса предполагает
реакцию образования молекулы воды из
кислорода и водорода:
H2
+ ½O2
= Н2О,
то есть с 1 атомом водорода
соединяется ½
атомов кислорода.
Следовательно, Z(О)
= 2. Масса 1 моль атомов кислорода равна
16 г, отсюда
Мэк(O)
= М (О)·
=
= 8 г/ моль.
Эквиваленты
одних и тех же элементов в различных
химических соединениях могут различаться,
так как величина эквивалента зависит
от характера превращения, претерпеваемого
им. Так, в соединении SO2
эквивалентная масса серы равна 8 г/моль,
что составляет 1/4 от атомной массы, а в
соединении SO3
–
5,3 г/моль, что составляет 1/6 от атомной
массы серы (ZS
= 4 и 6, соответственно). Практический
расчет эквивалентной массы элемента в
соединении ведут по формуле
Мэк
(элемента) = Аэк
=
, (1.10)
где
А –
атомная масса, ω –
степень окисления элемента в данном
соединении. (Ниже будет показано, что
для реакции образования соединения из
простых веществ ZВ
= |ω|).
Например,
ZВ
(Mn) в соединении KMnO4
(ω = +7) составляет 7, а
Мэк
(Mn)
=
=
= 7,85 г/моль; в соединении Mn2O3
(ω = +3) – ZВ
= 3 и
Мэк
(Mn)
=
=
= 18,3 г/моль. (55-
масса 1-го моля атомов марганца или
атомная масса).
Эквивалентная
масса вещества в химических реакциях
имеет различные значения в зависимости
от того, в каком взаимодействии это
вещество участвует. Если во взаимодействии
сложного вещества участвует его известное
количество или известно количество
реагирующих групп, то для расчета
эквивалентных масс можно пользоваться
следующими правилами и формулами.
а)
Вещества друг с другом реагируют
одинаковыми количествами эквивалентов.
Например,
в реакции
2Al
+ 3/2O2
= Al2O3
6
моль эквивалентов Al
реагируют с таким же количеством
кислорода
(ZВ
(Al)
= 3, ZВ
(O)
= 2).
б)
Эквивалентная масса кислоты в реакциях
замещения ионов водорода равна:
М
эк.
кислоты
=
(1.11)
Пример
9. Определить эквивалент
и эквивалентную массу H2SO4
в реакциях:
-
H2SO4
+ KOH
= KHSO4
+ H2O
;
-
H2SO4
+ 2KOH
= K2SO4
+ 2H2O
.
Решение.
В первой реакции
заместился один ион водорода, следовательно,
эквивалент серной кислоты равен 1, ZВ
(H2SO4)
= 1, Мэк(H2SO4)
= М1
= 98 г/моль. Во второй реакции заместились
оба иона водорода, следовательно,
эквивалент серной кислоты равен двум
молям, ZВ
(H2SO4)
= 2, а Mэк
(H2SO4)
= 98·½
= 49 г/моль.
в)
Эквивалентная масса основания в реакции
замещения ионов гидроксила равна:
Мэк.
основания
=
.(1.12)
Пример
10. Определить эквивалент и эквивалентные
массы гидроксида висмута в реакциях:
1)
Bi(OH)3
+ HCl = Bi(OH)2Cl
+ H2O;
2)
Bi(OH)3
+ 3HCl = BiCl3
+ H2O.
Решение.
1)
ZВ
Bi(OH)3
= 1, Mэк Bi(OH)3
= 260 г/моль (т. к. из трех ионов гидроксила
заместился один);
2) ZВ
Bi(OH)3
= 3, a Mэк Bi(OH)3
= 260·= 86,3 г/моль (т. к. из трех ионов ОН–
заместились все три).
г)
Эквивалентная
масса соли в реакциях полного замещения
катиона или аниона равна:
Мэк.
соли
=
или
(1.13)
Мэк
соли
=
.
Так,
ZВ
Al2(SO4)3
= 3∙2 = 6. Однако в реакции эта величина
может быть больше (неполное замещение)
или меньше (комплексообразование). Если,
например, это соединение участвует во
взаимодействии по реакции
Al2(SO4)3
+ 12KOH
= 2K3[Al(OH)6]
+ 3K2SO4
,
то
при этом три аниона с суммарным зарядом
6 замещаются 12 ОН–
ионами, следовательно, 12 эквивалентов
этого вещества должно вступать в реакцию.
Таким образом, ZВ
Al2(SO4)3
=
12, а
Мэк
= М·fВ
= 342/12 = 28,5 г/моль.
д)
Эквивалентная
масса оксида в реакциях полного замещения
равна:
Мэк
оксида
=
.(1.14)
Например,
ZВ
(Fe2O3)
= 3·2 = 6. Мэк
= М(Fe2O3)·fВ
= 160×1/6
= 26,6 г/моль. Однако в реакции
Fe2O3
+ 4HCl
= 2FeOHCl2
+ H2O
ZВ
(Fe2O3)
= 4, Мэк
= М(Fe2O3)∙fВ
= 160×1/4
= 40 г/моль, так как Fe2O3
взаимодействует с четырьмя эквивалентами
HCl (fВ
= 1).
При
решении задач, связанных с газообразными
веществами, целесообразно пользоваться
значением эквивалентного
объема.
Это объем, занимаемый одним молем
эквивалентов газообразного вещества.
Пример
11. Рассчитайте эквивалентные объемы
газообразных водорода и кислорода при
н.у.
Решение.
Для водорода при н.у. этот объем равен
11,2 литров (молярный объем Н2составляет 22,4 л, а так как Мэк(Н)
= 1г (т.е. в 2 раза меньше, чем молярная
масса), то эквивалентный объем будет в
2 раза меньше молярного, т. е. 11,2 л),для
кислорода – 5,6л (молярный объем О2составляет 22,4 л, а так как Мэк(О)
= 8г (т.е. в 4 раза меньше, чем молярная
масса О2), то эквивалентный
объем будет в 4 раза меньше, чем молярный.
Пример
12.На
восстановление 1,80 г оксида металла
израсходовано 883 мл водорода (н.у.).
Вычислить эквивалентные массы оксида
и металла.
Решение.
Согласно закону эквивалентов (1.9) массы
(объемы) реагирующих веществ пропорциональны
их эквивалентным массам (объемам):
. Отсюда
(г/моль);
+
,
тогда
г/моль.
Пример
13. Вычислить эквивалентную
массу цинка, если 1,168 г Zn вытеснили из
кислоты 438 мл Н2
(t = 17 оС
и Р = 750 мм рт. ст.).
Решение.
Согласно закону эквивалентов (1.9):
;
Из
уравнения Менделеева-Клапейрона
(1.4):
г,
=
32,6 г/моль.
д)
Эквивалентная масса окислителя и
восстановителя определяются
делением молярной массы на изменение
степени окисления в соответствующей
реакции на 1моль.
Пример
14. Определить эквивалентные массы
окислителя и восстановителя в реакции:
+6
+4
+3
+6
K2Cr2O7
+ 3Na2SO3
+ 4H2SO4
= Cr2(SO4)3
+ 3Na2SO4
+ K2SO4
+ 4H2O.
Решение.
Окислителем в этой реакции являетсяK2Cr2O7,
а восстановителем –Na2SO3.
Суммарное изменение степени окисления
хрома вK2Cr2O7Dw(2Cr)
= 2.(+3) – 2.(+6) = – 6;
Поэтому
г/моль.
Суммарное
изменение степени окисления серы в
Na2SO3:Dw(S)
= +6 – (+4) = +2;
Поэтому
г/моль.
Эквивалентом элемента называют такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях HBr, H2O, PH3 эквиваленты брома, кислорода, фосфора соответственно равны 1 моль, 1/ 2 моль, 1/3 моль.
Э к в и в а л е н т о м сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Эквивалентную массу вещества вычисляют, исходя из его
мольной массы. Например, эквивалентные массы KOH, H2SO4, Ca3(PO4)2 соответственно равны 56 г/моль, 49 г/моль, 310 : 6 = 51.7 г/моль.
(попросту молярная масса деленная на валентность)
Если соединение простое, то 2Mg+O2=2MgO
И получается, что эквивалентную массу магния можно получить разделив его молекулярную массу на 2.
М=24,3/2=12,15 г/моль
Вроде так, если в реакции не получаются перекиси.