Ученик
(76),
закрыт
9 лет назад
Анна
Мудрец
(11793)
9 лет назад
Записываем полуреакцию восстановления иона MnO4(-) в кислой среде до иона Mn(2+).
MnO4(-) + 5e + 8H(+) = Mn(+2) + 4H2O
Теперь вспоминаем формулировку химического эквивалента.
Эквивалент химический – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н(+) или один ион ОН(–), а в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
В полуреакции восстановления ион MnO4(-) в кислой среде принял 5 электронов. Значит, эквивалентное число перманганата калия в данной полуреакции восстановления равно 5.
z(KMnO4) = 5
Молярная масса эквивалента KMnO4 при восстановлении до соли марганца (II).
M(1/z KMnO4) = m(KMnO4)/z(KMnO4) = 158/5 = 31,6 г/моль
Вычисление молярных масс эквивалентов окислителей и восстановителей
При
вычисления молярных масс эквивалентов
окислителей и восстановителей исходят
из числа электронов, которые присоединяет
или отдает в данной реакции один моль
вещества. Для нахождения молярной массы
эквивалента окислителя (восстановителя)
нужно его молярную массу разделить на
число принятых (отданных) электронов в
данной полуреакции.
Например,
в реакции окисления сульфата железа
(II)
перманганатом калия в кислой среде:
2
KMnO4
+ 10 FeSO4
+ 8 H2SO4
= 2 MnSO4
+ 5 Fe2(SO4)3
+ K2SO4
+ 8 H2O
1
MnO4–
+ 8 H+
+ 5 e
Mn2+
+ 4 H2O
5
Fe2+
– e
Fe3+
ион
MnO4–
как окислитель принимает пять электронов,
а ион Fe2+
как восстановитель отдает один электрон.
Поэтому для расчета молярных масс
эквивалентов окислителя и восстановителя
их молярные массы следует разделить на
пять и на один, соответственно.
MЭ(KMnO4)
=
![]()
МЭ(FeSO4)
=
![]()
MЭ(Fe2+)
= M(Fe2+)
= 55,85 г/моль
В
реакции окисления сульфита натрия
перманганатом калия в нейтральной
среде:
2
KMnO4
+ 3 Na2SO3
+ H2O
= 2 MnO2
+ 3 Na2SO4
+ 2 KOH
2
MnO4–
+ 2 H2O
+ 3 e
MnO2
+ 4 OH–
3
SO32-
+ 2 OH–
+ 2 e
SO42-
+ H2O
ион
MnO4–
принимает только три электрона, а ион
восстановителя SO32-
отдает два электрона, следовательно:
MЭ(KMnO4)
=
![]()
MЭ(Na2SO3)
=
![]()
Из
приведенных примеров видно, что молярные
массы эквивалентов окислителей и
восстановителей зависят от условий
проведения реакций и определяются
исходя из соответствующих полуреакций.
Перманганатометрия
Метод
основан на окислительно-восстановительных
реакциях, в которых окислителем является
перманганат-ион MnO4–.
Перманганат
калия проявляет окислительные свойства
в кислой, нейтральной и щелочной средах.
Однако его окислительная активность в
кислой среде (Ео
= 1,51 В) гораздо выше, чем в нейтральной
(Ео
= 0,59 В) и щелочной (Ео
= 0,56 В) средах. Поэтому титрование
перманганатом калия проводят в кислых
средах.При восстановлении перманганат-ионов
в кислой среде образуются почти бесцветные
ионы Mn2+,
что позволяет легко фиксировать точку
эквивалентности.
Полуреакция
восстановления иона MnO4–
в кислой среде может быть представлена
следующей полуреакцией:
MnO4–
+ 8 H+
+ 5e
Mn2+
+ 4 H2O
Перманганатометрия
используется не только для количественного
определения восстановителей, но и
окислителей.
Восстановители
обычно определяются методом прямого
титрования
раствором перманганата калия, окислители
– методом обратного
титрования.
В этом случае раствором перманганата
калия оттитровывают избыток восстановителя,
приливаемого к окислителю.
Индикатором
в этом методе
служит сам рабочий раствор – перманганат
калия. Одна избыточная капля КMnO4
окрашивает бесцветный титруемый раствор
в бледно-розовый цвет.
Лабораторная
работа № 6
Стандартизация рабочего раствора перманганата калия kMnO4
Перманганат
калия обычно содержит ряд примесей,
поэтому нельзя считать, что раствор,
приготовленный из навески, имеет точную
концентрацию, т.е. является стандартным.
Кроме того, концентрация перманганата
в растворе понижается из-за его
взаимодействия с органическими веществами
и другими восстановителями, присутствующими
в воде.
Раствор
перманганата калия должен храниться в
склянке из темного стекла, так как под
действием света происходит разложение
его по реакции:
4
KMnO4
+2 H2O
4 MnO2
+ 4 KOH
+ 3O2
Через
5-7 дней после приготовления раствор
перманганата калия отфильтровывают
через стеклянный фильтр и проводят его
стандартизацию.
Молярную
концентрацию эквивалента раствора
перманганата калия обычно устанавливают
по стандартному раствору перекристаллизованного
кристаллогидрата щавелевой кислоты
Н2С2О4.
2Н2О.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
АХ
Алексей Хатаженков
Записываем полуреакцию восстановления иона MnO4(-) в кислой среде до иона Mn(2+).
MnO4(-) + 5e + 8H(+) = Mn(+2) + 4H2O
Теперь вспоминаем формулировку химического эквивалента.
Эквивалент химический – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н(+) или один ион ОН(–), а в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
В полуреакции восстановления ион MnO4(-) в кислой среде принял 5 электронов. Значит, эквивалентное число перманганата калия в данной полуреакции восстановления равно 5.
z(KMnO4) = 5
Молярная масса эквивалента KMnO4 при восстановлении до соли марганца (II).
M(1/z KMnO4) = m(KMnO4)/z(KMnO4) = 158/5 = 31,6 г/моль
Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.

Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:

Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.

В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.

А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.

Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.

Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:

Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:

Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.

Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.

Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:

В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:

И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.

В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:

В другой реакции гидроксида калия и фосфорной кислоты:

Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:

И в третьем случае:

Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:

Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:

Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
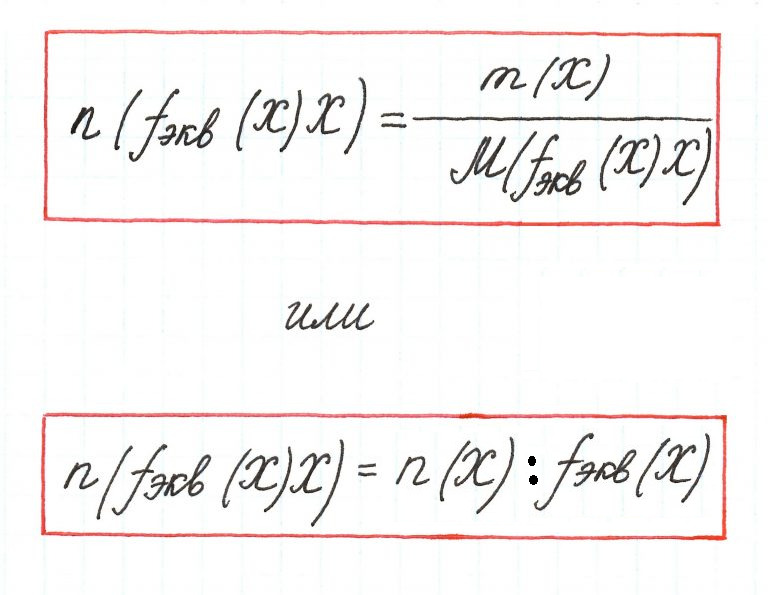
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.

Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?

Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?

Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:

Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.

Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:

У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:

Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:

Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:

Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:

Например:

Для оснований:

Например:

Для кислот:

Например:

Для солей:

Например:

Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Refer to the definition of equivalent (IUPAC Gold Book):
equivalent entity
Entity corresponding to the transfer of a $ce{H+}$ ion in a neutralization reaction, of an electron in a redox reaction, or to a magnitude of charge number equal to 1 in ions.
In other words, $pu{1 equiv}$ is the amount of substance reacting with $pu{1 mol}$ of hydrogen atom.
If hydrogen acts as a reducing or oxidizing agent, then either way $pu{1 mol}$ of hydrogen atoms liberates or accepts $pu{1 mol}$ of electrons:
$$
begin{align}
ce{0.5 H2 &→ H+ + e-}\
ce{0.5 H2 + e- &→ H-}
end{align}
$$
That’s why an equivalent of a redox agent is its amount which liberates or accepts $pu{1 mol}$ of electrons upon being oxidized or reduced, respectively, assuming electrons don’t exist in solution on its own for a significant period of time.
Note that $ce{KMnO4}$ participates in redox reaction
$$ce{2Koverset{+7}{Mn}O4 + 16 Hoverset{-1}{Cl} = 2 KCl + 2 overset{+2}{Mn}Cl2 + 8 H2O + 5 overset{0}{Cl}_2}$$
and the half-reaction for the reduction of manganese is
$$ce{overset{+7}{Mn}O4- + 8 H+ + 5 e- → overset{+2}{Mn}^2+ + 4H2O}$$
Also note that $n$-factor of permangante here is not the number of protons $ce{H+}$, which are also used up in water formation; rather it’s the number of transferred electrons, e.g. $n = 5$ and
$$M_mathrm{equiv}(ce{KMnO4}) = frac{M(ce{KMnO4})}{n} = frac{pu{158.03 g mol-1}}{5} = pu{31.61 g mol-1}$$
Obviously, the equivalent mass of permanganate isn’t a constant and depends on the $mathrm{pH}$ of the reaction.
For example, in neutral medium half-reaction appears as
$$ce{overset{+7}{Mn}O4- + 2 H2O + 3 e- → overset{+4}{Mn}O2 + 4 OH-}$$
and there is no explicitly shown protons to count at all!
However, the $n$-factor is $3$, and the equivalent mass of permanganate would be a different value:
$$M_mathrm{equiv}(ce{KMnO4}) = frac{M(ce{KMnO4})}{n} = frac{pu{158.03 g mol-1}}{3} = pu{52.68 g mol-1}$$
