Определение молярной массы эквивалента металла
Цель работы: усвоить
понятия химического эквивалента,
молярной массы эквивалента, закона
эквивалентов; ознакомиться с
экспериментальным определением молярной
массы эквивалента металла методом
вытеснения водорода из кислоты.
Теоретическая часть
Известно,
что количество вещества определяется
числом структурных единиц (атомов,
молекул, ионов) этого вещества и выражается
в молях.
Моль ()– это единица количества вещества,
содержащая столько же структурных
единиц данного вещества, сколько атомов
содержится в 0,012 кг углерода, состоящего
только из изотопа12С.
Молярная
масса (М) вещества
представляет собой отношение массы
вещества (m) к его количеству (),
а значение молярной массы численно
совпадает с относительной молекулярной
массой вещества или относительной
атомной массой элемента, но измеряется
в г/моль.
Эквивалентом
вещества (э),
вступающего в какую-либо реакцию,
называют такое его количество, которое
приходится на единицу валентности
соответствующего элемента при образовании
им соединения.
Химический
эквивалент и молярная масса эквивалента
представляют собой важнейшие характеристики
элементов, простых и сложных веществ,
учитывая то, что согласно закону
эквивалентов
все вещества взаимодействуют между
собой в эквивалентных количествах.
Единицей
химического эквивалента (э),
так же как и количества вещества является
моль,
а молярная
масса эквивалента (Мэ),
соответственно измеряется в г/моль.
Так,
водород в своих соединениях, как правило,
одновалентен, и его эквивалент равен 1
моль Н или 1/2 моль Н2,
а молярная масса его эквивалента Мэ(Н)
= 1 г/моль.
Кислород
в своих соединениях двухвалентен, тогда
его эквивалент равен 1/2 моль О или 1/4
моль О2,
а молярная масса его эквивалента Мэ(О)
= 8 г/моль.
Железо
в своих соединениях может быть и двух-,
и трехвалентным, тогда его эквивалент
в первом случае будет равен 1/2 моль Fe, а
молярная масса эквивалента Мэ(Fe) = 28
г/моль. Эквивалент железа во втором
случае будет равен 1/3 моль Fe, а молярная
масса эквивалента Мэ(Fe) = 18,6 г/моль.
Следовательно, молярную массу эквивалента
простого вещества можно рассчитать по
формуле:
![]() , (1)
, (1)
где М(эл-та)
– молярная масса элемента;
В(эл-та)
– валентность элемента.
Молярные
массы эквивалентов сложных веществ
(оксидов, кислот, оснований, солей)
рассчитываются несколько иначе.
Молярная
масса эквивалента оксида
рассчитывается отношением молярной
массы оксида к произведению числа атомов
элемента на его валентность.
![]() ,
,
где М(оксида)
– молярная масса оксида;
n(эл-та) –
число атомов элемента;
В(эл-та) –
валентность элемента.
Для
оксида железа (Ш), например, молярная
масса его будет равна:
![]()
Молярная масса
эквивалента кислотырассчитывается
отношением молярной массы кислоты к
числу атомов водорода в кислоте, способных
замещаться в химических реакциях.
![]() ,
,
где М
(кислоты) – молярная масса кислоты;
n
(H) – число замещающихся в химической
реакции атомов водорода.
Для серной
кислоты (H2SO4),
например, молярная масса эквивалента
будет равна:
![]()
Молярная
масса эквивалента основания
рассчитывается отношением молярной
массы основания к числу гидроксогрупп.
![]() ,
,
где
М (основания) – молярная масса основания;
n
(OH) – число гидроксогрупп.
Для
гидроксида кальция (Ca(OH)2),
например, молярная масса эквивалента
будет равна:
![]()
Молярная
масса эквивалента соли
рассчитывается отношением молярной
массы соли к произведению числа атомов
металла на их валентность.
![]() ,
,
где М
(соли) – молярная масса соли;
n (Ме) –
число атомов металла;
В (Ме) – валентность
металла.
Для
сульфата натрия (Na2SO4),
например, молярная масса эквивалента
будет равна:
![]()
Из
закона
эквивалентов
следует, что массы вступающих и
образующихся в результате реакции
веществ прямопропорциональны молярным
массам их эквивалентов:
![]() , (2)
, (2)
где
m(1)
и Мэ(1)
– масса и молярная масса эквивалента
первого вещества;
m(2)
и Мэ(2)
– масса и молярная масса эквивалента
второго вещества.
Из
следствия из закона Авогадро вытекает
понятие молярный
объем – объем,
который занимает 1 моль любого газа при
нормальных условиях, т.е. при р = 105
Па (1 атм или 760 мм рт. ст.) и Т = 273 К ( 0о
С). Значение
этого объема равно 22,4 л/моль (22400 мл/моль).
Отсюда можно вывести понятие и молярного
объема эквивалента
газа (или эквивалентного объема) –
объема, занимаемого при нормальных
условиях одним эквивалентом (одной
молярной массой эквивалента) газа.
Известно,
что эквивалент водорода равен 1/2 моль
Н2,
тогда молярный объем эквивалента
водорода Vэ(Н2)
= 11,2 л/моль; соответственно Vэ(О2)
= 5,6 л/моль, т.к. эквивалент кислорода
равен 1/4 моль О2.
Если
же в реакции участвуют газы и известны
их объемы, то соотношение (2) можно
представить следующим образом:
![]() (3)
(3)
где m(1)
и Мэ(1) –
масса и молярная масса эквивалента
первого вещества;
V(2)
и Vэ(2) –
объем и молярный объем эквивалента
второго вещества.
Следует
иметь ввиду, что объемы, входящие в
соотношение (3), нужно приводить
к нормальным условиям
по формуле объединенного закона
Гей-Люссака – Бойля –Мариотта:
![]() ,
,
откуда![]() (4)
(4)
где р,
V, Т –
давление, объем и температура газа при
условиях опыта;
ро,
Vо,
То
– давление, объем и температура газа
при нормальных условиях.
Известны
методы экспериментального определения
молярных масс эквивалентов: 1) метод
прямого определения – молярную массу
эквивалента определяют по данным прямого
синтеза кислородного или водородного
соединения данного элемента; 2)
аналитический метод – производится
точный анализ соединения данного
элемента с любым другим, молярная масса
эквивалента которого известна; 3) метод
вытеснения водорода – используется для
определения молярной массы эквивалента
тех металлов, которые способны вытеснить
водород из разбавленных кислот и щелочей;
4) электрохимический метод – определяется
масса металла, осаждающегося на электроде
при электролизе раствора соли этого
металла. Молярная масса эквивалента
рассчитывается по закону Фарадея: при
прохождении через раствор или расплав
электролита 965000 Кулонов электричества
на электродах выделяется по одному
эквиваленту вещества.
ЭКСПЕРИМЕНТАЛЬНАЯ
ЧАСТЬ
Сущность
экспериментального определения молярной
массы эквивалента металла заключается
в определении объема водорода (приведенного
к нормальным условиям), вытесняемого
из кислоты навеской металла, взятой на
аналитических весах.
Произведением
молярной массы эквивалента металла на
его валентность определяют молярную
массу атома металла.
По
молярной массе атома металла и его
валентности находят местоположение
металла в периодической системе элементов
Д.И.Менделеева, т.е. его название.
По
указанию преподавателя студент взвешивает
на аналитических весах навеску металла
известной валентности.
Прибор
для определения молярной массы эквивалента
изображен на рисунке.
П

еред началом работы прибор следует
проверить на герметичность. Для этого
отсоединяют пробирку А от прибора, через
воронку С заливают водой таким образом,
чтобы уровень воды в бюретке В установился
на нулевом делении или несколько ниже;
избыток воды удалить. Присоединяют
пробирку А на место. Затем поднимают
воронку C вверх и следят за уровнем воды
в бюретке В. Если уровень в последней
непрерывно повышается, то это означает,
что прибор негерметичен и следует
проверить все резиновые соединения.
Если же прибор герметичен, то повышение
уровня воды в бюретке В произойдет
незначительно только в первый момент,
а потом он будет оставаться неизменным.
Убедившись
в герметичности прибора, отсоединяют
пробирку А от прибора и, записав начальный
уровень воды в бюретке В, наливают в
пробирку А 1/4 ее объема соляной кислоты,
приготовленной для определения молярной
массы эквивалента металла соответствующей
валентности.
Держа
пробирку А в положении, близком к
горизонтальному, помещают на сухое
место у отверстия пробирки взвешенный
металл и в таком положении соединяют
пробирку А с бюреткой В, следя за тем,
чтобы металл не упал в кислоту.
Убедившись
вторично
в герметичности прибора путем поднятия
воронки С вверх, стряхивают металл в
кислоту и наблюдают за ходом реакции.
По
окончании реакции (прекращение выделения
пузырьков водорода), устанавливают
уровень воды в бюретке В и воронке С на
одной высоте, перемещая кольцо К с
воронкой С вниз по штативу, и записывают
уровень воды в бюретке В после окончания
опыта. Шкала бюретки В проградуирована
в миллилитрах (мл).
С
помощью барометра определяют величину
атмосферного давления ( ратм ),
термометра – температуру ( t ) воздуха
в помещении (соответственно и температуру
воды в приборе) в момент проведения
опыта.
С
помощью таблицы 1 определяют давление
водяного пара ( рН2Опар ),
соответствующего измеренной температуре
опыта, в мм рт.ст.
Таблица
1
Зависимость
давления водяного пара от температуры
|
t |
15 |
16 |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
25 |
|
рН2Опар |
12,8 |
13,6 |
14,5 |
15,5 |
16,5 |
17,5 |
18,7 |
19,8 |
21,1 |
22,4 |
23,8 |
Порядок расчета
-
Определите
объем выделившегося водорода в результате
опыта. Для этого от значения уровня
воды в бюретке В после окончания опыта
( V2
) следует вычесть значение уровня воды
в бюретке В в начале опыта ( V1
).
V(Н2)
= V2
– V1.
Переведите
значение объема выделившегося в
результате опыта водорода в кубические
дециметры, учитывая, что 1 см3
= 10 –3
дм3.
-
Приведите
экспериментальный объем выделившегося
водорода к нормальным условиям,
воспользовавшись формулой 4. Следует
учесть, что давление внутри бюретки В
складывается из давления водорода и
давления водяного пара внутри объема
бюретки при данной температуре:
ратм
= рН2
+ рН2Опар
, тогда
![]()
![]()
где ратм
– измеренное атмосферное давление во
время проведения опыта;
рН2Опар –
давление водяного пара при температуре
опыта;
V
(Н2) –
экспериментальный объем водорода;
Т
– температура проведения опыта (К),
равная (273+t);
ро,
То
– давление и температура при нормальных
условиях.
-
Вычислите
молярную массу эквивалента металла, с
точностью до 0,1 г/моль, воспользовавшись
формулой 3:
![]()
4. Воспользовавшись
формулой 1, рассчитайте молярную массу
металла и укажите какой это металл.
![]()
Результаты
эксперимента представьте в виде таблицы
2.
Таблица
2
|
масса |
pатм, мм |
t, |
V1,, |
V2, |
V(H2), |
pH2Oпар, мм |
V0(H2), |
Мэ |
М |
5. Вычислите
величины абсолютной и относительной
ошибок (Х).
Абсолютная
ошибка:
Хабс.
= М (Ме)
табличное – М
(Ме)
экпериментальное
Относительная
ошибка:
![]()
Вопросы для
самоконтроля
1. Что
называется эквивалентом вещества?
-
Что
является единицей эквивалента вещества? -
Какую
размерность имеет молярная масса
эквивалента вещества? -
Какие
значения имеют молярные массы эквивалентов
водорода и кислорода? -
Как
можно рассчитать молярную массу
эквивалента элемента? -
Что
такое молярный объем и молярный объем
эквивалента? -
Какие
значения имеют молярные объемы
эквивалентов водорода и кислорода? -
Как
формулируется закон эквивалентов? -
Почему
при выполнении расчетов в экспериментальной
части работы нужно знать давление
водяного пара? -
Какие
Вы знаете методы экспериментального
определения молярной массы эквивалента
металлов?
Задачи
-
Медь
с кислородом образует два соединения,
в которых содержится 79,9 % меди и 20,1 %
кислорода, и 88,8 % меди и 11,2 % кислорода.
Определите молярные массы эквивалентов
меди в этих соединениях и составьте
формулы этих соединений. -
При
сгорании 3 г магния образовалось 5 г
оксида магния. Рассчитайте молярную
массу эквивалента магния. -
При
взаимодействии 2,4 г углерода с кислородом
образовалось 5,6 г оксида. Определите
молярную массу эквивалента углерода
в этом соединении и напишите уравнение
реакции. -
При
взаимодействии 4 г двухвалентного
металла с кислородом образовалось 5,6
г оксида. Определите, какой это металл
и напишите уравнение реакции. -
При
растворении в соляной кислоте 5,4 г
трехвалентного металла выделилось
6,72 л водорода, измеренного при н.у.
Определите, какой это металл и напишите
уравнение реакции. -
При
взаимодействии одновалентного металла
с 0,2 г водорода образовалось 4,8 г гидрида
металла. Определите, какой это металл
и напишите уравнение этой реакции. -
При
окислении 8 г металла, проявляющего
валентность, равную I, получено 9 г
оксида. Определите, какой это металл и
напишите уравнение данной реакции. -
Рассчитайте
объем водорода, выделившегося при
растворении в соляной кислоте 18 г
металла, молярная масса эквивалента
которого равна 9 г/моль. -
При
взаимодействии 0,9 г трехвалентного
металла с серой образовалось 2,5 г
сульфида металла. Определите, какой
это металл, учитывая, что молярная масса
эквивалента серы в этом соединении 16
г/моль. Напишите уравнение соответствующей
реакции. -
При
окислении 6,4 г серы образовалось 16 г
оксида. Определите молярную массу
эквивалента серы в этом соединении и
напишите уравнение соответствующей
реакции.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение объема водорода
Задача № 11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
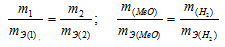
Та как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 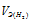 , молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000 мл/моль.
Тогда можно записать:
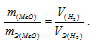
Отсюда:
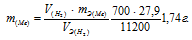
Ответ: 1,74г.
Определение эквивалентной массы вещества
Задача № 12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
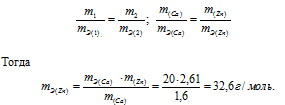
Ответ: 32,6г/моль.
Определение отношения масс реагирующих веществ
Задача № 13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Формула сульфата имеет вид MeSO4, а дигидроортофосфата – MeH2PO4. Таким образом, на образование сульфата затрачивается две эквивалентные массы щёлочи, а на образование дигидроортофосфата – одна эквивалентная масса щёлочи. Так как H2SO4 с двумя эквивалентными массами щёлочи, то её эквивалентная масса в реакции нейтрализации равна М/2 г/моль, а фосфорная кислота реагирует с одной эквивалентной массой щёлочи, то её эквивалентная масса равна М/1г/моль. Отсюда, отношение мас этих кислот, с учётом, что их молекулярные массы равны будет иметь вид:
mH2SO4 : mH3PO4 = ½M : 1M = 1 : 2
Это можно подтвердить уравнениями реакций нейтрализации этих кислот с гидроксидом натрия:
H2SO4 +2NaOH = Na2SO4 + 2H2O;
H3PO4 + NaOH = NaH2PO4 +H2O.
Ответ: mH2SO4 : mH3PO4 = 1 : 2.
Задача № 14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Согласно закону эквивалентов 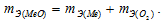 По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
По условию задачи при образовании первого оксида ушло в два раза больше кислорода, чем при образовании второго, следовательно, эквивалентная масса меди в первом оксиде будет в два раза меньше, чем во втором. Валентность металла определяется из соотношения mэ =A/B, где mэ – эквивалентная масса металла; А – мольная масс металла; В – стехиометрическая валентность металла. Тогда B = A/mэ. Приняв, что А и mэ – постоянные величины, запишем соотношения валентностей для первого и второго оксидов:
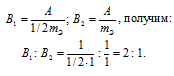
Таким образом, валентность меди в первом оксиде равна II, а во втором – I.
Ответ: 2 : 1.
Определение значения эквивалентной массы вещества
Задача № 15
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты.
Решение:
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Эквивалент (эквивалентная масса) кислоты равна мольной массе (М) делённой на число атомов водорода, замещённых в данной реакции на металл (на число вступающих в реакцию атомов водорода). Так как при взаимодействии ортофосфорной кислоты со щёлочью образовалась соль Na2HPO4, т.е. на натрий заместилось два атома водорода в кислоте H3PO4. Следовательно, эквивалентная масса ортофосфорной кислоты в реакции со щёлочью при образовании гидрофосфата натрия равна М/2 = М(H3PO4)/2 = 98/ 2 = 49г/моль.
Ответ: 49г/моль.
Задача № 16
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
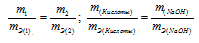
Эквивалентная масса гидроксида натрия равна М(NaOH)0/1 = 40г/моль.
Тогда
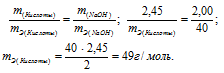
Ответ: 49г/моль.
Задача № 17
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
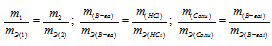
Эквивалентная масса хлороводорода равна М(HCl) = 36,5/1 = 36,5г/моль.
Тогда
а) Находим эквивалентную массу вещества:
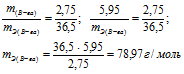
б) Находим эквивалентную массу соли:
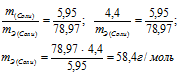
Ответ: а) 58,4г/моль; б) 78,97 г/моль.
Определение эквивалентного объема водорода
Задача № 18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Если одно из веществ находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
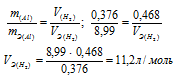
Ответ: 11,2л/моль.
НК
Надежда Карабец
Молярная масса эквивалента СОЛИ вычисляется по следующей формуле
Мэкв(соли) = М(соли)/[z(Me)*x(Me)]
М(соли) – молярная масса соли
z(Me) = валентность металла, образующего соль
x(Me) = число атомов металла в соли
Рассчитаем молярную массу эквивалента нитрата цинка Zn(NO3)2.
Мэкв(Zn(NO3)2) = М(Zn(NO3)2)/[z(Zn)*x(Zn)] = 189/(2*1) = 94,5 г/моль
М(Zn(NO3)2) = 189 г/моль – молярная масса нитрата цинка Zn(NO3)2
z(Zn) = 2 – валентность цинка в нитрате цинка Zn(NO3)2
x(Zn) = 1 – число атомов цинка в нитрате цинка Zn(NO3)2
Молярную массу эквивалента можно обозначать М(1/z Zn(NO3)2) или М(1/2 Zn(NO3)2). Обозначение 1/2 говорит, что фактор эквивалентности молекулы нитрата цинка Zn(NO3)2 равен 1/2.
ЭКВИВАЛЕНТНАЯ МАССА (химический эквивалент). Эквивалентная масса элемента – это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. При образовании соединений элементы взаимодействуют друг с другом в количествах, пропорциональных их эквивалентным массам или величинам, кратным этим массам. Для численного выражения эквивалентных масс необходим эталон; в качестве такого эталона приняты атомная масса водорода или ее эквивалент, например атомная масса хлора (Cl–), 1/2 атомной массы кислорода (O2–) или 1/3 атомной массы алюминия (Al3+). Таким образом, эквивалентная масса элемента равна его атомной массе, деленной на его валентность или степень окисления. В настоящее время атомные массы указывают в единицах, отнесенных к массе изотопа углерода с массовым числом 12; этому изотопу приписана масса 12,0000. Тогда атомная масса водорода будет равна 1,00797, хлора – 35,453, кислорода – 15,9994, алюминия – 26,9815. Следовательно, эквивалентная масса элемента – это масса, которая может химически соединяться или замещать в химическом соединении 1,00797 ч. (ч. – часть) водорода, 35,453 ч. хлора, 7,9997 (15,9994:2) ч. кислорода, 8,9938 (26,9815:3) ч. алюминия либо их эквиваленты. При таком определении эквивалентную массу можно найти экспериментально.
Методы определения.
Первые опыты по определению эквивалентных масс провели Дж.Дальтон, Й.Берцелиус, Ж.Дюма, Ж.Стас и другие ученые, но основная заслуга принадлежит здесь Т.Ричардсу, который впервые выполнил тщательные измерения эквивалентных масс с высочайшей точностью. Нагревая чистый перхлорат калия KClO3, превращали его в хлорид калия (KCl), при этом из 100 масс. ч. KClO3 образовывалось 60,835 масс. ч. KCl и 39,165 масс. ч. кислорода. Поскольку одна молекула KClO3 содержит на 3 атома кислорода, т.е. на 47,998 масс. ч., больше, чем KCl, то эквивалентная масса хлорида равна 47,998Ч(60,835:39,165) = 74,555. Далее, известное количество чистого серебра превращали в нитрат серебра, который использовали для осаждения хлорида серебра из раствора при взаимодействии с чистым хлоридом калия. Было установлено, что для полного превращения 74,555 масс. ч., т.е. массового эквивалента хлорида калия KCl, в хлорид серебра, который содержит 35,453 масс. ч. хлора, требуется 107,87 масс. ч. серебра. Эквивалентная масса калия при этом равна 74,555 – 35,453 = 39,102. Аналогично, зная эквивалентную массу серебра и изучая реакции образования им соответствующих галогенидов, например бромида AgBr, можно рассчитать эквивалентную массу галогена (в частности, брома). С использованием эквивалентных масс хлора и брома были определены эквивалентные массы многих металлов. Для нахождения эквивалентной массы какого-либо металла (М) синтезируют его чистый хлорид или бромид MBrx и осаждают галоген в виде галогенида серебра. Зная массы использованного MBrx и полученного AgBr, эквивалентные массы серебра (107,87) и брома (79,999), несложно определить эквивалентную массу металла М, который соединяется с 79,999 масс. ч. брома.
Описанный метод используется для точных расчетов, а для приближенных оценок можно применять другие способы, основанные на измерении объема и расчете массы водорода, выделившегося при растворении металла в кислоте, на определении массы одного металла, вытесняемого известным количеством другого из раствора, на определении состава гидридов или оксидов непосредственно по реакции соединения или аналитическими методами. Эквивалентные массы позволяют не только устанавливать соотношения, в которых элементы соединяются или замещают друг друга, но и точно определять атомные массы.
Кратные эквивалентные массы.
Иногда два элемента соединяются друг с другом в разных соотношениях, образуя два (или более) разных соединения. Например, известны два оксида меди. В одном из них, оксиде меди(II), 31,8 ч. меди соединены с эквивалентной массой, т.е. с 7,9997 масс. ч., кислорода, тогда как в оксиде меди(I) эта же эквивалентная масса кислорода соединена с 63,6 масс. ч. меди. Соответственно эквивалентные массы меди равны 31,8 и 63,6, при этом последняя величина ровно в два раза больше первой, а значит, эквивалентные массы являются кратными величинами. Этот вывод согласуется с ранее высказанным утверждением, что элементы соединяются пропорционально их эквивалентным массам или величинам, кратным этим массам.
Электрохимический эквивалент.
При прохождении через электролит количества электричества 1 F (фарадей) = 96 500 Кл (1 Кл = 1 АЧс) выделяется один химический эквивалент (т.е. эквивалентная масса) любого вещества. Следовательно, масса, выделяемая при прохождении 1 Кл (кулон), равна 1 экв., деленному на 96 500. Эта величина, называемая электрохимическим эквивалентом данного элемента, лежит в основе еще одного метода экспериментального определения эквивалентных масс.
Эквивалентные массы соединений.
Понятие эквивалентной массы было распространено и на соединения; в этом случае эквивалентная масса определяется как масса вещества, кратная эквивалентной массе элемента, являющегося ключевым для данного соединения. Например, для кислот ключевым элементом является водород, образующий в растворе ионы водорода; таким образом, эквивалентная масса кислоты есть масса кислоты, кратная 1,00797 массовым частям водорода, способного образовывать ионы водорода, т.е. водорода, который может быть замещен. Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты. Эквивалентная масса основания есть масса основания, которая реагирует с эквивалентной массой любой кислоты и, следовательно, является химическим эквивалентом этой массы. Иначе можно сказать, что эквивалентная масса основания равна его молярной массе, деленной на валентность металла, образующего основание. Для солей эквивалентная масса обычно кратна эквивалентной массе металла, образовавшего эту соль; она равна молярной массе соли, деленной на произведение валентности металла и числа его атомов в молекуле соли. Для эквивалентной массы окислителей и восстановителей можно дать несколько определений. С практической точки зрения наиболее удобно определение, согласно которому эквивалентная масса есть количество вещества, кратное 7,9997 ч. кислорода (или реагирующее с ними) либо его эквиваленту. Другое определение основано на том, что при восстановлении этого количества кислорода происходит перенос одного электрона. В этом случае эквивалентная масса окислителя или восстановителя есть масса, соответствующая массе вещества, принимающего или отдающего один электрон в окислительно-восстановительной реакции.
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
