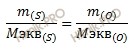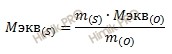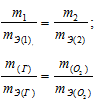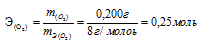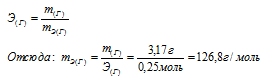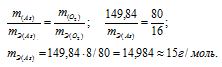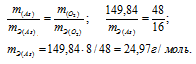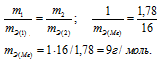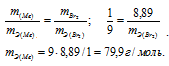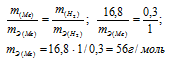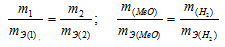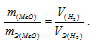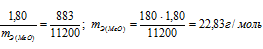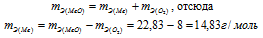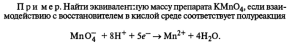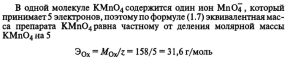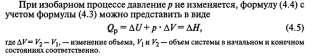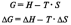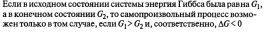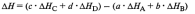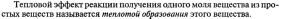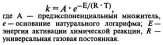Какова эквивалентная масса серы (S), если 4 грамма ее окисляются 2,8 литрами кислорода (O) (нормальные условия)?
Решение задачи
Согласно закону эквивалентов: массы реагирующих веществ пропорциональны молярным массам эквивалента этих веществ.
Учитывая, что кислород – газ, вычислим массу кислорода, по формуле перерасчета, устанавливающей связь между объемом газа и массой:
Получаем:
m (O2) = 32 ∙ 2,8 / 22,4 = 4 (г).
Учитывая, что молярная масса эквивалентов кислорода (O) равна 8 г/моль, определим эквивалентную массу серы (S) по закону эквивалентов:
Откуда выразим эквивалентную массу серы (S):
Получаем:
M экв (S) = 4 ∙ 8 / 4 = 8 (г/моль).
Ответ:
эквивалентная масса серы (S) равна 8 г/ моль.
Понятие эквивалент элемента часто подменяют понятием эквивалентная масса, хотя это разные понятия.
Эквивалент химический – это реальная или условная ЧАСТИЦА, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества.
Нам необходимо найти эквивалент химического элемента.
Эквивалентом химического элемента называют такую его ЧАСТЬ, которая соединяется с одним АТОМОМ водорода или замещает один атом водорода в химических реакциях
Эквивалент атома водорода всегда равен единице, а эквивалент химического элемента может быть меньше или равен единице. Эквивалент химического элемента численно равен фактору эквивалентности элемента.
Пусть оксид серы в общем виде имеет формулу SOх, где х – число атомов кислорода в оксиде.
ПЕРВЫЙ ОКСИД
Массовая доля серы в первом оксиде w1(S) = 0,4, тогда массовая доля кислорода в первом оксиде
w1(O) = 1 – w1(S) = 1 – 0,4 = 0,6
Отношение массовых долей в первом оксиде
w1(O)/w1(S) = 0,6/0,4 = 1,5
С другой стороны отношение массовых долей в оксиде равно отношению масс элементов в оксиде
w1(O)/w1(S) = m(O)/m(S) = x*A(O)/A(S) = 16x/32 = 0,5x
Получаем
0,5x = 1,5
Отсюда
х = 3
Следовательно, первый оксид имеет формулу SO3, в котором сера шестивалентна.
Тогда
z(S) = 6 – эквивалентное число серы, равное ее валентности в оксиде SO3
Фактор эквивалентности серы в первом оксиде
fэкв (S) = 1/z(S) = 1/6
Следовательно, эквивалент серы в первом оксиде равен 1/6
Если под понятием эквивалент ты подразумевал эквивалентную массу серы в оксиде, то эквивалентная масса серы в оксиде может быть найдена по формуле
Мэкв (S) = M(S)*fэкв (S) = 32*(1/6) ≈ 5,33 г/моль
ВТОРОЙ ОКСИД
Массовая доля серы в втором оксиде w2(S) = 0,5, тогда массовая доля кислорода во втором оксиде
w2(O) = 1 – w1(S) = 1 – 0,5 = 0,5
Отношение массовых долей во втором оксиде
w2(O)/w2(S) = 0,5/0,5 = 1
w2(O)/w2(S) = m(O)/m(S) = x*A(O)/A(S) = 16x/32 = 0,5x
Получаем
0,5x = 1
Отсюда
х = 2
Следовательно, второй оксид имеет формулу SO2, в котором сера четырехвалентна.
Тогда
z(S) = 4 – эквивалентное число серы, равное ее валентности в оксиде SO2
Фактор эквивалентности серы во втором оксиде
fэкв (S) = 1/z(S) = 1/4
Следовательно, эквивалент серы во втором оксиде равен 1/4
Эквивалентная масса серы во втором оксиде
Мэкв (S) = M(S)*fэкв (S) = 32*(1/4) = 8 г/моль
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение эквивалентной массы вещества
Задача №1
При сгорании 5,00г металла образуется 9,44г оксида металла. Определить эквивалентную массу металла.
Решение:
Из условия задачи следует, что в оксиде металла на 5г металла приходится 4,44г кислорода (9,44 – 5 = 4,44). Согласно закону эквивалентов, массы (объёмы) взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
5г металла эквивалентны 4,44г кислорода
mЭ(Ме) г/моль металла эквивалентны 8г/моль кислорода
Откуда mЭ(Ме) = 8 . 5/4,44 = 9,01г/моль.
Ответ: mЭ(Ме) = 9,01г/моль.
Задача №2
Одно и то же количество металла соединяется с 0,200г кислорода и с 3,17г одного из галогенов. Определить эквивалентную массу галогена.
Решение:
I Вариант
Из условия задачи следует, что 0,200г кислорода и 3,17г галогена эквивалентно соединяются с металлом. Согласно закону эквивалентов, массы взаимодействующих веществ пропорциональны их эквивалентным массам. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, составляем пропорцию:
0,200г кислорода эквивалентны 3,17г галогена
mЭ(О2) 8г/моль кислорода эквивалентны mЭ(Г) Х г/моль
Откуда: mЭ(Г) 8 . 3,17/0,200 = 126,8г/моль.
Ответ: mЭ(Г) = 126,8г/моль.
II Вариант
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Таким образом, количество эквивалентов галогена и кислорода численно равны между собой, что составляет:
Зная количество эквивалентов и массу вещества можно определить эквивалентную массу этого вещества:
Ответ: 126,г/моль.
Задача №3
Масса 1л кислорода равна 1,4г. Сколько литров кислорода расходуется при сгорании 21г магния, эквивалент которого равен 1/2 моля?
Решение:
Находим эквивалентную массу магния: mЭ(Mg) = 1/2M(Mg) =24/2 = 12г/моль. Следовательно, 21г магния составляет 21/2 =1,75 эквивалентной массы Mg. Согласно закону эквивалентов масса израсходованного кислорода составляет 1,75 его эквивалентной массы. Учитывая, что эквивалентная масса кислорода равна 8 г/моль, рассчитаем массу кислорода, расходуемую на сжигание магния: m(O2) = 1,75 . 8 = 14г. Зная, что 1л кислорода по массе составляет 1,4г, рассчитаем объём кислорода расходуемого при сгорании 21г магния, составив пропорцию:
1,4 : 1 = 14 : х;
х = 14 . 1/1,4 = 10л.
Ответ: V(O2) = 10л.
Задача№4
Определить эквивалентные массы металла и серы, если 3,24г металла образует 3,48г оксида и 3,72г сульфида.
Решение:
Из условия задачи следует, что в оксиде металла на 3,24г металла приходится 0,24г кислорода (3,48 – 3,24 = 0,24г). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам). Так как эквивалентная масса кислорода составляет 8г/моль, то эквивалентную массу металла находим из пропорции:
8 : 0,24 = х : 3,24;
х = 8 . 3,24/0,24 =108г/моль.
В сульфиде металла на 3,24г металла приходится 0,48г серы (3,72 – 3,24 = 0,48г). Эквивалентную массу серы находим из пропорции:
3,24 : 108 = 0,48 : х;
х = 108 . 3,24/0,48 = 16г/моль.
Ответ: mэ(Me) = 108г/моль; mэ(S) = 16г/моль.
Задача№5
Вычислить атомную массу двухвалентного металла и определить, какой это металл, если 8,34г металла окисляются 0,680л кислорода (условия нормальные).
Решение:
Зная, что эквивалентный объём кислорода равен 5,6л/моль, рассчитаем эквивалентную массу металла, составив пропорцию:
8,345 : 0,680 = х : 5,6;
х = 8,34 . 5,6/0,680 = 68,68г/моль.
Атомную массу металла находим, учитывая, что металл двухвалентный, умножением его эквивалентной массы на 2:
М(Ме) = mэ(Ме) . В, где
В – валентность металла; М – молярная масса металла; mэ(Ме) – эквивалентная масса металла.
М(Ме) = 68,68 . 2 = 137,4г/моль.
Определяем, какой это металл по таблице «Периодическая система химических элементов Д.И. Менделеева», учитывая, что его атомная масса составляет 137,4. Такой атомной массе соответствует барий – элемент№56.
Ответ: 137,4; Ba.
Задача№6
Мышьяк образует два оксида, из которых один содержит 65,2% (масс.) As, а другой 75,7% (масс.) As. Определить эквивалентные массы мышьяка в обоих оксидах.
Решение:
а) Находим формулу оксида мышьяка, учитывая, что оксид содержит 65,2% As по массе. Тогда оксид содержит кислорода по массе 34,8% (100 – 65,2 = 34,8). Находим формулу оксид мышьяка:
AsхОу = х : у = 65,2/Ar(As) : 34,8/Ar(O2) = 65,2/74,92 : 34,8/16 = 1 : 2,5 = 2 : 5
Формула оксида будет иметь вид: As2O5.
M(As2O5) = 229,84г/моль.
Находим массу мышьяка и массу кислорода в оксиде:
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 5 = 80г.
Согласно закону эквивалентов массы элементов в оксиде пропорциональны их эквивалентным массам:
б) Подобные расчеты производим, учитывая, что оксид содержит 75,7% As и 24,3% О2 (100 – 75,7 = 24,3) по массе:
AsхОу = х : у = 75,7/74,92 : 24,3/16 = 1,01 : 1,51 = 1 : 1,5 2 : 3
Формула оксида будет иметь вид: As2O3.
M(As2O5) = 197,84г/моль.
m(As) = 74,92 . 2 = 149,84г; m(O2) = 16 . 3 = 48г.
Ответ: а) 15г/моль; 24,97г/моль.
Задача№7
,00г некоторого металла соединяется с 8,89г брома и с 1,78г серы. Найти эквивалентные массы брома и металла, зная, что эквивалентная масса серы равна 16,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их а (объёмам):
Находим эквивалентную массу брома, учитывая, что эквивалентная масса металла равна 9г/моль:
Ответ: 9г/моль; 79,9г/моль.
Задача№8
Эквивалентная масса хлора равна 35,5 г/моль, мольная масса атомов меди равна 63,5 г/моль. Эквивалентная масса хлорида меди равна 99,5 г/моль. Какова формула хлорида меди?
Решение:
Согласно закону эквивалентов:
mэ(соли) = mэ(Cu) + mэ(Cl2).
Отсюда mэ(Cl2) = mэ(соли) – mэ(Cl2) = 99,5 – 35,5 = 64г/моль.
Зная эквивалентные массы хлора и меди можно определить количество их атомов в молекуле соли: mэ(А) = М(А)/mэ(А).
Тогда: CuxCly = x : y = 63,5/63,546 : 35,45/35,5 = 0,992 : 0,999 = 1 : 1
Отсюда CuxCly = CuCl.
Ответ: CuCl.
Задача№9.
Для растворения 16,8г металла потребовалось 14,7г серной кислоты. Определить эквивалентную массу металла и объем выделившегося водорода (условия нормальные).
Решение:
M(H2SO4) =98г/моль.
Находим массу водорода в 14,7г серной кислоты, составив пропорцию: 98 : 2 14,7 : х;
х = 2 . 14,7/98 = 0,3г.
Согласно закону эквивалентов массы взаимодействующих веществ пропорциональны их эквивалентным массам:
Учитывая, что эквивалентный объём водорода равен 11,2л/моль, рассчитаем объём который занимает 0,3г водорода: из пропорции:
1 : 11,2 = 0,3 : х;
х = 11,2 . 0,3/ 1 = 3,36л.
Ответ: mэ(Ме) = 56г/моль; V(H2) = 3,36л.
Задача№10
На восстановление 1,80г оксида металла израсходовано 883 мл водорода, измеренного при нормальных условиях. Вычислить эквивалентные массы оксида и металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Так как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 4л. Отсюда эквивалентный объём водорода равен, молекула которого состоит из двух атомов, т. е. содержит два моля атомов водорода, равен 22,4/2 = 11,2 л/моль или 12000мл/моль.
Отношение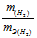
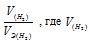
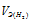
Тогда получим отношение
Находим эквивалентную массу оксида металла:
Согласно закону эквивалентов:
Ответ: 22,83г/моль; 14,83г/моль.
Эквивалентом
веществаназывается условная частица,
в целое число раз меньшая (или равная),
чем соответствующая ей структурная или
формульная единица вещества (атом,
молекула, ион), участвующая в конкретной
реакции.
Эквивалентная
масса равна отношению молярной массы
элемента к его окислительному числу.
Эквивалентная
масса оксидаравна сумме эквивалентных
масс данного элемента и кислорода.
Эквивалентная
масса солиравна отношению молярной
массы соли к произведению числа атомов
металла на его валентность.
Эквивалентная
масса основанияравна отношению
молярной массы основания к числу
замещенных гидроксогрупп.
Эквивалентная
масса кислотыравна отношению молярной
массы кислоты к числу замещенных атомов
водорода.

объём
Объём, который
занимает эквивалент вещества С, называется
эквивалентным. Он может быть найден
делением эквивалентной массы вещества
на плотность или делением объема на
число эквивалентов этого числа.
Закон
эквивалентов.
Согласно
закону эквивалентов, вещества
взаимодействуют и образуются в
эквивалентных количествах.
2.Примеры расчёта эквивалента элемента, оксида, основания, соли, кислоты, окислителя, восстановителя.
-
ЭЛЕМЕНТА.
Определим эквивалентную массу серы в
молекуле серной кислоты. Окислительное
число серы в молекуле серной кислоты
равно 6. По формуле эквивалентная масса
серы равна M/B= 32/6 = 5,33 г/моль. -
ОКСИДА.
Определим эквивалентную массу оксида
серы. Окислительное число серы в молекуле
оксида серы равно 4. По формуле
эквивалентная масса серы рана
М/В=32/4=8г/моль. Эквивалентная масса
оксида по формуле равна ЭS+ЭO=8+8=16г/моль. -
ОСНОВАНИЯ.
Определим эквивалентную массу молекулы
оксида алюминия. По формуле
ЭAl(OH)3=78/3=26г/моль. -
СОЛИ.
Определим эквивалентную массу молекулы
хлорида алюминия. В молекуле AlCl3
число атомов металла равно 1, а
валентность равна 3. По формуле
ЭAlCl3=133,5/(1*3)=44,5г/моль. -
КИСЛОТЫ.
Определим эквивалентную массу молекулы
серной кислоты. Серная кислота
двуосновная. По формуле эквивалентная
масса серной кислоты равна М/(чз
Н)=98/2=49г/моль. -
ОКИСЛИТЕЛЯ.
-
ВОССТАНОВИТЕЛЯ.
Найти эквивалентную массуZnдля данной реакции:
Zn+CuSO4=ZnSO4+Cu
Zn-2e→Zn2+-восстановитель
Cu2++ 2e → Cu-окислитель
ЭZn=M/z=65/2=33
3.
ПЕРВЫЙ
ЗАКОН ТЕРМОДИНАМИКИ.
Количество
теплоты, переданное системе, идет на
изменение внутренней энергии системы
и на совершаемую системой работу против
внешних сил.
Q
= ΔU + W
(4.4)
ВТОРОЙ
ЗАКОН ТЕРМОДИНАМИКИ.
Характеризует
направленность реальных, необратимых
процессов теплообмена: Невозможен
процесс, единственным результатом
которого является передача энергии в
форме теплоты от тела менее нагретого
к телу более нагретому.
ТРЕТИЙ
ЗАКОН ТЕРМОДИНАМИКИ.
В
конденсированных системах при абсолютном
нуле и вблизи него процесс протекает
без изменения энтропии.
4.Энергия Гиббса. Направленность самопроизвольных химических реакций.
Энергия
Гиббса – это величина, показывающая
изменение энергии в ходе химической
реакции и дающая таким образом ответ
на принципиальную возможность химической
реакции.
5.Термохимический
закон Гесса. Тепловой эффект реакции.
Закон Гесса:
тепловой эффект химической реакции не
зависит от пути реакции, а зависит только
от вида и начального и конечного состояния
веществ.
Тепловой
эфффект реакции.
6.Скорость
химической реакции. Закон действия
масс.
Скорость
химической реакции – это изменение
концентрации исходного или образовавшегося
в реакции вещества в единицу времени.
Скорость
химической реакции прямо пропорциональна
произведению концентраций реагирующих
веществ.
7.Зависимость
скорости химической реакции от
температуры. Температурный коэффициент.
Закон Вант-Гоффа. Теория активации.
Закон
Вант-Гоффа: при повышении температуры
на каждые 10 К скорость химической реакции
возрастает в 2-4 раза.
Уравнение
Аррениуса:
8.Явление
катализа. Катализаторы, принцип действия.
Теория переходного состояния и образования
активированных комплексов. Биокатализаторы.
9.Химическое
равновесие с точки зрения термодинамики.
Константа равновесия.
10.Смещение
химического равновесия. Принцип Ле
Шателье.
11.Агрегатные
состояния. Растворы: понятие, теория.
Растворы насыщенные, ненасыщенные,
пересыщенные.
Состояние
одного и того же вещества, переходы
между которыми сопровождаются
скачкообразными изменениями объема и
физических свойств вещества, называются
агрегатными. Вещества могут существовать
в твердом, жидком и газообразном
состоянии. Переходы вещества из одного
состояния в другое обусловлены изменением
характера теплового движения частиц и
их взаимодействия. Газом называют
состояние вещества, из которого без
понижения температуры не может быть
получено твердое или жидкое состояния.
Переход вещества из жидкого состояния
в газообразное при температурах ниже
критической называется парообразованием.
Пар можно получить также сублимацией
твердого вещества. Обратные процессы
перехода пара в жидкое и твердое состояние
называется конденсацией. В основе
изучения газообразного состояния лежит
понятие об идеальном газе. К состоянию
идеального газа приближаются газы при
низких давлениях, когда расстояния
между молекулами настолько велики, что
можно принебречь силами притяжения
между ними. Уравнение Менделеева-Клапейрона
pV=n*RT
Перход
твердого вещества в жидкое называется
плавлением. Обратный процесс
–кристаллизацией. Температура, при
которой существуют три фазы вещества
называется тройной точкой.
ПОНЯТИЕ О
РАСТВОРАХ
В гомогенных
системах частицы растворенного вещества
раздроблены до молекулярных размеров.
Такие системы называются истинными
растворами и просто растворами и являются
весьма устойчивыми. В истинных растворах
Соседние файлы в предмете Неорганическая химия
- #
- #
- #
- #
- #
- #
- #
02.05.201519.99 Mб350Неорг. Химия.pdf
Найди верный ответ на вопрос ✅ «11. Найдите эквивалент и эквивалентные массы серы в соединениях: Н2S; SO3; FeSO4; CuSO3. …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » 11. Найдите эквивалент и эквивалентные массы серы в соединениях: Н2S; SO3; FeSO4; CuSO3.