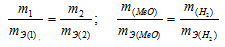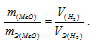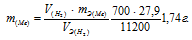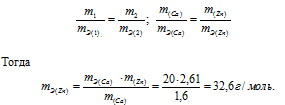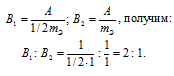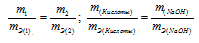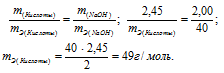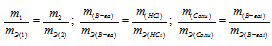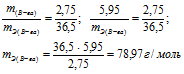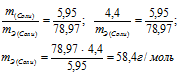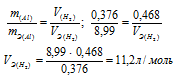Как рассчитать эквивалентную массу
Эквивалентной массой, или молярной массой эквивалента, называется количество вещества, взаимодействующее с одним молем водорода или вытесняющие столько же атомов водорода из его соединений. Обозначается эта величина Mэкв, измеряется в г/моль и вычисляется по формулам или экспериментальным путем.

Вам понадобится
- – периодическая система;
- – калькулятор;
- – химическая посуда;
- – разбавленная соляная кислота;
- – навеска металла.
Инструкция
Чтобы найти эквивалентную массу простого вещества, воспользуйтесь формулой:Mэкв = Mа/B, где Mэкв – масса эквивалента;Mа – атомная масса элемента; B – валентность.Например, согласно формуле эквивалентная масса натрия будет равна 22,99 г/моль, а двухвалентной серы – 32/2 = 16 г/моль и т.д. Для сложных веществ молярной массой эквивалента будет называться количество вещества, прореагировавшего без остатка с одним эквивалентом другого вещества, например, водорода.
Помните, что расчет этой величины для разных химических соединений имеет нюансы. Например, при вычислении эквивалентной массы оксидов – складывайте значения эквивалентных масс, составляющих соединение. Допустим, дан оксид цинка. Сначала считаете Mэкв (Zn) = 65/2 =32,5 г/моль. Потом – Mэкв (O) = 16/2 = 8 г/моль. Таким образом, получите эквивалентную массу ZnO равную 40,5 г/моль. А рассчитать массу эквивалента кислоты можно, разделив ее молекулярную массу на количество атомов водорода, содержащихся в ней: Mэкв (H2SO4) = 98/2 = 49 г/моль и т.д.
Для экспериментального определения эквивалентной массы сначала повторите технику безопасности при работе с кислотами и газами. Затем возьмите бюретку, пробирку и воронку. Соедините их между собой резиновыми трубками. Налейте в бюретку дистиллированной воды, с помощью воронки установите ее уровень на нуле.
В пробирку налейте 5 мл соляной кислоты (постарайтесь не замочить стенки). На сухую стенку поместите навеску металла. Следите за тем, чтобы он не упал в кислоту раньше времени. Закройте пробирку пробкой и встряхните. Водород будет вытеснять воду из бюретки. После завершения реакции выровняйте уровень воды в бюретке и воронке. Запишите конечный результат, температуру и давление при проведении опыта.
Определите вытесненный объем водорода, сравнив начальный и конечный уровень воды в бюретке. Приведите полученный результат к нормальным условиям, используя показания барометра и термометра. И затем только рассчитайте массу эквивалента металла, используя формулу:m (металла)/V (водорода при норм.условиях) = Mэкв.(металла)/Vэкв (водорода).
Источники:
- рассчитать молярную массу эквивалента
- ЭКВИВАЛЕНТНАЯ МАССА
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.

Лучший ответ по мнению автора
|
|||||||||||||||
Закон эквивалентов
Количественный подход к
изучению химических явлений и установление
закона постоянства состава показали,
что вещества вступают во взаимодействие
в определенных соотношениях масс, что
привело к введению такого важного
понятия, как “эквивалент”,
и установлению закона
эквивалентов.
Эквивалент
–
это
частица или часть частицы, которая
соединяется (взаимодействует) с одним
атомом водорода или с одним электроном.
Из
этого определения видно, что понятие
“эквивалент” относится к конкретной
химической реакции; если его относят к
атому в химическом соединении, то имеют
в виду реакцию образования этого
соединения из соответствующего простого
вещества и называют эквивалентом
элемента в соединении.
В
одной формульной единице вещества (В)
может содержаться Zв
эквивалентов этого вещества. Число Zв
называют показателем
эквивалентности.
Фактор
эквивалентности (f)
–
доля частицы, составляющая эквивалент;
f
£
1 и может быть равным 1, 1/2, 1/3 и т.д.
fВ
=
. (1.7)
Масса
1 моль эквивалентов, выраженная в граммах,
называется молярной
эквивалентной массой (Мэк)
(г/моль); численно она равна относительной
молекулярной массе эквивалента (кратко
ее называют эквивалентной массой).
Мэк
=
fВ·М. (1.8)
Закон
эквивалентов: массы
взаимодействующих без остатка веществ
соотносятся как их эквивалентные массы.
Математическое выражение закона
эквивалентов:
, (1.9)
где Мэк,1
и Мэк,2
–
эквивалентные массы.
Пример
8. Определить эквивалент
и эквивалентную массу кислорода в Н2О.
Решение.
Такая формулировка вопроса предполагает
реакцию образования молекулы воды из
кислорода и водорода:
H2
+ ½O2
= Н2О,
то есть с 1 атомом водорода
соединяется ½
атомов кислорода.
Следовательно, Z(О)
= 2. Масса 1 моль атомов кислорода равна
16 г, отсюда
Мэк(O)
= М (О)·
=
= 8 г/ моль.
Эквиваленты
одних и тех же элементов в различных
химических соединениях могут различаться,
так как величина эквивалента зависит
от характера превращения, претерпеваемого
им. Так, в соединении SO2
эквивалентная масса серы равна 8 г/моль,
что составляет 1/4 от атомной массы, а в
соединении SO3
–
5,3 г/моль, что составляет 1/6 от атомной
массы серы (ZS
= 4 и 6, соответственно). Практический
расчет эквивалентной массы элемента в
соединении ведут по формуле
Мэк
(элемента) = Аэк
=
, (1.10)
где
А –
атомная масса, ω –
степень окисления элемента в данном
соединении. (Ниже будет показано, что
для реакции образования соединения из
простых веществ ZВ
= |ω|).
Например,
ZВ
(Mn) в соединении KMnO4
(ω = +7) составляет 7, а
Мэк
(Mn)
=
=
= 7,85 г/моль; в соединении Mn2O3
(ω = +3) – ZВ
= 3 и
Мэк
(Mn)
=
=
= 18,3 г/моль. (55-
масса 1-го моля атомов марганца или
атомная масса).
Эквивалентная
масса вещества в химических реакциях
имеет различные значения в зависимости
от того, в каком взаимодействии это
вещество участвует. Если во взаимодействии
сложного вещества участвует его известное
количество или известно количество
реагирующих групп, то для расчета
эквивалентных масс можно пользоваться
следующими правилами и формулами.
а)
Вещества друг с другом реагируют
одинаковыми количествами эквивалентов.
Например,
в реакции
2Al
+ 3/2O2
= Al2O3
6
моль эквивалентов Al
реагируют с таким же количеством
кислорода
(ZВ
(Al)
= 3, ZВ
(O)
= 2).
б)
Эквивалентная масса кислоты в реакциях
замещения ионов водорода равна:
М
эк.
кислоты
=
(1.11)
Пример
9. Определить эквивалент
и эквивалентную массу H2SO4
в реакциях:
-
H2SO4
+ KOH
= KHSO4
+ H2O
;
-
H2SO4
+ 2KOH
= K2SO4
+ 2H2O
.
Решение.
В первой реакции
заместился один ион водорода, следовательно,
эквивалент серной кислоты равен 1, ZВ
(H2SO4)
= 1, Мэк(H2SO4)
= М1
= 98 г/моль. Во второй реакции заместились
оба иона водорода, следовательно,
эквивалент серной кислоты равен двум
молям, ZВ
(H2SO4)
= 2, а Mэк
(H2SO4)
= 98·½
= 49 г/моль.
в)
Эквивалентная масса основания в реакции
замещения ионов гидроксила равна:
Мэк.
основания
=
.(1.12)
Пример
10. Определить эквивалент и эквивалентные
массы гидроксида висмута в реакциях:
1)
Bi(OH)3
+ HCl = Bi(OH)2Cl
+ H2O;
2)
Bi(OH)3
+ 3HCl = BiCl3
+ H2O.
Решение.
1)
ZВ
Bi(OH)3
= 1, Mэк Bi(OH)3
= 260 г/моль (т. к. из трех ионов гидроксила
заместился один);
2) ZВ
Bi(OH)3
= 3, a Mэк Bi(OH)3
= 260·= 86,3 г/моль (т. к. из трех ионов ОН–
заместились все три).
г)
Эквивалентная
масса соли в реакциях полного замещения
катиона или аниона равна:
Мэк.
соли
=
или
(1.13)
Мэк
соли
=
.
Так,
ZВ
Al2(SO4)3
= 3∙2 = 6. Однако в реакции эта величина
может быть больше (неполное замещение)
или меньше (комплексообразование). Если,
например, это соединение участвует во
взаимодействии по реакции
Al2(SO4)3
+ 12KOH
= 2K3[Al(OH)6]
+ 3K2SO4
,
то
при этом три аниона с суммарным зарядом
6 замещаются 12 ОН–
ионами, следовательно, 12 эквивалентов
этого вещества должно вступать в реакцию.
Таким образом, ZВ
Al2(SO4)3
=
12, а
Мэк
= М·fВ
= 342/12 = 28,5 г/моль.
д)
Эквивалентная
масса оксида в реакциях полного замещения
равна:
Мэк
оксида
=
.(1.14)
Например,
ZВ
(Fe2O3)
= 3·2 = 6. Мэк
= М(Fe2O3)·fВ
= 160×1/6
= 26,6 г/моль. Однако в реакции
Fe2O3
+ 4HCl
= 2FeOHCl2
+ H2O
ZВ
(Fe2O3)
= 4, Мэк
= М(Fe2O3)∙fВ
= 160×1/4
= 40 г/моль, так как Fe2O3
взаимодействует с четырьмя эквивалентами
HCl (fВ
= 1).
При
решении задач, связанных с газообразными
веществами, целесообразно пользоваться
значением эквивалентного
объема.
Это объем, занимаемый одним молем
эквивалентов газообразного вещества.
Пример
11. Рассчитайте эквивалентные объемы
газообразных водорода и кислорода при
н.у.
Решение.
Для водорода при н.у. этот объем равен
11,2 литров (молярный объем Н2составляет 22,4 л, а так как Мэк(Н)
= 1г (т.е. в 2 раза меньше, чем молярная
масса), то эквивалентный объем будет в
2 раза меньше молярного, т. е. 11,2 л),для
кислорода – 5,6л (молярный объем О2составляет 22,4 л, а так как Мэк(О)
= 8г (т.е. в 4 раза меньше, чем молярная
масса О2), то эквивалентный
объем будет в 4 раза меньше, чем молярный.
Пример
12.На
восстановление 1,80 г оксида металла
израсходовано 883 мл водорода (н.у.).
Вычислить эквивалентные массы оксида
и металла.
Решение.
Согласно закону эквивалентов (1.9) массы
(объемы) реагирующих веществ пропорциональны
их эквивалентным массам (объемам):
. Отсюда
(г/моль);
+
,
тогда
г/моль.
Пример
13. Вычислить эквивалентную
массу цинка, если 1,168 г Zn вытеснили из
кислоты 438 мл Н2
(t = 17 оС
и Р = 750 мм рт. ст.).
Решение.
Согласно закону эквивалентов (1.9):
;
Из
уравнения Менделеева-Клапейрона
(1.4):
г,
=
32,6 г/моль.
д)
Эквивалентная масса окислителя и
восстановителя определяются
делением молярной массы на изменение
степени окисления в соответствующей
реакции на 1моль.
Пример
14. Определить эквивалентные массы
окислителя и восстановителя в реакции:
+6
+4
+3
+6
K2Cr2O7
+ 3Na2SO3
+ 4H2SO4
= Cr2(SO4)3
+ 3Na2SO4
+ K2SO4
+ 4H2O.
Решение.
Окислителем в этой реакции являетсяK2Cr2O7,
а восстановителем –Na2SO3.
Суммарное изменение степени окисления
хрома вK2Cr2O7Dw(2Cr)
= 2.(+3) – 2.(+6) = – 6;
Поэтому
г/моль.
Суммарное
изменение степени окисления серы в
Na2SO3:Dw(S)
= +6 – (+4) = +2;
Поэтому
г/моль.
ЭКВИВАЛЕНТНАЯ МАССА (химический эквивалент). Эквивалентная масса элемента – это масса 1 эквивалента элемента; эквивалентом элемента называют такое его количество, которое реагирует с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. При образовании соединений элементы взаимодействуют друг с другом в количествах, пропорциональных их эквивалентным массам или величинам, кратным этим массам. Для численного выражения эквивалентных масс необходим эталон; в качестве такого эталона приняты атомная масса водорода или ее эквивалент, например атомная масса хлора (Cl–), 1/2 атомной массы кислорода (O2–) или 1/3 атомной массы алюминия (Al3+). Таким образом, эквивалентная масса элемента равна его атомной массе, деленной на его валентность или степень окисления. В настоящее время атомные массы указывают в единицах, отнесенных к массе изотопа углерода с массовым числом 12; этому изотопу приписана масса 12,0000. Тогда атомная масса водорода будет равна 1,00797, хлора – 35,453, кислорода – 15,9994, алюминия – 26,9815. Следовательно, эквивалентная масса элемента – это масса, которая может химически соединяться или замещать в химическом соединении 1,00797 ч. (ч. – часть) водорода, 35,453 ч. хлора, 7,9997 (15,9994:2) ч. кислорода, 8,9938 (26,9815:3) ч. алюминия либо их эквиваленты. При таком определении эквивалентную массу можно найти экспериментально.
Методы определения.
Первые опыты по определению эквивалентных масс провели Дж.Дальтон, Й.Берцелиус, Ж.Дюма, Ж.Стас и другие ученые, но основная заслуга принадлежит здесь Т.Ричардсу, который впервые выполнил тщательные измерения эквивалентных масс с высочайшей точностью. Нагревая чистый перхлорат калия KClO3, превращали его в хлорид калия (KCl), при этом из 100 масс. ч. KClO3 образовывалось 60,835 масс. ч. KCl и 39,165 масс. ч. кислорода. Поскольку одна молекула KClO3 содержит на 3 атома кислорода, т.е. на 47,998 масс. ч., больше, чем KCl, то эквивалентная масса хлорида равна 47,998Ч(60,835:39,165) = 74,555. Далее, известное количество чистого серебра превращали в нитрат серебра, который использовали для осаждения хлорида серебра из раствора при взаимодействии с чистым хлоридом калия. Было установлено, что для полного превращения 74,555 масс. ч., т.е. массового эквивалента хлорида калия KCl, в хлорид серебра, который содержит 35,453 масс. ч. хлора, требуется 107,87 масс. ч. серебра. Эквивалентная масса калия при этом равна 74,555 – 35,453 = 39,102. Аналогично, зная эквивалентную массу серебра и изучая реакции образования им соответствующих галогенидов, например бромида AgBr, можно рассчитать эквивалентную массу галогена (в частности, брома). С использованием эквивалентных масс хлора и брома были определены эквивалентные массы многих металлов. Для нахождения эквивалентной массы какого-либо металла (М) синтезируют его чистый хлорид или бромид MBrx и осаждают галоген в виде галогенида серебра. Зная массы использованного MBrx и полученного AgBr, эквивалентные массы серебра (107,87) и брома (79,999), несложно определить эквивалентную массу металла М, который соединяется с 79,999 масс. ч. брома.
Описанный метод используется для точных расчетов, а для приближенных оценок можно применять другие способы, основанные на измерении объема и расчете массы водорода, выделившегося при растворении металла в кислоте, на определении массы одного металла, вытесняемого известным количеством другого из раствора, на определении состава гидридов или оксидов непосредственно по реакции соединения или аналитическими методами. Эквивалентные массы позволяют не только устанавливать соотношения, в которых элементы соединяются или замещают друг друга, но и точно определять атомные массы.
Кратные эквивалентные массы.
Иногда два элемента соединяются друг с другом в разных соотношениях, образуя два (или более) разных соединения. Например, известны два оксида меди. В одном из них, оксиде меди(II), 31,8 ч. меди соединены с эквивалентной массой, т.е. с 7,9997 масс. ч., кислорода, тогда как в оксиде меди(I) эта же эквивалентная масса кислорода соединена с 63,6 масс. ч. меди. Соответственно эквивалентные массы меди равны 31,8 и 63,6, при этом последняя величина ровно в два раза больше первой, а значит, эквивалентные массы являются кратными величинами. Этот вывод согласуется с ранее высказанным утверждением, что элементы соединяются пропорционально их эквивалентным массам или величинам, кратным этим массам.
Электрохимический эквивалент.
При прохождении через электролит количества электричества 1 F (фарадей) = 96 500 Кл (1 Кл = 1 АЧс) выделяется один химический эквивалент (т.е. эквивалентная масса) любого вещества. Следовательно, масса, выделяемая при прохождении 1 Кл (кулон), равна 1 экв., деленному на 96 500. Эта величина, называемая электрохимическим эквивалентом данного элемента, лежит в основе еще одного метода экспериментального определения эквивалентных масс.
Эквивалентные массы соединений.
Понятие эквивалентной массы было распространено и на соединения; в этом случае эквивалентная масса определяется как масса вещества, кратная эквивалентной массе элемента, являющегося ключевым для данного соединения. Например, для кислот ключевым элементом является водород, образующий в растворе ионы водорода; таким образом, эквивалентная масса кислоты есть масса кислоты, кратная 1,00797 массовым частям водорода, способного образовывать ионы водорода, т.е. водорода, который может быть замещен. Другими словами, эквивалентная масса кислоты равна ее молярной массе, деленной на основность кислоты. Эквивалентная масса основания есть масса основания, которая реагирует с эквивалентной массой любой кислоты и, следовательно, является химическим эквивалентом этой массы. Иначе можно сказать, что эквивалентная масса основания равна его молярной массе, деленной на валентность металла, образующего основание. Для солей эквивалентная масса обычно кратна эквивалентной массе металла, образовавшего эту соль; она равна молярной массе соли, деленной на произведение валентности металла и числа его атомов в молекуле соли. Для эквивалентной массы окислителей и восстановителей можно дать несколько определений. С практической точки зрения наиболее удобно определение, согласно которому эквивалентная масса есть количество вещества, кратное 7,9997 ч. кислорода (или реагирующее с ними) либо его эквиваленту. Другое определение основано на том, что при восстановлении этого количества кислорода происходит перенос одного электрона. В этом случае эквивалентная масса окислителя или восстановителя есть масса, соответствующая массе вещества, принимающего или отдающего один электрон в окислительно-восстановительной реакции.
Эквивалент. Закон зквивалентов. Определение эквивалентной массы вещества
Определение объема водорода
Задача № 11.
Некоторое количество металла, эквивалентная масса которого равна 27,9 г/моль, вытесняет из кислоты 700 мл водорода, измеренного при нормальных условиях. Определить массу металла.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Та как водород находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Мольный объём любого газа при н.у. равен 22,4л. Отсюда эквивалентный объём водорода равен 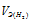
Тогда можно записать:
Отсюда:
Ответ: 1,74г.
Определение эквивалентной массы вещества
Задача № 12.
1,60г кальция и 2,61г цинка вытесняют из кислоты одинаковые количества водорода. Вычислить эквивалентную массу цинка, зная, что эквивалентная масса кальция равна 20,0 г/моль.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Ответ: 32,6г/моль.
Определение отношения масс реагирующих веществ
Задача № 13.
Серная и ортофосфорная кислоты имеют одинаковую молекулярную массу. Каково отношение масс этих кислот, пошедших на нейтрализацию одного и того же количества щелочи, если образовались соответственно сульфат и дигидроортофосфат?
Решение:
Формула сульфата имеет вид MeSO4, а дигидроортофосфата – MeH2PO4. Таким образом, на образование сульфата затрачивается две эквивалентные массы щёлочи, а на образование дигидроортофосфата – одна эквивалентная масса щёлочи. Так как H2SO4 с двумя эквивалентными массами щёлочи, то её эквивалентная масса в реакции нейтрализации равна М/2 г/моль, а фосфорная кислота реагирует с одной эквивалентной массой щёлочи, то её эквивалентная масса равна М/1г/моль. Отсюда, отношение мас этих кислот, с учётом, что их молекулярные массы равны будет иметь вид:
mH2SO4 : mH3PO4 = ½M : 1M = 1 : 2
Это можно подтвердить уравнениями реакций нейтрализации этих кислот с гидроксидом натрия:
H2SO4 +2NaOH = Na2SO4 + 2H2O;
H3PO4 + NaOH = NaH2PO4 +H2O.
Ответ: mH2SO4 : mH3PO4 = 1 : 2.
Задача № 14.
Медь образует два оксида. На определенное количество меди при образовании первого оксида пошло вдвое больше кислорода, чем при образовании второго. Каково отношение валентности меди в первом оксиде к ее валентности во втором?
Решение:
Согласно закону эквивалентов 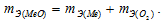
Таким образом, валентность меди в первом оксиде равна II, а во втором – I.
Ответ: 2 : 1.
Определение значения эквивалентной массы вещества
Задача № 15
При взаимодействии ортофосфорной кислоты со щелочью образовалась соль Na2HPO4. Найти для этого случая значение эквивалентной массы ортофосфорной кислоты.
Решение:
Уравнение реакции имеет вид:
H3PO4 + 2NaOH = Na2HPO4 + 2H2O
Эквивалент (эквивалентная масса) кислоты равна мольной массе (М) делённой на число атомов водорода, замещённых в данной реакции на металл (на число вступающих в реакцию атомов водорода). Так как при взаимодействии ортофосфорной кислоты со щёлочью образовалась соль Na2HPO4, т.е. на натрий заместилось два атома водорода в кислоте H3PO4. Следовательно, эквивалентная масса ортофосфорной кислоты в реакции со щёлочью при образовании гидрофосфата натрия равна М/2 = М(H3PO4)/2 = 98/ 2 = 49г/моль.
Ответ: 49г/моль.
Задача № 16
На нейтрализацию 2,45г кислоты идет 2,00г гидроксида натрия. Определить эквивалентную массу кислоты.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Эквивалентная масса гидроксида натрия равна М(NaOH)0/1 = 40г/моль.
Тогда
Ответ: 49г/моль.
Задача № 17
При взаимодействии 5,95г некоторого вещества с 2,75г хлороводорода получилось 4,40г соли. Вычислить эквивалентные массы вещества и образовавшейся соли.
Решение:
Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Эквивалентная масса хлороводорода равна М(HCl) = 36,5/1 = 36,5г/моль.
Тогда
а) Находим эквивалентную массу вещества:
б) Находим эквивалентную массу соли:
Ответ: а) 58,4г/моль; б) 78,97 г/моль.
Определение эквивалентного объема водорода
Задача № 18.
0,376г алюминия при взаимодействии с кислотой вытеснили 0,468л водорода, измеренного при нормальных условиях. Определить эквивалентный объем водорода, зная, что эквивалентная масса алюминия равна 8,99 г/моль.
Решение:
Если одно из веществ находится в газообразном состоянии, то, соответственно, его количество измеряется в объёмных единицах (мл, л, м3). Согласно закону эквивалентов, массы (объёмы) реагирующих друг с другом веществ m1 и m2 пропорциональны их эквивалентным массам (объёмам):
Ответ: 11,2л/моль.