Эквивалентная электропроводность растворов
Эквивалентной
электропроводностьюназывается
электрическая проводимость раствора
электролита толщиной 1 м, находящегося
между одинаковыми электродами с такой
площадью, чтобы объем жидкости, заключенный
между ними, содержал 1 моль химического
эквивалента растворенного вещества.
Таким образом,
если удельная электропроводность
характеризует проводимость единичного
объема раствора электролита (в системе
СИ – 1 м3), в котором
содержание данного вещества может быть
различным, то эквивалентная
электропроводность характеризует
электрическую проводимость раствора,
содержащего один моль химического
эквивалента растворенного вещества.
Причем объем самого раствора может
изменяться в широких пределах вплоть
до бесконечного при бесконечном
разбавлении.
О бщее
бщее
же количество электролита, определяющее
величину его эквивалентной
электропроводности, остается одним и
тем же при любой концентрации и в любом
объеме раствора. Схема, объясняющая
связь между удельной и эквивалентной
электропроводностью вещества, представлена
на рис. 83.
Рис. 83. Зависимость
между удельной и эквивалентной
электрическими проводимостями
Эквивалентная
электропроводность обозначается
греческой буквой λV(ламбда), причем индексом внизу показывают
обычно объем раствора (в м3), в
котором содержится 1 моль химического
эквивалента электролита.
Эквивалентная
электропроводность равна удельной
электропроводности 1 м3
раствора, умноженной на объем (V)
этого же раствора (в м3),
содержащий 1 моль химического эквивалента
электролита
λV=ϰ∙V
Учитывая, что 1/V= С (молярная концентрация эквивалента
электролита в растворе, моль/м3)
λV
= ϰ/C
Эквивалентная
электропроводность измеряется в
См ∙ моль–1 ∙ м2
или Ом–1 ∙ моль–1 ∙ м2.
В справочной литературе эквивалентную
электропроводность часто приводят в
единицах измерения См ∙ моль–1 ∙ см2
или Ом–1 ∙ моль–1 ∙ см2.
(При этом удельная электропроводность
ϰ
выражается в
Ом–1 ∙ см–1
или См ∙ см–1,
молярная концентрация эквивалента в
моль/см3).
Эквивалентная
электропроводность зависит от тех же
факторов, что и удельная.
Для сильных и
слабых электролитов λVвозрастает с уменьшением концентрации
раствора, достигая максимального
значения при достаточно большом
разбавленииV(рис. 84). Она
называется иначепредельной электрической
проводимостьюи обозначаетсяλ∞.
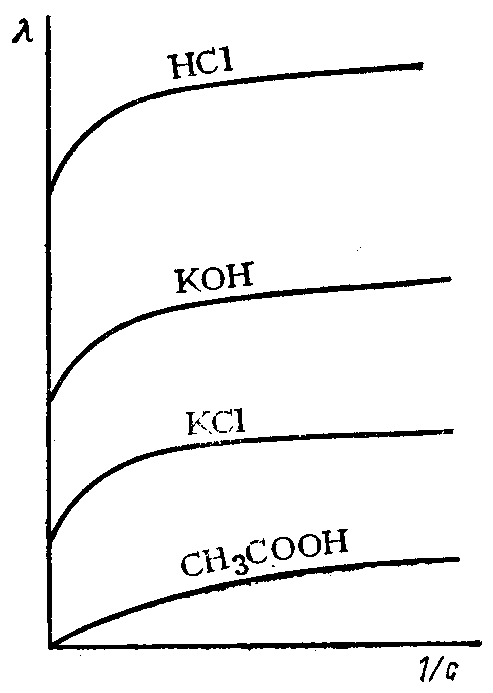
Рис. 84. Зависимость
эквивалентной электропроводности
растворов электролитов от степени
разбавления
В таких условиях
в растворах сильных электролитов ионы
находятся на достаточно больших
расстояниях друг от друга, электростатические
взаимодействия между ними отсутствуют,
ионные атмосферы не образуются.
В растворах слабых
электролитов степень диссоциации
достигает своей максимальной величины
(= 1) и все молекулы
распадаются на ионы.
Таким образом λ∞в таких условиях зависит только от
скорости движения ионов.
Кольрауш
установил, что при таком разведении
катионы и анионы проводят электричество
независимо друг от друга, т.к. силы
взаимодействия между ними отсутствуют.
В этим случае, эквивалентная
электропроводность раствора будет
равна сумме электропроводностей катионов
(λк) и анионов (λа)
λ∞= λк+ λа
Данное равенство
называется законом независимого движения
ионов или законом Кольрауша.
Величины λки λаназываются иначеподвижностями
катионов и анионов. Они, соответственно,
равны
λк=F ∙ uкλа = F ∙ ua
где
F – постоянная
Фарадея, равная 96500 k;
uк и ua
– абсолютные скорости движения (м/с),
соответственно, катионов и анионов при
приложенной разности потенциалов 1 В/м.
В таком случае
закон Кольрауша можно записать иначе
λ∞=F ∙ uк+F ∙ ua=F ∙ (uк+ua)
Таким образом,
эквивалентная электропроводность
электролита при бесконечном разбавлении
пропорциональна сумме абсолютных
скоростей движения его ионов.
Соседние файлы в папке LEKTsII_Obschaya_khimia
- #
- #
- #
- #
- #
- #
- #
Лекция 2
Электропроводность (удельная и эквивалентная), ее зависимость от концентрации и температуры. Методы измерения электропроводности.
Подвижность ионов, закон Кольрауша, аномальная подвижность ионов Н3О+ и ОН–.
Электропроводность К – величина, обратная электрическому сопротивлению R. Так как R = r  , то К =
, то К =  ×
×  = k
= k 

где r – удельное электрическое сопротивление; l – расстояние между электродами; S – площадь электрода; k – удельная электропроводность.
Удельная электропроводность k жидкости – это электропроводность одного кубического сантиметра раствора, заполняющего пространство между плоскими электродами одинаковой, очень большой площади, находящимися на расстоянии 1 см. Кубический сантиметр раствора должен находиться вдали от границ электрода. [k] = Ом-1× см-1.
По закону Ома : R = U/I ; U = E× l (Е – напряженность поля, или падение напряжения на 1 см расстояния; l – расстояние между электродами); I = i× S (i – плотность тока, или ток, приходящийся на 1 см2 поверхности электрода; S – площадь электрода). Тогда :
k 
 =
=  ; i = k× E
; i = k× E
При Е = 1 В/см i = k.
Рекомендуемые материалы
I =  ; i =
; i = 
Таким образом, k – это количество электричества, которое проходит в единицу времени через единицу поперечного сечения проводника при напряженности электрического поля 1 В/см.
Кривая зависимости удельной электропроводности растворов от концентрации обычно имеет максимум (четко выраженный для сильных электролитов и сглаженный для слабых). Наличие максимумов на кривых k – с можно объяснить следующим образом. В разбавленных растворах сильных электролитов (a = 1) электропроводность растет пропорционально числу ионов, которое, в свою очередь, растет с концентрацией. В концентрированных растворах сильных электролитов ионная атмосфера существенно уменьшает скорость движения ионов, и электропроводность падает. В слабых электролитах плотность ионной атмосферы мала и скорость движения ионов мало зависит от концентрации, однако с увеличением концентрации раствора заметно уменьшается степень диссоциации, что приводит к уменьшению концентрации ионов и падению электропроводности.
Удельная электропроводность зависит от температуры. Зависимость дается эмпирическим уравнением :
kt = k18 × [1 + a (t – 18)]
a – температурный коэффициент электропроводности; k18 (k25) – стандартное значение.

Эквивалентная электропроводность l [в см2/(г-экв×Ом)] – это электропроводность такого объема (j см3) раствора, в котором содержится 1 г-экв растворенного вещества, причем электроды находятся на расстоянии 1 см друг от друга.
Найдем связь между k и l . Представим себе погруженные в раствор параллельные электроды на расстоянии 1 см, имеющие весьма большую площадь. Электропроводность раствора, заключенного между поверхностями таких электродов, имеющими площадь, равную j см2, и есть эквивалентная электропроводность раствора. Объем раствора между этими площадями электродов равен j см3 и содержит 1 г-экв соли. Величина j , равная 1000/с см3/г-экв, называется разведением. Таким образом :
l = k× j ; l = 
Мольная электропроводность электролита – это произведение эквивалентной электропроводности на число грамм-эквивалентов в 1 моль диссоциирующего вещества.
Зависимость эквивалентной электропроводности от концентрации :
1. Зависимость l – с : с увеличением с величина l уменьшается сначала резко, а затем более плавно.
2. Зависимость l –  : для сильных электролитов соблюдается медленное линейное уменьшение l с увеличением
: для сильных электролитов соблюдается медленное линейное уменьшение l с увеличением  , что соответствует эмпирической формуле Кольрауша :
, что соответствует эмпирической формуле Кольрауша :
l = l¥ – А
l¥ – предельная эквивалентная электропроводность при бесконечном разведении : с ® 0 , j ® ¥ .
3. Зависимость l – j : значение l сильных электролитов растет с увеличением j и асимптотически приближается к l¥ . Для слабых электролитов значение l также растет с увеличением j, но приближение к пределу и величину предела в большинстве случаев практически нельзя установить.

Все вышесказанное касалось электропроводности водных растворов. Для электролитов с другими растворителями рассмотренные закономерности сохраняются, но имеются и отступления от них, например, на кривых l – с часто наблюдается минимум (аномальная электропроводность).
Способы измерения электропроводности – самостоятельно.
ПОДВИЖНОСТЬ ИОНОВ.
Свяжем электропроводность электролита со скоростью движения его ионов в электрическом поле. Для вычисления электропроводности надо подсчитать число ионов, проходящих через поперечное сечение электролитического сосуда в единицу времени. Так как электричество переносится ионами различных знаков, движущимися в противоположных направлениях, то общая сила тока складывается из количеств электричества, перенесенных катионами (I+) и анионами (I–) :
I = I+ + I–
Обозначим:
u¢ – скорость движения катионов (см/с);
v¢ – скорость движения анионов (см/с);
с¢ – эквивалентная концентрация (г-экв/см3);
q – поперечное сечение цилиндрического сосуда (см2);
l – расстояние между электродами (см);
Е – разность потенциалов между электродами (В).
Подсчитаем количество катионов, проходящих через поперечное сечение электролита в 1 секунду. За это время через сечение пройдут все катионы, находившиеся на расстоянии не более чем u¢ см от выбранного сечения, т.е. все катионы в объеме u¢q :
n+ = u¢qc+
Т.к. каждый г-экв ионов несет согласно закону Фарадея F =96485 к электричества, то сила тока (в А) :
I+ = n+ F = u¢qc+ F
Аналогично для анионов :
I– = n– F = v¢qc– F
Для суммарной силы тока (с+ = с– = с¢) :
I = I+ + I– = (u¢ + v¢)qc¢F
Скорости движения ионов u¢ и v¢ зависят от природы ионов, напряженности электрического поля Е/l , концентрации, Т, вязкости среды и т.п. Пусть все факторы постоянны, кроме напряженности электрического поля; можно считать, что скорость ионов пропорциональна приложенной силе, т.е. напряженности поля :
u¢ = u  , v¢ = v
, v¢ = v 
u, v – скорости ионов в стандартных условиях, т.е. при напряженности поля, равной 1 В/см; они называются абсолютными подвижностями ионов и измеряются в см2/(с×В).
I = (u + v)c¢qFE/l
По закону Ома I = E/R = E×K = E×k 
Отсюда k = (u + v)c¢qF/S = (u + v)c¢F (т.к. q º S)
l =  ; с¢ = с/1000 ; l = k/с¢ = (u + v)F
; с¢ = с/1000 ; l = k/с¢ = (u + v)F
u×F и v×F – это скорости движения ионов, выраженные в электростатических единицах; они называются подвижностями ионов :
u×F = l+ , v×F = l–
Для сильных электролитов : l = l+ + l–
Для слабых электролитов : с+ = с×a , с– = с×a , l = (l+ + l–)×a
При бесконечном разведении (j ® ¥ , a ® 1 , с+ = с– = с) :
l¥ = lо+ + lо–
– как для сильных, так и для слабых электролитов. Величины lо+ и lо– являются предельными подвижностями ионов. Они равны эквивалентным электропроводностям катиона и аниона при бесконечном разведении и измеряются в тех же единицах, что и l и l¥ , т.е. в см2/(Ом×г-экв). Вышеприведенное уравнение является выражением закона Кольрауша : эквивалентная электропроводность при бесконечном разведении равна сумме предельных подвижностей ионов.
Т.о., для всех электролитов можно записать :
lс = aс×l¥ , aс = lс / l¥
l+ и l– зависят от концентрации (разведения), особенно для сильных электролитов; lо+ и lо– – табличные величины. Все эти величины относятся к 1 г-экв ионов.
Подвижность является важнейшей характеристикой ионов, отражающей их специфическое участие в электропроводности электролита. В водных растворах все ионы, за исключением ионов Н3О+ и ОН–, обладают подвижностями одного порядка; их абсолютные подвижности (u и v) равны нескольким см в час.
Эквивалентная электропроводность растворов солей выражается величинами порядка 100 – 130 см2/(г-экв×Ом). Ввиду исключительной подвижности иона гидроксония величины l¥ для кислот в 3-4 раза больше, чем для солей; щелочи занимают промежуточное положение.
Движение иона можно уподобить движению макроскопического шарика в вязкой среде и применить в этом случае формулу Стокса :
u = 
где е – заряд электрона; z – число элементарных зарядов иона; r – эффективный радиус иона; h – коэффициент вязкости; E/l – напряженность поля.
Движущую силу – напряженность поля Е/l при вычислении абсолютных подвижностей принимаем равной единице. Следовательно, скорость движения ионов обратно пропорциональна их радиусу. Рассмотрим ряд Li+, Na+, K+. Так как в указанном ряду истинные радиусы ионов увеличиваются, то подвижности должны уменьшаться в той же последовательности. Однако в действительности это не так. Подвижности увеличиваются при переходе от Li+ к K+ почти в два раза. Из этого можно сделать заключение, что в растворе и ионной решётке ионы обладают разными радиусами. При этом чем меньше истинный (кристаллохимический) радиус иона, тем больше его эффективный радиус в электролите. Это явление можно объяснить тем, что в растворе ионы не свободны, а гидратированы. Тогда эффективный радиус движущегося в электрическом поле иона будет определяться в основном степенью его гидратации, то есть количеством связанных с ионом молекул воды.
Связь иона с молекулами растворителя ионно-дипольная, а так как напряжённость поля на поверхности иона лития гораздо больше, чем на поверхности иона калия, то степень гидратации иона лития больше степени гидратации иона калия. Согласно формуле Стокса многозарядные ионы должны обладать большей подвижностью, чем однозарядные. Однако скорости движения многозарядных ионов мало отличаются от скоростей движения однозарядных, что, очевидно, объясняется большей степенью их гидратации.
ПОДВИЖНОСТЬ ИОНОВ ГИДРОКСОНИЯ И ГИДРОКСИЛА.
Аномально высокая подвижность ионов гидроксония и гидроксила была отмечена давно. Раньше считали, что в растворе существуют ионы водорода, большая скорость движения которых объясняется исключительно малым радиусом ионов. Установили, что в растворе имеются не ионы водорода H+, а ионы гидроксония H3O+. Эти ионы, так же как и ионы гидроксила, гидратированы, и эффективные радиусы их имеют тот же порядок, что и радиусы других ионов. Следовательно, если бы механизм переноса электричества этими ионами был обычным, то подвижность их не отличалась бы существенно от подвижностей других ионов. Это и наблюдается в действительности в большинстве неводных растворов. Аномально высокая подвижность H3O+ и OH– проявляется только в растворах в воде и простейших спиртах, что, очевидно, связано с тем, что они являются ионами самого растворителя – воды.
Известно, что процесс диссоциации воды протекает по схеме
H2O + H2O = OH– + H3O+
Ещё посмотрите лекцию “Последовательности, тексты с разветвлениями” по этой теме.
ï¾H+¾
и сводится к переходу протона от одной молекулы воды к другой. Образовавшиеся ионы гидроксония непрерывно обмениваются протонами с окружающими молекулами воды, причём обмен протонами происходит хаотически. Однако при создании разности потенциалов кроме беспорядочного движения возникает и направленное : часть протонов начинает двигаться к катоду и, следовательно, переносит электричество.
Таким образом, электричество переносится в основном не ионами гидроксония, а протонами, перескакивающими от одной молекулы воды к другой ориентированно.
Благодаря описанному движению протонов увеличивается электропроводность раствора, потому что протоны имеют очень малый радиус и проходят не весь путь до катода, а лишь расстояния между молекулами воды. Этот тип проводимости можно назвать эстафетным или цепным.
Аналогично можно объяснить большую подвижность гидроксильных ионов, только в этом случае переход протонов происходит не от ионов гидроксония к молекулам воды, а от молекул воды к ионам гидроксила, что приводит к кажущемуся перемещению ионов гидроксила по направлению к аноду. Ионы гидроксила действительно появляются в анодном пространстве, но это объясняется в основном не движением их, а перескоком протонов по направлению к катоду.
Конечно, ионы H3O+ и OH–, как таковые, также движутся при создании разности потенциалов между электродами и переносят электричество, но вклад их в электропроводность приблизительно такой же, как и вклад других ионов. Большая электропроводность кислот и оснований объясняется именно цепным механизмом электропроводности с участием протонов.

Параллельным соединением резисторов (или приемников энергии, ветвей, сопротивлений) называется такое, при котором к одним и тем же двум узлам электрической цепи (рисунок 1) присоединены несколько резисторов (ветвей).

Рис. 1 Изображение параллельного соединения трех резисторов
Проводимость при параллельном соединении![]()
![]()
Сопротивление при параллельном соединении:
Для трёх параллельно соединенных сопротивлений
![]()
Для двух параллельно соединенных сопротивлений
![]()
Для ветвей с одинаковым сопротивлением где n количество ветвей
![]() .
.
Ток при параллельном соединении
![]()
Мощность при параллельном соединении
![]()
Доказательство
Так как резисторы присоединены к одним и тем же узлам, то каждый из них находится под одинаковым напряжением U. Согласно закону Ома токи в сопртивлениях определяются по формулам
![]()
Из этих формул следует, что токи в параллельных ветвях с сопротивлениями распределяются прямо пропорционально проводимостям ветвей или обратно пропорционально их сопротивлениям. Ряд параллельно соединенных резисторов можно заменить эквивалентным с сопротивлением R, значение которого должно быть таким, чтобы при том же напряжении на выводах ток в эквивалентном резисторе был равен сумме токов в отдельных ветвях:
![]()
Эквивалентная проводимость
![]() (1)
(1)
т. е. эквивалентная проводимость параллельного соединения резисторов равна сумме проводимостей всех параллельных ветвей. Следовательно, эквивалентное сопротивление будет меньше самого малого из параллельно соединенных резисторов.
Формула (1) дает возможность определить и эквивалентное сопротивление параллельного соединения резисторов. Например, при трех ветвях эквивалентная проводимость
![]()
и эквивалентное сопротивление
![]() .
.
Для двух резисторов
![]()
Если сопротивление ветвей одинаково R1 = R2 = R3, то можно воспользоваться формулой
![]()
в общем случае при соединении n резисторов с одинаковым сопротивлением R1 эквивалентное сопротивление равно
![]() .
.
Мощности параллельно соединенных резисторов равна сумме мощностей всех резисторов
![]()
|
|
Макеты страниц
ГЛАВА III. КОНДУКТОМЕТРИЯ и КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
А. ТЕОРЕТИЧЕСКИЕ ОСНОВЫ МЕТОДА
§ 1. Удельная и эквивалентная электропроводность
Электропроводность растворов электролитов обусловливается движением ионов под действием электрического поля. Перенос электричества в растворах электролитов осуществляется ионами. Как и все проводники, растворы электролитов характеризуются определенным сопротивлением. Величина, обратная этому сопротивлению, называется электропроводностью:

где  — сопротивление раствора, ом;
— сопротивление раствора, ом;  — электропроводность раствора, выражаемая в обратных омах,
— электропроводность раствора, выражаемая в обратных омах,  .
.
Сопротивление раствора электролита прямо пропорционально расстоянию  между погруженными в него электродами и обратно пропорционально их площади
между погруженными в него электродами и обратно пропорционально их площади  :
:

Коэффициент пропорциональности  называется удельным сопротивлением. Если
называется удельным сопротивлением. Если  , то
, то  .
.
Следовательно, удельное сопротивление равно сопротивлению столба жидкости длиной в 1 см с поперечным сечением  , т. е. сопротивлению
, т. е. сопротивлению  раствора.
раствора.
Удельная электропроводность  представляет собой величину, обратную удельному сопротивлению:
представляет собой величину, обратную удельному сопротивлению:

Таким образом, удельная электропроводность соответствует электропроводности  раствора, находящегося между электродами площадью в
раствора, находящегося между электродами площадью в  , расположенными на расстоянии 1 см друг от друга.
, расположенными на расстоянии 1 см друг от друга.
Электропроводность электролитов удобнее относить к числу грамм-эквивалентов растворенного вещества. Поэтому было введено понятие эквивалентной электропроводности: Эквивалентная электропроводность (X) равна электропроводности такого объема раствора, помещенного между двумя параллельными электродами, расположенными на расстоянии 1 см, который содержит один грамм-эквивалент вещества.
Эквивалентная и удельная электропроводность связаны следующей зависимостью. Если концентрация электролита (С) выражена в грамм-эквивалентах на  , то в
, то в  раствора содержится
раствора содержится  грамм-эквивалентов. Объем (V) в кубических сантиметрах, содержащий 1 г-экв растворенного вещества, называется разбавлением.
грамм-эквивалентов. Объем (V) в кубических сантиметрах, содержащий 1 г-экв растворенного вещества, называется разбавлением.
Этот объем равен  . Эквивалентную электропроводность можно выразить через удельную электропроводность и разбавление
. Эквивалентную электропроводность можно выразить через удельную электропроводность и разбавление  -экв):
-экв):

Эквивалентные электропроводности (подвижности) ионов. Предположим что в растворе электролита на расстоянии I находятся электроды площадью S, к которым приложена разность потенциалов  как в растворах электричество переносится ионами, величина удельной электропроводности зависит от концентрации и заряда ионов, а также скорости их движения. Допустим, что электролит образует однозарядные ионы. Обозначим концентрацию электролита (С) в грамм-эквивалентах, а степень его диссоциации через а. Абсолютные скорости движения катионов и анионов при падении потенциала в 1 в на 1 см назовем
как в растворах электричество переносится ионами, величина удельной электропроводности зависит от концентрации и заряда ионов, а также скорости их движения. Допустим, что электролит образует однозарядные ионы. Обозначим концентрацию электролита (С) в грамм-эквивалентах, а степень его диссоциации через а. Абсолютные скорости движения катионов и анионов при падении потенциала в 1 в на 1 см назовем  и
и  . Если разность потенциалов между электродами Е, а расстояние между ними
. Если разность потенциалов между электродами Е, а расстояние между ними  , скорости катионов и анионов имеют значение
, скорости катионов и анионов имеют значение  и
и  . Сила тока, проходящего через раствор, зависит от количества ионов обоих знаков, перемещающихся в противоположных направлениях. Через поперечное сечение S между электродами в 1 сек пройдут все катионы и анионы, содержащиеся в объеме
. Сила тока, проходящего через раствор, зависит от количества ионов обоих знаков, перемещающихся в противоположных направлениях. Через поперечное сечение S между электродами в 1 сек пройдут все катионы и анионы, содержащиеся в объеме  .
.
Сила тока, т. е. количество электричества в кулонах, перенесенное ионами в 1 сек, равна:

где  — число Фарадея, равное 96 500 кулонов.
— число Фарадея, равное 96 500 кулонов.
Согласно закону  , отсюда электропроводность равна.
, отсюда электропроводность равна.

Если  , а 1—1 см, то W представляет собой удельную электропроводность
, а 1—1 см, то W представляет собой удельную электропроводность  :
:

Поскольку эквивалентная электропроводность  , находим:
, находим:

Абсолютные скорости движения ионов очень малы, поэтому пользуются величинами в F раз большими, называемыми подвижностями ионов. Подвижности ионов представляют собой эквивалентные электропроводности ионов, которые обозначают  и
и  . Отсюда значения удельной и эквивалентной электропроводности могут быть выражены:
. Отсюда значения удельной и эквивалентной электропроводности могут быть выражены:

и

При бесконечно большом разбавлении  и эквивалентная электропроводность стремится к наибольшему значению
и эквивалентная электропроводность стремится к наибольшему значению  . В этом случае
. В этом случае

Таким образом, предельная эквивалентная электропроводность равна сумме предельных эквивалентных электропроводностей ионов или сумме подвижностей ионов при бесконечном разбавлении. Предельные эквивалентные электропроводности некоторых ионов приведены в табл. 4.
ТАБЛИЦА 4. Предельная эквивалентная электропроводность (подвижность) ионов  в водных растворах при
в водных растворах при 

Подвижности ионов имеют большое значение для кондуктометрических определений,  этих величин, изменяющихся в связи с изменеаием состава ионов, можно предвидеть характер изменения
этих величин, изменяющихся в связи с изменеаием состава ионов, можно предвидеть характер изменения  в процессе титрования.
в процессе титрования.
Влияние природы электролита и растворителя на электропроводность. Природа электролитами растворителя оказывает большое влияние на электропроводность. Как видно из табл. 4, ионы обладают различной подвижностью. Аномально высокой подвижностью в водных растворах обладают  -ионы
-ионы  и
и  -ионы
-ионы  . Это объясняется специфическим механизмом их движения в растворе. Перемещение этих ионов к электродам осуществляется «эстафетным» путем. Находящиеся в растворе ионы гидроксония
. Это объясняется специфическим механизмом их движения в растворе. Перемещение этих ионов к электродам осуществляется «эстафетным» путем. Находящиеся в растворе ионы гидроксония  передают свои протоны соседним молекулам воды, которые в свою очередь превращаются в ионы гидроксония, а протоны перемещаются по направлению к катоду. Аналогичные процессы происходят и с участием гидроксильных ионов. Другие катионы и анионы в водных растворах сравнительно мало различаются своей подвижностью; изменение подвижности наблюдается в пределах 30—70.
передают свои протоны соседним молекулам воды, которые в свою очередь превращаются в ионы гидроксония, а протоны перемещаются по направлению к катоду. Аналогичные процессы происходят и с участием гидроксильных ионов. Другие катионы и анионы в водных растворах сравнительно мало различаются своей подвижностью; изменение подвижности наблюдается в пределах 30—70.
В других растворителях электропроводность электролитов изменяется. Наибольшее влияние при этом оказывает вязкость растворителя и его диэлектрическая проницаемость; изменяются скорости движения ионов, степени диссоциации электролитов, а в растворителях с низкими значениями диэлектрической проницаемости наблюдаются процессы ассоциации ионов.
Подвижности водородных и гидроксильных ионов уменьшаются и в некоторых средах мало отличаются от подвижностей других ионов.
Влияние концентрации электролита на электропроводность. Сильные электролиты. Сильные электролиты в водных растворах практически полностью диссоциированы и для них принимают степень диссоциации а, равную 1. Однако абсолютные скорости движения, а следовательно, и подвижности зависят от концентрации ионов в растворе, что объясняется силами межионного взаимодействия. С увеличением концентрации уменьшаются расстояния между ионами и увеличиваются межионные взаимодействия, что приводит к торможению движения катионов и анионов, а следовательно, к понижению их подвижности. Поэтому эквивалентная электропроводность сильных электролитов, имеющая максимальное значение при бесконечном разбавлении, уменьшается с повышением концентрации.
Отношение эквивалентной электропроводности при данной концентрации к эквивалентной электропроводности при бесконечном разбавлении называется коэффициентом электропроводности  . Этим коэффициентом вносится поправка на силы межионного взаимодействия. Величину
. Этим коэффициентом вносится поправка на силы межионного взаимодействия. Величину  электропроводности сильного электролита при данной концентрации с учетом коэффициента электропроводности находят по формуле:
электропроводности сильного электролита при данной концентрации с учетом коэффициента электропроводности находят по формуле:

При малых концентрациях зависимость эквивалентной электропроводности сильного электролита от концентрации выражается эмпирическим уравнением:

где а постоянная, зависящая от природы растворителя и температуры; С — концентрация электролита.
Удельная электропроводность сильных электролитов с учетом коэффициента электропроводности выражается формулой:

С увеличением концентрации удельная электропроводность сильных электролитов сначала возрастает, а затем может понижаться, что приводит к появлению максимума удельной электропроводности. Это объясняется влиянием двух факторов. С одной стороны, увеличение концентрации вызывает повышение электропроводности, так как увеличивается содержание ионов в единице объема. С другой стороны, увеличение концентрации снижает скорость движения ионов, что уменьшает проводимость. Однако максимумы обнаруживаются для концентрированных растворов, которые обычно не применяются в аналитической практике.
Слабые электролиты. Растворы слабых электролитов имеют невысокие концентрации ионов, и межионные взаимодействия в них невелики. Поэтому в разбавленных растворах  может быть принят равным единице, а эквивалентные электропроводности ионов можцо считать равными их предельному значению
может быть принят равным единице, а эквивалентные электропроводности ионов можцо считать равными их предельному значению  . Следовательно, в разбавленных растворах удельная и эквивалентная электропроводности равны:
. Следовательно, в разбавленных растворах удельная и эквивалентная электропроводности равны:

и

Таким образом, большое влияние на электропроводность слабых электролитов оказывает степень их диссоциации. С разбавлением эквивалентная электропроводность слабых электролитов растет вследствие увеличения степени диссоциации и принимает максимальное значение при бесконечном разбавлении  .
.
При кондуктометрическом определении слабых электролитов большое значение имеют величины констант диссоциации, так как они дают возможность рассчитывать равновесные концентрации ионов при данном разбавлении и предугадывать характер изменения проводимости раствора при титровании.
Удельная электропроводность слабых электролитов незначительно увеличивается с повышением концентрации. При высоких концентрациях уменьшение степени диссоциации может вызвать ее понижение.
Если раствор представляет смесь электролитов, величину удельной электропроводности разбавленных растворов вычисляют по уравнению:

 — концентрация ионов;
— концентрация ионов;  — эквивалентные электропроводности ионов.
— эквивалентные электропроводности ионов.
Влияние температуры на электропроводность. Зависимость удельной электропроводности от температуры выражают уравнением:

где  — удельная электропроводность раствора при
— удельная электропроводность раствора при  ;
;  — коэффициенты, зависящие от природы электролита и концентрации;
— коэффициенты, зависящие от природы электролита и концентрации;  — температура.
— температура.
С повышением температуры электропроводность увеличивается, так как уменьшение вязкости раствора приводит к увеличению подвижности ионов. Увеличение степени диссоциации также может привести к повышению электропроводности. Повышение температуры на 1 град вызывает увеличение электропроводности раствора на  .
.
Оглавление
- ПРЕДИСЛОВИЕ
- ВВЕДЕНИЕ
- ГЛАВА I. ОСНОВЫ ФИЗИКО-ХИМИЧЕСКИХ (ИНСТРУМЕНТАЛЬНЫХ) МЕТОДОВ АНАЛИЗА
- § 1. Особенности физико-химических методов анализа
- § 2. Области применения инструментальных методов анализа
- § 3. Анализ веществ высокой чистоты
- § 4. Повышение чувствительности и точности методов определения следов примесей
- § 5. Инструментальные методы титрования
- § 6. Применение физико-химических методов анализа для определения индивидуальных соединений
- § 7. Применение физико-химических методов для анализа смесей веществ
- § 8. Классификация инструментальных количественных методов анализа
- § 9. Электрохимические методы анализа
- § 10. Спектральные (оптические) методы анализа
- § 11. Хроматографические методы анализа
- § 12. Радиометрические методы анализа
- § 13. Масс-спектрометрические методы анализа
- § 14. Физико-химический анализ по Н. С. Курнакову
- § 15. Другие методы анализа
- ГЛАВА II. ПОТЕНЦИОМЕТРИЯ И ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Зависимость величины электродных потенциалов от концентрации (активности)
- § 2. Применение потенциометрического метода анализа
- § 3. Потенциометрическое титрование
- § 4. Потенциометрическое титрование без тока (i=0)
- § 5. Различные способы нахождения конечной точки потенциометрического титрования
- § 6. Некомпенсационный метод потенциометрического титрования
- § 7. Потенциометрическое титрование под током (i != 0)
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 8. Измерение электродвижущей силы
- § 9. Установка для поляризации электродов при потенциометрическом титровании под током
- § 10. Некоторые приборы, применяемые в потенциометрическом титровании
- § 11. Электроды
- В. ПРАКТИЧЕСКИЕ РАБОТЫ ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ БЕЗ ТОКА (i=0)
- § 12. Кислотно-основное титрование
- § 13. Титрование по методу окисления — восстановления
- § 14. Титрование по методу осаждения
- § 15. Титрование по методу комплексообразования
- ПОТЕНЦИОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ ПОД ТОКОМ (i != 0)
- § 16. Титрование по методу окисления — восстановления
- ГЛАВА III. КОНДУКТОМЕТРИЯ и КОНДУКТОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Удельная и эквивалентная электропроводность
- § 2. Кондуктометрическне методы анализа
- § 3. Кислотно-основное титрование
- § 4. Титрование, основанное на реакциях осаждения
- § 5. Титрование, основанное на реакциях окисления — восстановления
- § 6. Титрование, основанное на реакциях комплексообразования
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 7. Измерение электропроводности растворов
- § 8. Конструкции электролитических ячеек
- § 9. Измерения в хронокондуктометрическом титровании
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 10. Подготовка к определению
- §11. Определение индивидуальных кислот методом кондуктометрического титрования
- § 12. Определение индивидуальных оснований методом кондуктометрического титрования
- § 13. Анализ смесей оснований методом кондуктометрического титрования
- § 14. Определение солей методом кондуктометрического титрования
- § 15. Анализ смесей кислот и солей слабых оснований методом кондуктометрического титрования
- § 16. Анализ смесей кислот методом хронокондуктометрического титрования
- § 17. Анализ смесей оснований и солей слабых кислот методом хронокондуктометрического титрования
- ГЛАВА IV. ВЫСОКОЧАСТОТНОЕ ТИТРОВАНИЕ
- § 1. Общие положения теории высокочастотного титрования
- § 2. Физические основы и погрешности метода высокочастотного титрования
- § 3. Физические основы метода диэлкометрического титрования
- § 4. Погрешности метода диэлкометрического титрования
- ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ЕМКОСТНОГО ТИПА
- § 5. Электрическая эквивалентная схема ячейки и физические процессы, протекающие в ее объеме
- § 6. Импеданс и полная проводимость ячейки
- § 7. Характеристические кривые ячейки
- § 8. Чувствительность ячейки
- § 9. Критерий применимости и постоянная с-ячейки
- ТЕОРИЯ ИЗМЕРИТЕЛЬНЫХ ЯЧЕЕК ИНДУКТИВНОГО ТИПА
- § 10. Электрическая эквивалентная схема ячейки
- § 11. Импеданс и характеристические кривые ячейки
- § 12. Критерий применимости и постоянная L-ячейки
- § 13. Влияние на характеристические кривые ячейки ее некомпенсированного электрического поля
- ДИАГРАММЫ СООТВЕТСТВИЯ
- § 14. Диаграмма соответствия для титрования по активной составляющей полной проводимости
- § 15. Диаграмма соответствия для титрования по реактивной составляющей полной проводимости
- § 16. Выбор типа диаграмм
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 17. Измерительные ячейки (датчики) высокочастотного метода и области их применения
- § 18. Классификация аппаратуры высокочастотного метода
- § 19. Высокочастотные титраторы
- § 20. Общие правила работы с приборами для высокочастотного анализа
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 21. Высокочастотное титрование стандартных растворов
- § 22. Высокочастотное титрование растворов неизвестной концентрации
- ГЛАВА V. ПОЛЯРОГРАФИЧЕСКИЙ МЕТОД АНАЛИЗА И АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Предельный, или диффузионный, ток
- § 2. Возникновение диффузионного тока на твердых микроэлектродах
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ПОЛЯРОГРАФИЧЕСКОГО АНАЛИЗА
- § 3. Полярографы
- § 4. Электролитическая ячейка
- § 5. Электролизеры
- § 6. Электроды сравнения
- § 7. Снятие полярограммы на полярографической установке с визуальным полярографом
- § 8. Методы количественного полярографического анализа
- § 9. Правила техники безопасности при работе с металлической ртутью
- В. НОВЫЕ НАПРАВЛЕНИЯ В ПОЛЯРОГРАФИИ
- § 10. Амальгамная полярография с накоплением
- § 11. Осциллографическая полярография
- § 12. Переменнотоковая полярография
- Г. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ ПОЛЯРОГРАФИЧЕСКОГО МЕТОДА АНАЛИЗА
- § 13. Примеры полярографических определений
- АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 14. Особенности амперометрического титрования
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
- § 15. Схема установки и применяемые электроды
- § 16. Амперометрическое титрование с двумя индикаторными электродами
- В. ПРАКТИЧЕСКИЕ РАБОТЫ С ПРИМЕНЕНИЕМ АМПЕРОМЕТРИЧЕСКОГО ТИТРОВАНИЯ
- § 17. Примеры амперометрического титрования
- ГЛАВА VI. КУЛОНОМЕТРИЯ И КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 1. Сущность и классификация кулонометрических методов
- ПРЯМАЯ КУЛОНОМЕТРИЯ
- § 2. Прямая кулонометрия при постоянном потенциале рабочего электрода (прямая потенциостатическая кулонометрия)
- § 3. Использование прямой потенциостатической кулонометрии
- § 4. Прямая кулонометрия при постоянной силе тока электролиза (прямая амперостатическая кулонометрия)
- § 5. Использование прямой амперостатической кулонометрии
- КУЛОНОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ
- § 6. Кулонометрическое титрование при постоянной силе тока электролиза
- § 7. Использование амперостатического кулонометрического титрования
- § 8. Кулонометрическое титрование првд постоянном потенциале рабочего электрода
- § 9. Особенности кулонометрических методов анализа
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 10. Электроды
- § 11. Электролизеры
- § 12. Приборы для измерения количества электричества, израсходованного на электролиз вещества
- § 13. Приборы, обеспечивающие стабильность потенциала рабочего электрода или силы тока электролиза, и установки для кулонометрического анализа
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 14. Работы, выполняемые методом прямой кулонометрии
- § 15. Работы, выполняемые методом косвенной кулонометрии, или кулонометрического титрования, при постоянной силе тока электролиза
- ГЛАВА VII. СПЕКТРАЛЬНЫЕ (ОПТИЧЕСКИЕ) МЕТОДЫ АНАЛИЗА
- § 1. Общая характеристика метода
- § 2. Классификация методов эмиссионного спектрального анализа
- § 3. Качественный спектральный анализ
- § 4. Полуколичественные методы спектрального анализа
- § 5. Количественный спектральный анализ
- § 6. Основы фотографического метода эмиссионного количественного анализа
- § 7. Зависимость между почернением фотопластинки и интенсивностью излучения
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 8. Источники возбуждения спектров
- § 9. Спектральные приборы
- § 10. Вспомогательные приборы и принадлежности
- § 11. Микрофотометр МФ-2
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 12. Качественный анализ при помощи стилоскопа
- § 13. Качественный анализ фотографическим методом при помощи спектра железа в ультрафиолетовой области
- § 14. Полуколичественный анализ
- § 15. Количественный анализ
- СПЕКТРОФОТОМЕТРИЯ ПЛАМЕНИ
- § 16. Общая характеристика метода
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 17. Схема установки, применяемой для анализа методом спектрофотометрии пламени
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 18. Определения по методу спектрофотометрии пламени
- АТОМНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
- § 19. Общая характеристика метода
- МОЛЕКУЛЯРНО-АБСОРБЦИОННЫЙ СПЕКТРАЛЬНЫЙ АНАЛИЗ
- § 20. Общая характеристика метода
- § 21. Законы поглощения света
- § 22. Отклонения от закона Бугера—Ламберта—Бера
- § 23. Качественный анализ спектрофотометрическим методом
- § 24. Количественный анализ спектрофотометрическим методом
- § 25. Методы определения концентрации веществ, поглощающих в видимой и ультрафиолетовой областях спектра
- § 26. Определение нескольких компонентов в растворе
- § 27. Определение концентрации вещества в растворе дифференциальным методом
- § 28. Выбор толщины слоя и оптимальной концентрации исследуемого раствора
- § 29. Выбор длины волны поглощаемого излучения при спектрофотометрических измерениях
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 30. Приборы, применяемые для спектрофотометрического анализа в ультрафиолетовой и видимой областях спектра
- § 31. Приборы, применяемые для колориметрического анализа
- § 32. Приборы, применяемые для спектрофотометрического анализа в инфракрасной области спектра
- § 33. Нулевые растворы
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 34. Определение в ультрафиолетовой области спектра
- § 35. Определение в видимой области спектра
- § 36. Определение в инфракрасной области спектра
- СПЕКТРОФОТОМЕТРИЧЕСКИЕ (ФОТОМЕТРИЧЕСКИЕ) МЕТОДЫ ТИТРОВАНИЯ
- § 37. Общая характеристика метода
- § 38. Кривые спектрофотометрического титрования
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ ТИТРОВАНИЯ
- § 39. Установки для спектрофотометрического титрования
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 40. Спектрофотометрическое титрование
- НЕФЕЛОМЕТРИЧЕСКИЙ И ТУРБИДИМЕТРИЧЕСКИЙ МЕТОДЫ АНАЛИЗА
- § 41. Общая характеристика методов
- Б. АППАРАТУРА И ТЕХНИКА ВЫПОЛНЕНИЯ АНАЛИЗА
- § 42. Приборы, применяемые для нефелометрических и турбидиметрических измерений
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 43. Нефелометрические и турбидиметрические определения
- § 44. Фототурбидиметрическое и фотонефелометрическое титрование
- ГЛАВА VIII. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Классификация хроматографических методов анализа
- § 2. Адсорбционная хроматография
- § 3. Разновидности газовой хроматографии
- § 4. Распределительная хроматография
- § 5. Ионообменная хроматография
- § 6. Константа ионного обмена
- § 7. Осадочная хроматография
- § 8. Окислительно-восстановительная хроматография
- § 9. Адсорбционно-комплексообразовательная хроматография
- § 10. Хроматографические колонки, применяемые в адсорбционно-жидкостной хроматографии
- § 11. Аппаратура, применяемая в газовой хроматографии
- § 12. Приборы и материалы, применяемые в распределительной хроматографии
- § 13. Колонки, применяемые в ионообменной хроматографии
- § 14. Колонки, применяемые в осадочной и окислительновосстановительной хроматографии
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 15. Работы по методу адсорбционной (жидкостной и газовой) хроматографии
- § 16. Работы по методу распределительной хроматографии
- § 17. Работы по методу ионообменной хроматографии
- § 18. Работы по методу осадочной хроматографии
- § 19. Работы по методу окислительно-восстановительной хроматографии
- § 20. Работы по методу адсорбционно-комплексообразовательной хроматографии
- ГЛАВА IX. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
- § 1. Виды радиоактивного распада
- § 2. Скорость распада
- § 3. Взаимодействие излучения с веществом
- § 4. Ошибки при измерении радиоактивности
- Б. ЭЛЕМЕНТЫ ТЕХНИКИ БЕЗОПАСНОСТИ ПРИ РАБОТЕ С РАДИОАКТИВНЫМИ ВЕЩЕСТВАМИ
- § 5. Понятия и единицы измерения
- § 6. Классификация источников радиоактивного излучения и радиоактивных изотопов
- § 7. Классификация химических операций с радиоактивными веществами
- § 8. Устройство лабораторий и классификация работ
- § 9. Специальное оборудование для работ с радиоактивными веществами
- § 10. Средства индивидуальной защиты
- § 11. Проведение работ в химической лаборатории с радиоактивными веществами
- § 12. Правила работы с радиоактивными веществами
- В. МЕТОДЫ РЕГИСТРАЦИИ РАДИОАКТИВНОГО ИЗЛУЧЕНИЯ
- § 13. Ионизационные методы
- § 14. Сцинтилляционный метод
- Г. АППАРАТУРА И ТЕХНИКА ИЗМЕРЕНИЯ РАДИОАКТИВНОСТИ
- § 15. Радиометрические установки
- § 16. Измерение радиоактивности
- § 17. Измерение дозы на рабочем месте, индивидуальной дозы, полученной работающим, и загрязненности рабочих поверхностей, рук и одежды
- § 18. Абсолютные и относительные измерения активности
- Д. РАДИОМЕТРИЧЕСКИЕ МЕТОДЫ ОПРЕДЕЛЕНИЯ
- § 19. Приготовление раствора с заданной активностью
- § 20. Прямое определение ионов химических элементов в растворе с помощью радиоактивных реагентов
- § 21. Практические работы, выполняемые методом прямого определения
- § 22. Метод радиометрического титрования
- § 23. Практические работы, выполняемые методом радиометрического титрования
- § 24. Метод изотопного разбавления
- § 25. Практические работы, выполняемые методом изотопного разбавления
- § 26. Метод активационного анализа
- § 27. Практические работы, выполняемые методом активационного анализа
- § 28. Фотонейтронный метод
- § 29. Практические работы, выполняемые фотонейтронным методом
- § 30. Методы определения содержания химических элементов по излучению их естественных радиоактивных изотопов
- § 31. Практические работы по определению содержания химических элементов методом измерения излучения их естественных радиоактивных изотопов
- § 32. Методы анализа, основанные на поглощении излучения
- § 33. Практические работы, выполняемые по методу анализа, основанному на поглощении излучения
- § 34. Метод, основанный на отражении бетта-излучения
- § 35. Практические работы, выполняемые по методу, основанному на отражении бетта-излучения
- ГЛАВА X. ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ РЕДКИХ ЭЛЕМЕНТОВ
- § 1. Работы, выполняемые методом амперометрического титрования
- § 2. Работы, выполняемые полярографическим методом
- § 3. Работы, выполняемые фотометрическим методом
- § 4. Работы, выполняемые экстракционно-фотометрическим методом
- § 5. Работы, выполняемые спектрофотометрическим методом
- § 6. Работы, выполняемые флуориметрическим методом
- § 7. Работы, выполняемые методом потенциометрического титрования
- ГЛАВА XI. ФИЗИКО-ХИМИЧЕСКИЕ (ИНСТРУМЕНТАЛЬНЫЕ) МЕТОДЫ АНАЛИЗА НЕВОДНЫХ РАСТВОРОВ
- § 1. Влияние химической природы и физико-химических свойств растворителей на свойства растворенного вещества
- § 2. Классификация неводных растворителей по их протонно-донорно-акцепторным свойствам
- § 3. Классификация неводных растворителей по признаку их влияния на относительную силу электролитов
- § 4. Дифференцирующее действие растворителей
- § 5. Константы диссоциации, потенциалы полунейтрализации в неводных средах и относительная шкала кислотности
- § 6. Шкала pH и константы автопротолиза неводных растворителей
- § 7. Абсолютная (единая) шкала кислотности растворителей
- § 8. Химико-аналитическое использование неводных растворителей
- Б. АППАРАТУРА И ТЕХНИКА ТИТРОВАНИЯ НЕВОДНЫХ РАСТВОРОВ
- § 9. Установки, используемые при амперометрическом титровании неводных растворов
- § 10. Установки, используемые при потенциометрическом титровании неводных растворов
- § 11. Установки, используемые при кондуктометрическом титровании неводных растворов
- § 12. Установки, используемые при высокочастотном титровании неводных растворов
- § 13. Установки, используемые при спектрофотометрическом титровании неводных растворов
- В. ПРАКТИЧЕСКИЕ РАБОТЫ
- § 14. Очистка и обезвоживание неводных растворителей
- § 15. Титранты, применяемые для титрования кислот и оснований в неводных растворах
- § 16. Амперометрическое титрование
- § 17. Методы прямого потенциометрического титрования
- § 18. Методы косвенного потенциометрического титрования
- § 19. Дифференцированное потенциометрическое титрование
- § 20. Комбинированные методы потенциометрического титрования
- § 21. Хронопотенциометрическое титрование
- § 22. Кондуктометрическое титрование
- § 23. Хронокондуктометрическое титрование
- § 24. Спектрофотометрическое титрование

