Эквивале́нт вещества́ или просто эквивале́нт — реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в кислотно-осно́вных (ионообменных) химических реакциях или электрону в окислительно-восстановительных реакциях[1][2].
Например, в реакции 



Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число молей вещества, эквивалентное одному молю катионов водорода в рассматриваемой реакции.
Эквивалентная масса[править | править код]
Эквивалентная масса — это масса одного эквивалента данного вещества.
Эквивалентная молярная масса вещества[править | править код]
Молярная масса эквивалентов обычно обозначается как 

Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества:
Фактор эквивалентности[править | править код]
Отношение эквивалентной молярной массы к собственной молярной массе вещества называется фактором эквивалентности (обозначается обычно как 
Число эквивалентности[править | править код]
Число эквивалентности 


Например, в реакции
эквивалентом является мнимая частица 



| вещество | реакция | |||
|---|---|---|---|---|
| простое * | сложное | ОВР (Окислительно-восстановительная реакция) | обменная | |

|
число атомов в формульной единице | число катионов (анионов) | число атомов элемента, поменявших степень окисления | число замещенных частиц в формульной единице |

|
характерная валентность элемента | фиктивный заряд на катионе (анионе) | число принятых (отданных) элементом электронов | фиктивный заряд на частице |
*Для инертных газов 
Фактор эквивалентности помогает сформулировать закон эквивалентности.
Закон эквивалентов[править | править код]
В результате работ И. В. Рихтера (1792—1800) был открыт закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2 = m2Э1
См. также[править | править код]
- Электрохимический эквивалент
Примечания[править | править код]
- ↑ IUPAC Gold Book internet edition: «equivalent entity».
- ↑ International Union of Pure and Applied Chemistry (1998). Compendium of Analytical Nomenclature (definitive rules 1997, 3rd. ed.). Oxford: Blackwell Science. ISBN 0-86542-6155. section 6.3.
Литература[править | править код]
- Кремлёв А. М. Эквиваленты химические // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Закон эквивалентов
Количественный подход к
изучению химических явлений и установление
закона постоянства состава показали,
что вещества вступают во взаимодействие
в определенных соотношениях масс, что
привело к введению такого важного
понятия, как “эквивалент”,
и установлению закона
эквивалентов.
Эквивалент
–
это
частица или часть частицы, которая
соединяется (взаимодействует) с одним
атомом водорода или с одним электроном.
Из
этого определения видно, что понятие
“эквивалент” относится к конкретной
химической реакции; если его относят к
атому в химическом соединении, то имеют
в виду реакцию образования этого
соединения из соответствующего простого
вещества и называют эквивалентом
элемента в соединении.
В
одной формульной единице вещества (В)
может содержаться Zв
эквивалентов этого вещества. Число Zв
называют показателем
эквивалентности.
Фактор
эквивалентности (f)
–
доля частицы, составляющая эквивалент;
f
£
1 и может быть равным 1, 1/2, 1/3 и т.д.
fВ
=
![]() . (1.7)
. (1.7)
Масса
1 моль эквивалентов, выраженная в граммах,
называется молярной
эквивалентной массой (Мэк)
(г/моль); численно она равна относительной
молекулярной массе эквивалента (кратко
ее называют эквивалентной массой).
Мэк
=
fВ·М. (1.8)
Закон
эквивалентов: массы
взаимодействующих без остатка веществ
соотносятся как их эквивалентные массы.
Математическое выражение закона
эквивалентов:
![]()
, (1.9)
где Мэк,1
и Мэк,2
–
эквивалентные массы.
Пример
8. Определить эквивалент
и эквивалентную массу кислорода в Н2О.
Решение.
Такая формулировка вопроса предполагает
реакцию образования молекулы воды из
кислорода и водорода:
H2
+ ½O2
= Н2О,
то есть с 1 атомом водорода
соединяется ½
атомов кислорода.
Следовательно, Z(О)
= 2. Масса 1 моль атомов кислорода равна
16 г, отсюда
Мэк(O)
= М (О)·![]()
=
![]() = 8 г/ моль.
= 8 г/ моль.
Эквиваленты
одних и тех же элементов в различных
химических соединениях могут различаться,
так как величина эквивалента зависит
от характера превращения, претерпеваемого
им. Так, в соединении SO2
эквивалентная масса серы равна 8 г/моль,
что составляет 1/4 от атомной массы, а в
соединении SO3
–
5,3 г/моль, что составляет 1/6 от атомной
массы серы (ZS
= 4 и 6, соответственно). Практический
расчет эквивалентной массы элемента в
соединении ведут по формуле
Мэк
(элемента) = Аэк
=
![]() , (1.10)
, (1.10)
где
А –
атомная масса, ω –
степень окисления элемента в данном
соединении. (Ниже будет показано, что
для реакции образования соединения из
простых веществ ZВ
= |ω|).
Например,
ZВ
(Mn) в соединении KMnO4
(ω = +7) составляет 7, а
Мэк
(Mn)
=
=
![]() = 7,85 г/моль; в соединении Mn2O3
= 7,85 г/моль; в соединении Mn2O3
(ω = +3) – ZВ
= 3 и
Мэк
(Mn)
=
=
![]() = 18,3 г/моль. (55-
= 18,3 г/моль. (55-
масса 1-го моля атомов марганца или
атомная масса).
Эквивалентная
масса вещества в химических реакциях
имеет различные значения в зависимости
от того, в каком взаимодействии это
вещество участвует. Если во взаимодействии
сложного вещества участвует его известное
количество или известно количество
реагирующих групп, то для расчета
эквивалентных масс можно пользоваться
следующими правилами и формулами.
а)
Вещества друг с другом реагируют
одинаковыми количествами эквивалентов.
Например,
в реакции
2Al
+ 3/2O2
= Al2O3
6
моль эквивалентов Al
реагируют с таким же количеством
кислорода
(ZВ
(Al)
= 3, ZВ
(O)
= 2).
б)
Эквивалентная масса кислоты в реакциях
замещения ионов водорода равна:
М
эк.
кислоты
=
![]() (1.11)
(1.11)
Пример
9. Определить эквивалент
и эквивалентную массу H2SO4
в реакциях:
-
H2SO4
+ KOH
= KHSO4
+ H2O
;
-
H2SO4
+ 2KOH
= K2SO4
+ 2H2O
.
Решение.
В первой реакции
заместился один ион водорода, следовательно,
эквивалент серной кислоты равен 1, ZВ
(H2SO4)
= 1, Мэк(H2SO4)
= М1
= 98 г/моль. Во второй реакции заместились
оба иона водорода, следовательно,
эквивалент серной кислоты равен двум
молям, ZВ
(H2SO4)
= 2, а Mэк
(H2SO4)
= 98·½
= 49 г/моль.
в)
Эквивалентная масса основания в реакции
замещения ионов гидроксила равна:
Мэк.
основания
=
![]() .(1.12)
.(1.12)
Пример
10. Определить эквивалент и эквивалентные
массы гидроксида висмута в реакциях:
1)
Bi(OH)3
+ HCl = Bi(OH)2Cl
+ H2O;
2)
Bi(OH)3
+ 3HCl = BiCl3
+ H2O.
Решение.
1)
ZВ
Bi(OH)3
= 1, Mэк Bi(OH)3
= 260 г/моль (т. к. из трех ионов гидроксила
заместился один);
2) ZВ
Bi(OH)3
= 3, a Mэк Bi(OH)3
= 260·![]() = 86,3 г/моль (т. к. из трех ионов ОН–
= 86,3 г/моль (т. к. из трех ионов ОН–
заместились все три).
г)
Эквивалентная
масса соли в реакциях полного замещения
катиона или аниона равна:
Мэк.
соли
=
![]()
или
(1.13)
Мэк
соли
=
![]() .
.
Так,
ZВ
Al2(SO4)3
= 3∙2 = 6. Однако в реакции эта величина
может быть больше (неполное замещение)
или меньше (комплексообразование). Если,
например, это соединение участвует во
взаимодействии по реакции
Al2(SO4)3
+ 12KOH
= 2K3[Al(OH)6]
+ 3K2SO4
,
то
при этом три аниона с суммарным зарядом
6 замещаются 12 ОН–
ионами, следовательно, 12 эквивалентов
этого вещества должно вступать в реакцию.
Таким образом, ZВ
Al2(SO4)3
=
12, а
Мэк
= М·fВ
= 342/12 = 28,5 г/моль.
д)
Эквивалентная
масса оксида в реакциях полного замещения
равна:
Мэк
оксида
=
![]() .(1.14)
.(1.14)
Например,
ZВ
(Fe2O3)
= 3·2 = 6. Мэк
= М(Fe2O3)·fВ
= 160×1/6
= 26,6 г/моль. Однако в реакции
Fe2O3
+ 4HCl
= 2FeOHCl2
+ H2O
ZВ
(Fe2O3)
= 4, Мэк
= М(Fe2O3)∙fВ
= 160×1/4
= 40 г/моль, так как Fe2O3
взаимодействует с четырьмя эквивалентами
HCl (fВ
= 1).
При
решении задач, связанных с газообразными
веществами, целесообразно пользоваться
значением эквивалентного
объема.
Это объем, занимаемый одним молем
эквивалентов газообразного вещества.
Пример
11. Рассчитайте эквивалентные объемы
газообразных водорода и кислорода при
н.у.
Решение.
Для водорода при н.у. этот объем равен
11,2 литров (молярный объем Н2составляет 22,4 л, а так как Мэк(Н)
= 1г (т.е. в 2 раза меньше, чем молярная
масса), то эквивалентный объем будет в
2 раза меньше молярного, т. е. 11,2 л),для
кислорода – 5,6л (молярный объем О2составляет 22,4 л, а так как Мэк(О)
= 8г (т.е. в 4 раза меньше, чем молярная
масса О2), то эквивалентный
объем будет в 4 раза меньше, чем молярный.
Пример
12.![]() На
На
восстановление 1,80 г оксида металла
израсходовано 883 мл водорода (н.у.).
Вычислить эквивалентные массы оксида
и металла.
Решение.
Согласно закону эквивалентов (1.9) массы
(объемы) реагирующих веществ пропорциональны
их эквивалентным массам (объемам):
![]() . Отсюда
. Отсюда
![]()
(г/моль);
![]()
+
![]() ,
,
тогда
![]() г/моль.
г/моль.
Пример
13. Вычислить эквивалентную
массу цинка, если 1,168 г Zn вытеснили из
кислоты 438 мл Н2
(t = 17 оС
и Р = 750 мм рт. ст.).
Решение.
Согласно закону эквивалентов (1.9):
![]() ;
;
Из
уравнения Менделеева-Клапейрона
(1.4):
![]() г,
г,
![]() =
=
32,6 г/моль.![]()
д)
Эквивалентная масса окислителя и
восстановителя определяются
делением молярной массы на изменение
степени окисления в соответствующей
реакции на 1моль.
Пример
14. Определить эквивалентные массы
окислителя и восстановителя в реакции:
+6
+4
+3
+6
K2Cr2O7
+ 3Na2SO3
+ 4H2SO4
= Cr2(SO4)3
+ 3Na2SO4
+ K2SO4
+ 4H2O.
Решение.
Окислителем в этой реакции являетсяK2Cr2O7,
а восстановителем –Na2SO3.
Суммарное изменение степени окисления
хрома вK2Cr2O7Dw(2Cr)
= 2.(+3) – 2.(+6) = – 6;
Поэтому
![]() г/моль.
г/моль.
Суммарное
изменение степени окисления серы в
Na2SO3:Dw(S)
= +6 – (+4) = +2;
Поэтому
![]() г/моль.
г/моль.
Как рассчитать эквивалентную массу
Эквивалентной массой, или молярной массой эквивалента, называется количество вещества, взаимодействующее с одним молем водорода или вытесняющие столько же атомов водорода из его соединений. Обозначается эта величина Mэкв, измеряется в г/моль и вычисляется по формулам или экспериментальным путем.

Вам понадобится
- – периодическая система;
- – калькулятор;
- – химическая посуда;
- – разбавленная соляная кислота;
- – навеска металла.
Инструкция
Чтобы найти эквивалентную массу простого вещества, воспользуйтесь формулой:Mэкв = Mа/B, где Mэкв – масса эквивалента;Mа – атомная масса элемента; B – валентность.Например, согласно формуле эквивалентная масса натрия будет равна 22,99 г/моль, а двухвалентной серы – 32/2 = 16 г/моль и т.д. Для сложных веществ молярной массой эквивалента будет называться количество вещества, прореагировавшего без остатка с одним эквивалентом другого вещества, например, водорода.
Помните, что расчет этой величины для разных химических соединений имеет нюансы. Например, при вычислении эквивалентной массы оксидов – складывайте значения эквивалентных масс, составляющих соединение. Допустим, дан оксид цинка. Сначала считаете Mэкв (Zn) = 65/2 =32,5 г/моль. Потом – Mэкв (O) = 16/2 = 8 г/моль. Таким образом, получите эквивалентную массу ZnO равную 40,5 г/моль. А рассчитать массу эквивалента кислоты можно, разделив ее молекулярную массу на количество атомов водорода, содержащихся в ней: Mэкв (H2SO4) = 98/2 = 49 г/моль и т.д.
Для экспериментального определения эквивалентной массы сначала повторите технику безопасности при работе с кислотами и газами. Затем возьмите бюретку, пробирку и воронку. Соедините их между собой резиновыми трубками. Налейте в бюретку дистиллированной воды, с помощью воронки установите ее уровень на нуле.
В пробирку налейте 5 мл соляной кислоты (постарайтесь не замочить стенки). На сухую стенку поместите навеску металла. Следите за тем, чтобы он не упал в кислоту раньше времени. Закройте пробирку пробкой и встряхните. Водород будет вытеснять воду из бюретки. После завершения реакции выровняйте уровень воды в бюретке и воронке. Запишите конечный результат, температуру и давление при проведении опыта.
Определите вытесненный объем водорода, сравнив начальный и конечный уровень воды в бюретке. Приведите полученный результат к нормальным условиям, используя показания барометра и термометра. И затем только рассчитайте массу эквивалента металла, используя формулу:m (металла)/V (водорода при норм.условиях) = Mэкв.(металла)/Vэкв (водорода).
Источники:
- рассчитать молярную массу эквивалента
- ЭКВИВАЛЕНТНАЯ МАССА
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
§ 2.1.2. Эквивалент
Эквивалент молекулы сложного вещества – это условная часть молекулы, являющаяся носителем одной функциональной связи или одного электрона, участвующего в окислительно-восстановительном процессе.
Эквивалентная масса 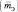 – это масса одного эквивалента.
– это масса одного эквивалента.
Например, если серная кислота (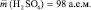 ;
;
М (Н2 SO4) = 98 г/моль), имеющая структурную формулу:
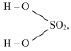
взаимодействует с NaOH по реакции:
Н2SO4 + 2NaOH = Na2SO4 + 2Н2О, (2.1),
то у неё функциональны две связи Н – О. Вся молекула оказывается носительницей двух функциональных связей, а, значит, двух эквивалентов. Поэтому эквивалентом в данном случае является половина молекулы Н2SO4. Следовательно,
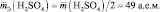
Молярная масса эквивалента (МЭ) – это масса одного моля эквивалента. В данном случае (MЭ(Н2SO4)) для приведённой реакции рассчитывается по формуле:
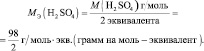
В аналогичной реакции взаимодействия NaOH с НСl молярная масса эквивалента соляной кислоты численно совпадает с молярной массой НСl:
НСl + NaOH = NaСl + Н2О;
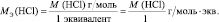
Эквивалент молекулы простого вещества – это условная часть молекулы, являющаяся носителем одной валентности.
Например, молекула водорода состоит из двух атомов, каждый из которых обладает валентностью, равной единице. Поэтому, суммарная валентность молекулы этого простого вещества равна двум. Вся молекула оказывается носительницей двух валентностей, а, значит, согласно последнему определению, двух эквивалентов. Эквивалентом водорода оказывается половина молекулы. Молярная масса эквивалента ((MЭ(Н2)) рассчитывается по формуле:
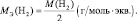
Следует подчеркнуть, что хотя молекула водорода, также как и молекула соляной кислоты, содержит только одну функциональную связь, однако формулы для расчёта молярных масс эквивалентов этих веществ существенно различаются, потому что одно из них является простым, а другое сложным.
В общем случае, молярные массы эквивалентов (МЭ) рассчитываются следующим образом.
Для простых веществ:
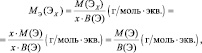
где МЭ(ЭХ) – молярная масса эквивалента простого вещества, состоящего из х атомов элемента Э; М(ЭХ) – молярная масса этого вещества; М(Э) – молярная масса элемента; В(Э) – валентность элемента.
Для элементов (Э), входящих в состав сложного вещества:
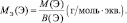
То есть, молярные массы эквивалентов простых веществ и молярные массы эквивалентов элементов, входящих в состав сложного вещества, могут рассчитываться по одной и той же формуле.
Для кислот НХА, где А – кислотный остаток:
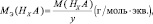
где y – основность кислоты, т. е. количество ионов H+, принимающих участие в процессе (y ≤ х).
Например, в реакции (2.1) основность серной кислоты равна двум. А для процесса:
Н2SO4 + NaOH = NaНSO4 + Н2О,
основность кислоты равна единице и не совпадает с общим количеством ионов Н+, принимающих участие в процессе.
Для оснований (Э(ОН)Х):
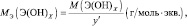
где у’ – кислотность основания, т. е. количество гидроксогрупп, принимающих участие в процессе. (y’ ≤ х).
Например, для реакции:
Са(ОН)2 + 2НСl = СаСl2 + 2Н2О;
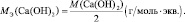
А для процесса:
Са(ОН)2 + НСl = СаОНСl + Н2О;
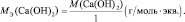
Для солей (МеХАу, где Ме – металл):
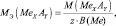
где В(Ме) – валентность металла; z – количество атомов металла, принимающих участие в процессе (z ≤ х).
Для оксидов (ЭХОY):
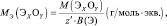
где Э – элемент или фрагмент молекулы, неизменяемый в реакции; z′ – количество Э, принимающее участие в процессе.
Например, для реакции:
Аl2O3 + 6HCl = 2АlCl3 + 3H2O;
Э ≡ Al; 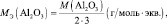
а для реакции:
UO3 + 2HCl = UO2Cl2 + H2O;
Э ≡ UO2; 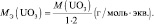
Из приведённых примеров видно, что значение молярной массы эквивалента сложных веществ зависит от конкретной реакции, в которой они принимают участие. А значение молярной массы эквивалента элементов, входящих в состав сложного вещества – не зависит от реакции.
Следует подчеркнуть, что рассмотренные выше формулы для нахождения молярных масс эквивалентов сложных веществ, справедливы только в том случае если эти вещества не участвуют в окислительно – восстановительном процессе. Например, в реакции
2КMnO4 + 3 K2SO3 + H2O = 2MnO2 + 3 K2SO4 + 2KOH;
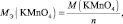
где n – количество электронов, получаемых перманганатом калия
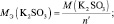
n′ – количество электронов, отдаваемых сульфитом калия. В данном случае
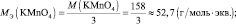
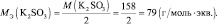
Обобщив, приведённые выше равенства, можно утверждать, что молярную массу эквивалента любого вещества (МЭ) рассчитывают по формуле (2.2):
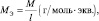 (2.2)
(2.2)
где M – молярная масса вещества, измеряемая в г/моль; l – количество эквивалентов, приходящееся на одну молекулу, численно равное количеству:
– валентностей (для простых веществ);
– функциональных связей (для сложных веществ, не участвующих в окислительно-восстановительном процессе);
– электронов, получаемых или отдаваемых молекулой (для сложных веществ, участвующих в окислительно-восстановительном процессе).
Подобно тому, как молярная масса вещества (М) представляет собой отношение массы (m) к количеству этого вещества (n)
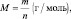
а молярный объём газа (Vo) – отношение объёма (V), занимаемого им при нормальных условиях (p ≈ 105 Па; t °C ≈ 0 °C)[19] к количеству газа (nг):
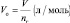
молярный объём эквивалента газообразного вещества (VЭ) представляет собой отношение V к количеству молярных масс эквивалента nЭ:
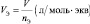
из последних двух равенств вытекает соотношение
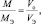
в котором все величины являются параметрами одного и того же газа.
Действительно:
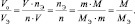
Задачи для самостоятельного решения
1. Определить молярные массы эквивалентов соединения Н3РО4 в реакциях:
Н3РО4 + 3КОН = К3РО4 + 3Н2О;
Н3РО4 + 2КОН = К2НРО4 + 2Н2О;
Н3РО4 + КОН = КН2РО4 + Н2О.
Рассчитать молярные массы эквивалентов каждого из атомов в Н3РО4.
2. Определить эквивалентную массу Na2SO4 в реакциях:
Na2SO4 + ВаСl2 = ВаSO4 + 2NaСl;
Na2SO4 + H2SO4 = 2NaHSO4.
3. Определить молярную массу эквивалента Na2O в реакциях:
Na2O + 2НСl = 2NaСl + Н2О;
Na2O + Н2О = 2NaOН.
4. Определить эквивалентную массу Аl(OH)3 в реакциях:
2Аl(OH)3 + 3H2SO4 = Аl2(SO4)3 + 6Н2О;
Аl(OH)3 + H2SO4 = АlOHSO4 + 2Н2О.
5. Рассчитать молярную массу эквивалента кислорода и определить объём, занимаемый молярной массой эквивалента кислорода при н.у.
6. Определить эквивалентные массы, молярные массы эквивалента метана (СН4) и хлора в реакции
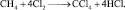
1. Дайте определения эквиваленту молекулы сложного вещества и эквиваленту молекулы простого вещества?
2. По какой формуле можно рассчитать молярную массу эквивалента любого вещества?
3. Какое уравнение связывает молярную массу, молярный объём, молярную массу эквивалента и молярный объём эквивалента одного и того же газа.
The most commonly used phrase in chemistry is “equivalent weight,” which is also one of the fundamental concepts in physical chemistry. Equivalent weight commonly referred to as a gram equivalent is the mass of one equivalent or the mass of a particular material that will combine with or replace a specific amount of another substance. To say it another way, the mass of a substance that can displace 1.008 grams of hydrogen or 8.0 grams of oxygen or 35.5 grams of chlorine is its gram equivalent or equivalent weight. Let us study the Equivalent Weight in detail in this article.
What is Equivalent Weight?
Equivalent weight is defined as the ratio of the molecular weight of the solute to the valency of the solute. The equivalent weight of the substance varies according to the reaction it undergoes. The normality of the solution is calculated using the equivalent weight of the substance. The general formula to calculate the equivalent weight is,
Equivalent Weight = Molecular Weight / (n-factor)Valency
How to calculate the Equivalent Weight?
The Equivalent Weight of a compound is the result of dividing the molecular weight by the charge number of that compound.
E = Molecular Weight / n-factor (charge number)
where,
E is Equivalent Weight
Charge number indicates how many protons or hydroxide-equivalents the compound has
The equivalent weight of the compound can be defined as the weight (or mass) of a substance that will include a single reactive proton (or hydrogen ion, H+) or a single reactive hydroxide ion (OH–). The idea of equivalent weight is necessary because some compounds are doubly reactive for every mole present because they have the capacity to supply or receive more than one proton.
Hydrogen has an atomic mass of one (1.008 to be precise). Hydrogen’s valency is always 1. As a result, hydrogen has an equal weight of 1. In the majority of reactions, oxygen has a valency of 2.
Moles
A compound is described as having 6.02 × 1023 distinct particles (atoms or molecules) per unit mole. In fact, there are exactly this many atoms in 12 grams of carbon. The mass of one mole of each element, or its molecular weight (MW), is given in the corresponding box for that element on the periodic table.
Equivalent Weight of Acids and Bases
The equivalent mass of an acid or base in an acid-base reaction is always equal to the mass that contributes to or interacts with one mole of the hydrogen ion (H+). In a similar manner, the mass that supplies or reacts with one gram mole of electrons (e-) produced in the redox reaction is the substance’s equivalent weight.
Knowing an acid’s molecular weight and the charge present in it helps to calculate its equivalent weight.
For example, take sulfuric acid,
H2SO4 + 2OH− → 2H2O + SO42−
Using a periodic table to get each element’s MW and adding it we get 2(1) + (32) + 4(16) = 98.0, and we can determine the acid’s Molecular Weight.
Because the sulfate ion is left with a charge of 2, we get to know that this acid can give two protons.
Hence, the equivalent weight = 98.0/2 = 49.0
Logic is the same for a base. A proton can be taken up by ammonium hydroxide in solution to form an ammonium ion:
NH4OH + H+ = H2O + NH4+
Ammonium hydroxide’s Molecular Weight is calculated as (14) + (4)(1) + (16) + 1 = 35.0
The equivalent Weight for this molecule is 35.0/1 = 35.0 since just one proton is consumed.
How to Calculate Gram-Equivalent Weight?
The number of grams of a substance divided by its equivalent weight is known as a gram equivalent. It can also be written as n moles times the number of charge elements present.
Gram equivalent weight is the equivalent weight given in mass units. The calculated equivalent weight and the gram equivalent weight are equal numerically.
Eq = MW / n
where,
Eq is Equivalent weight
MW is Molecular Weight in grams/mole
n is number of equivalents charge
Also, Read
- Normality
- Molarity
- Difference Between Molarity and Molality
Solved Problems on Equivalent Weight
Question 1: Calculate the Equivalent weight of H2SO4.
Answer:
Two H+ ions are present for every mole of sulfuric acid, or n = 2. Find the total atomic masses of the S, O, and H in your formula by referencing a periodic table:
S = 32.07
O = 16.00
H = 1.01
Add the molecular weight of H2SO4:
32.07 + 4(16.00) + 2(1.01) = 98.08 g/mol
Eq = 98.08 / 2 = 49.04 g/eq.
H2SO4 has a gram equivalent weight of 49.04 g/eq.
Question 2: Calculate the Equivalent weight of NaOH.
Answer:
Since there is just one OH-, there are only one equivalent. Find the total atomic masses of the Na, O, and H in your formula by referencing to periodic table:
Na = 22.99
O = 16.00
H = 1.01
Add the molecular weight of NaOH:
22.99 + 16.00 + 1.01 = 40.00 g/mole
Eq = 40.00 / 1 = 40.00 g/eq
NaOH has a gram equivalent weight of 40.00 g/eq
Question 3: Calculate the Equivalent weight of HCL.
Answer:
Since there is just one H+, there are only one equivalent. Find the total atomic masses of Cl and H in your formula by referencing to periodic table:
Cl = 35.45
H = 1.01
Add the molecular weight of HCL:
35.45 + 1.01 = 36.46 g/mole
Eq = 36.46 / 1 = 36.46 g/eq
HCL has a gram equivalent weight of 36.46 g/eq
Question 4: Calculate the Equivalent weight of Ca(OH)2 →Ca+ + 2 OH–
Answer:
The calcium hydroxide base releases two hydroxyl ions into the environment. Its valency factor, or X value, will therefore be 2.
The calcium hydroxide base has a molecular weight of 74 g/mole.
Equivalent weight = molecular weight / valency
Equivalent weight of calcium hydroxide base= 74 / 2 = 37 g/eq
Therefore, calcium hydroxide has a equivalent weight of 37 g/eq
Question 5: Calculate the Equivalent weight of Al(OH)3 → Al+3 + 3 OH–
Answer:
The aluminum hydroxide base releases three hydroxyl ions. Its valency factor, or X value, will therefore 3.
The aluminum hydroxide base has a molecular weight of 78 g/mol.
Equivalent weight = molecular weight / valency
Equivalent weight of aluminum hydroxide base= 78 / 3 = 26 g/eq.
Therefore, aluminum hydroxide has a equivalent weight of 26 g/eq
FAQs on Equivalent Weight
Question 1: How do you calculate the equivalent weight of acid and base?
Answer:
Divide the molar mass of the base by the quantity of hydroxyl groups to determine the equivalent mass of the base. Divide the molar mass of an acid by the number of protons to determine its equivalent weight.
Question 2: What is the equivalent concentration, and how to calculate it?
Answer:
EW stands for equivalent weight in grams per equivalent. It is computed by dividing the solute’s molecular weight by its equivalents per mole. The amount of H+ ions that an acid contributes to a mole of acid determines how many equivalents are there for acids.
Question 3: What does “equivalent concentration” mean?
Answer:
The molar concentration of a solution (ci), is divided by an equivalency factor (f), to determine its equivalent concentration, or normalcy. Normality = cif
Question 4: What are the factors on which the equivalent weight of any compound depends?
Answer:
The equivalent weight of any compound depends upon the following two factors,
- Molecular weight
- Valency factor

