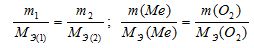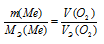Выше
уже говорилось, что простые вещества
(или химические соединения), вступающие
в химические реакции друг с другом, а
также продукты реакций находятся в
строго определенных количественных
соотношениях. Следствием этого факта
было введение в научный и практический
обиход понятия эквивалент.
Эквивалентом
химического элемента
(или
молем
эквивалентов)
называется такое его количество, которое
может заместить или присоединить к себе
в химических реакциях 1моль атомов
водорода или любого другого химического
элемента, эквивалент которого известен.
В
соединениях НС1, H2S,
NH3,
CH4
эквиваленты хлора, серы, азота и углерода
равны 1 молю, 1/2 моля, 1/3 моля и 1/4 моля,
соответственно.
Эквивалент
(или
моль эквивалентов) сложного вещества
– это такое его количество, которое
взаимодействует без остатка с одним
эквивалентом атомов водорода или с
одним эквивалентом любого другого
вещества.
Масса
одного эквивалента
(или моля эквивалентов) химического
элемента или вещества называется их
эквивалентной массой (или молярной
массой эквивалентов).
Единицей
измерения эквивалентной массы служит
г/моль.
Эквивалентная
масса химического элемента Мэ
равна отношению мольной массы атомов
МА
к его валентности В:

Так,
эквивалентные массы хлора, серы, азота
и углерода в приведенных выше соединениях
равны 34,45 г/моль, (32/2 = 16) г/моль, (14/3 = 4,67)
г/моль и (12/4 = 3) г/моль.
Способ
определения эквивалентной массы сложных
соединений зависит от их класса. Так,
эквивалентная масса Мэк
кислоты
равна ее мольной массе Мк,
деленной на основность О (число ионов
водорода Н+,
которое кислота отдает в реакции с
основанием: основность НС1 равна 1, H2SO4
– 2, Н3РО4
– 3):

Эквивалентная
масса Мэо
основания равна его мольной массе М,
отнесенной к валентности металла ВМе:

И
наконец, эквивалентная масса Mэc
соли определяется как отношение ее
мольной массы Мс
к произведению валентности металла ВМе
на число k
его атомов в молекуле:

Многие
элементы, соединяясь друг с другом,
могут образовывать по несколько
соединений (например, СО и СО2).
Отсюда следует, что эквивалент химического
элемента и его эквивалентная масса
могут различаться в зависимости от
того, какое соединение было взято для
их определения. Так, в случае приведенных
выше моно- и диоксида углерода эквивалентные
массы углерода равны, соответственно,
(12/2 = 6) г/моль и (12/4 = 3) г/моль, поскольку
мольная масса атомов углерода равна 12
г/моль, а его валентность равна 2 в случае
монооксида углерода и 4 – в случае
диоксида.
Кроме
понятия эквивалентной массы, широко
пользуются также понятием эквивалентного
объема,
под которым понимают объем, который
занимает 1 эквивалент рассматриваемого
газообразного вещества. Единицей
измерения эквивалентного объема является
л/моль. Поскольку 1 эквивалент водорода
(атомарного) составляет половину 1 моля
молекулярного водорода, становится
понятно, что эквивалентный объем водорода
при нормальных условиях равен половине
мольного объема, т. е. 11,2 л/моль.
Соответственно, эквивалентный объем
кислорода равен 5,6 л/моль, так как
эквивалент кислорода равен 1/4 моля, т.
е. в 2 раза меньше эквивалента водорода.
Изучение
количественных закономерностей
химических реакций привело к установлению
закона
эквивалентов.
Массы
m1
и m2
(или объемы V1
и V2)
реагирующих друг с другом веществ
пропорциональны их эквивалентным массам
МЭ1
и МЭ2
(объемам VЭ1,
и VЭ2):

Из
этого уравнения легко получается
соотношение:

где
v1,
и v2
— количества эквивалентов реагентов.
Таким
образом, количества эквивалентов
реагирующих без остатка веществ равны
между собой.
Пример
3.1.
Чему равна эквивалентная масса металла,
если при взаимодействии 3 г его оксида
с серной кислотой образовалось 9 г
сульфата?
Решение:
Составим
уравнение реакции и для наглядности
проставим под формулами оксида и сульфата
их массы:
МеО +
H2SO4
= MeSO4
+ Н2О
Эквивалентная
масса металла равна отношению его
мольной массы ММе
к валентности. Записав формулу оксида
в виде МеО, мы тем самым определили, что
валентность металла равна 2. Нам остается
найти мольную массу металла. Для этого
составим пропорцию:
3
г оксида так относится к 9 г
сульфата, как
мольная
масса оксида относится к мольной
массе сульфата
(ММс
+ 16) г/моль (Мме
+ 96) г/моль
Из
этой пропорции получаем следующее
равенство:
(ММе
+ 16)*9 = (ММе
+ 96)*3.
Откуда
находим, что ММе=24
г/моль.
Деля
эту величину на найденную валентность,
находим, что эквивалентная масса металла
Мэ
= 12 г/моль.
Ответ:
Мэ
= 12 г/моль.
Пример
3.2.
При взаимодействии с водой некоторого
количества металла с эквивалентной
массой, равной 19,55 г/моль, выделилось 3
л водорода. Определить массу металла.
Решение:
Поскольку
эквивалентный объем водорода известен
(11,2 л/моль), составим пропорцию:
19,55
г/моль металла эквивалентны 11,2 л/моль
водорода
х
г
металла эквивалентны 3 л водорода
Откуда:

Ответ:
Масса металла равна 5,24 г
Задачи
3.1. При
сгорании 5,00 г металла образуется 9,44 г
его оксида. Определить эквивалентную
массу металла.
3.2.
Определить эквивалентные массы металла
и серы, если 3,24 г металла образует 3,48 г
оксида и
3,72 г сульфида.
3.3.
Вычислить атомную массу двухвалентного
металла и определить, какой это металл,
если 8,34 г металла окисляются при
нормальных условиях 0,680 л кислорода.
3.4. Для
растворения 16,8 г металла потребовалось
14,7 г серной кислоты. Определить
эквивалентную массу металла и объем
выделившегося водорода (условия
нормальные).
3.5.
1,60 г кальция и 2,61 г цинка вытесняют из
кислоты одинаковые количества водорода.
Вычислить эквивалентную массу цинка,
зная, что эквивалентная масса кальция
равна 20,0 г/моль.
3.6. На
нейтрализацию 2,45 г кислоты идет 2,00 г
гидроксида натрия. Определить эквивалентную
массу кислоты.
3.7.
Сколько эквивалентных масс содержится
в молярной массе ортофосфорной кислоты?
3.8.
Найти отношение между эквивалентными
массами серы в следующих ее соединениях:
1) SO2;
2) SO3;
3) H2S;
4)
H2SО4.
3.9.
Определить эквивалент серы в ее оксидах,
содержащих 40 и 50 % серы.
3.10. На
нейтрализацию 2,45 г кислоты израсходовано
2 г гидроксида натрия. Определить
эквивалентную массу кислоты.
3.11. 1
г четырехвалентного элемента соединяется
с 0,27 г кислорода. Определить, какой это
элемент.
3.12.
При сгорании 10,8 г металла расходуется
6,72 л кислорода при нормальных условиях.
Определить эквивалентную массу металла.
3.13.
Одно и то же количество металла соединяется
с 4.8 г кислорода и с 48 г одного из галогенов.
Какой это галоген?
3.14.
При сгорании 5,4 г трехвалентного металла
образовалось 10,2 г оксида. Какой взят
металл?
3.15.
2,71 г хлорида трехвалентного металла
взаимодействуют с 2 г гидроксида натрия.
Назвать металл, входящий в состав соли.
3.16.
Для растворения 5,4 г металла потребовалось
29,4 г серной кислоты. Определить
эквивалентную массу металла и объем
выделившегося при нормальных условиях
водорода.
3.17.
Определить валентность железа в хлоридах,
если в одном содержится 34,5 % железа, а в
другом – 44.1 %.
3.18.
Одно и то же количество металла соединяется
с 1 г кислорода и с 2 г другого элемента.
Определить эквивалент этого элемента.
3.19.
Определить эквивалент металла в следующих
соединениях:
1)
Mn2O7;
2)
Mg2P2O7;
3) CrO3;
4)
Ва(ОН)2;
5)
Са3(РО4)2.
3.20.
При нагревании 5 г металла получено 5,4
г оксида. Определить эквивалент металла.
3.21. Из
3,85 г нитрата металла получено 1,60 г его
гидроксида. Вычислите молярную массу
эквивалента металла.
3.22. В
какой массе Сa(OH)2
содержится столько же эквивалентных
масс, сколько в 312 г Al(OH)3?
3.23.
Сколько металла, эквивалентная масса
которого
12,16 г/моль, взаимодействуют
с 310 см3
кислорода при нормальных условиях?
3.24.
При взаимодействии 3,24 г трёхвалентного
металла с кислородом выделилось 4,03 л
водорода при нормальных условиях.
Вычислить молярную массу эквивалента,
молярную и относительную массы металла.
3.25. Из
3,31 г нитрата металла получено 2,78 г его
хлорида. Вычислите молярную массу
эквивалента этого металла.
Соседние файлы в папке химия
- #
- #
- Подробности
- Категория: Химия-Шиманович
Расчет молярной массы эквивалента, молярной и относительной атомной массы металла
Задание 10.
Чему равен при н.у. эквивалентный объем кислорода? На сжигание 1,5 г двухвалентного металла требуется 0,69 л кислорода (н.у.) Вычислите молярную массу эквивалента, молярную массу и относительную атомную массу этого металла.
Решение:
Эквивалентный объём кислорода VЭ(О2) равен 22,4/4 = 5,6 л, потому что молекула его состоит из двух двухвалентных атомов кислорода. Согласно закону эквивалентов массы (объёмы) реагирующих веществ m1 и m2 пропорциональны их молярным массам (объёмам):
Если одно из веществ находится в газообразном состоянии, то, как правило, его количество измеряется в объёмных единицах (см3, л, м3). Заменив отношение m(O2)/МЭ(О2) равным ему:
Из этого уравнения находим молярную массу эквивалента металла:
Молярная масса металла определяется из соотношения МЭ = А/В, где МЭ – молярная масса эквивалента металла; А – молярная масса металла; В – стехиометрическая валентность элемента; А = МЭ . В = 12,17 . 2 = 24,34 г/моль.
Так как относительная атомная масса в а. е. м. численно равна относительной молярной массе, выраженной в г/моль, то искомая масса металла равна 24,34 а. е. м.
Ответ: МЭ(МеО) = 12,17 г/моль; МЭ(Ме) = 24,34 г/моль; М(Ме) = 24,34 г/моль; Ar(Ме) = 24,34.
КОМИТЕТ
ОБРАЗОВАНИЯ ГОРОДА КУРСКА
муниципальное
бюджетное общеобразовательное учреждение
«Средняя
общеобразовательная школа № 50
имени Юрия Алексеевича Гагарина»
305018,
г. Курск, ул. Серегина, д.12
тел. 38-34-14,
37-94-55. E – mail: kursk50@yandex.ru
МЕТОДИЧЕСКАЯ
РАЗРАБОТКА УРОКА ХИМИИ
в
8 классе. Факультатив.
Урок
– лекция
Тема
«Понятие эквивалент. Лекция № 1»
Выполнила:
Березанская
Юлия Александровна, учитель химии
Курск
2020
Цели:
·
углубление
знаний по химии;
·
развитие
способностей и интереса к химии;
·
развитие умений
самостоятельной добычи знаний;
·
профессиональная
ориентация учащихся.
Задачи:
Образовательные:
·
познакомить с понятиями
эквивалент, фактор эквивалентности, закон эквивалентов;
·
научить решать задачи,
используя для расчетов эквиваленты;
·
повторить и закрепить знания о
структурных формулах молекул веществ, валентности;
Воспитательные:
·
развивать настойчивость и
умение преодолевать трудности для достижения намеченной цели;
Развивающие:
·
формирование способностей
сравнительного анализа;
·
умение находить оптимальные
решения;
·
прививать интерес к нахождению
новых рациональных способов решения классических задач.
Тип урока: дистанционные образовательные технологии, вводный урок.
Вид урока: урок-лекция.
Межпредметные
связи: математика.
Педагогические
технологии: организация самостоятельной
деятельности школьников.
Результаты:
понимание учениками смысла понятий эквивалент, фактор эквивалентности, закон
эквивалентов. Умение применять расчеты с использованием эквивалентов в решении классических
задач.
Материалы: конспект лекции.
Ход урока.
Понятие эквивалент
современным школьникам не изучается, но использование эквивалента очень
облегчает решение многих задач.
Не
будем пока вводить новые понятия и определения. Рассмотрим рисунки:
Рис 1. Молекула воды. Рис.2.
Молекула аммиака. Рис. 3. Молекула метана
Хорошо видно, что в образовании одной
связи в молекуле воды (рис.1) участвует целая часть атома водорода и половина
(1/2 часть) атома кислорода, в молекуле аммиака (рис.2) в образовании одной
связи участвует один целый атом водорода и треть (1/3 часть) атома азота, в
молекуле метана (рис.3) в образовании одной связи участвует один целый атом
водорода и четверть (1/4 часть) атома углерода.
Рассмотрим дроби
1/2,1/3, 1/4. В знаменателе каждой дроби стоит число, по значению и смыслу- это
валентность атома: кислорода-II, азота-III, углерода-IV. Это число называется эквивалентным
числом, обозначают Z, а значение 1/ Z – называют фактором
эквивалентности. Он показывает долю атома, которая в реакциях
ионного обмена равноценна одному целому атому водорода (или доля атома, которая
участвует в образовании одной связи с одним атомом водорода).
Эквивалент-это
реальная или условная частица (или доля реальной частицы), которая в
кислотно-основных реакциях и реакциях ионного обмена равноценна одному иону
водорода Н+ или одному иону ОН—.
В
расчетах мы пользуемся массами эквивалентов или количеством вещества
эквивалентов.
Масса эквивалента–
это и есть масса доли атома, рассчитываем массу доли так: делим массу атома на эквивалентное
число (валентность атома в соединении).
Если молярную
массу эквивалента атома обозначить Мэкв, то получим формулу: Мэкв=
Или молярную массу
атома умножаем на фактор эквивалентности, что математически не меняет смысла
расчетов:
Мэкв=М*1/
Z
Разберем на примере молекул воды, аммиака,
метана:
Мэкв(О)=16г/моль *1/2=8г/моль, тогда масса
эквивалента кислорода 8 г/моль,
Мэкв(N)=14г/моль
*1/3=14/3 г/моль, тогда масса эквивалента азота 14/3 г/моль,
Мэкв(С)=12г/моль *1/4=3г/моль, тогда масса
эквивалента углерода 3 г/моль,
Мэкв(Н)=1г/моль*1/1=1г/моль, тогда масса
эквивалента водорода 1г/моль.
Введение
в химию понятия «эквивалент» произошло в конце 18 – начале 19 века. Понятие эквивалент
вытекает из закона постоянства состава:
элементы
соединяются друг с другом в строго определенных количественных соотношениях.
С
введением понятия «моль» как единицы количества вещества появилось
соответствующее
определение эквивалента.
Эквивалент
элемента – это такое его количество, которое
соединяется с одним молем атомов водорода или замещает то же количество атомов
водорода в химических реакциях.
Закон эквивалентов
сформулирован так:
массы (объемы)
реагирующих друг с другом веществ пропорциональны их эквивалентным массам
(объемам)
или можно
сформулировать кратко:
Вещества реагируют
и образуются согласно их эквивалентам.
Для реакции aA
+ bB
= cC
+dD
закон эквивалентных отношений выглядит так:
=
или
=
Как
видим, посчитать эквивалентные массы не сложно, а в расчетах не надо учитывать
коэффициенты.
Теперь рассмотрим задачу
4 из Пригласительного этапа олимпиады школьников Сириус:
Задание 4. Одно и
то же количество вещества металла реагирует с 1,68г кислорода и 26,67 г
галогена. Определите галоген, если известно, что валентность металла в оксиде и
галогениде одна и та же. В ответе запишите химический знак элемента.
Решение. По закону
эквивалентных отношений:
m(О2),
m(Hal2)
даны по условию, молярную массу эквивалента кислорода рсчитаем Mэкв(О)
=16/2=8, молярную массу галогена выразим и рассчитаем
г/моль
Зная молярную массу эквивалента галогена,
найдем молярную массу атома галогена: М=127*1=127г/моль, это йод
Ответ: I
Используя понятие эквивалент, можно решить
и задачу 11 этой же Олимпиады.
Задание 11. 22,1 г оксида металла,
известного человечеству с древности, полностью восстановили до простого
вещества, используя 3,36 л (н. у.) водорода. Определите металл, в ответе
запишите его порядковый номер.
Для
газообразных соединений пользуются эквивалентным объемом
Эквивалентный объем – это объем, который занимает 1 эквивалент
рассматриваемого газообразного вещества.
Измеряется эквивалентный объем в л/моль. Поскольку 1 эквивалент
водорода (атомарного) составляет половину 1 моля молекулярного водорода, то
эквивалентный объем водорода при нормальных условиях равен половине мольного
объема, т.е. 11,2 л/моль. Соответственно, эквивалентный объем кислорода равен
5,6 л/моль, так как эквивалент кислорода равен 1/4 моля (два атома, каждый с
валентностью II).
Закон
эквивалентных отношений с участием газообразных веществ можно записать так:
=
, где
-это объем газа, а
В оксидах: масса эквивалентов
оксида равна сумме эквивалентов металла и кислорода
Мэкв(МеО)=Мэкв(Ме)+Мэкв(О)
(эквиваленты
сложных веществ мы рассмотрим на следующем уроке)
Решение.
По закону эквивалентных отношений: =
, подставим в формулу и решим относительно Мэкв(Ме):
Мэкв(Ме)=
Мы получили эквивалентную массу металла, но по условию нам не дана
валентность металла, тогда рассуждаем, если металл одновалентный, то ищем в
таблице металл с массой 65,67, не находим. Если металл двухвалентный, то ищем
металл с массой 65,67*2=131,34:ксенон он-не металл. Дальше предполагаем
валентность три: 65,67*3=197. Это золото и полностью удовлетворяет условию
задачи.
Ответ: 79.
Для закрепления предлагаю решить подобные
задачи:
1. Расчитайте
молярную массу эквивалентов некоторого неметалла (неМе), если известно, что его
образец массой 1,0 г полностью сгорает в кислороде, масса которого также равна
1,0г. Назовите неметалл, если степень его окисления в оксиде равна +4.
Ответ: сера.
2. При
растворении в кислоте некоторого металла массой 1,8г выделилось 2,24л водорода.
Определите молярную массу эквивалентов этого металла.
Ответ: 9г/моль
Справочник
урока:
Закон постоянства
состава:
элементы
соединяются друг с другом в строго определенных количественных соотношениях.
Z – эквивалентное
число- валентность атома
1/ Z – фактором
эквивалентности- доля атома, которая участвует в
образовании одной связи с одним атомом водорода.
Эквивалент –это
реальная или условная частица (или доля реальной частицы), которая в
кислотно-основных реакциях и реакциях ионного обмена равноценна одному иону
водорода Н+ или одному иону ОН—.
Эквивалент
элемента – это такое его количество, которое
соединяется с одним молем атомов водорода или замещает то же количество атомов
водорода в химических реакциях.
Закон эквивалентов:
массы (объемы)
реагирующих друг с другом веществ пропорциональны их эквивалентным массам
(объемам)
или кратко: Вещества реагируют и образуются
согласно их эквивалентам.
Мэкв(А)=М(А)/Z, nэкв(А)=n(A)/Z
Закон эквивалентов:
вещества реагируют и образуются согласно их эквивалентам.
Для реакции aA + bB
= cC
+dD:
=
или
=
Эквивалентный объем – это объем, который занимает 1 эквивалент
рассматриваемого газообразного вещества.
Закон
эквивалентных отношений, если один из участников процесса- газ: 
В оксидах: масса
эквивалентов оксида равна сумме эквивалентов металла и кислорода
Мэкв(МеО)=Мэкв(Ме)+Мэкв(О)
На следующем уроке мы
рассмотрим эквиваленты сложных веществ: оксидов, кислот, оснований, солей,
рассмотрим способы решения задач на процентное содержание атомов с помощью
эквивалентов.
До встречи!
Химия (Эквивалент кислорода)
Сергей Тихий
Ученик
(218),
на голосовании
6 лет назад
Ребят, химики, помогите пожалуйста, нужна помощь. Эквивалент кислорода равен 8 г/моль. Чтобы его найти, мы делим молярную массу кислорода (32г/моль) на 4. Объясните пожалуйста, почему мы делим на 4?
Голосование за лучший ответ
ReDiSkA
Профи
(672)
6 лет назад
Эквивалент (Э) вещества показывает, какое его количество в молях соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в Н2О эквивалент кислорода равен 1/2 моля, а у углерода в СН4 – 1/4 моля. Эквивалент кислорода в О2 тоже равен 1/4, так как молекула кислорода может присоединить 4 атома водорода:
О2 + 2Н2 = 2H2O
Зелёная Шапка
Мудрец
(13336)
6 лет назад
Сначала мы давай порядок в терминах наведем…
Эквивалент (“химический эквивалент”, он же “фактор эквивалентности”) – величина безразмерная и равна 1/n, где n – число электронов в данной реакции с участием рассматриваемой частицы (если это ОВР) или число протонов (гидроксид-ионов), если это кислотно-основный процесс.
А то, что “8г/моль” – это молярная масса эквивалента. Она равна эквиваленту, умноженному на молярную массу. (В нашем случае 1/4*32)
4 – это то самое число электронов. В реакции O2 + 2H2O + 4e = 4OH-