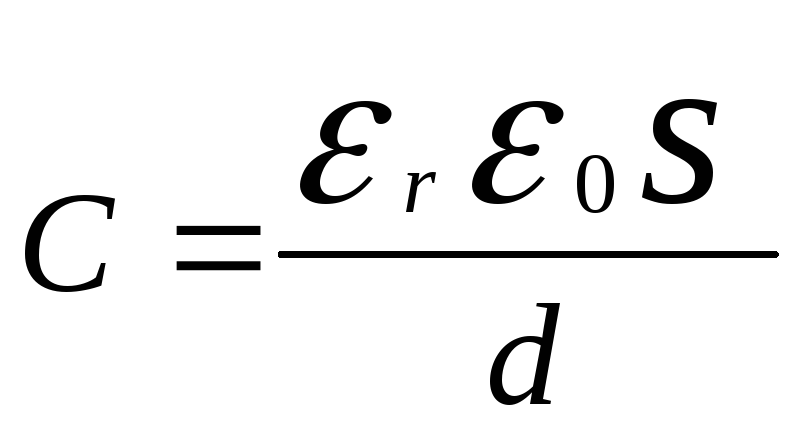Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 октября 2021 года; проверки требуют 2 правки.
Электрохимический эквивалент (устар. электролитический эквивалент) — масса вещества, которая должна выделиться во время электролиза на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества заряда. Электрохимический эквивалент измеряется в кг/Кл. Лотар Мейер использовал термин электролитический эквивалент.
Законы Фарадея[править | править код]
Первый закон Фарадея устанавливает строгую зависимость между количеством электричества, прошедшим через раствор или сплав электролитов, и количеством разложенного током вещества[1]. А именно, масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод:
,
где 


Согласно второму закону Фарадея, электрохимический эквивалент в свою очередь прямо пропорционален эквивалентной массе вещества. А именно:
,
где 

,
где 

.
Таблица значений электрохимических эквивалентов[править | править код]
| Элемент | молярная масса  (г/моль) (г/моль)
|
изменение валентности z |
 (мкмоль/кулон) |
электрохимический эквивалент (мг/кулон) |
электрохимический эквивалент (г/Ампер-час) |
пример применения |
|---|---|---|---|---|---|---|
| Водород | 1,0079 | 1 ↔ 0 | 10,364 | 0,0104 | 0,0376 | электролиз воды |
| Кислород | 15,999 | 2 ↔ 0 | 5,1821 | 0,0829 | 0,298 | |
| Фтор | 18,998 | 1 ↔ 0 | 10,364 | 0,197 | 0,709 | производство фтора |
| Натрий | 22,990 | 1 ↔ 0 | 10,364 | 0,238 | 0,858 | производство натрия |
| Алюминий | 26,981 | 3 ↔ 0 | 3,4548 | 0,0932 | 0,336 | производство алюминия |
| Хлор | 35,451 | 1 ↔ 0 | 10,364 | 0,367 | 1,32 | электролиз хлорида натрия[en] |
| Хром | 51,996 | 6 ↔ 3 или 3 ↔ 0 | 3,4548 | 0,180 | 0,647 | |
| Хром | 51,996 | 6 ↔ 0 | 1,7274 | 0,0898 | 0,323 | |
| Марганец | 54,938 | 4 ↔ 3 или 3 ↔ 2 | 10,364 | – | – | щелочной элемент |
| Марганец | 54,938 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 0,285 | 1,02 | |
| Марганец | 54,938 | 7 ↔ 4 или 3 ↔ 0 | 3,4548 | 0,190 | 0,683 | |
| Марганец | 54,938 | 7 ↔ 0 | 1,4806 | 0,0813 | 0,293 | |
| Железо | 55,845 | 3 ↔ 2 | 10,364 | – | – | |
| Железо | 55,845 | 2 ↔ 0 | 5,1821 | 0,289 | 1,04 | |
| Железо | 55,845 | 3 ↔ 0 | 3,4548 | 0,193 | 0,695 | |
| Никель | 58,693 | 2 ↔ 0 | 5,1821 | 0,304 | 1,09 | |
| Кобальт | 58,933 | 2 ↔ 0 | 5,1821 | 0,305 | 1,10 | |
| Медь | 63,546 | 2 ↔ 1 или 1 ↔ 0 | 10,364 | 0,659 | 2,37 | |
| Медь | 63,546 | 2 ↔ 0 | 5,1821 | 0,329 | 1,19 | рафинирование меди[de] |
| Цинк | 65,409 | 2 ↔ 0 | 5,1821 | 0,339 | 1,22 | |
| Родий | 102,91 | 3 ↔ 0 | 3,4548 | 0,356 | 1,28 | |
| Палладий | 106,42 | 2 ↔ 0 | 5,1821 | 0,552 | 1,99 | |
| Серебро | 107,87 | 1 ↔ 0 | 10,364 | 1,12 | 4,02 | |
| Кадмий | 112,41 | 2 ↔ 0 | 5,1821 | 0,583 | 2,10 | |
| Олово | 118,71 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 0,615 | 2,21 | |
| Олово | 118,71 | 4 ↔ 0 | 2,5911 | 0,308 | 1,11 | |
| Платина | 195,08 | 2 ↔ 0 | 5,1821 | 1,01 | 3,64 | |
| Золото | 196,97 | 1 ↔ 0 | 10,364 | 2,04 | 7,35 | Au(I) |
| Золото | 196,97 | 3 ↔ 0 | 3,4548 | 0,680 | 2,45 | |
| Свинец | 207,2 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 1,07 | 3,87 | свинцово-кислотный аккумулятор |
| Свинец | 207,2 | 4 ↔ 0 | 2,5911 | 0,537 | 1,93 |
Примечания[править | править код]
- ↑ Кистяковский В. А. Электрохимический эквивалент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература[править | править код]
- Петрий, О. А. Эквивалент электрохимический // Краткая химическая энциклопедия / гл. ред. И. Л. Кнунянц. — М. : Сов. энциклопедия. — Т. 5: Т−Я. — С. 979.
электрохимический эквивалент. чему равен электрохимический эквивалент алюминия (кгКл)
Знаток
(398),
закрыт
11 лет назад
111 111
Мыслитель
(6820)
12 лет назад
Электрохимический эквивалент К равен
К=МF*n, где F=95600 клкг, n – валентность, М – молекулярная масса
М=27 * 10 в степени -3 кгмоль
К=0,0273*95600=9,4 * 10 в степени “-8”
Электрохимический эквивалент — количество вещества, которое должно выделиться на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества электричества:


ГДЗ #1

10. Определите количество выделившегося на катоде при электролизе алюминия (электролит Al2S04), если затрачена энергия 20 кВт * ч при напряжении на электродах 12 В, КПД установки 80%. Электрохимический эквивалент алюминия k = 9,3 * 10^-8 кг/Кл.
На этой странице вы сможете найти и списать готовое домешнее задание (ГДЗ) для школьников по предмету Физика, которые посещают 10 класс из книги или рабочей тетради под названием/издательством “Классический курс”, которая была написана автором/авторами: Мякишев. ГДЗ представлено для списывания совершенно бесплатно и в открытом доступе.
Тип 24 № 2205
i
Каков расход электроэнергии на получение 1 кг алюминия, если электролиз ведется при напряжении 10 В, а КПД установки 80%? Электрохимический эквивалент алюминия 0,93 · 10−7 кг/Кл.
Спрятать решение
Решение.
Работа электрического тока По закону Фарадея
Следовательно, полезная работа
Из формулы КПД найдем затраченную электроэнергию:
Ответ: 130 МДж (37 кВт · ч).
Источник: Гельфгат И. М. Сборник задач по физике для 10 класса, Х.: «Гимназия», 2001 (№ 14.34)
Электрохимические расчёты Электролиз
Количество вещества,
выделяющееся при электролизе на
отрицательном электроде (катоде),
пропорционально количеству электричества
(заряду), проходящему через электролит.
Количество вещества
m,
выделяющееся при прохождении заряда в
один кулон, называется электрохимическим
эквивалентом А, поэтому:
m = A*Q или
m = A*I*t,
где m
– масса выделенного вещества (кг, г, мг,
см3);
Q
– количество электричества (Кл = А*с); I
– электрический ток (А); t
– время (с).
У каждого металла
свой электрохимический эквивалент А
имеет размерность, соответственно
кг/(А*с), г/(А*с), мг/(А*с), см3/(А*с)
Электрохимический
эквивалент меди
А = 0.329 мг/(А*с)
Электрохимический
эквивалент кислорода
А = 0.058 см3/(А*с)
Электрохимический
эквивалент водорода
А = 0.116 см3/(А*с)
Электрохимический
эквивалент олова
А = 0.03075 мг/(А*с)
Электрохимический
эквивалент хрома
А = 0.180 мг/(А*с)
Электрохимический
эквивалент алюминия
А = 0.093 мг/(А*с)
В настоящее время
на алюминиевых заводах производится
электролиз при полупроводниковых
выпрямителей с током до 50÷100 кА.
Аккумуляторы
Напряжение питания
каждого элемента свинцового аккумулятора
после зарядки 2.7 В и не должно падать
ниже 1.83 В при разрядке.
Напряжение
железоникелевого аккумулятора в среднем
равно 1.1 В. Зарядный и разрядный ток
аккумулятора ограничен и заряжается
заводом-изготовителем (примерно 1 А на
1 дм2
пластины).
Количество
электричества, которое можно получить
от заряженного аккумулятора, называется
ёмкостью аккумулятора и измеряется в
ампер-часах (А*ч). Аккумуляторы
характеризуются также отдачей по
энергии и току. Отдача по энергии равна
отношению энергии, полученной при
разрядке, к энергии, затраченной на
зарядку аккумулятора:
ηэн
= Wр/Wз
.
Для свинцового
аккумулятора η = 70 %, а для железоникелевого
η = 50 %. Отдача по ёмкости равна отношению
количества электричества, полученного
при разрядке, к количеству электричества,
необходимого для зарядки:
η = Qр/Qз
= (Iр*tр)/(Iз*tр).
У свинцовых
аккумуляторов η = 90 %, а у железоникелевых
η = 70 %.
По определению:
ηэн
= Wр/Wз
= (Uр*Iр*tр)/(Uз*Iз*tз).
Так как Uр/Uз
< 1, то отдача по ёмкости аккумулятора
больше, чем отдача по энергии, т. е. ηэн
< η.
Расчёт ёмкости конденсатора
Конденсатор состоит
из двух или более электродов (пластин,
обкладок), которые разделены изоляцией
(диэлектрик, воздух). Ёмкость С характеризует
способность конденсатора накапливать
электрический заряд Q.
Заряд, напряжение и ёмкость конденсатора
связаны соотношением:
Q
= C*U
Коэффициент
пропорциональности есть ёмкость
конденсатора. Единицей измерения ёмкости
является фарад (Ф). Ёмкость 1 Ф имеет
конденсатор, заряд которого при напряжении
1 В равен 1 Кл (кулон) = 1 А*с. Фарад – очень
большая единица измерения. Поэтому на
практике пользуются более мелкими
единицами: микрофарада (мкФ), нанофарада
(нФ) и пикофарада (пФ), причём
1 Ф = 106
мкФ = 109
нФ = 1012
пФ
1
мкФ = 103
нФ = 106
пФ
1
нФ = 103
пФ
Ёмкость воздушного
конденсатора (в пикофарадах) определяется
по формуле:
С = (1.11*S)/(4*π*d)
Где S
– площадь одной обкладки, см2;
d
– расстояние между обкладками, см.
Ё
воздушного конденсатора (рис.1), состоит
изn-пластин,
т.е. n-1
параллельно соединенных конденсаторов
с двумя электродами,
рис1
Если пространство
между пластинами заполнить диэлектриком
– например, бумагой, то ёмкость
конденсатора увеличится в εr.
В случае бумажной изоляции, ёмкость
увеличится в εr
= 3 раза, при слюдяной изоляции в εr
= 5-8 раз, при стеклянной – εr
= 7 раз и т.
д. Величина εr
(эпсилон) называется относительной
диэлектрической проницаемостью изоляции
(диэлектрика). Ёмкость конденсатора с
двумя обкладками, изоляция которого
имеет диэлектрическую проницаемость
εr
Эта формула получена
из более общей
где ε0
– электрическая постоянная (диэлектрическая
проницаемость вакуума)
);
– относительная
диэлектрическая проницаемость диэлектрика
(безразмерная величина). В эту формулу
размерность подставляется в метрах,
ёмкость получается в фарадах.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #