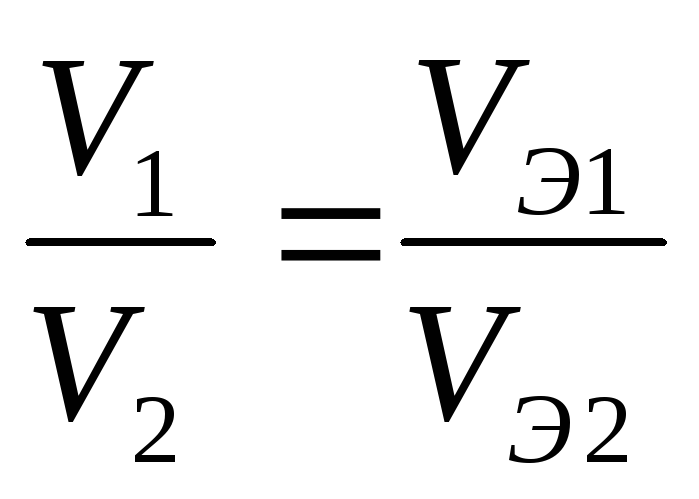Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 октября 2021 года; проверки требуют 2 правки.
Электрохимический эквивалент (устар. электролитический эквивалент) — масса вещества, которая должна выделиться во время электролиза на электроде, согласно закону Фарадея, при прохождении через электролит единицы количества заряда. Электрохимический эквивалент измеряется в кг/Кл. Лотар Мейер использовал термин электролитический эквивалент.
Законы Фарадея[править | править код]
Первый закон Фарадея устанавливает строгую зависимость между количеством электричества, прошедшим через раствор или сплав электролитов, и количеством разложенного током вещества[1]. А именно, масса вещества, осаждённого на электроде при электролизе, прямо пропорциональна количеству электричества, переданного на этот электрод:
,
где 


Согласно второму закону Фарадея, электрохимический эквивалент в свою очередь прямо пропорционален эквивалентной массе вещества. А именно:
,
где 

,
где 

.
Таблица значений электрохимических эквивалентов[править | править код]
| Элемент | молярная масса  (г/моль) (г/моль)
|
изменение валентности z |
 (мкмоль/кулон) |
электрохимический эквивалент (мг/кулон) |
электрохимический эквивалент (г/Ампер-час) |
пример применения |
|---|---|---|---|---|---|---|
| Водород | 1,0079 | 1 ↔ 0 | 10,364 | 0,0104 | 0,0376 | электролиз воды |
| Кислород | 15,999 | 2 ↔ 0 | 5,1821 | 0,0829 | 0,298 | |
| Фтор | 18,998 | 1 ↔ 0 | 10,364 | 0,197 | 0,709 | производство фтора |
| Натрий | 22,990 | 1 ↔ 0 | 10,364 | 0,238 | 0,858 | производство натрия |
| Алюминий | 26,981 | 3 ↔ 0 | 3,4548 | 0,0932 | 0,336 | производство алюминия |
| Хлор | 35,451 | 1 ↔ 0 | 10,364 | 0,367 | 1,32 | электролиз хлорида натрия[en] |
| Хром | 51,996 | 6 ↔ 3 или 3 ↔ 0 | 3,4548 | 0,180 | 0,647 | |
| Хром | 51,996 | 6 ↔ 0 | 1,7274 | 0,0898 | 0,323 | |
| Марганец | 54,938 | 4 ↔ 3 или 3 ↔ 2 | 10,364 | – | – | щелочной элемент |
| Марганец | 54,938 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 0,285 | 1,02 | |
| Марганец | 54,938 | 7 ↔ 4 или 3 ↔ 0 | 3,4548 | 0,190 | 0,683 | |
| Марганец | 54,938 | 7 ↔ 0 | 1,4806 | 0,0813 | 0,293 | |
| Железо | 55,845 | 3 ↔ 2 | 10,364 | – | – | |
| Железо | 55,845 | 2 ↔ 0 | 5,1821 | 0,289 | 1,04 | |
| Железо | 55,845 | 3 ↔ 0 | 3,4548 | 0,193 | 0,695 | |
| Никель | 58,693 | 2 ↔ 0 | 5,1821 | 0,304 | 1,09 | |
| Кобальт | 58,933 | 2 ↔ 0 | 5,1821 | 0,305 | 1,10 | |
| Медь | 63,546 | 2 ↔ 1 или 1 ↔ 0 | 10,364 | 0,659 | 2,37 | |
| Медь | 63,546 | 2 ↔ 0 | 5,1821 | 0,329 | 1,19 | рафинирование меди[de] |
| Цинк | 65,409 | 2 ↔ 0 | 5,1821 | 0,339 | 1,22 | |
| Родий | 102,91 | 3 ↔ 0 | 3,4548 | 0,356 | 1,28 | |
| Палладий | 106,42 | 2 ↔ 0 | 5,1821 | 0,552 | 1,99 | |
| Серебро | 107,87 | 1 ↔ 0 | 10,364 | 1,12 | 4,02 | |
| Кадмий | 112,41 | 2 ↔ 0 | 5,1821 | 0,583 | 2,10 | |
| Олово | 118,71 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 0,615 | 2,21 | |
| Олово | 118,71 | 4 ↔ 0 | 2,5911 | 0,308 | 1,11 | |
| Платина | 195,08 | 2 ↔ 0 | 5,1821 | 1,01 | 3,64 | |
| Золото | 196,97 | 1 ↔ 0 | 10,364 | 2,04 | 7,35 | Au(I) |
| Золото | 196,97 | 3 ↔ 0 | 3,4548 | 0,680 | 2,45 | |
| Свинец | 207,2 | 4 ↔ 2 или 2 ↔ 0 | 5,1821 | 1,07 | 3,87 | свинцово-кислотный аккумулятор |
| Свинец | 207,2 | 4 ↔ 0 | 2,5911 | 0,537 | 1,93 |
Примечания[править | править код]
- ↑ Кистяковский В. А. Электрохимический эквивалент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
Литература[править | править код]
- Петрий, О. А. Эквивалент электрохимический // Краткая химическая энциклопедия / гл. ред. И. Л. Кнунянц. — М. : Сов. энциклопедия. — Т. 5: Т−Я. — С. 979.
2. Электрохимический эквивалент.
Электрохимический эквивалент представляет собой количество вещества, прореагировавшего в результате протекания единицы количества электричества.
Электрохимический эквивалент может быть получен расчетным путем, если известна электрохимическая реакция, т.е. исходные вещества и ее продукты. Уравнение для расчета электрохимического эквивалента выглядит следующим образом:

где М – молярная масса реагента, n – число электронов, участвующих в реакции, F – число или постоянная Фарадея: F = 96486 ≈96500 Кл/моль.
Печатать книгу
| Сайт: | Профильное обучение |
| Курс: | Физика. 10 класс |
| Книга: | § 35. Электрический ток в электролитах |
| Напечатано:: | Гость |
| Дата: | Четверг, 25 Май 2023, 01:42 |
Оглавление
- Природа электрического тока в электролитах
- Закон электролиза Фарадея
- Техническое применение электролиза
- Примеры решения задач
- Упражнение 25
При изучении предыдущего параграфа вы узнали, что в металлах перенос заряда не сопровождается переносом вещества, а носителями свободных зарядов являются электроны. Но существует класс проводников, прохождение электрического тока в которых всегда сопровождается химическими изменениями и переносом вещества. Какова природа электрического тока в таких проводниках?
Природа электрического тока в электролитах. Из опытов следует, что растворы многих солей, кислот и щелочей, а также расплавы солей и оксидов металлов проводят электрический ток, т. е. являются проводниками. Такие проводники назвали электролитами.
Электролиты — вещества, растворы или расплавы которых проводят электрический ток.
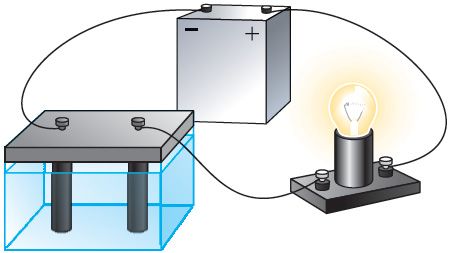
Проведём опыт. Соберём электрическую цепь, состоящую из источника тока, лампы накаливания и ванны с дистиллированной водой, в которой находятся два угольных электрода. При замыкании цепи лампа не светится, следовательно, дистиллированная вода не проводит электрический ток. Повторим опыт, добавив в дистиллированную воду сахар. Лампа не светится и в этом случае. Раствор сахара в воде также не является проводником. А теперь добавим в дистиллированную воду небольшое количество соли, например, хлорида меди(II) CuCl2. В цепи проходит электрический ток, о чём наглядно свидетельствует свечение лампы (рис. 200). Следовательно, раствор соли в воде является проводником электрического тока, т. е. при растворении хлорида меди(II) в дистиллированной воде появились свободные носители электрического заряда.
Изучая химию, вы узнали, что при растворении солей, кислот и щелочей в воде происходит электролитическая диссоциация, т. е. распад молекул электролита на ионы. В проведённом опыте хлорид меди(II) CuCl2 в водном растворе диссоциирует на положительно заряженные ионы меди Cu2+ и отрицательно заряженные ионы хлора Cl−.
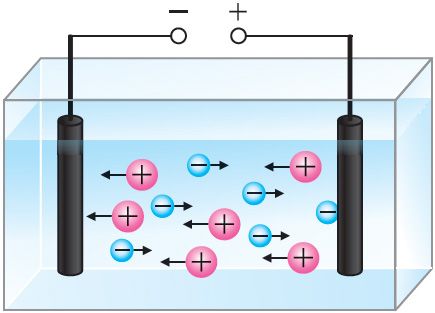
Ионы Cu2+ и Cl− в растворе при отсутствии электрического поля движутся беспорядочно. Под действием внешнего электрического поля на беспорядочное движение ионов накладывается их направленное движение (рис. 201). При этом положительно заряженные ионы Cu2+ движутся к катоду (электроду, подключённому к отрицательному полюсу источника тока), отрицательно заряженные ионы Cl− — к аноду (электроду, подключённому к положительному полюсу источника тока). На аноде будет происходить процесс окисления ионов Cl− до атомов.
Нейтральные атомы образуют молекулы хлора, который выделяется на аноде:
На катоде будет происходить процесс восстановления ионов Cu2+ до нейтральных атомов и осаждение металлической меди:
Это явление называют электролизом.
Электролиз — процесс выделения на электроде вещества, связанный с окислительно-восстановительными реакциями, протекающими при прохождении электрического тока через растворы (расплавы) электролитов.
Таким образом, свободные носители электрического заряда в электролитах — положительно и отрицательно заряженные ионы, которые образуются в результате электролитической диссоциации, а проводимость электролитов является ионной. Электролиты относят к проводникам второго рода.
От теории к практике
Почему опасно прикасаться голыми руками к неизолированным металлическим проводам, по которым проходит электрический ток?
Закон электролиза Фарадея. Закон электролиза был экспериментально установлен Фарадеем в 1833 г.
Масса m вещества, выделившегося на электроде, прямо пропорциональна электрическому заряду q, прошедшему через электролит:
В формуле (1) коэффициент пропорциональности k называют электрохимическим эквивалентом данного вещества. Он численно равен массе вещества, выделившегося на одном из электродов при прохождении через электролит единичного электрического заряда. В СИ электрохимический эквивалент измеряют в килограммах на кулон . Значения электрохимических эквивалентов некоторых веществ приведены в таблице.
| Вещество | k, 10-8 |
Вещество | k, 10-8 |
| Алюминий | 9,32 | Никель (двухвалентный) | 30,4 |
| Водород | 1,04 | Никель (трёхвалентный) | 20,3 |
| Кислород | 8,29 | Хлор | 36,7 |
| Медь (одновалентная) | 65,9 | Хлом | 18,0 |
| Медь (двухвалентная) | 32,9 | Цинк | 33,9 |
Поскольку q = It, где I — сила тока, t — промежуток времени прохождения тока через электролит, то
m = kIt.
От теории к практике
Никелирование изделия двухвалентным никелем осуществлялось в течение промежутка времени t = 20 мин при силе тока I = 15 А. Определите массу слоя никеля, осаждённого на изделии.
Массу m вещества, выделившегося на электроде при прохождении через электролит электрического заряда q, можно определить, зная массу m0 одного иона и число N осевших на этом электроде ионов:
,
,
где M — молярная масса выделившегося вещества, NА — постоянная Авогадро.
Тогда число ионов: .
С другой стороны, число ионов, нейтрализовавшихся на электроде:
где q0 — заряд одного иона. Так как заряд иона q0 кратен элементарному заряду e, то q0 = en, где n — валентность иона.
Значит, и
(2)
Сравнивая формулы (2) и (1), получим
(3)
Так как NА и е – универсальные постоянные, то физическую величину в честь М. Фарадея назвали постоянной Фарадея.
С учётом этого формулу (3) для определения электрохимического эквивалента вещества можно записать в виде:
Используя закон электролиза, можно определить значение заряда электрона в школьной лаборатории. Допустим, что I — сила тока, который проходил через электролит в течение промежутка времени t (можно измерить амперметром). При этом на электроде выделилось вещество, масса которого m (можно измерить, взвесив электрод до и после прохождения тока через электролит). Тогда модуль заряда электрона определяют по формуле.
Техническое применение электролиза. Электролиз нашёл различные применения в промышленности. Рассмотрим некоторые из них.
1. Нанесение защитных и декоративных покрытий на металлические изделия (гальваностегия).
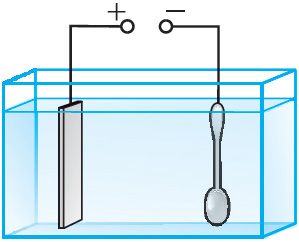
Для предохранения металлов от окисления, а также для придания изделиям прочности и улучшения внешнего вида их покрывают тонким слоем благородных металлов (золотом, серебром) или малоокисляющимися металлами (хромом, никелем). Предмет, подлежащий гальваническому покрытию, например, ложку (рис. 202), погружают в качестве катода в электролитическую ванну. Электролитом является раствор соли металла, которым осуществляется покрытие. Анодом служит пластина из такого же металла. Пропуская через электролитическую ванну в течение определённого промежутка времени электрический ток, ложку покрывают слоем металла нужной толщины. Для наиболее равномерного покрытия ложки её необходимо поместить между двумя или более анодными пластинами. После покрытия ложку вынимают из ванны, сушат и полируют.
2. Производство металлических копий с рельефных моделей (гальванопластика).
Для получения копий предметов (монет, медалей, барельефов и т. п.) делают слепки из какого-нибудь пластичного материала (например, воска). Для придания слепку электропроводности его покрывают графитовой пылью, погружают в электролитическую ванну в качестве катода и получают на нём слой металла нужной толщины. Затем, нагревая, удаляют воск.
Процесс гальванопластики был разработан в 1836 г. русским академиком Б. С. Якоби (1801–1874).
3. Получение металлов из расплавленных руд и их очистка, электрохимическая обработка металлов.
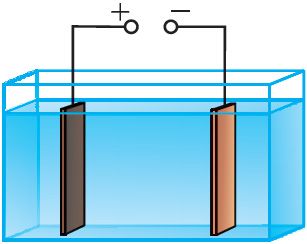
Процесс очистки металлов происходит в электролитической ванне. Анодом служит металл, подлежащий очистке, катодом — тонкая пластина из чистого металла, а электролитом — раствор соли данного металла. Например, пластину из неочищенной меди помещают в качестве анода в ванну с раствором медного купороса, где катодом служит лист чистой меди (рис. 203). В загрязнённых металлах могут содержаться ценные примеси. Так, в меди часто содержатся никель и серебро. При пропускании через ванну электрического тока медь с анода переходит в раствор, из раствора на катоде выделяется чистая медь, а примеси выпадают в виде осадка или переходят в раствор.
1. Что называют электролитом?
2. Какова природа электрического тока в электролитах?
3. Какой процесс называют электролизом?
4. Приведите примеры использования электролиза.
5. Сформулируйте закон электролиза. Каков физический смысл электрохимического эквивалента?
6. Через электролитическую ванну, наполненную раствором сульфата меди(II) CuSO4, пропускают электрический ток. Изменится ли масса меди, выделяющейся на катоде за одинаковые промежутки времени, если увеличить напряжение между электродами? увеличить температуру раствора электролита? увеличить концентрацию раствора электролита? Почему?
Примеры решения задач
Пример 1. Через электролитическую ванну, содержащую раствор серной кислоты, в течение промежутка времени t = 60,0 мин проходил ток. Выделившийся на катоде газообразный водород собран в сосуде вместимостью V = 350 см3. Определите температуру водорода, если его давление p = 150 кПа, а сила тока, проходившего через электролитическую ванну, I = 1,20 А.
Дано:
t = 60,0 мин = 3,60 · 103 с
I = 1,20 А
V = 350 см3 = 3,50 · 10–4 м3
p = 150 кПа = 1,50 · 105 Па
T — ?
Решение: Для нахождения температуры водорода воспользуемся уравнением Клапейрона‒Менделеева:
где М = 2,02 · 10-3 — молярная масса водорода, R = 8,31
— универсальная газовая постоянная. Следовательно,
. Массу водорода, выделившегося на катоде, определим, воспользовавшись законом электролиза: m = kIt, где k — электрохимический эквивалент водорода (k = 1,04 · 10–8
). С учётом этого температуру водорода рассчитаем по формуле
.
Ответ: Т = 284 К.
Пример 2. Хромирование тонкой прямоугольной пластинки длиной а = 3,0 см и шириной b = 5,0 см в большой гальванической ванне осуществляется в течение промежутка времени t = 2,0 ч при силе тока I = 1,5 А. Определите толщину образовавшегося на пластинке слоя хрома. Плотность хрома ρ = 7,18 · 103 .
Дано:
а = 3,0 см = 3,0 · 10–2 м
b = 5,0 см = 5,0 · 10–2 м
t = 2,0 ч = 7,2 · 103 с
I = 1,5 А
ρ = 7,18 · 103
h — ?
Решение: Для определения массы хрома, осаждённого на двух сторонах пластинки, воспользуемся законом Фарадея: m = kIt, где k = 1,8 ∙ 10–7 .
С другой стороны, массу хрома можно выразить через плотность ρ и объём V: m = ρV = ρab ∙ 2h , где h — толщина образовавшегося на пластинке слоя хрома. С учётом этого: 2ρabh = kIt, откуда толщина слоя хрома:
Ответ: h = 90 мкм.
Упражнение 25
1. Через водный раствор сульфата меди(II) CuSO4, находящийся в электролитической ванне, пропускают электрический ток. Определите число атомов меди, ежесекундно осаждающихся на катоде ванны, если сила тока в цепи I = 4,0 А.
2. В процессе электролиза на катоде осаждается двухвалентный никель, образуя слой массой m = 0,15 кг. Определите работу, совершённую электрическим током, если напряжение между электродами электролитической ванны U = 4,0 В.
3. Электроды, находящиеся в растворе сульфата меди(II) CuSO4, подключены к источнику тока с ЭДС = 12 В и внутренним сопротивлением r = 0,40 Ом. Определите массу меди, осаждённой на катоде за промежуток времени t = 10 мин, если сопротивление раствора между электродами R = 0,60 Ом.
4. При электролизе слабого раствора серной кислоты на катоде электролитической ванны выделился газообразный водород, температура которого t = 22 ºС, давление р = 100 кПа и объём V = 1,5 л. Электролиз проходил при напряжении U = 6,0 В, а коэффициент полезного действия установки η = 75 %. Определите расход электроэнергии.
5. Воздушный шар наполнен водородом, сохраняющим тепловое равновесие с атмосферным воздухом. Небольшое отверстие в нижней части шара обеспечивает практически одинаковое давление газа внутри шара и атмосферного воздуха. Масса тонкой оболочки шара и поднимаемого им груза m = 2,2 · 102 кг. Какой электрический заряд при электролизе потребовалось бы пропустить через слабый раствор серной кислоты, чтобы получить необходимую массу водорода? Как долго продолжался бы такой процесс при силе тока I = 0,15 кА? (Ответ: q ≥ 1,6 · 109 Кл; τmin = 4,1 месяца.)
С количественной
стороны процесс электролиза впервые
был изучен в 30-х годах XIX века выдающимся
английским физиком Фарадеем, который
в результате своих исследований установил
следующие законы электролиза:
I
закон. Масса
образующегося при электролизе вещества
пропорциональна количеству прошедшего
через раствор электричества.
Этот закон вытекает
из сущности электролиза. Как уже
говорилось, в месте соприкосновения
металла с раствором происходит
электрохимический процесс – взаимодействие
ионов или молекул электролита с
электронами металла, так что
электролитическое образование вещества
является результатом этого процесса.
Ясно, что количество вещества, получающегося
у электрода, всегда будет пропорционально
числу прошедших по цепи электронов, т.
е. количеству электричества.
Количество вещества,
выделяющегося при прохождении через
электролит 1 кулона электричества,
называется электрохимическим эквивалентом
(Э).
где Q
– количество электричества, пропущенного
через раствор или расплав электролита:
Q
= I∙t,
где t
‑ время, в сек., I
‑ сила тока.
где МЭ
‑ молярная
масса эквивалента вещества, n
– число электронов в электродном
процессе. Таким образом:
Или, при выделении
газообразных веществ:
Измерениями
установлено, что количество электричества,
обусловливающее электрохимическое
превращение одного эквивалента вещества,
равно 96 485 (округленно 96 500) кулонам.
Величина 96 500 Кл/моль называется постоянной
Фарадея и обозначается буквой F.
II
закон. При
электролизе различных химических
соединений равные количества электричества
приводят к электрохимическому превращению
эквивалентных количеств веществ.
Следовательно,
для восстановления на катоде и окисления
на аноде одного моль-эквивалента любого
вещества необходимо затратить одно и
то же количество электричества, а именно
96500 кулонов.
1.11 Последовательность восстановления частиц на катоде и окисления на аноде
Руководствуясь
таблицей стандартных электродных
потенциалов металлов, можно указать
следующие случаи при электролизе водных
растворов электролитов:
1) На катоде легче
всего разряжаются катионы того металла,
которому отвечает наиболее положительный
потенциал. Так, например, из смеси
катионов Cu2+,
Ag+
и Zn2+
при достаточном напряжении на клеммах
электролизера вначале восстанавливаются
ионы серебра (φ0=+0.79
В), затем меди (φ0=+0.337
В) и, наконец, цинка (φ0=
–0.76 В).
2) Катионы металлов
со стандартным электродным потенциалом,
большим, чем у водорода, расположены в
ряду напряжений после него: Cu2+,
Hg22+,
Ag+,
Pt2+,
…, до Pt4+.
При электролизе они почти полностью
восстанавливаются на катоде и выделяются
в виде металла:
Men+
+ nē
→ Meo
3) Катионы металлов
с малой величиной стандартного
электродного потенциала (металлы начала
ряда напряжений Li+,
Na+,
K+,
Rb+,
… до Al3+
включительно). При электролизе на катоде
они не восстанавливаются, вместо них
восстанавливаются молекулы воды:
2H2O
+ 2ē → H2
+ 2OH–
4) Катионы металлов
со стандартным электродным потенциалом
меньшим, чем у водорода, но большим, чем
у алюминия (Mn2+,
Zn2+,
Cr3+,
Fe2+,
…, до H). При электролизе эти катионы,
характеризующиеся средними величинами
электроноакцепторной способности, на
катоде восстанавливаются одновременно
с молекулами воды:
Men+
+ nē → Meo
2H2O
+ 2ē → H2
+ 2OH–
Процессы, протекающие
на аноде, зависят как от электролита,
так и от материала (вещества), из которого
сделан анод. Нерастворимые аноды не
претерпевают окисления в ходе электролиза.
В определенных условиях роль нерастворимых
анодов могут выполнять Fe, Ni, Pb, Sn и др.
Растворимые аноды в процессе электролиза
могут окисляться (разрушаться) и
переходить в раствор в виде ионов. Они
изготовляются из меди, серебра, цинка,
кадмия, никеля и других металлов.
Растворимые аноды используют при
нанесении металлических покрытий на
изделие (катод).
На нерастворимом
аноде в процессе
электролиза происходит окисление
анионов или молекул воды.
1) На аноде легче
всего окисляются те ионы, у которых
стандартный электродный потенциал
меньше.
2) При электролизе
водных растворов бескислородных кислот
и их солей (кроме HF и фторидов) у анода
будут окисляться (разряжаться) анионы.
Так, например, при электролизе растворов
кислот и их солей (HI, HBr, HCl, H2S
или гидроксидов) на аноде будет окисляться
соответствующий ион передавать свои
электроны во внешнюю цепь электролизера:
2I–
– 2ē → I20
S2-
– 2ē → So
4OH–
– 4ē → 2H2O
+ O2
3) При электролизе
кислородсодержащих кислот и их солей
(SO42–,
NO3–,
PO43–
и т. п.) с максимальной степенью окисления
неметалла на аноде окисляются не анионы,
а молекулы воды с выделением кислорода,
так как потенциал окисления воды
значительно меньше, чем для таких анионов
2H2O
– 4ē
→ O2
+ 4H+
На растворимом
аноде в
процессе электролиза происходит
окисление материала, из которого
изготовлен анод
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
23.11.2019279.04 Кб0n1.doc
- #
- #
1 Найти электрохимический эквивалент натрия. Молярная масса натрия μ = 0,023 кг/моль, его валентность z=1. Постоянная Фарадея
Решение:
2 Цинковый анод массы m = 5 г поставлен в электролитическую ванну, через которую проходит ток I=2 А. Через какое время t анод полностью израсходуется на покрытие металлических изделий? Электрохимический эквивалент цинка
Решение:
3 Найти постоянную Фарадея, если при прохождении через электролитическую ванну заряда q = 7348 Кл на катоде выделилась масса золота m = 5 г. Химический эквивалент золота А = 0,066 кг/моль.
Решение:
Согласно объединенному закону Фарадея
отсюда
4 Найти элементарный электрический заряд е, если масса вещества, численно равная химическому эквиваленту, содержит N0=NА/z атомов или молекул.
Решение:
Ионы в растворе электролита несут на себе число элементарных зарядов, равное валентности z. При выделении массы вещества, численно равной его химическому эквиваленту, через раствор проходит заряд, численно равный постоянной Фарадея, т. е.
Следовательно, элементарный заряд
5 Молярная масса серебра μ1 =0,108 кг/моль, его валентность z1 = 1 и электрохимический эквивалент . Найти электрохимический эквивалент золота k2, если молярная масса золота μ2 = 0,197 кг/моль, его валентность z2 = 3.
Решение:
По второму закону Фарадея имеем
отсюда электрохимический эквивалент золота
6 Найти массы веществ, выделившихся за время τ = 10 ч на катодах трех электролитических ванн, включенных последовательно в сеть постоянного тока. Аноды в ваннах — медный, никелевый и серебряный — опущены соответственно в растворы CuSO4, NiSО4 и AgNО3. Плотность тока при электролизе j=40 А/м2, площадь катода в каждой ванне S= 500 см2. Электрохимические эквиваленты меди, никеля и серебра
Решение:
Ток в ваннах I=jS. По первому закону Фарадея массы выделившихся при электролизе веществ
7 При никелировании изделий в течение времени τ = 2 ч отложился слой никеля толщины l=0,03 мм.
Найти плотность тока при электролизе. Электрохимический эквивалент никеля , его плотность
Решение:
8 Амперметр, включенный последовательно с электролитической ванной, показывает ток I0=1,5А. Какую поправку надо внести в показание амперметра, если за время τ = 10 мин на катоде отложилась масса меди m= 0,316 г? Электрохимический эквивалент меди .
Решение:
По первому закону Фарадея m = kIτ, где I-ток в цепи; отсюда I=m/kτ=1,6 А, т.е. в показание амперметра надо внести поправку
9 Желая проверить правильность показаний вольтметра, его подключили параллельно резистору с известным сопротивлением R= 30 Ом. Последовательно в общую цепь включили электролитическую ванну, в которой ведется электролиз серебра. За время τ = 5 мин в этой ванне выделилась масса серебра m = 55,6 мг. Вольтметр показывал напряжение Vo = 6 В. Найти разность между показанием вольтметра и точным значением падения напряжения на резисторе. Электрохимический эквивалент серебра .
Решение:
По первому закону Фарадея m = klτ, где I-ток в цепи. Точное значение падения напряжения на сопротивлении V=IR = mR/kτ= 4,91 В. Разность между показанием вольтметра и точным значением падения напряжения
10 Для серебрения ложек через раствор соли серебра в течение времени τ = 5 ч пропускается ток I=1,8 А. Катодом служат n=12 ложек, каждая из которых имеет площадь поверхности S=50 см2. Какой толщины слой серебра отложится на ложках? Молярная масса серебра μ = 0,108 кг/моль, его валентность z = 1 и плотность .
Решение:
Толщина слоя
11 Две электролитические ванны включены последовательно. В первой ванне находится раствор хлористого железа (FeCl2), во второй — раствор хлорного железа (FeCl3). Найти массы выделившегося железа на катодах и хлора на анодах в каждой ванне при прохождении через ванну заряда . Молярные массы железа и хлора
.
Решение:
В первой ванне железо двухвалентно (z1=2), во второй — трехвалентно (z2 = 3). Поэтому при прохождении через растворы одинаковых зарядов выделяются различные массы железа на катодах: в первой ванне
во второй ванне
Так как валентность атомов хлора z=1, то на аноде каждой ванны выделяется масса хлора
12 При электролизе раствора серной кислоты (CuSO4) расходуется мощность N=37 Вт. Найти со-противление электролита, если за время t = 50 мин выделяется масса водорода m = 0,3 г. Молярная масса водорода μ = 0,001 кг/моль, его валентность z=1.
Решение:
13 При электролитическом способе получения никеля на единицу массы расходуется Wm= 10 кВт·ч/кг электроэнергии. Электрохимический эквивалент никеля . При каком напряжении производится электролиз?
Решение:
14 Найти массу выделившейся меди, если для ее получения электролитическим способом затрачено W= 5 кВт·ч электроэнергии. Электролиз проводится при напряжении V=10 В, к.п.д. установки η = 75%. Электрохимический эквивалент меди .
Решение:
К.п.д. установки
где q-заряд, прошедший через ванну. Масса выделившейся меди m=kq; отсюда
15 Какой заряд проходит через раствор серной кислоты (CuSO4) за время τ = 10 с, если ток за это время равномерно возрастает от I1=0 до I2 = 4А? Какая масса меди выделяется при этом на катоде? Электрохимический эквивалент меди .
Решение: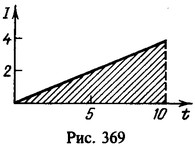
Заряд, протекший через раствор,
Нахождение заряда графическим путем показано на рис. 369. На графике зависимости тока от времени заштрихованная площадь численно равна заряду. Масса меди, выделившейся на катоде,
16 При рафинировании меди с помощью электролиза к последовательно включенным электролитическим ваннам, имеющим общее сопротивление R = 0,5 Ом, подведено напряжение V=10 В. Найти массу чистой меди, выделившейся на катодах ванны за время τ = 10 ч. Э.д.с. поляризации ε = 6 В. Электрохимический эквивалент меди .
Решение:
17 При электролизе воды через электролитическую ванну в течение времени τ = 25 мин шел ток I=20 А. Какова температура t выделившегося кислорода, если он находится в объеме V= 1 л под давлением р = 0,2 МПа? Молярная масса воды μ = 0,018 кг/моль. Электрохимический эквивалент кислорода .
Решение:
где R= 8,31 Дж/(молъ К)-газовая постоянная.
18 При электролитическом способе получения алюминия на единицу массы расходуется W1m = 50 кВт·ч/кг электроэнергии. Электролиз проводится при напряжении V1 = 16,2 В. Каким будет расход электроэнергии W2m на единицу массы при напряжении V2 = 8,1 В?
Решение: