При растворении в воде некоторые вещества имеют способность проводить электрический ток.
Электролиты проводят ток за счет так называемой ионной проводимости, которой обладают многие соединения с ионным строением (соли, кислоты, основания).
Вещества, имеющие сильнополярные связи, но в растворе при этом подвергаются неполной ионизации (например, хлорид ртути II) являются слабыми электролитами.
Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Приведем некоторые закономерности, руководствуясь которыми можно определить относятся вещества к сильным или слабым электролитам:
Электролиты, как сильные, так и слабые и даже очень сильно разбавленные не подчиняются закону Рауля и принципу Вант-Гоффа.
Имея способность к электропроводности, значения давления пара растворителя и температуры плавления растворов электролитов будут более низкими, а температуры кипения более высокими по сравнению с аналогичными значениями чистого растворителя. В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
K = [A — ] a ·[B + ] b /[Aa Bb]
Для слабых электролитов концентрация каждого иона равна произведению степени диссоциации α на общую концентрацию электролита С.
Таким образом, выражение для константы диссоциации можно преобразовать:
K = α 2 C/(1-α)
Для разбавленных растворов (1-α) =1, тогда
K = α 2 C
Отсюда нетрудно найти степень диссоциации
α = (K/C) 1/2
Ионно–молекулярные уравнения
Как составить полное и сокращенное ионные уравнения
Рассмотрим несколько примеров реакций, для которых составим молекулярное, полное и сокращенное ионное уравнения.
1) Пример нейтрализации сильной кислоты сильным основанием
1. Процесс представлен в виде молекулярного уравнения.
HCl + NaOH = NaCl + HOH
2. Представим процесс в виде полного ионного уравнения. Т.е. запишем в ионном виде все соединения — электролиты, которые в растворе полностью ионизированы.
H + + Cl — +Na + + OH — = Na + + Cl — + HOH
3. После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
H + + OH — = HOH
Мы видим, что процесс нейтрализации сводится к соединению H + и OH — и образованию воды.
При составлении ионных уравнений следует помнить, что в ионном виде записываются только сильные электролиты. Слабые электролиты, твердые вещества и газы записываются в их молекулярном виде.
2) Пример реакции осаждения
Смешаем водные растворы AgNO3 и HI:
| Молекулярное уравнение | AgNO3 + HI →AgI↓ + HNO3 |
| Полное ионное уравнение | Ag + + NO3 — + H + + I — →AgI↓ + H + + NO3 — |
| Сокращенное ионное уравнение | Ag + + I — →AgI↓ |
Процесс осаждения сводится к взаимодействию только Ag + и I — и образованию нерастворимого в воде AgI.
Чтобы узнать способно ли интересующее нас вещество растворяться в воде, необходимо воспользоваться таблицей растворимости кислот, солей и оснований в воде. В приведенной таблице также указан цвет образуемого осадка, сила кислот и оснований и способность анионов к гидролизу.
Пример образования летучего соединения
Рассмотрим третий тип реакций, в результате которой образуется летучее соединение. Это реакции взаимодействия карбонатов, сульфитов или сульфидов с кислотами. Например,
| Молекулярное уравнение | Na2SO3 + 2HI → 2NaI + SO2↑ + H2O |
| Полное ионное уравнение | 2Na + + SO3 2- + 2H + + 2I — → 2Na + + 2I — + SO2↑ + H2O |
| Сокращенное ионное уравнение | SO3 2- + 2H + → SO2↑ + H2O |
Отсутствие взаимодействия между растворами веществ
При смешении некоторых растворов ионных соединений, взаимодействия между ними может и не происходить, например
| Молекулярное уравнение | CaCl2 + 2NaI = 2NaCl +CaI2 |
| Полное ионное уравнение | Ca 2+ + Cl — + 2Na + + I — = 2Na + + Cl — + Ca 2+ + 2I — |
| Сокращенное ионное уравнение | отсутствует |
Условия протекания реакции (химического превращения)
Итак, подводя итог, отметим, что химические превращения наблюдаются в случаях, если соблюдается одно из следующих условий:
- Образование неэлектролита. В качестве неэлектролита может выступать вода.
- Образование осадка.
- Выделение газа.
- Образование слабого электролита, например уксусной кислоты.
- Перенос одного или нескольких электронов. Это реализуется в окислительно – восстановительных реакциях.
- Образование или разрыв одной или нескольких ковалентных связей.
Электролитическая диссоциация
Электролитической диссоциацией называют процесс, в ходе которого молекулы растворенного вещества распадаются на ионы в результате взаимодействия с растворителем (воды). Диссоциация является обратимым процессом.
Диссоциация обуславливает ионную проводимость растворов электролитов. Чем больше молекул вещества распадается на ионы, тем лучше оно проводит электрический ток и является более сильным электролитом.
В общем виде процесс электролитической диссоциации можно представить так:
KA ⇄ K + (катион) + A – (анион)

Замечу, что сила кислоты определяется способностью отщеплять протон. Чем легче кислота его отщепляет, тем она сильнее.
У HF крайне затруднен процесс диссоциации из-за образования водородных связей между F (самым электроотрицательным элементом) одной молекулы и H другой молекулы.
Ступени диссоциации
Некоторые вещества диссоциируют на ионы не в одну стадию (как NaCl), а ступенчато. Это характерно для многоосновных кислот: H2SO4, H3PO4.
Посмотрите на ступенчатую диссоциацию ортофосфорной кислоты:

Важно заметить, что концентрация ионов на разных ступенях разная. На первых ступенях ионов всегда много, а до последних доходят не все молекулы. Поэтому в растворе ортофосфорной кислоты концентрация дигидрофосфат-анионов будет больше, чем фосфат-анионов.
Для серной кислоты диссоциация будет выглядеть так:

Для средних солей диссоциация чаще всего происходит в одну ступень:
Из одной молекулы ортофосфата натрия образовалось 4 иона.
Из одной молекулы сульфата калия образовалось 3 иона.
Электролиты и неэлектролиты
Химические вещества отличаются друг от друга по способности проводить электрический ток. Исходя из этой способности, вещества делятся на электролиты и неэлектролиты.

Электролиты – жидкие или твердые вещества, в которых присутствуют ионы, способные перемещаться и проводить электрический ток. Связи в их молекулах обычно ионные или ковалентные сильнополярные.
К ним относятся соли, сильные кислоты и щелочи (растворимые основания).
Степень диссоциации сильных электролитов составляет от 0,3 до 1, что означает 30-100% распад молекул, попавших в раствор, на ионы.

Неэлектролиты – вещества недиссоциирующие в растворах на ионы. В молекулах эти веществ связи ковалентные неполярные или слабополярные.
К неэлектролитам относятся многие органические вещества, слабые кислоты, нерастворимые в воде основания и гидроксид аммония.
Степень их диссоциации до 0 до 0.3, то есть в растворе неэлектролита на ионы распадается до 30% молекул. Они плохо или вообще не проводят электрический ток.

Молекулярное, полное и сокращенное ионные уравнения
Молекулярное уравнение представляет собой запись реакции с использованием молекул. Это те уравнения, к которым мы привыкли и которыми наиболее часто пользуемся. Примеры молекулярных уравнений:

Полные ионные уравнения записываются путем разложения молекул на ионы. Запомните, что нельзя раскладывать на ионы:
- Слабые электролиты (в их числе вода)
- Осадки
- Газы

Сокращенное ионное уравнение записывается путем сокращения одинаковых ионов из левой и правой части. Просто, как в математике – остается только то, что сократить нельзя.

© Беллевич Юрий Сергеевич 2018-2022
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Электролитическая диссоциация
Теория электролитической диссоциации

Темы кодификатора ЕГЭ: Электролитическая диссоциация электролитов вводных растворах. Сильные и слабые электролиты.
Электролиты – это вещества, растворы и расплавы которых проводят электрический ток.
Электрический ток – это упорядоченное движение заряженных частиц под действием электрического поля. Таким образом, в растворах или расплавах электролитов есть заряженные частицы. В растворах электролитов, как правило, электрическая проводимость обусловлена наличием ионов.
Ионы – это заряженные частицы (атомы или группы атомов). Разделяют положительно заряженные ионы (катионы) и отрицательно заряженные ионы (анионы).
Электролитическая диссоциация — это процесс распада электролита на ионы при его растворении или плавлении.
Разделяют вещества — электролиты и неэлектролиты. К неэлектролитам относятся вещества с прочной ковалентной неполярной связью (простые вещества), все оксиды (которые химически не взаимодействуют с водой), большинство органических веществ (кроме полярных соединений — карбоновых кислот, их солей, фенолов) — альдегиды, кетоны, углеводороды, углеводы.
К электролитам относят некоторые вещества с ковалентной полярной связью и вещества с ионной кристаллической решеткой.
В чем же суть процесса электролитической диссоциации?
Поместим в пробирку несколько кристаллов хлорида натрия и добавим воду. Через некоторое время кристаллы растворятся. Что произошло?
Хлорид натрия – вещество с ионной кристаллической решеткой. Кристалл NaCl состоит из ионов Na + и Cl — . В воде этот кристалл распадается на структурные единицы-ионы. При этом распадаются ионные химические связи и некоторые водородные связи между молекулами воды. Попавшие в воду ионы Na + и Cl — вступают во взаимодействие с молекулами воды. В случае хлорид-ионов можно говорить про электростатическое притяжение дипольных (полярных) молекул воды к аниону хлора, а в случае катионов натрия оно приближается по своей природе к донорно-акцепторному (когда электронная пара атома кислорода помещается на вакантные орбитали иона натрия). Окруженные молекулами воды ионы покрываются гидратной оболочкой. Диссоциация хлорида натрия описывается уравнением:
NaCl = Na + + Cl –
При растворении в воде соединений с ковалентной полярной связью, молекулы воды, окружив полярную молекулу, сначала растягивают связь в ней, увеличивая её полярность, затем разрывают её на ионы, которые гидратируются и равномерно распределяются в растворе. Например, соляная ксилота диссоциирует на ионы так: HCl = H + + Cl — .
При расплавлении, когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов.
Процесс электролитической диссоциации характеризуется величиной степени диссоциации молекул вещества:
Степень диссоциации — это отношение числа продиссоциировавших (распавшихся) молекул к общему числу молекул электролита. Т.е., какая доля молекул исходного вещества распадается в растворе или расплаве на ионы.
Nпродисс — это число продиссоциировавших молекул,
Nисх — это исходное число молекул.
По степени диссоциации электролиты делят на делят на сильные и слабые.
Сильные электролиты (α≈1):
1. Все растворимые соли (в том числе соли органических кислот — ацетат калия CH3COOK, формиат натрия HCOONa и др.)
2. Сильные кислоты: HCl, HI, HBr, HNO3, H2SO4 (по первой ступени), HClO4 и др.;
3. Щелочи: NaOH, KOH, LiOH, RbOH, CsOH; Ca(OH)2, Sr(OH)2, Ba(OH)2.
Сильные электролиты распадаются на ионы практически полностью в водных растворах, но только в ненасыщенных. В насыщенных растворах даже сильные электролиты могут распадаться только частично. Т.е. степень диссоциации сильных электролитов α приблизительно равна 1 только для ненасыщенных растворов веществ. В насыщенных или концентрированны растворах степень диссоциации сильных электролитов может быть меньше или равна 1: α≤1.
Слабые электролиты (α
1. Слабые кислоты, в т.ч. органические;
2. Нерастворимые основания и гидроксид аммония NH4OH;
3. Нерастворимые и некоторые малорастворимые соли (в зависимости от растворимости).
Неэлектролиты:
1. Оксиды, не взаимодействующие с водой (взаимодействующие с водой оксиды при растворении в воде вступают в химическую реакцию с образованием гидроксидов);
2. Простые вещества;
3. Большинство органических веществ со слабополярными или неполярными связями (альдегиды, кетоны, углеводороды и т.д.).
Как диссоциируют вещества? По степени диссоциации различают сильные и слабые электролиты.
Сильные электролиты диссоциируют полностью (в насыщенных растворах), в одну ступень, все молекулы распадаются на ионы, практически необратимо. Обратите внимание — при диссоциации в растворе образуются только устойчивые ионы. Самые распространенные ионы можно найти в таблице растворимости — это ваша официальная шпаргалка на любом экзамене. Степень диссоциации сильных электролитов примерно равна 1. Например, при диссоциации фосфата натрия образуются ионы Na + и PO4 3– :
Диссоциация слабых электролитов : многоосновных кислот и многокислотных оснований происходит ступенчато и обратимо. Т.е. при диссоциации слабых электролитов распадается на ионы только очень небольшая часть исходных частиц. Например, угольная кислота:
HCO3 – ↔ H + + CO3 2–
Гидроксид магния диссоциирует также в 2 ступени:
Mg(OH)2 ⇄ Mg(OH) + OH –
Mg(OH) + ⇄ Mg 2+ + OH –
Кислые соли диссоциируют также ступенчато, сначала разрываются ионные связи, затем — ковалентные полярные. Например, гидрокабонат калия и гидроксохлорид магния:
KHCO3 ⇄ K + + HCO3 – (α=1)
HCO3 – ⇄ H + + CO3 2– (α + + Cl – (α=1)
MgOH + ⇄ Mg 2+ + OH – (α 1. При растворении в воде электролиты диссоциируют (распадаются) на ионы.
2. Причина диссоциации электролиты в воде – это его гидратация, т.е. взаимодействие с молекулами воды и разрыв химической связи в нем.
3. Под действием внешнего электрического поля положительно заряженные ионы двигаюися к положительно заряженному электроду — катоду, их называют катионами. Отрицательно заряженные электроны двигаются к отрицательному электроду – аноду. Их называют анионами.
4. Электролитическая диссоциация происходит обратимо для слабых электролитов, и практически необратимо для сильных электролитов.
5. Электролиты могут в разной степени диссоциировать на ионы — в зависимости от внешних условий, концентрации и природы электролита.
6. Химические свойства ионов отличаются от свойств простых веществ. Химические свойства растворов электролитов определяются свойствами тех ионов, которые из него образуются при диссоциации.
Примеры .
1. При неполной диссоциации 1 моль соли общее количество положительных и отрицательных ионов в растворе составило 3,4 моль. Формула соли – а) K2S б) Ba(ClO3)2 в) NH4NO3 г) Fe(NO3)3
Решение: для начала определим силу электролитов. Это легко можно сделать по таблице растворимости. Все соли, приведенные в ответах — растворимые, т.е. сильные электролиты. Далее, запишем уравнения электролитической диссоциации и по уравнению определим максимально число ионов в каждом растворе:
а) K2S ⇄ 2K + + S 2– , при полном распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не получится никак;
б) Ba(ClO3)2 ⇄ Ba 2+ + 2ClO3 – , опять при распаде 1 моль соли образуется 3 моль ионов, больше 3 моль ионов не образуется никак;
в) NH4NO3 ⇄ NH4 + + NO3 – , при распаде 1 моль нитрата аммония образуется 2 моль ионов максимально, больше 2 моль ионов не образуется никак;
г) Fe(NO3)3 ⇄ Fe 3+ + 3NO3 – , при полном распаде 1 моль нитрата железа (III) образуется 4 моль ионов. Следовательно, при неполном распаде 1 моль нитрата железа возможно образование меньшего числа ионов (неполный распад возможен в насыщенном растворе соли). Следовательно, вариант 4 нам подходит.
[spoiler title=”источники:”]
http://studarium.ru/article/159
http://chemege.ru/ted/
[/spoiler]
Содержание:
Электролиты и неэлектролиты:
Еще в начале XIX в. ученые сделали важное наблюдение: электрический ток могут проводить не только металлы, но и растворы многих веществ, например уксусной кислоты, поваренной соли и др.
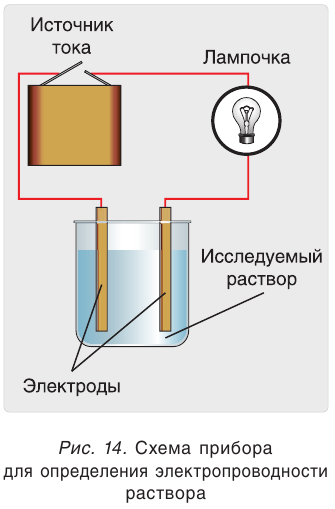
Электропроводность раствора можно установить с помощью прибора, изображенного на рисунке 14. Два электрода помещают в раствор и соединяют с источником тока. Если раствор проводит электрический ток, то цепь замыкается, о чем свидетельствуют показание вольтметра или загоревшаяся лампочка.
При погружении электродов в дистиллированную воду лампочка не загорается. Чистая вода не проводит электрический ток (рис. 15). Не проводит ток и сухая поваренная соль NaCl, если в нее погрузить электроды. Водный раствор этой же соли проводит электрический ток. Можно сделать вывод, что в растворе имеются носители электрического тока — заряженные частицы (ионы). Точно так же ведут себя в растворах и другие соли, а также щёлочи и кислоты. Безводные
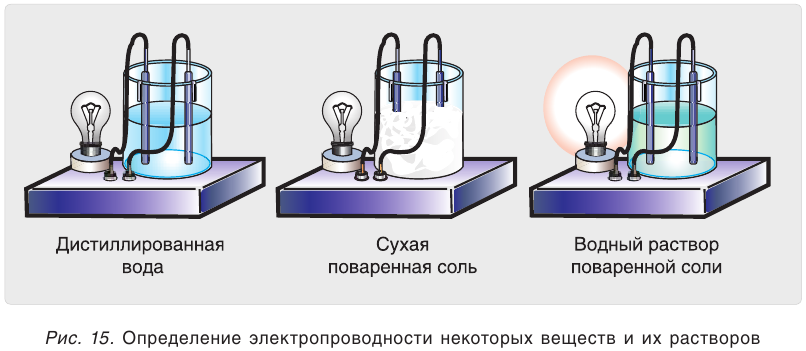
кислоты — очень плохие проводники электрического тока, но водные растворы многих кислот являются хорошими проводниками. Электропроводными являются также расплавы ионных соединений — солей и щелочей.
Исследуем электропроводность растворов и таких веществ, как сахароза, глюкоза, спирт. Мы видим, что лампочка в приборе не загорается. Следовательно, водные растворы этих веществ не проводят электрический ток. Это объясняется тем, что такие вещества состоят из молекул, которые переходят в раствор, не распадаясь на ионы.
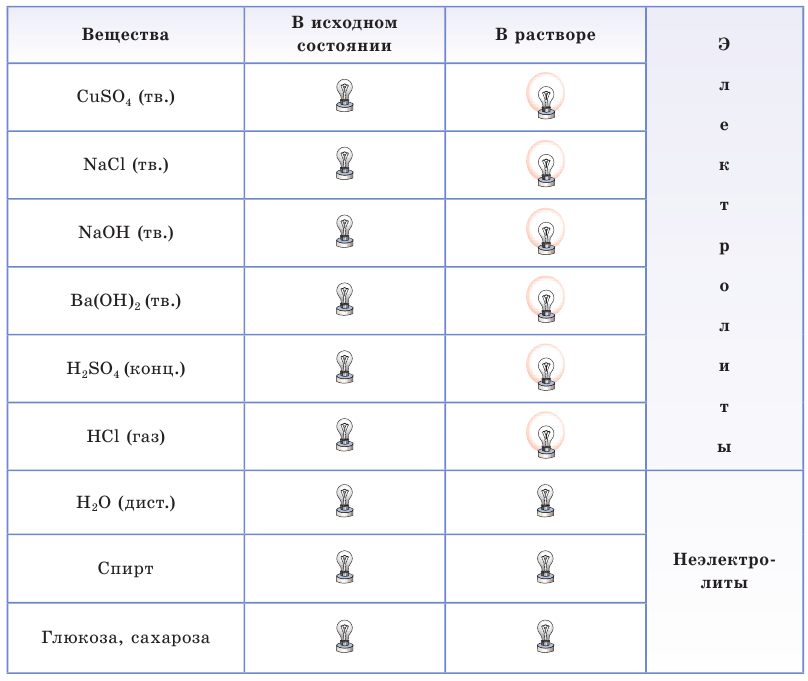
Результаты испытаний электропроводности веществ в исходном (твердом, жидком или газообразном) состоянии и их водных растворов отражены в таблице 10.
Таблица10. Электропроводность некоторых веществ и их растворов
Известный английский физик Майкл Фарадей предложил разделить все вещества в зависимости от их способности проводить ток в растворенном или расплавленном состоянии на электролиты и неэлектролиты (рис. 16). Термин «электролит» происходит от греческого слова литос — растворенный (разложенный).
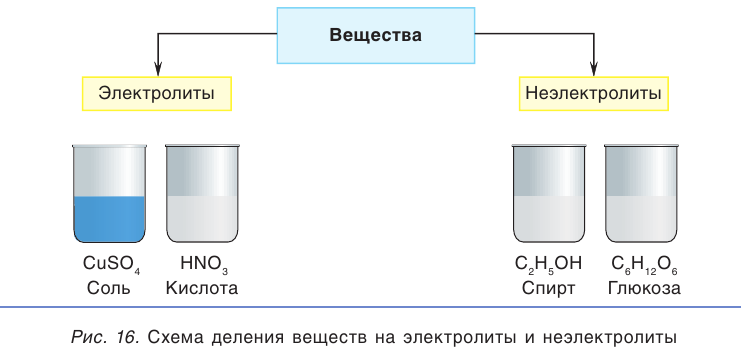
Вещества, водные растворы или расплавы которых проводят электрический ток, называются электролитами.
К электролитам относятся соединения с ионным типом связи. Это соли и др.) и основания
и др.) и основания 
 Кристаллы этих веществ построены из ионов, закономерно расположенных в узлах кристаллической решетки и удерживаемых в таком положении электростатическими силами. В процессе растворения этих электролитов в воде образующие их ионы переходят в раствор.
Кристаллы этих веществ построены из ионов, закономерно расположенных в узлах кристаллической решетки и удерживаемых в таком положении электростатическими силами. В процессе растворения этих электролитов в воде образующие их ионы переходят в раствор.
Электролитами являются и многие кислоты — вещества, образованные молекулами с ковалентными полярными связями 
 и др.).
и др.).
Вещества, водные растворы или расплавы которых не проводят электрический ток, называются неэлектролитами.
Неэлектролитами является большинство органических веществ, таких как сахароза, спирт, глицерин, простые вещества неметаллов и др. Они существуют в виде неполярных или малополярных молекул, которые при растворении в воде распределяются между ее молекулами.
По способности проводить электрический ток в растворах и расплавах вещества делятся на электролиты и неэлектролиты.
Электролиты — это вещества, водные растворы или расплавы которых проводят электрический ток.
Электролитами являются ионные соединения (основания, соли) и большинство кислот.
Электролитическая диссоциация веществ
Почему растворы и расплавы электролитов проводят электрический ток? Для ответа на этот вопрос шведский ученый Сванте Аррениус в 1887 г. детально изучил поведение веществ в водных растворах и выдвинул теорию, которая получила название теории электролитической диссоциации. Термин «диссоциация» происходит от латинского слова dissociatio — разъединение, распад.
Теория электролитической диссоциации
Электрический ток — это направленное движение заряженных частиц. Какие же частицы являются носителями электрического тока в растворах? В результате многочисленных экспериментов Аррениус установил, что растворы электролитов содержат больше частиц, чем их было в исходном веществе. Например, если в воде растворить хлороводород химическим количеством 1 моль, в растворе суммарное число частиц будет 2 моль, а 1 моль хлорида алюминия образует 4 моль частиц. Учитывая, что кристаллы хлорида алюминия имеют ионное строение, мы можем утверждать, что ионы алюминия и хлорид-ионы в воде переходят в раствор. Объяснения этих наблюдений явились основой теории электролитической диссоциации. Согласно этой теории, при растворении в воде или при расплавлении электролиты распадаются (диссоциируют) на ионы — положительно и отрицательно заряженные частицы.
Электролитическая диссоциация — это распад электролитов на ионы в водных растворах или расплавах.
При диссоциации электролитов образуются как простые ионы, состоящие из одного атома  и др.), так и сложные ионы, состоящие из нескольких атомов
и др.), так и сложные ионы, состоящие из нескольких атомов  и др.).
и др.).
Обратите внимание:
- заряд иона и степень окисления атома записываются по-разному!
При обозначении заряда иона справа вверху от его формулы сначала записывают цифру, а потом знак + или –. При обозначении же степени окисления атома, как вы уже знаете, над символом элемента сначала записывается знак + или –, а потом — число.
Для обозначения заряженных частиц Аррениус использовал термин «ион», предложенный ранее М. Фарадеем. Слово «ион» в переводе с греческого означает «движущийся, идущий, странствующий». В растворах ионы непрерывно перемещаются («странствуют») в различных направлениях.
Главной причиной электролитической диссоциации в водных растворах является взаимодействие электролитов с молекулами воды. Такое взаимодействие называется гидратацией.
При погружении кристалла ионного соединения в воду полярные молекулы воды (диполи) притягиваются к ионам, находящимся на поверхности кристалла: отрицательными полюсами — к положительно заряженным ионам, а положительными полюсами — к отрицательно заряженным. Под действием молекул воды ионы отрываются от кристалла и переходят в раствор. При этом каждый отдельный ион оказывается окруженным диполями воды (рис. 17). Такие ионы называются гидратированными ионами.
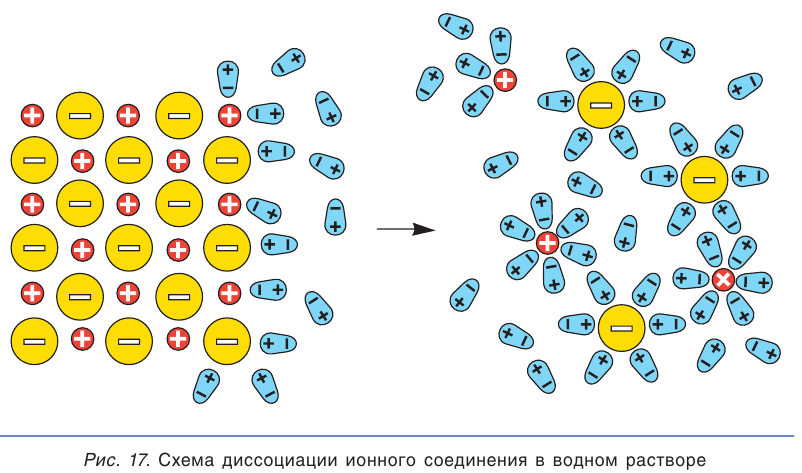
Процесс электролитической диссоциации изображают химическим уравнением, в котором вместо знака равенства пишут либо одну, либо две противоположно направленные стрелки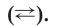 Обычно в уравнениях электролитической диссоциации не указывают формулы молекул воды, связанных с ионами в растворе:
Обычно в уравнениях электролитической диссоциации не указывают формулы молекул воды, связанных с ионами в растворе:
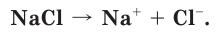
При составлении уравнений электролитической диссоциации руководствуются следующими правилами. В левой части уравнения записывают формулу вещества-электролита, а в правой — формулы ионов, на которые распадается электролит. Их число указывают с помощью коэффициентов:
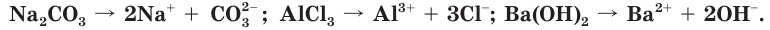
Обратите внимание: сложные ионы, например 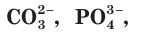 в процессе диссоциации не разрушаются!
в процессе диссоциации не разрушаются!
В молекулах с ковалентной связью ионов нет. Если в веществе ковалентная связь является малополярной, то при его растворении в воде разрываются только слабые связи между молекулами, а сами молекулы вещества остаются целыми, т. е. не распадаются на ионы и равномерно распределяются по всему объему раствора. Но что происходит при растворении в воде веществ с сильно полярной ковалентной связью, например газа хлороводорода HCl?
Когда полярная молекула хлороводорода попадает в воду, к той ее части, где сосредоточен положительный заряд, молекулы воды притягиваются своими отрицательными полюсами. К той части молекулы HCl, которая заряжена отрицательно, молекулы воды притягиваются положительными полюсами. В результате под действием диполей воды ковалентная полярная связь в молекуле хлороводорода разрывается с образованием гидратированных ионов водорода и хлора, которые переходят в раствор (рис. 18):
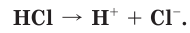
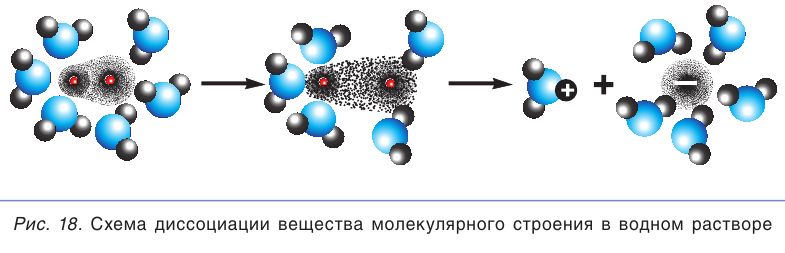
При разрыве химической связи электронная пара остается у отрицательно заряженного иона хлора. В растворе вместо каждой нейтральной молекулы HCl оказываются по два гидратированных иона: положительно заряженный ион водорода (H+ ) и отрицательно заряженный ион хлора (Cl– ). При этом общий заряд положительных ионов равен общему заряду отрицательных ионов.
Диссоциация молекул других кислот (иодоводородной, азотной, серной и др.) протекает в водных растворах сходным образом.
Если атомы в молекулах растворяемых веществ связаны ковалентной малополярной или неполярной связью, то эти вещества в водных растворах не распадаются на ионы. Поэтому такие вещества являются неэлектролитами.
Следовательно, электролитами могут быть только вещества с ионной и ковалентной полярной связью.
- При растворении в воде электролиты диссоциируют на отдельные ионы, которые в растворе окружены молекулами воды (гидратированы).
- Распад электролитов на ионы в водном растворе или расплаве называется электролитической диссоциацией.
- Главной причиной электролитической диссоциации в растворе является взаимодействие электролитов с молекулами воды.
Ионы в растворах электролитов
Ионы, образующиеся в процессе диссоциации электролитов в водных растворах, отличаются по своим свойствам от соответствующих нейтральных атомов и молекул.
Как вы уже знаете, при растворении поваренной соли в воде, содержащиеся в ее кристаллах ионы натрия и хлора переходят в раствор:
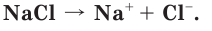
Сравним свойства атома и иона натрия. Общим, одинаковым в этих частицах является заряд ядра, равный 11+. Отличаются же они строением электронных оболочек, а следовательно, и свойствами (табл. 11).
Таблица 11. Отличия атомов натрия от ионов

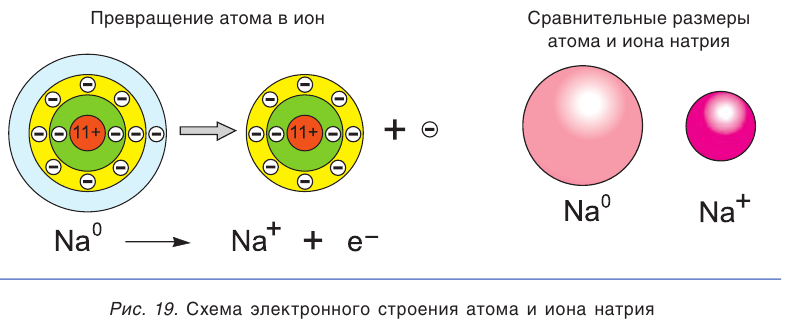
Высокая химическая активность натрия обусловлена тем, что у его атома на внешнем электронном слое находится всего один электрон. При взаимодействии с другими атомами атом натрия отдает этот электрон и превращается в гораздо более устойчивую частицу — ион Na+ (рис. 19). Так, атомы натрия взаимодействуют с водой, вытесняя из нее водород, а при растворении поваренной соли в воде водород не выделяется.
Строение и, следовательно, свойства атомов хлора Cl также будут отличаться от свойств ионов хлора Cl– (табл. 12).
Таблица 12. Отличия атомов хлора от ионов

Химическая активность атома хлора связана с нехваткой одного электрона на внешнем электронном слое для его завершения (рис. 20). Этот электрон атом хлора присоединяет при взаимодействии с атомами металлов, превращаясь при этом в устойчивый ион хлора 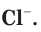
Атомы хлора Cl могут соединяться друг с другом ковалентной неполярной связью, образуя молекулу 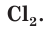 . Свободный хлор
. Свободный хлор 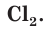 — ядовитый газ с зеленоватой окраской и характерным запахом, а ионы хлора
— ядовитый газ с зеленоватой окраской и характерным запахом, а ионы хлора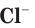 бесцветны и не имеют запаха. Раствор поваренной соли, как и сама соль NaCl, широко используется при приготовлении пищи, не причиняя вреда организму.
бесцветны и не имеют запаха. Раствор поваренной соли, как и сама соль NaCl, широко используется при приготовлении пищи, не причиняя вреда организму.
Аналогичным образом различаются свойства атомов водорода H, молекулярного водорода 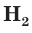 и ионов водорода
и ионов водорода  Молекулярный водород
Молекулярный водород 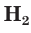 — это газ, который почти не растворяется в воде и горит на воздухе. Ионы водорода
— это газ, который почти не растворяется в воде и горит на воздухе. Ионы водорода 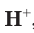 , напротив, в воде могут находиться в очень большом количестве.
, напротив, в воде могут находиться в очень большом количестве.
Таким образом, различия в свойствах атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц.
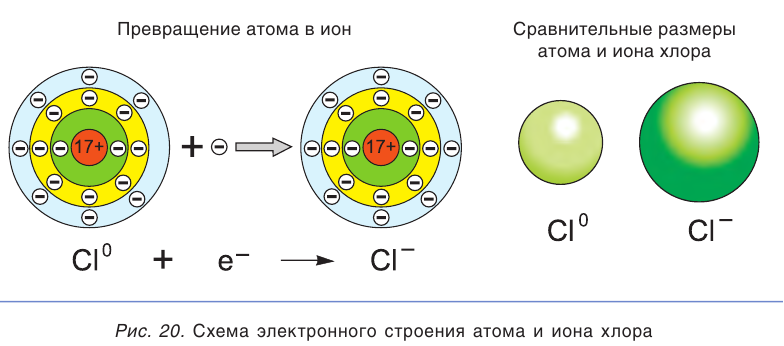
В растворе ионы находятся в хаотическом движении. Но если опустить в раствор электролита электроды и подать на них электрическое напряжение, то ионы приобретают направленное движение: положительно заряженные ионы перемещаются к катоду (отрицательно заряженному электроду), а отрицательно заряженные ионы — к аноду (положительно заряженному электроду) (рис. 21). Поэтому положительно заряженные ионы получили название катионы, а отрицательно заряженные — анионы. Следы движения окрашенных ионов (например, 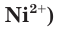 можно наблюдать на влажной фильтровальной бумаге, если на нее поместить крупинки соли
можно наблюдать на влажной фильтровальной бумаге, если на нее поместить крупинки соли 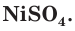
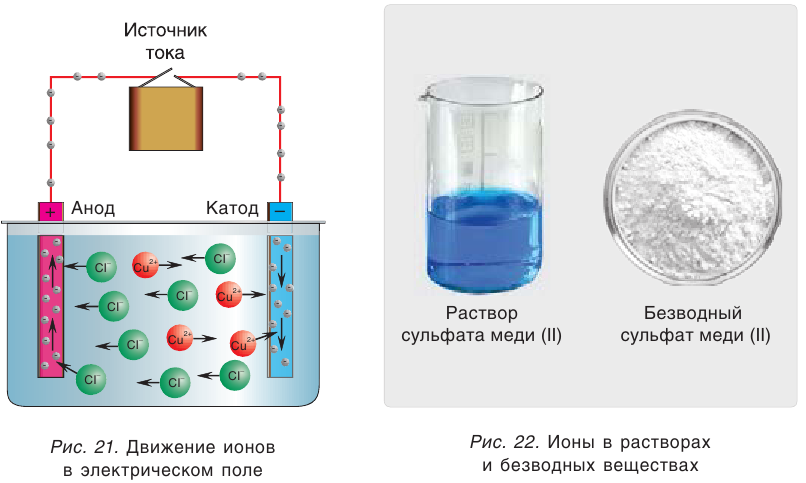
Свойства ионов в растворах во многом отличаются и от свойств этих же ионов в безводных веществах. Так, например, катионы меди 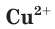 в сульфате меди(II) практически бесцветны, а раствор этой соли имеет голубой цвет (рис. 22). Это обусловлено, прежде всего, гидратацией катионов меди
в сульфате меди(II) практически бесцветны, а раствор этой соли имеет голубой цвет (рис. 22). Это обусловлено, прежде всего, гидратацией катионов меди 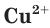 , т. е. их взаимодействием с молекулами воды.
, т. е. их взаимодействием с молекулами воды.
В состав большинства минеральных вод, которые продаются в наших магазинах, входят катионы натрия, кальция, магния, хлорид-анионы, сульфат-анионы, гидрокарбонат-анионы.
- Различия в свойствах атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц.
- Положительно заряженные ионы называются катионами, а отрицательно заряженные — анионами.
Сильные и слабые электролиты
Все ли электролиты диссоциируют одинаково? Каждое вещество обладает определенными свойствами и, возможно, процесс диссоциации разных веществ протекает в различной степени. Действительно, если сравнить электропроводность растворов хлороводородной и угольной кислот, то оказывается, что при их одинаковой молярной концентрации раствор хлороводорода обладает большей электропроводностью. Следовательно, в растворе хлороводородной кислоты больше заряженных частиц (ионов), т. е. молекулы НСl диссоциируют лучше.
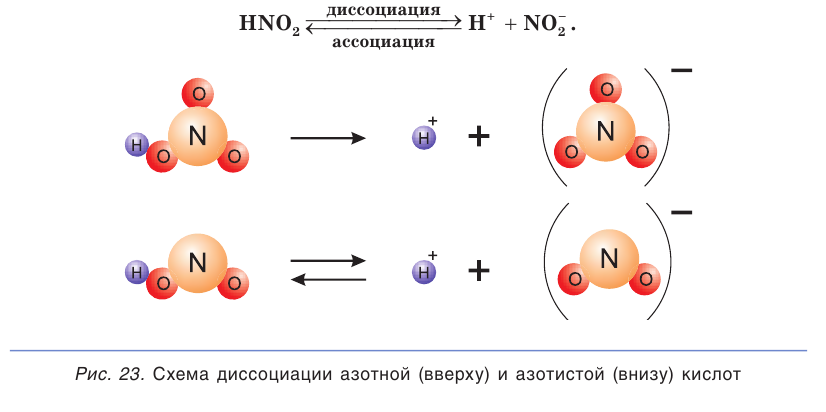
В зависимости от способности к диссоциации все электролиты условно делят на две группы — сильные и слабые. К сильным электролитам относятся вещества, которые при растворении практически полностью диссоциируют на ионы. Это почти все соли, щёлочи  и др.), кислоты
и др.), кислоты 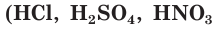 и др.), которые так и называются — сильные кислоты (рис. 23, вверху). Диссоциацию таких электролитов записывают в виде уравнения со стрелкой в одном направлении:
и др.), которые так и называются — сильные кислоты (рис. 23, вверху). Диссоциацию таких электролитов записывают в виде уравнения со стрелкой в одном направлении:
При растворении ионного соединения его кристаллическая структура разрушается под действием молекул воды, в результате чего в растворе образуются гидратированные ионы (см. рис. 17). Поэтому все растворимые ионные соединения в растворах находятся в виде ионов.
Вещества молекулярного строения с ковалентной полярной связью также способны распадаться на ионы в водных растворах (см. рис. 18). Полярные молекулы воды усиливают полярность молекулы электролита, превращая ее практически в ионную структуру с последующим распадом на ионы. Диссоциация полярных молекул может быть полной или частичной в зависимости от степени полярности связей в молекуле.
К слабым электролитам относятся вещества, при растворении диссоциирующие на ионы в незначительной степени. Это, например, такие кислоты как 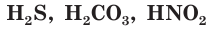 (азотистая кислота),
(азотистая кислота), 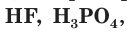 все органические кислоты. В водных растворах они диссоциируют обратимо. Это означает, что одновременно в растворе осуществляются два противоположных процесса — распад молекул на ионы (диссоциация) и объединение ионов в молекулы (ассоциация). Поэтому в растворах слабых электролитов наряду с ионами содержатся недиссоциированные молекулы. Диссоциацию таких электролитов, например азотистой кислоты
все органические кислоты. В водных растворах они диссоциируют обратимо. Это означает, что одновременно в растворе осуществляются два противоположных процесса — распад молекул на ионы (диссоциация) и объединение ионов в молекулы (ассоциация). Поэтому в растворах слабых электролитов наряду с ионами содержатся недиссоциированные молекулы. Диссоциацию таких электролитов, например азотистой кислоты  отображают в виде уравнения с двумя противоположно направленными стрелками (см. рис. 23, внизу):
отображают в виде уравнения с двумя противоположно направленными стрелками (см. рис. 23, внизу):
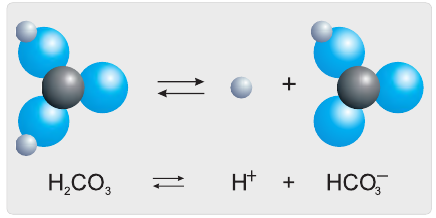

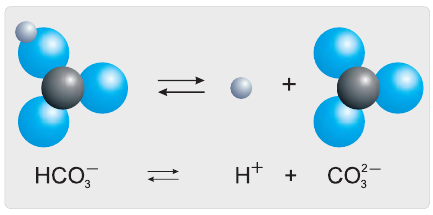
Разберем более подробно процесс диссоциации слабой двухосновной угольной кислоты 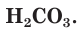 Как и азотистая кислота, она диссоциирует не полностью и обратимо. От молекулы
Как и азотистая кислота, она диссоциирует не полностью и обратимо. От молекулы 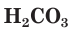 ионы водорода отщепляются не одновременно, как в случае сильных кислот, а последовательно, или ступенчато. На первой ступени диссоциации образуются катионы водорода и анионы
ионы водорода отщепляются не одновременно, как в случае сильных кислот, а последовательно, или ступенчато. На первой ступени диссоциации образуются катионы водорода и анионы 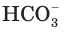 (рис. 24):
(рис. 24):
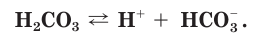
Анионы 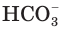 − называются гидрокарбонат-ионами. Соединяясь с ионами
− называются гидрокарбонат-ионами. Соединяясь с ионами  , они превращаются в недиссоциированные молекулы
, они превращаются в недиссоциированные молекулы 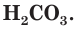 При этом, как и в случае азотистой кислоты, процессы диссоциации и ассоциации протекают одновременно, и в растворе содержатся как ионы, так и недиссоциированные молекулы кислоты.
При этом, как и в случае азотистой кислоты, процессы диссоциации и ассоциации протекают одновременно, и в растворе содержатся как ионы, так и недиссоциированные молекулы кислоты.
На второй ступени гидрокарбонат-ионы обратимо диссоциируют с образованием катионов водорода и карбонат-анионов (рис. 25):

Как правило, на второй ступени диссоциация происходит гораздо слабее.
Кроме слабых кислот, к слабым электролитам относятся также малорастворимые основания, например  раствор аммиака в воде.
раствор аммиака в воде.
Чистая вода является очень слабым электролитом и незначительно диссоциирует на ионы водорода и гидроксид-ионы:
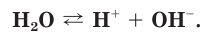
Содержание ионов  и
и  в воде чрезвычайно мало, поэтому диссоциацией воды мы обычно пренебрегаем, а среда дистиллированной воды является нейтральной.
в воде чрезвычайно мало, поэтому диссоциацией воды мы обычно пренебрегаем, а среда дистиллированной воды является нейтральной.
С количественными характеристиками способности веществ к диссоциации вы познакомитесь при дальнейшем изучении химии.

- По способности диссоциировать в водных растворах электролиты делятся на сильные и слабые.
- Растворимые вещества с ионной и ковалентной сильно полярной связью относятся к сильным электролитам.
- Растворимые вещества с ковалентной малополярной связью относятся к слабым электролитам. В их растворах наряду с ионами присутствуют недиссоциированные молекулы.
Электролитическая диссоциация кислот, оснований и солей
Вы уже знаете, что химические вещества делятся на классы — оксиды, кислоты, основания, соли. Как ведут себя в водных растворах вещества этих классов?
Вспомните отношение оксидов к воде. Основные оксиды активных металлов взаимодействуют с водой с образованием щелочей. Кислотные оксиды в результате растворения в воде образуют кислоты. Таким образом, основные и кислотные оксиды не являются электролитами и при контакте с водой не распадаются на ионы, а реагируют с ней. Электролитами являются кислоты, щёлочи и соли.
Водные растворы кислот имеют некоторые общие свойства. Для них характерны кислый вкус, способность окрашивать лакмус в красный цвет, взаимодействовать с некоторыми металлами с выделением водорода, а также с основными оксидами и основаниями. Точно также некоторые общие свойства имеют водные растворы всех щелочей: они мыльные на ощупь, окрашивают лакмус в синий цвет, способны реагировать с кислотными оксидами, кислотами. Водные растворы солей одной и той же кислоты или солей одного и того же металла также имеют общность свойств. Основная причина общности свойств растворов таких электролитов определяется однотипностью процессов их диссоциации.
Диссоциация кислот
Кислоты диссоциируют в водных растворах на ионы водорода H+ и анион кислотного остатка, например:

Как вы уже знаете, молекулы кислот могут содержать разное количество атомов водорода. Число атомов водорода в молекуле кислоты, способное замещаться атомами металла с образованием соли, определяет основность кислоты. Так, например, 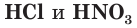 — одноосновные,
— одноосновные, 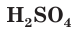 и
и 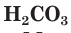 — двухосновные,
— двухосновные, 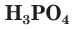 – трехосновная кислоты.
– трехосновная кислоты.
Многоосновные сильные кислоты диссоциируют ступенчато. Однако, поскольку при этом атомы водорода, превращаясь в ионы, уходят в раствор практически одновременно, диссоциацию таких кислот записывают одним уравнением:
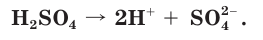
Диссоциация многоосновных слабых кислот протекает сложнее, чем сильных. Например, слабые двухосновные кислоты частично диссоциируют только по первой ступени: 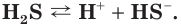 Диссоциация по второй ступени
Диссоциация по второй ступени практически невозможна. Поэтому в водных растворах слабых кислот наряду с ионами водорода и анионами кислотного остатка присутствуют недиссоциированные молекулы. Свойства таких растворов, например специфический запах сероводородной кислоты
практически невозможна. Поэтому в водных растворах слабых кислот наряду с ионами водорода и анионами кислотного остатка присутствуют недиссоциированные молекулы. Свойства таких растворов, например специфический запах сероводородной кислоты 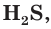 связаны с наличием в растворе молекул, которые могут испаряться из раствора.
связаны с наличием в растворе молекул, которые могут испаряться из раствора.
Таким образом, в растворах всех кислот содержатся ионы водорода 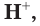 которые и обусловливают общие свойства водных растворов кислот: кислый вкус, способность изменять окраску индикаторов, взаимодействовать с другими веществами. Растворы, которые содержат ионы водорода, принято называть кислыми или говорить, что они имеют кислотный характер (кислую среду). Чем больше ионов водорода находится в растворе, тем выше кислотность среды.
которые и обусловливают общие свойства водных растворов кислот: кислый вкус, способность изменять окраску индикаторов, взаимодействовать с другими веществами. Растворы, которые содержат ионы водорода, принято называть кислыми или говорить, что они имеют кислотный характер (кислую среду). Чем больше ионов водорода находится в растворе, тем выше кислотность среды.
У газа хлороводорода HCl, так же как и у безводной серной кислоты, кислотные свойства отсутствуют. Эти свойства проявляются только в водных растворах указанных веществ, так как в процессе их диссоциации образуются ионы водорода, которые и определяют кислотный характер растворов. Следовательно, можно дать такое определение кислот.
Кислоты — это электролиты, при диссоциации которых в водных растворах в качестве катионов образуются только ионы водорода.
Первое определение кислот в химии было предложено Р. Бойлем (1627—1691). Кислотами он называл вещества, которые реагировали с содой с выделением газа и окрашивали фиолетовые цветки фиалки в красный цвет. Позже он исследовал отвары, спиртовые вытяжки, соки других растений и установил, что щёлочи также меняют их окраску.
Диссоциация оснований
Растворимые в воде основания называются щелочами. В результате диссоциации щелочей образуются катионы металлов и гидроксид-ионы:
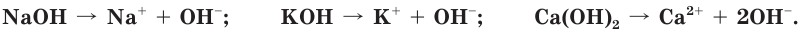
Мыльность растворов, способность окрашивать индикаторы, их едкое действие — результат присутствия в водном растворе гидроксид-ионов  Поэтому можно дать такое определение оснований.
Поэтому можно дать такое определение оснований.
Основания — это электролиты, при диссоциации которых в водных растворах в качестве анионов образуются только гидроксид-ионы.


Вместе с тем и кислоты, и основания обладают индивидуальными свойствами, зависящими от природы аниона или катиона соответственно. Некоторые свойства серной кислоты и ее солей (например, образование осадка с раствором хлорида бария) обусловлены свойствами ее аниона 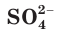 (рис. 26).
(рис. 26).
Диссоциация солей
Соли — это электролиты, которые в водных растворах диссоциируют на катионы металлов и анионы кислотных остатков:
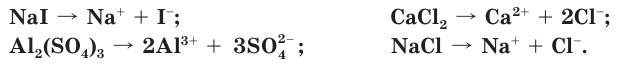
Свойства растворов солей также обусловлены свойствами всех ионов, которые образуются в процессе диссоциации.
Раствор, в котором находятся одинаковые количества ионов 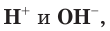 как в чистой воде, называют нейтральным. Если в растворе содержится больше ионов
как в чистой воде, называют нейтральным. Если в растворе содержится больше ионов  такой раствор называют кислым, а раствор, в котором больше ионов
такой раствор называют кислым, а раствор, в котором больше ионов  , — щелочным (табл. 13).
, — щелочным (табл. 13).
Таблица 13. Характеристика среды растворов



Определить среду раствора — это значит обнаружить в нем ионы  и
и 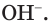 Это можно сделать с помощью уже известных вам веществ — индикаторов (рис. 27). Индикаторы — органические вещества, некоторые из которых встречаются в живой природе. В лаборатории чаще всего применяются уже известные вам лакмус, метилоранж, фенолфталеин, универсальный индикатор.
Это можно сделать с помощью уже известных вам веществ — индикаторов (рис. 27). Индикаторы — органические вещества, некоторые из которых встречаются в живой природе. В лаборатории чаще всего применяются уже известные вам лакмус, метилоранж, фенолфталеин, универсальный индикатор.
Лабораторный опыт 1
Обнаружение катионов водорода и гидроксид-анионов в растворах
Обнаружение ионов, обеспечивающих кислую или щелочную среду в растворах, имеет большое значение в лабораторной практике, медицине, промышленности и в быту.
1. Обратите внимание на окраску лакмуса, метилоранжа и фенолфталеина в нейтральной среде — водном растворе или на полоске универсальной индикаторной бумаги. Занесите результаты ваших наблюдений в таблицу.
2. Налейте в две пробирки раствор серной кислоты (или хлороводородной кислоты) и добавьте в одну пробирку 1—2 капли лакмуса (или метилоранжа), а во вторую 2—3 капли фенолфталеина. Обратите внимание на изменение окраски индикатора.
3. В пробирку с раствором гидроксида натрия добавьте 2—3 капли фенолфталеина. Появление малиновой окраски свидетельствует о наличии в растворе гидроксид-ионов.
Повторите опыт по обнаружению гидроксид-ионов в растворе щёлочи при помощи лакмуса или метилоранжа. Результаты опытов оформите в виде таблицы:
Как вы думаете, в какой цвет окрасится капля лакмуса, если ее поместить на срез лимона?

Растворы кислот, щелочей, ряда солей опасны для человека. Растворы многих кислот, попадая на кожу, в глаза, могут вызвать ожоги. Чем сильнее кислота, тем тяжелее ожог. Также опасны и вызывают химические ожоги щёлочи, содержащие гидроксид-ионы. Это свойство отражено в устаревших названиях щелочей, например «едкий натр» (NaOH), «едкое кали» (KOH) (рис. 28). Ионы, входящие в состав солей, также не безопасны для человека. Например, к сильным ядам относятся соли, содержащие катионы свинца, ртути и др.
- Свойства водных растворов сильных электролитов определяются свойствами ионов, образующихся при их диссоциации.
- Кислоты — это электролиты, в водных растворах которых в качестве катионов содержатся только ионы водорода.
- Основания — электролиты, в водных растворах которых в качестве анионов содержатся только гидроксид-ионы.
- Соли — это электролиты, в водных растворах которых содержатся катионы металлов и анионы кислотных остатков.
- Если содержание ионов H+ в растворе больше, чем содержание ионов OH– , такой раствор называют кислым, а раствор, в котором содержание ионов OH– больше, чем ионов H+ , — щелочным.
Реакции ионного обмена
Познакомившись с диссоциацией солей, кислот и щелочей, мы узнали, что сильные электролиты существуют в растворах только в виде ионов. Следовательно, все реакции, которые происходят между электролитами в растворах, являются реакциями между ионами и называются ионными реакциями.
Ионными реакциями называются реакции, протекающие в водных растворах с участием ионов электролитов.
Многие реакции, протекающие в растворах, относятся к реакциям обмена. Напомним, что к этому типу относятся реакции между сложными веществами, в результате которых эти вещества обмениваются своими составными частями. Такими составными частями веществ в электролитах являются ионы.
Реакции ионного обмена в растворах электролитов протекают только в том случае, если в результате взаимодействия между ионами образуются малодиссоциирующие (вода или другие слабые электролиты), нерастворимые (осадки) и газообразные вещества.
Реакция ионного обмена, сопровождающаяся образованием слабого электролита (воды)
Вы уже знаете, что реакция между кислотой и основанием называется реакцией нейтрализации. В результате такого процесса образуются соль и вода:
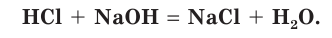
Уравнение реакции, записанное в такой форме, обычно называют молекулярным (или уравнением в молекулярной форме). Молекулярным уравнением может изображаться любая реакция.
За ходом нейтрализации удобно следить с помощью индикатора, изменение окраски которого свидетельствует об окончании реакции между кислотой и щёлочью.
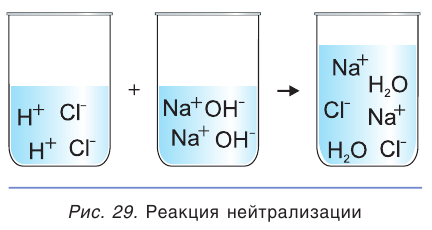
Три из четырех участников рассматриваемой реакции (HCl, NaOH и NaCl) являются сильными электролитами, т. е. находятся в растворе в виде ионов (рис. 29). Вода — слабый электролит, практически не диссоциирующий на ионы. Поэтому ионное уравнение данной реакции можно записать следующим образом:
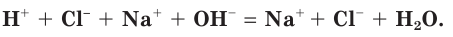
Такая запись процесса называется полным ионным уравнением. В ионном уравнении все сильные электролиты записываются в виде формул их ионов. Твердые, плохо растворимые, газообразные вещества и слабые электролиты (включая воду) записываются в виде их молекулярных формул.
Если в правой и левой частях полного ионного уравнения исключить (сократить) одинаковые по химическому составу и числу ионы  то получим сокращенное (краткое) ионное уравнение:
то получим сокращенное (краткое) ионное уравнение:

В левой части уравнения такого вида обычно сначала записывается катион, а потом — анион. Уравнение показывает, что реакция нейтрализации сводится к взаимодействию ионов водорода с гидроксид-ионами с образованием малодиссоциирующего вещества, каким является вода.
Составьте самостоятельно все три формы уравнений реакции нейтрализации между азотной кислотой и гидроксидом калия. Вы видите, что любая реакция между сильной кислотой и щёлочью сводится к взаимодействию ионов водорода с гидроксид-ионами. Поэтому одно и то же сокращенное ионное уравнение может описывать несколько реакций ионного обмена с участием различных веществ, и ему будут соответствовать несколько уравнений в молекулярном виде.
Реакции ионного обмена, сопровождающиеся образованием осадков
Взаимодействие между водными растворами сульфата натрия 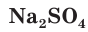 и хлорида бария
и хлорида бария 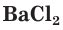 — пример процесса образования нерастворимого вещества:
— пример процесса образования нерастворимого вещества:
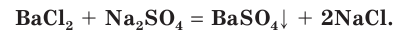
Полное ионное уравнение такой реакции имеет вид:
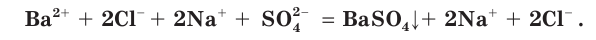
Если в этом уравнении исключить одинаковые ионы в правой и левой частях (это означает, что такие ионы не участвуют в процессе!), то получим уравнение в сокращенном ионном виде:
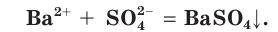
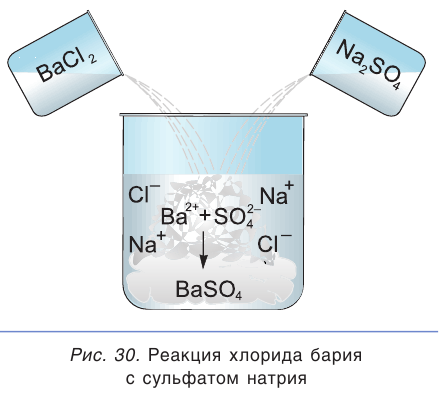
Это уравнение показывает, что при взаимодействии раствора сульфата натрия с раствором хлорида бария происходит связывание ионов бария 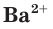 с сульфат-ионами
с сульфат-ионами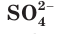 с образованием осадка сульфата бария (рис. 30). Точно такое же сокращенное ионное уравнение будет, если вместо хлорида бария взять, например, нитрат бария
с образованием осадка сульфата бария (рис. 30). Точно такое же сокращенное ионное уравнение будет, если вместо хлорида бария взять, например, нитрат бария 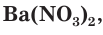 , а вместо сульфата натрия — сульфат калия
, а вместо сульфата натрия — сульфат калия 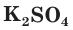 или серную кислоту
или серную кислоту 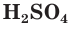 . Таким образом, одному и тому же сокращенному ионному уравнению будут соответствовать несколько уравнений в молекулярном виде.
. Таким образом, одному и тому же сокращенному ионному уравнению будут соответствовать несколько уравнений в молекулярном виде.
При составлении уравнений реакций обмена с образованием осадка необходимо пользоваться таблицей растворимости (см. форзац II), в которой указана растворимость электролитов в воде.
Например, необходимо определить, будет ли выпадать осадок при смешивании растворов нитрата кальция  и карбоната калия
и карбоната калия 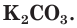 . Записываем уравнение реакции:
. Записываем уравнение реакции:
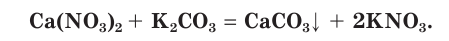
Для определения растворимости карбоната кальция 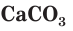 в таблице растворимости находим столбец катиона
в таблице растворимости находим столбец катиона 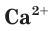 и строку аниона
и строку аниона 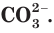 В месте их пересечения стоит буква «Н». Это означает, что карбонат кальция нерастворим в воде и выпадает в осадок при смешивании растворов нитрата кальция и карбоната калия.
В месте их пересечения стоит буква «Н». Это означает, что карбонат кальция нерастворим в воде и выпадает в осадок при смешивании растворов нитрата кальция и карбоната калия.
Аналогичным образом определяем, что нитрат калия  в воде растворим. Значит, уравнение реакции записываем так:
в воде растворим. Значит, уравнение реакции записываем так:
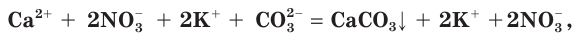
а в сокращенном ионном виде:
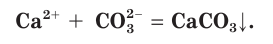
(Прочерк в таблице растворимости означает, что вещество не существует или разлагается водой.)
Реакции ионного обмена, сопровождающиеся выделением газов
Связывание ионов приводит и к образованию газообразного продукта, выделяющегося из раствора.

Например, если к раствору соды 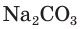 прилить раствор серной кислоты, то наблюдается выделение пузырьков углекислого газа (рис. 31):
прилить раствор серной кислоты, то наблюдается выделение пузырьков углекислого газа (рис. 31):
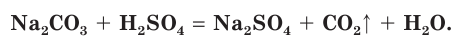
В полной ионной форме это уравнение записывается следующим образом:
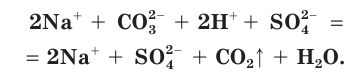
Сокращенное ионное уравнение реакции в этом случае такое:
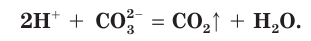
Таким образом, реакции ионного обмена в растворах электролитов протекают полностью («до конца»), если соблюдается одно из следующих условий:
- образуется осадок;
- выделяется газообразное вещество;
- образуется вода или другой слабый электролит.
С точки зрения теории электролитической диссоциации это означает, что в реакции образуются вещества, полученные в результате связывания ионов в осадок, газ или малодиссоциирующее вещество.
Многие реакции между растворами электролитов являются реакциями между ионами, т. е. ионными реакциями.
Реакции ионного обмена происходят только в том случае, если в результате образуются малорастворимые, газообразные или малодиссоциирующие вещества.
Уравнения реакций, отражающие взаимодействие между ионами в растворе, называются ионными уравнениями — полными или сокращенными.
Расчеты по уравнениям химических реакций, протекающих в растворах электролитов
Как вы уже знаете, реакции с участием электролитов осуществляются за счет взаимодействия ионов, содержащихся в их растворах. В таких реакциях могут участвовать также слабодиссоциирующие и малорастворимые вещества и неэлектролиты, например оксиды. При написании ионных уравнений реакций формулы таких веществ записываются в молекулярном виде. Последовательность действий рассмотрим на конкретных примерах.
Пример №1
Взаимодействие гидроксида меди(II) с соляной кислотой.
а) Записываем молекулярное уравнение реакции:
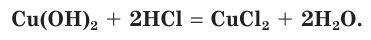
б) Составляем полное ионное уравнение. Для этого определяем, какие вещества являются сильными электролитами 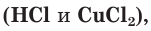 и записываем их формулы в ионном виде. Малорастворимые и слабодиссоциирующие вещества
и записываем их формулы в ионном виде. Малорастворимые и слабодиссоциирующие вещества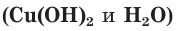 записываем в молекулярном виде:
записываем в молекулярном виде:
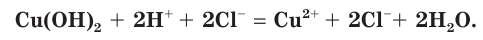
Обратите внимание, что коэффициенты, стоящие перед формулами веществ в молекулярном уравнении, учитываются и в полном ионном уравнении.
в) Записываем сокращенное ионное уравнение. Для этого из левой и правой частей полного ионного уравнения удаляем (вычеркиваем) ионы, не участвующие в химической реакции 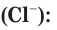
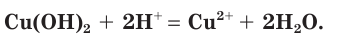
Анализируем сокращенное ионное уравнение и делаем вывод, что данная реакция протекает за счет взаимодействия ионов водорода с осадком гидроксида меди(II) с образованием ионов меди(II) и воды.
На основе уравнений реакций, протекающих в растворах электролитов, можно проводить различные количественные расчеты.
Пример №2
Хватит ли ионов водорода, содержащихся в растворе хлороводородной кислоты массой 152 г с массовой долей НCl, равной 12 %, для полного растворения осадка гидроксида меди(II) массой 19,6 г?
Решение
1. Определим химическое количество гидроксида меди (II):
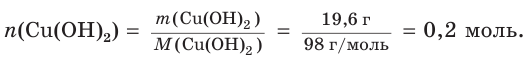
2. Рассчитаем массу хлороводородной кислоты в растворе:
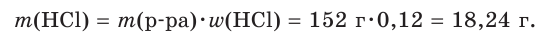
3. Найдем химическое количество HCl и, соответственно, химическое количество ионов водорода в растворе:
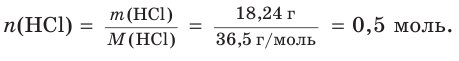
Поскольку из 1 моль НCl в результате диссоциации образуется 1 моль ионов водорода, следовательно, из 0,5 моль НCl образуется 0,5 моль ионов водорода, т. е.
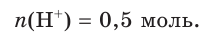
4. По сокращенному ионному уравнению составим пропорцию и определим, какое химическое количество ионов понадобится для реакции с  химическим количеством 0,2 моль:
химическим количеством 0,2 моль:
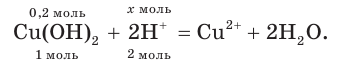
Отсюда получим, что х = 0,4 моль ионов водорода — столько потребуется для реакции. Поскольку в растворе имеется 0,5 моль ионов 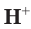 , этого их химического количества будет достаточно для растворения осадка.
, этого их химического количества будет достаточно для растворения осадка.
Пример №3
Взаимодействие раствора гидроксида натрия с газообразным оксидом серы(IV) SO2.
а) Записываем молекулярное уравнение реакции:
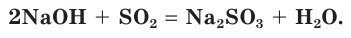
б) Составляем полное ионное уравнение реакции. Для этого определяем, какие вещества являются сильными электролитами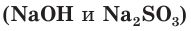 и записываем их формулы в ионном виде. Формулу газообразного
и записываем их формулы в ионном виде. Формулу газообразного 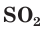 и воды
и воды 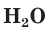 записываем в молекулярном виде:
записываем в молекулярном виде:
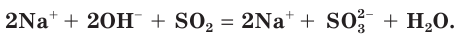
в) Записываем сокращенное ионное уравнение:
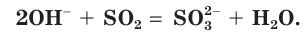
Из анализа сокращенного ионного уравнения делаем вывод, что данная реакция протекает за счет взаимодействия гидроксид-ионов  с молекулами
с молекулами 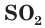 с образованием сульфит-ионов
с образованием сульфит-ионов 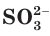 и воды.
и воды.
Пример №4
Какой объем (дм3 , н. у.) оксида серы (IV) понадобится для реакции с гидроксид-ионами, которые содержатся в растворе гидроксида натрия массой 180 г с массовой долей щёлочи, равной 0,1?
Решение
1. Рассчитаем массу гидроксида натрия в растворе:
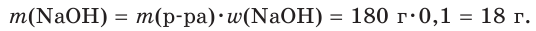
2. Определим химическое количество гидроксида натрия в растворе:
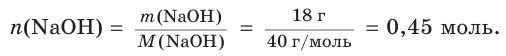
Соответственно, химическое количество гидроксид-ионов в растворе также равно 0,45 моль. Поскольку из 1 моль NaOH в результате диссоциации образуется 1 моль гидроксид-ионов, 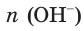 = 0,45 моль.
= 0,45 моль.
3. По молекулярному (или сокращенному ионному) уравнению составим пропорцию и вычислим, какое химическое количество 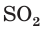 понадобится для реакции с NaOH химическим количеством 0,45 моль:
понадобится для реакции с NaOH химическим количеством 0,45 моль:
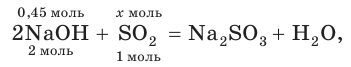
отсюда х = 0,225 моль SO2.
4. Найдем объем оксида серы (IV):
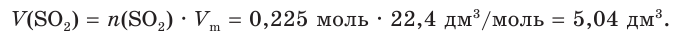
В результате реакций ионного обмена между кислотами и основаниями в растворах образуются соли и вода. При полной нейтрализации кислота и щёлочь расходуются полностью с образованием нейтрального раствора. Если же кислота берется в недостатке по отношению к щёлочи (или наоборот), происходит неполная нейтрализация.
Пример №5
Взаимодействие раствора гидроксида калия с раствором серной кислоты.
а) Составляем молекулярное уравнение реакции:
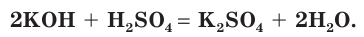
б) Записываем полное ионное уравнение реакции. Поскольку в данной реакции сильными электролитами являются 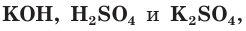 полное ионное уравнение имеет вид:
полное ионное уравнение имеет вид:
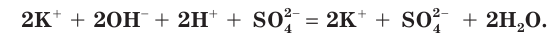
в) Записываем сокращенное ионное уравнение:
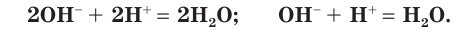
Пример №6
К раствору массой 200 г с массовой долей серной кислоты, равной 4,9 %, прибавили раствор массой 400 г с массовой долей гидроксида калия, равной 0,056. Какова окраска индикатора лакмуса в растворе после реакции?
Решение
1. Рассчитаем массы веществ в исходных растворах:
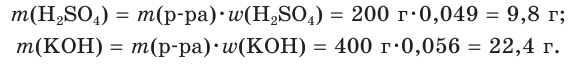
2. Определим химические количества веществ:

3. На основании молекулярного уравнения реакции определим химическое количество гидроксида калия, необходимого для полной нейтрализации серной кислоты в растворе:
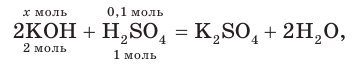
откуда получим: х = 0,2 моль KOH.
4. Поскольку найденное химическое количество KOH (0,2 моль) меньше содержащегося в исходном растворе (0,4 моль), щёлочь была взята в избытке, и среда полученного раствора щелочная. В таком растворе лакмус окрашивается в синий цвет.
В некоторых случаях при смешивании растворов двух сильных электролитов химические реакции не происходят. Смешаем, например, растворы нитрата натрия и хлорида кальция. Составим молекулярное уравнение предполагаемой реакции обмена:
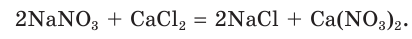
Определим, какие ионы находятся в полученном растворе, записав полное ионное уравнение:
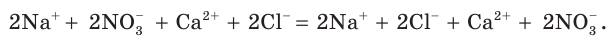
Очевидно, что в данном случае ионы друг с другом не связываются и никаких изменений в растворе не происходит. Следовательно, реакция просто не идет, а в растворе содержатся ионы четырех видов.
- Металлы в химии
- Неметаллы в химии
- Галогены в химии
- Подгруппа кислорода
- Валентность и степень окисления
- Ионная связь
- Химические реакции
- Теория электролитической диссоциации
…
Электролиты
При растворении в воде некоторые вещества имеют способность проводить электрический ток.
Те соединения, водные растворы которых способны проводить электрический ток называются электролитами.
Электролиты проводят ток за счет так называемой ионной проводимости, которой обладают многие соединения с ионным строением (соли, кислоты, основания).
Вещества, имеющие сильнополярные связи, но в растворе при этом подвергаются неполной ионизации (например, хлорид ртути II) являются слабыми электролитами.
Многие органические соединения (углеводы, спирты), растворенные воде, не распадаются на ионы, а сохраняют свое молекулярное строение. Такие вещества электрический ток не проводят и называются неэлектролитами.
Приведем некоторые закономерности, руководствуясь которыми можно определить относятся вещества к сильным или слабым электролитам:
- Кислоты. К сильным кислотам из наиболее распространенных относятся HCl, HBr, HI, HNO3, H2SO4, HClO4. Все они являются сильными электролитами. Почти все остальные кислоты, в том числе и органические являются слабыми электролитами.
- Основания. Наиболее распространенные сильные основания – гидроксиды щелочных и щелочноземельных металлов (исключая Be) относятся к сильным электролитам. Слабый электролит – NH3.
- Соли. Большинство распространенных солей – ионных соединений — сильные электролиты. Исключения составляют, в основном, соли тяжелых металлов.
Теория электролитической диссоциации
Электролиты, как сильные, так и слабые и даже очень сильно разбавленные не подчиняются закону Рауля и принципу Вант-Гоффа.
Имея способность к электропроводности, значения давления пара растворителя и температуры плавления растворов электролитов будут более низкими, а температуры кипения более высокими по сравнению с аналогичными значениями чистого растворителя. В 1887 г С. Аррениус, изучая эти отклонения, пришел к созданию теории электролитической диссоциации.
Электролитическая диссоциация предполагает, что молекулы электролита в растворе распадаются на положительно и отрицательно заряженные ионы, которые названы соответственно катионами и анионами.
Сущность теории электролитической диссоциации
- В растворах электролиты распадаются на ионы, т.е. диссоциируют. Чем более разбавлен раствор электролита, тем больше его степень диссоциации.
- Диссоциация — явление обратимое и равновесное.
- Молекулы растворителя бесконечно слабо взаимодействуют (т.е. растворы близки к идеальным).
Степень диссоциации электролита зависит от:
- природы самого электролита
- природы растворителя
- концентрации электролита
- температуры.
Степень диссоциации
Степень диссоциации α, показывает какое число молекул n распалось на ионы, по сравнению с общим числом растворенных молекул N:
α = n/N
- Степень диссоциации равна 0 α = 0 означает, что диссоциация отсутствует.
- При полной диссоциации электролита степень диссоциации равна 1 α = 1.
С точки зрения степени диссоциации, по силе электролиты делятся на:
- сильные (α > 0,7),
- средней силы ( 0,3 > α > 0,7),
- слабые (α < 0,3 ).
Константа диссоциации
Более точно процесс диссоциации электролита характеризует константа диссоциации, не зависящая от концентрации раствора. Если представить процесс диссоциации электролита в общем виде:
Aa Bb ↔ aA— + bB+
K = [A—]a·[B+]b/[Aa Bb]
Для слабых электролитов концентрация каждого иона равна произведению степени диссоциации α на общую концентрацию электролита С.
Таким образом, выражение для константы диссоциации можно преобразовать:
K = α2C/(1-α)
Для разбавленных растворов (1-α) =1, тогда
K = α2C
Отсюда нетрудно найти степень диссоциации
α = (K/C)1/2
Ионно–молекулярные уравнения
Как составить полное и сокращенное ионные уравнения
Рассмотрим несколько примеров реакций, для которых составим молекулярное, полное и сокращенное ионное уравнения.
1) Пример нейтрализации сильной кислоты сильным основанием
1. Процесс представлен в виде молекулярного уравнения.
HCl + NaOH = NaCl + HOH
2. Представим процесс в виде полного ионного уравнения. Т.е. запишем в ионном виде все соединения — электролиты, которые в растворе полностью ионизированы.
H+ + Cl— +Na+ + OH— = Na+ + Cl— + HOH
3. После «сокращения» одинаковых ионов в левой и правой частях уравнения получаем сокращенное ионное уравнение:
H+ + OH— = HOH
Мы видим, что процесс нейтрализации сводится к соединению H+ и OH— и образованию воды.
При составлении ионных уравнений следует помнить, что в ионном виде записываются только сильные электролиты. Слабые электролиты, твердые вещества и газы записываются в их молекулярном виде.
2) Пример реакции осаждения
Смешаем водные растворы AgNO3 и HI:
| Молекулярное уравнение | AgNO3 + HI →AgI↓ + HNO3 |
| Полное ионное уравнение | Ag+ + NO3— + H+ + I— →AgI↓ + H+ + NO3— |
| Сокращенное ионное уравнение | Ag+ + I— →AgI↓ |
Процесс осаждения сводится к взаимодействию только Ag+ и I— и образованию нерастворимого в воде AgI.
Чтобы узнать способно ли интересующее нас вещество растворяться в воде, необходимо воспользоваться таблицей растворимости кислот, солей и оснований в воде. В приведенной таблице также указан цвет образуемого осадка, сила кислот и оснований и способность анионов к гидролизу.
Пример образования летучего соединения
Рассмотрим третий тип реакций, в результате которой образуется летучее соединение. Это реакции взаимодействия карбонатов, сульфитов или сульфидов с кислотами. Например,
| Молекулярное уравнение | Na2SO3 + 2HI → 2NaI + SO2↑ + H2O |
| Полное ионное уравнение | 2Na+ + SO32- + 2H+ + 2I— → 2Na+ + 2I— + SO2↑ + H2O |
| Сокращенное ионное уравнение | SO32- + 2H+ → SO2↑ + H2O |
Отсутствие взаимодействия между растворами веществ
При смешении некоторых растворов ионных соединений, взаимодействия между ними может и не происходить, например
| Молекулярное уравнение | CaCl2 + 2NaI = 2NaCl +CaI2 |
| Полное ионное уравнение | Ca2+ + Cl— + 2Na+ + I— = 2Na+ + Cl— + Ca2++ 2I— |
| Сокращенное ионное уравнение | отсутствует |
Условия протекания реакции (химического превращения)
Итак, подводя итог, отметим, что химические превращения наблюдаются в случаях, если соблюдается одно из следующих условий:
- Образование неэлектролита. В качестве неэлектролита может выступать вода.
- Образование осадка.
- Выделение газа.
- Образование слабого электролита, например уксусной кислоты.
- Перенос одного или нескольких электронов. Это реализуется в окислительно – восстановительных реакциях.
- Образование или разрыв одной или нескольких ковалентных связей.
Больше примеров приведено в разделе Задачи к разделу растворы электролитов
Также для тренировки, рекомендуем пройти тест Задания 14. Электролиты и неэлектролиты. Катионы и анионы
КУРСЫ ПОВЫШЕНИЯ
КВАЛИФИКАЦИИ
Л.С.ГУЗЕЙ
Фундаментальные понятия
общей химии в школьном курсе
Учебный план курса
| № газеты | Учебный материал |
|---|---|
| 17 | Лекция № 1. Стехиометрия |
| 18 | Лекция № 2. Элементы химической кинетики |
| 19 | Лекция № 3. Элементы химической термодинамики. Kонтрольная работа № 1. Стехиометрия. Закономерности протекания химических реакций(срок выполнения – до 15 ноября 2005 г.) |
| 20 | Лекция № 4. Химическое равновесие в растворах электролитов |
| 21 | Лекция № 5. Окислительно-восстановительные процессы.Kонтрольная работа № 2. Равновесия в растворах электролитов (срок выполнения – до 15 декабря 2005 г.) |
| 22 | Лекция № 6. Строение атома и химическая связь |
| 23 | Лекция № 7. Химическая связь и строение молекул |
| 24 | Лекция № 8. Строение вещества. Дисперсные системы |
| Итоговая работа. Разработка урока для основной или старшей профильной школы. Итоговые работы, сопровождаемые справками из учебного заведения, должны быть направлены в Педагогический университет не позднее 28 февраля 2006 г. |
ЛЕКЦИЯ № 4
Химическое равновесие
в растворах электролитов
Требования образовательного стандарта,
рассмотренные в лекции.
Основное образование (8–9-е классы).
Электролитическая диссоциация веществ в водных
растворах. Электролиты и неэлектролиты.
Электролитическая диссоциация кислот, щелочей и
солей. Реакции ионного обмена.
Среднее (полное) общее образование (10–11-е
классы). Базовый уровень. Среда водных
растворов: кислая, нейтральная, щелочная.
Водородный показатель (рН) раствора.
Профильный уровень. Сильные и слабые
электролиты. Константа диссоциации.
Произведение растворимости. Кислотно-основные
взаимодействия в растворах. Амфолиты. Ионное
произведение воды.
Электролиты и неэлектролиты
Электролитами называют вещества, проводящие
электрический ток за счет движения ионов (а не
электронов, как в проводниках-металлах).
Из этого определения видно, что
вещества-электролиты должны содержать ионы,
которые могут двигаться. Это могут быть твердые,
жидкие и даже газообразные вещества (правда, на
практике к газам, находящимся в таком состоянии
– состоянии плазмы, термин «электролит» обычно
не применяют).
Ионной проводимостью в твердом состоянии
обладают некоторые оксиды (например, ZrO2,
содержащий примесь СаО) при высоких (порядка
1000 °С) температурах (рис.). Примесь оксида
кальция создает кислородные вакансии (на рисунке
ионы кальция затемнены, а пустыми
прямоугольниками обозначены места, в которых
отсутствуют ионы кислорода) в кристаллической
решетке оксида циркония, по которым и может
происходить диффузия этих ионов. Высокая
температура обеспечивает их подвижность. Это так
называемые твердые электролиты, используемые,
например, в топливных элементах (см. следующие
лекции). (Обратитесь также к лекции № 1, рис. 2.)
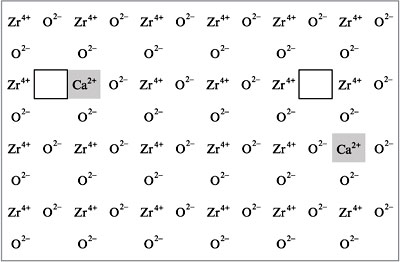 |
Рис.
|
Ионной проводимостью в жидком
состоянии обладают все расплавленные соли,
некоторые сорта стекла (как в твердом, так и в
жидком виде). Настоящая лекция посвящена
электролитам, представляющим водные растворы
кислот, оснований и солей.
1. Образование ионов в водных
растворах.
Электролитическая диссоциация
Свободные ионы, необходимые для создания
ионной проводимости, могут появиться в растворе
двумя способами.
Первый способ – разрушение
кристаллической решетки при растворении в воде
веществ, связь в которых по типу приближается к
ионной, и освобождение ионов.
Для протекания такого процесса необходимо
затратить значительную энергию. Например, для
разделения 1 моль кристаллического NaCl на
свободные ионы Na+ и Cl– необходимо
израсходовать 770 кДж энергии.
Но образующиеся ионы существуют в растворе не в
свободном виде, а вступают во взаимодействие с
молекулами растворителя – воды. Такое
взаимодействие носит название гидратации
ионов. При этом выделяется энергия, которая
компенсирует затраты на разрушение
кристаллической решетки. Для того же примера с NaCl
энергия гидратации иона Na+ составляет
398 кДж/моль, а иона Cl– – 377 кДж/моль.
В табл. 1 приведено еще несколько примеров.
Таблица 1
Теплоты гидратации некоторых ионов
(кДж/моль)
в зависимости от радиуса и заряда
| Kатион | Радиус, пм (1 пм = 10–12 м) |
Теплота гидра- тации |
Kатион | Радиус, пм | Теплота гидра- тации |
Kатион | Радиус, пм | Теплота гидра- тации |
|---|---|---|---|---|---|---|---|---|
| Li+ | 68 | 515 | Mg2+ | 74 | 1910 | Al3+ | 57 | 4640 |
| Na+ | 98 | 398 | Ca2+ | 104 | 1580 | Cr3+ | 62 | 4380 |
| K+ | 133 | 314 | Sr2+ | 120 | 1430 | Fe3+ | 67 | 4355 |
| Rb+ | 149 | 290 | Fe2+ | 80 | 2120 |
Кроме того, вода имеет большую
диэлектрическую проницаемость, что согласно
закону Кулона ослабляет притяжение растворенных
ионов друг к другу. Значение относительной
диэлектрической проницаемости для воды равно 78,
т.е. притяжение одинаковых зарядов, находящихся
на одном и том же расстоянии, в воде в 78 раз
слабее, чем в вакууме. Этот эффект дополнительно
облегчает отделение ионов друг от друга и распад
кристаллической решетки. Он также позволяет
ионам в растворе двигаться сравнительно
независимо друг от друга.
И наконец, при разрушении упорядоченной
кристаллической решетки энтропия системы,
очевидно, возрастает. Это также способствует
растворению ионных соединений.
Второй способ образования
электропроводящих растворов следующий. При
растворении многих веществ, которые сами по себе
не имеют ионного строения, происходит химическая
реакция с растворителем, в результате которой
опять-таки образуются ионы. Вот два примера:
HCl + H2O = H3O+ + Cl–,
NH3 + H2O ![]()
![]() + OH–.
+ OH–.
Эти реакции представляют собой перенос протона
от одной молекулы к другой: от молекулы HCl к
молекуле воды в первом случае и от воды к NH3
во втором. Реакция с участием HCl необратима, а с NH3 –
обратима, причем ее равновесие довольно сильно
смещено влево.
Оба рассмотренных выше типа химических
реакций, вызывающих появление при растворении
подвижных ионов (распад на ионы и реакции с
водой), объединяются под названием электролитической
диссоциации1.
Из данного в начале главы определения понятия
«электролит» следует, что в принципе его
следовало бы применять к уже образовавшемуся
раствору, содержащему «свободные» (на самом деле
в водном растворе — гидратированные) ионы.
Однако по историческим причинам общепринята
другая терминология.
Электролитами принято называть вещества
(главным образом, кислоты, основания и соли),
которые при растворении в воде дают подвижные
ионы, т.е. растворы которых являются
электролитами в буквальном смысле слова. Поэтому
обсуждаемые в настоящей главе растворы принято
называть растворами электролитов, хотя по
существу правильнее было бы называть их
«растворы-электролиты».
Способность образовывать ионы является
свойством не вещества самого по себе, а пары
вещество–растворитель. Например, хлороводород,
являющийся одним из наиболее типичных и
привычных электролитов в воде, при растворении в
бензоле никаких ионов не образует.
Довольно часто продукты реакции с
растворителем могут вступать в дальнейшие
превращения, например:
H2SO4 + H2O = HSO4–
+ H3O+,
HSO4– + H2O ![]() H3O+ + SO42–.
H3O+ + SO42–.
В таких случаях говорят, что вещество (в данном
примере – серная кислота) диссоциирует
ступенчато. Обратите внимание, что первая
реакция, или, как принято говорить, диссоциация
по первой ступени, протекает необратимо, а во
второй – при диссоциации по второй
ступени – устанавливается равновесие. Это не
является общим правилом: при диссоциации молекул
угольной кислоты H2CO3 равновесие
устанавливается на обеих стадиях. Сама угольная
кислота, в свою очередь, образуется при
растворении CO2 в воде по обратимой реакции
(которая, естественно, не является диссоциацией):
CO2 + H2O ![]() H2CO3,
H2CO3,
H2CO3 + H2O ![]() H3O+ + HCO3–,
H3O+ + HCO3–,
HCO3– + H2O ![]() H3O+ + CO32–.
H3O+ + CO32–.
2. Сильные и слабые электролиты
Реакция образования ионов при взаимодействии
растворяемых веществ с водой, как и любая другая,
может протекать либо до исчезновения исходного
вещества, т.е. необратимо, либо до установления
химического равновесия. К приведенным выше
примерам можно добавить еще несколько:
NaOH = Na+ + OH–,
Fe(OH)3 ![]() Fe(OH)2+
Fe(OH)2+
+ OH– ![]() Fe(OH)2+
Fe(OH)2+
+ 2OH– ![]() Fe3+ + 3OH–,
Fe3+ + 3OH–,
CH3COOH + H2O ![]() CH3COO– + H3O+.
CH3COO– + H3O+.
Ясно, что список можно продолжать. Как и ранее,
знак «=» использован для необратимой
диссоциации, а знак «![]() » –
» –
для обратимой.
Вещества, диссоциация которых протекает
необратимо, называют сильными электролитами.
К ним относятся в первую очередь вещества
ионного строения, при растворении которых
происходит освобождение ионов, а также вещества
молекулярного строения, реагирующие с водой до
конца. Основной особенностью сильных
электролитов является то, что в их растворах
полностью отсутствуют молекулы. Сильными
электролитами являются практически все соли
щелочных и щелочно-земельных металлов и их
гидроксиды, а также некоторые кислоты, число
которых невелико (в школьном курсе, во всяком
случае) и их следует запомнить: HCl, HBr, HI, HClO4, H2SO4,
HNO3, HMnO4, H2Cr2O7.
Вещества, при диссоциации которых
устанавливается химическое равновесие, называют
слабыми электролитами. В их растворах
содержатся как молекулы, так и ионы, являющиеся
продуктами их распада.
3. Константа диссоциации. Степень
диссоциации
Как и любое химическое равновесие, равновесие
диссоциации (если оно действительно
устанавливается) может быть описано
соответствующей константой диссоциации (см.
лекцию № 3). Например, для диссоциации уксусной
кислоты (см. выше) константа диссоциации имеет
вид:
Kд = ![]() .
.
Для равновесия осадок–насыщенный раствор
хлорида серебра
AgCl (кр.) ![]() Ag+
Ag+
(р-р) + Cl– (р-р)
константа равновесия, называемая в этом случае
произведением растворимости, выражается так:
ПР(AgCl) = [Ag+][Cl–].
Обратите внимание, что в случае разбавленных
растворов (а только такие и рассматриваются в
расчетных задачах) концентрация растворителя
(как и других участников, реагирующих в виде
практически чистых веществ, например осадков) в
константу равновесия не входит, т.к. может
считаться постоянной величиной.
Ясно, что для сильных электролитов константы
диссоциации не существует, поскольку
концентрация недиссоциированных молекул равна
нулю.
Константы диссоциации для слабых или
малорастворимых электролитов имеются в
справочниках. Несколько значений мы приводим в
табл. 2 и 3 (цифры I, II и III означают 1-ю, 2-ю и 3-ю
ступени диссоциации).
Таблица 2
Константы диссоциации некоторых слабых
электролитов
| Kласс веществ | Формула | Kд |
|---|---|---|
| Kислоты | HF | 6,6•10–4 |
| H2S | (I) 6•10–8 (II) 1•10–14 |
|
| H3PO4 | (I) 1,6•10–3 (II) 6,3•10–7 (III) 1,3•10–12 |
|
| H2CO3 | (I) 4,5•10–7 (II) 4,7•10–11 |
|
| НСООН (муравьиная) | 1,8•10–4 | |
| СН3СООН (уксусная) | 1,8•10–5 | |
| (HOOCCH2)2C(OH)COOH (лимонная) |
(I) 7,5•10–4 (II) 1,7•10–5 (III) 4,0•10–7 |
|
| C6H5OH (фенол) | 1,0•10–10 | |
| (COOH)2 (щавелевая) | (I) 5,4•10–2 (II) 5,4•10–5 |
|
| H2SiO3 | (I) 2,2•10–10 (II) 1,6•10–12 |
|
| HAlO2 | 5•10–13 | |
| Основания | Mg(OH)2 | (II) 2,5•10–3 |
| Al(OH)3 | (III) 1,4•10–9 | |
| NH3 (NH4OH) | 1,8•10–5 | |
| CH3NH2 (метиламин) | 4,2•10–4 | |
| C6H5NH2 (анилин) |
3,8•10–10 | |
| Cr(OH)3 | (III) 1,0•10–9 | |
| Fe(OH)2 | (II) 1,3•10–4 | |
| Fe(OH)3 | (II) 1,8•10–11 (III) 1,4•10–12 |
|
| Cu(OH)2 | (II) 3,4•10–7 | |
| Zn(OH)2 | (II) 4•10–5 |
Знание константы диссоциации
позволяет вычислить концентрации ионов в
растворе слабого электролита известной
концентрации. Рассмотрим способ решения таких
задач.
Пусть концентрация раствора слабого
электролита AB равна cAB моль/л, а его
константа диссоциации — KAB.
Решение любой задачи, связанной с нахождением
концентраций частиц в системе, в которой
протекают обратимые химические реакции, следует
начинать с записи уравнения протекающей реакции
и выражения соответствующей константы
равновесия. В данном случае реакция диссоциации
имеет вид:
AB ![]() A+ + B–,
A+ + B–,
а ее константа — ![]() . (1)
. (1)
Подчеркнем, что символы в квадратных скобках
обозначают равновесную (т.е. устанавливающуюся
после достижения системой равновесного
состояния) концентрацию соответствующих молекул
или ионов в моль/л. Не следует путать стоящую в
знаменателе равновесную концентрацию молекул [AB]
с общей концентрацией электролита cAB.
Последняя складывается из оставшейся в
молекулярном виде, а также диссоциировавшей
части вещества AB.
Константу диссоциации можно выразить через
общую концентрацию электролита cAB и степень
диссоциации ![]() ,
,
под которой будем понимать долю молекул, которая
распалась на ионы, от полного количества
вещества электролита. Например, если в реакцию
диссоциации вступила каждая вторая молекула,
степень диссоциации составляет 0,5, или 50%, если
одна из ста — 0,01 (1%), и т.д. Поскольку при
диссоциации каждой молекулы AB образуется по
одному иону каждого типа, их концентрации равны
[A] = [B] = ![]() •cAB,
•cAB,
а равновесная концентрация молекул равна
общей концентрации электролита за вычетом
концентрации продиссоциировавшей его части:
[AB] = cAB – ![]() •cAB = (1 –
•cAB = (1 – ![]() )cAB.
)cAB.
Подставив эти соотношения в уравнение (1),
получим:
![]() .
.
(2)
Поскольку cAB задана, а константа
диссоциации является характеристикой
электролита и может быть найдена в
соответствующих таблицах, из уравнения (2) можно
найти степень диссоциации. После приведения к
общему знаменателю получается квадратное
уравнение, которое можно решить обычным
способом. Рассчитав степень диссоциации, можно
вычислить концентрации всех частиц,
присутствующих в растворе.
В тех случаях, когда константа диссоциации
мала, а раствор не является очень разбавленным,
степень диссоциации также мала. Тогда выражение
(2) можно упростить, приняв (1– ![]() )
) ![]() 1:
1:
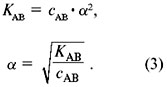
Последнее выражение называется законом
разбавления2 Оствальда
(1888). Как правило, точность формулы (3) достаточна
для практических целей. Например, для 0,1М
раствора CH3COOH, имеющей Kд = 1,8•10–5,
приближенная формула (3) дает ![]() = 0,0134, в то время как полное
= 0,0134, в то время как полное
решение уравнения (2) дает ![]() = 0,0133.
= 0,0133.
В тех случаях, когда диссоциация идет по
ступеням, расчет концентраций присутствующих в
растворе частиц производится в принципе так же,
но технически усложняется.
С понятием степени диссоциации связано
альтернативное определение понятий сильных и
слабых электролитов. Оно было введено во времена
Аррениуса, но довольно часто встречается в
литературе (в частности, во многих школьных
учебниках) и до сих пор. Сильными называют
электролиты, степень диссоциации которых
превышает 0,3 (30%), слабыми – электролиты с ![]() = 0,03 (3%) и менее.
= 0,03 (3%) и менее.
При этом для веществ, степень диссоциации
которых попадает в интервал от 0,03 до 0,3, вводится
новое понятие — «электролиты средней силы».
4. Равновесия растворов
электролитов с осадками. Произведение
растворимости
Рассмотрим реакцию растворения
малорастворимого вещества, являющегося в
растворе сильным электролитом (для конкретности
возьмем сульфат бария BaSO4). В его насыщенном
растворе устанавливается равновесие (не внутри
раствора, в котором молекул сульфата нет, ведь
это сильный электролит, а между осадком и
раствором):
BaSO4 (кр.) ![]()
Ba2+ (р-р) + SO42– (р-р).
Константа такого равновесия, называемая, как
уже говорилось выше, произведением
растворимости, имеет вид:
ПР = [Ba2+][SO42–].
(4)
Разумеется, в ее записи отсутствует
концентрация BaSO4, вступающего в реакцию в
виде индивидуального вещества, и константа
равновесия равна просто произведению
концентраций ионов в степенях, равных их
стехиометрическим коэффициентам.
Константа равновесия реакции растворения
малорастворимого сильного электролита, т. е.
произведение концентраций образующих его ионов
в степенях их стехиометрических коэффициентов в
насыщенном растворе, получила название произведения
растворимости и обозначается ПР.
Таблица 3
Произведения растворимости некоторых
малорастворимых электролитов при комнатной
температуре (18–25 °C)
| Вещество | ПР | Вещество | ПР |
|---|---|---|---|
| AgBr | 6•10–13 | Cu(OH)2 | 2,2•10–20 |
| AgCl | 1,8•10–10 | CuS | 6,3•10–36 |
| AgI | 8,3•10–17 | Fe(OH)2 | 8•10–16 |
| Al(OH)3 | 10–32 | Fe(OH)3 | 6,3•10–38 |
| BaSO4 | 1,1•10–10 | HgS | 1,6•10–52 |
| CaCO3 | 3,8•10–9 | KClO4 | 1,1•10–2 |
| Ca(OH)2 | 5,5•10–6 | Mg(OH)2 | 7,1•10–12 |
| CaSO4 | 2,5•10–5 | PbCl2 | 2•10–5 |
| Cr(OH)3 | 6,3•10–21 |
Условие малой растворимости
необходимо потому, что только в этом случае
запись константы равновесия имеет достаточно
простой вид. Если электролит не является сильным,
то помимо реакции растворения необходимо
учитывать и процессы образования в растворе
недиссоциированных молекул, что усложняет
описание. Впрочем, если вещество
малорастворимое, концентрация его насыщенного
раствора низка, а степень диссоциации согласно
закону разбавления Оствальда велика. Поэтому
присутствием недиссоциированных молекул в таких
растворах почти всегда можно пренебречь3.
Как и любая константа равновесия, произведение
растворимости не зависит от концентрации
веществ, присутствующих в растворе. Численные
значения произведения растворимости некоторых
малорастворимых электролитов приведены в табл. 3.
Ясно, что чем меньше численное значение ПР, тем
меньше растворимость. Однако непосредственно
судить о растворимости по величине ПР можно
только при аналогичных формулах веществ.
Например, сравнивая растворимость сульфатов
кальция и бария (по величине ПР), можно сразу
сказать, что первый растворим лучше второго.
Действительно, в насыщенных растворах этих
сульфатов:
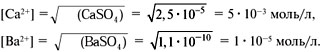
В то же время, несмотря на практически
одинаковые ПР, растворимость CaSO4 (его
концентрация в насыщенном растворе – ![]() ) намного меньше, чем
) намного меньше, чем ![]()
С помощью понятия произведения растворимости
можно сформулировать условия образования или
растворения осадков малорастворимых
электролитов.
1. Если произведение концентраций
присутствующих в растворе ионов в степенях их
стехиометрических коэффициентов превышает ПР
малорастворимого вещества, при достижении
равновесия из раствора должен выпасть осадок
этого вещества.
2. Если произведение концентраций находящихся в
растворе ионов в степенях их стехиометрических
коэффициентов меньше, чем ПР малорастворимого
вещества, присутствующего в виде осадка, этот
осадок должен растворяться.
Рассмотрим примеры.
1. При смешении 0,002М растворов AgNO3 и KCl
концентрации ионов Ag+ и Cl– в
полученном растворе равны4 0,001
моль/л, а их произведение с(Ag+)•с(Cl–) =
0,001•0,001 = 1•10–6, что значительно
превышает ПР(AgCl) = 1,8•10–10. Поэтому после
смешения растворов будет выпадать осадок
хлорида серебра.
2. При смешении растворов той же концентрации,
что в предыдущем примере, но хлорида кальция и
сульфата натрия, получим:
с(Ca2+)•с(SO42–) =
0,001•0,001 = 1•10–6,
что меньше, чем ПР(CaSO4) = 2,58•10–5,
так что осадок не выпадет.
5. Кислоты и основания. Понятие
протолиза
Согласно обычному определению, предложенному в
1887 г. С.Аррениусом, кислотами называют
соединения, образующие при диссоциации ионы H+
(т.е. H3O+), а основаниями —
гидроксид-ионы OH–. Однако настоящие ионы
водорода, т.е. свободные протоны, в водных
растворах существовать не могут: константа
равновесия реакции присоединения протона к
молекуле воды
H+ + H2O = H3O+
(5)
равна примерно 10200. (В лекции № 3 мы приводили
число частиц в нашей Вселенной. Сравните с данным
числом.) Это значит, что протоны в водной среде
полностью связаны молекулами воды (или другими
частицами, если их сродство к протону еще больше).
Именно поэтому мы не стали писать в уравнении
реакции (5) знака обратимости реакции, хотя
формально говорим о равновесии. Таким образом,
реакция диссоциации кислот, а также реакция
нейтрализации, являющаяся важнейшей реакцией
кислот и оснований, представляют собой перенос
протона от одной частицы к другой.
В 1923 г. Й.Н.Брёнстед дал определение понятий
кислоты и основания, основанное на переносе
протона. Согласно определению, или, как иногда
говорят, теории, Бренстеда, кислотой называется
частица (молекула или ион), отдающая протон, а
основанием — частица, принимающая протон;
частица, способная как отдавать, так и
присоединять протон, называется амфолитом.
Обратите внимание, что в определениях
Аррениуса речь идет о веществах, а у Бренстеда о
частицах — ионах или молекулах в растворе.
Примеры кислот по Бренстеду: H3O+, NH4+,
HCl; оснований: OH–, CO32–,
NH3, FeOH2+; амфолитов: H2O, HCO3–.
Все реакции переноса протона носят общее
название протолиза. Реакция переноса протона
между двумя одинаковыми частицами (например,
между молекулами воды) называется автопротолизом
(см. ниже).
Электролиты, не являющиеся кислотами или
основаниями, называются солями. Это по Аррениусу.
А у Бренстеда соли отсутствуют.
6. Диссоциация воды. Понятие pH
Поскольку вода принадлежит к наиболее типичным
амфолитам, она вступает в реакцию автопротолиза:
H2O + H2O ![]() H3O+ + OH–.
H3O+ + OH–.
Эта реакция протекает и в чистой воде, и в любых
водных растворах. Ее константа равновесия равна:
Kв = [H3O+][OH–]
(6)
(как всегда, концентрация воды, реагирующей в
виде чистого вещества, в запись константы
равновесия не входит). Эта константа обычно
называется ионным произведением воды.
Численное значение Kв зависит от
температуры (растет с ее повышением), но в
большинстве практических расчетов ее принимают
равной 1•10–14.
Ионное произведение воды не зависит от состава
раствора (пока этот раствор можно считать
разбавленным). Поэтому концентрации ионов H3O+
и OH– в водных растворах не произвольны, а
связаны уравнением (6), так что, зная одну из них,
можно найти другую.
Очевидно, что концентрация ионов H3O+
(на практике их часто обозначают просто H+ –
не забывая, конечно, о гидратации; мы тоже будем
так делать) может служить мерой кислотности
раствора.
В 1909 г. С.Сёренсен предложил для выражения
кислотности растворов указывать величину
отрицательного десятичного логарифма
концентрации ионов водорода, которая получила
обозначение5 pH:
pH = –lg [H+].
В чистой воде концентрации ионов H+ и OH–
одинаковы, поэтому [H+] = [OH–] = ![]() = 10–7, а
= 10–7, а
значение pH равно 7. При добавлении кислоты
концентрация ионов H+ увеличивается, а pH
соответственно уменьшается. И наоборот, при
добавлении сильного основания, увеличивающего
концентрацию ионов OH–, концентрация ионов
H+ в соответствии с соотношением (6)
уменьшается, а pH возрастает.
В табл. 4 приведены примеры растворов с
различными рН.
Таблица 4
Примеры рН растворов некоторых
веществ
| Вещество | pН < 7 | Вещество | pН |
|---|---|---|---|
| Промышленная концентрированная HCl (37%) |
–1,1 | Слезы | 7,0 |
| 1M раствор HCl | 0,0 | Kровь | 7,4 |
| Желудочный сок | 1,0–1,5 | Водопроводная вода | 7,5 |
| Лимонный сок | 2,1 | Морская вода | 8,0 |
| Томатный сок | 4,1 | Раствор пищевой соды NaHCO3 | 8,5 |
| Черный кофе | 5,0 | Известковая вода | 10,5 |
| Моча | 6,0 | Аммиак из аптечки | 11,9 |
| Человеческий пот | 4–6 | 1M раствор NaOH | 14 |
| Дождевая вода | 6,5 | Насыщенный раствор NaOH | ~15 |
| Слюна | 6,9 | ||
| Молоко | 6,9 |
7. Реакции ионного обмена
Реакции ионного обмена, т.е. реакции,
происходящие между веществами-электролитами,
как и все другие химические реакции, могут быть
обратимыми и необратимыми.
Очевидно, необратимыми являются реакции,
приводящие к образованию веществ, покидающих
раствор: газа, осадка или слабого электролита.
В этом определении имеются ключевые слова
«покидающих раствор». В лекции № 2 мы рассмотрели
примеры, когда абсолютизируются определения,
которые на самом деле являются субъективными.
Речь шла о реакциях соляной кислоты с цинком и
ионов серебра с ионами хлора. Аналогичный случай
имеет место с образованием слабого электролита.
Например, реакция ацетата натрия с соляной
кислотой (сокращенное ионное уравнение):
CH3COO– + H+ = CH3COOH.
(7)
Все знают, что соляная кислота намного сильнее
уксусной и вытесняет ее из растворов ее солей. Но
для уксусной кислоты существует константа
диссоциации, не равная нулю. Следовательно, и эту
реакцию можно рассматривать как обратимую.
Получается, что в растворах электролитов
истинно необратимых реакций нет. Есть практически
необратимые. И в зависимости от конкретных
решаемых задач мы называем реакцию обратимой или
необратимой.
8. Гидролиз солей
При растворении в воде солей слабых кислот или
слабых оснований появляется возможность
кислотно-основного взаимодействия с водой.
Например, при растворении ацетата натрия ион CH3COO–
может вступать во взаимодействие с водой как
основание-акцептор протона:
CH3COO– + H2O ![]() CH3COOH + OH–. (8)
CH3COOH + OH–. (8)
Сравните эту реакцию с реакцией (7). В отличие от
реакции (7), которую на практике считают
необратимой, в реакции (8) имеются слабые
электролиты и слева, и справа.
Аналогично ион NH4+,
который представляет собой кислоту (по
Бренстеду), может вступать во взаимодействие с
водой:
NH4+ + H2O ![]() NH3 + H3O+.
NH3 + H3O+.
(9)
Процессы кислотно-основного взаимодействия,
происходящие при растворении в воде солей слабых
кислот или (и) слабых оснований, носят название
гидролиза солей.
Как и всякое химическое равновесие, гидролиз
описывается соответствующей константой. Однако
эта константа не является независимой величиной
(и потому отсутствует в справочниках). Она может
быть рассчитана, если известна константа
диссоциации кислоты или основания и ионное
произведение воды. Не приводя общего вывода,
покажем способ такого расчета на примере
гидролиза ацетат-иона.
Константа равновесия реакции гидролиза (8)
равна:
![]() .
.
Это выражение можно преобразовать, умножив
числитель и знаменатель на [H+]:
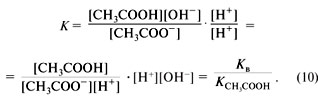
Таким образом, константа гидролиза равна
отношению ионного произведения воды к константе
диссоциации электролита, получающегося в
результате гидролиза. В данном примере
Kг = 10–14/(2•10–5) =
5•10–10,
т.е. равновесие гидролиза ацетат-иона сильно
сдвинуто влево. Тем не менее растворы ацетатов
щелочных металлов имеют заметно щелочную среду.
Вода является одним из самых слабых
электролитов. Поэтому константа гидролиза в
соответствии с уравнением (10) невелика.
Соответственно степень гидролиза, как правило,
мала (табл. 5).
Таблица 5
Степень гидролиза некоторых солей в 0,1М
растворе при 25 °С
| Соль | Степень гидролиза, % |
|---|---|
| CH3COONa | 0,008 |
| NH4Cl | 0,01 |
| KCN | 1,2 |
| Na2CO3 (1-я ступень) | 2,9 |
Вопросы и задания
1. Вычислите теплоту растворения хлорида
натрия в воде (необходимые данные – в тексте
лекции).
Ответ. При диссоциации 1 моль NaCl на
газообразные ионы затрачивается 770 кДж энергии.
При гидратации ионов Na+ и Cl–
выделяется 398 + 377 = 775 кДж/моль. Теплота
растворения, таким образом, составляет 775 – 770 = 5
кДж/моль.
2. Укажите катион с наибольшей энергией
гидратации (см. табл. 1). Почему именно этот катион
обладает наибольшей энергией гидратации?
Ответ. Это ион Al3+ – наименьший ион
среди самых высокозарядных ионов. Электрическое
поле иона тем интенсивнее, чем выше его заряд и
меньше радиус.
3. Классифицируйте следующие вещества (в
водных растворах) на сильные и слабые
электролиты: NaCl, CuCl2, BaSO4, Ba(OH)2,
Fe(OH)2, H3PO4.
Ответ. Сильные электролиты – NaCl, BaSO4,
Ba(OH)2. Иногда говорят, что сульфат бария —
слабый электролит. Но речь идет о состоянии в
растворе. В его растворе молекул BaSO4 нет,
т.е. его диссоциация необратима.
Слабые электролиты – CuCl2, Fe(OH)2, H3PO4.
В школьном курсе принято считать, что все соли –
сильные электролиты. На самом деле это не так.
Сильные электролиты – это только соли и
гидроксиды щелочных и щелочно-земельных (если не
относить к таковым бериллий и магний) металлов.
4. В табл. 2 выберите кислоты, в 0,001М растворах
которых концентрация ионов водорода наибольшая
и наименьшая.
Ответ. Наибольшая концентрация ионов
водорода в растворе щавелевой кислоты, имеющей
наибольшую первую константу диссоциации, и
наименьшая в растворе метаалюминиевой кислоты.
5. Какой раствор называется насыщенным?
Ответ. Насыщенным называется раствор,
находящийся в равновесии с растворенным
веществом. Поэтому насыщенным может быть только
такой раствор, который соприкасается с
растворенным веществом. Неправильно говорить,
что насыщенный раствор содержит максимально
возможное количество вещества при данных
условиях. Пересыщенный раствор содержит больше.
6. Чему равна молярная концентрация
насыщенных растворов: а) BaSO4; б) Fe(OH)2?
Ответ. а) В растворе имеем:
BaSO4 ![]() Ba2+
Ba2+
+ SO42–,
и молярная концентрация соли равна
концентрации любого из ионов, т.к. их
концентрации одинаковы:
![]()
б) В растворе имеем:
Fe(OH)2 ![]() Fe2+
Fe2+
+ 2OH–,
и молярная концентрация гидроксида равна
концентрации ионов железа [Fe2+]. Обозначим
ее через х, тогда [OH–] = 2x.
ПР(Fe(OH)2) = [Fe2+]•[OH–]2
= x•(2x)2 = 4x3 = 8•10–16.
Отсюда
![]()
7. Классифицируйте следующие частицы по
Бренстеду на кислоты, основания и амфолиты: H2SO4,
SO42–, HSO4–
, NH3, NH4+.
Ответ. Кислоты – H2SO4, NH4+;
основания – SO42–, NH3;
амфолит – HSO4–.
8. Вычислите концентрацию ионов водорода в
черном кофе. Какой концентрации соляной кислоты
(моль/л) это соответствует?
Ответ.
рН = 5, [H+] = 10–5, [HCl] = 10–5
моль/л.
9. Напишите уравнение реакции гидролиза
карбоната натрия по первой ступени и вычислите
ее константу.
Ответ. Растворение в воде соды (сильный
электролит) – необратимый процесс:
Na2CO3 = 2Na+ + CO32–.
А вот гидролиз соды по карбонат-иону –
обратимая реакция, в которой имеются слабые
электролиты как среди реагентов, так и среди
продуктов реакции:
CO32– + H2O ![]() HCO3–
HCO3–
+ OH–.
Константа равновесия этой реакции – константа
гидролиза:
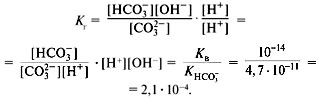
Как видите, даже в случае очень слабой угольной
кислоты константа гидролиза невелика,
равновесие сильно смещено влево. Это общее
правило: равновесие смещено в сторону более
слабого электролита.
1 Название «диссоциация»,
означающее буквально «распад», «разложение»,
связано с тем, что раньше все вещества считали
состоящими из молекул, а появление ионов
трактовали как результат распада молекул при
растворении (С. Аррениус, 1887 г.).
2 Название закона связано с тем,
что в то время для выражения состава растворов
чаще пользовались не концентрацией (числом молей
растворенного вещества в 1 л раствора), а
«разбавлением» — объемом раствора,
содержащим 1 моль растворенного вещества.
3 Например, в насыщенном растворе
AgCl в виде молекул находится около 1%
растворенного вещества.
4 При смешении исходные
концентрации уменьшились в 2 раза.
5 Читается «пэ-аш». Происходит от
первых букв латинского выражения Pundus Hydrogenium –
вес водорода.
СТЕПЕНЬ ДИССОЦИАЦИИ.
это отношение числа продиссоциировавших молекул к общему числу молекул растворённого электролита:
N (продисс)
α = ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶ ̶̶
N (общ)
Если степень диссоциации равна 0 – вещество не является электролитом.
ФАКТОРЫ, ВЛИЯЮЩИЕ НА СТЕПЕНЬ ДИССОЦИАЦИИ ВЕЩЕСТВ:
ТЕМПЕРАТУРА
чем выше температура, тем степень диссоциации выше;
КОНЦЕНТРАЦИЯ
чем больше концентрация вещества, тем степень диссоциации меньше.
Электролиты делят на СИЛЬНЫЕ И СЛАБЫЕ:
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫ(Α=1) :
2. Кислоты: HCl, HBr, HI, HNO3, HClO4, HMnO4, H2SO4(по первой ступени)
3. Основания: щелочи – NaOH, KOH, LiOH, RbOH, CsOH; гидроксиды щелочноземельных металлов – Ca(OH)2, Sr(OH)2, Ba(OH)2.
СЛАБЫЕ ЭЛЕКТРОЛИТЫ(Α < 1)
1. Почти все органические кислоты (CH3COOH, C2H5COOH и др.);
2. Некоторые неорганические кислоты: HF, HNO2, HClO, H2SO3, H2S, H2CO3, H2SiO3, H3PO4
3.Почти все малорастворимые в воде соли, основания и гидроксид аммония: (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH);
1. Если электролит – сильный, он диссоциирует полностью в ОДНУ СТУПЕНЬ, все молекулы превращаются в ионы:
Cu(NO3)2 à Cu2+ + 2NO3- (α=1)
KAl(SO4)2 à K+ + Al3+ +2SO42- (α=1)
2. Если электролит – слабый, он диссоциирует по ступеням, не полностью, степень диссоциации на каждой следующей ступени гораздо меньше, чем на предыдущей:
H2S ⇄ H+ + HS- (α<1)
HS- ⇄ H+ + S2- (α<<1)
Mg(OH)2 ⇄ Mg(OH) + + OH-( α<1)
Mg(OH)+ ⇄ Mg2+ + OH- (α<<1)
3. Если в составе вещества есть связи разных типов, то сначала диссоциируют ионные связи, затем наиболее полярные:
NaHCO3 à Na+ + HCO3- (α=1)
HCO3- ⇄ H+ + CO32- (α < 1)
Cu(OH)Cl à CuOH+ + Cl- (α=1)
CuOH+ ⇄ Cu2+ + OH- (α< 1)
