Загрузить PDF
Загрузить PDF
Электрон является частицей с отрицательным зарядом и входит в состав атома. Все основные элементы состоят из электронов, протонов и нейтронов. В химии важно уметь определять, сколько электронов содержит атом. Это можно сделать с помощью периодической системы химических элементов (таблицы Менделеева). Также необходимо знать, как найти число нейтронов и валентных электронов (электронов на внешней оболочке атома).
-

1
Возьмите таблицу Менделеева. Это цветная таблица, в которой все известные элементы упорядочены согласно их атомной структуре. Каждый элемент обозначается символом в виде одной, двух или трех латинских букв, наряду с атомным весом и атомным номером элемента.[1]
- Таблицу Менделеева можно найти в учебниках по химии или в интернете.
-

2
Найдите нужный элемент в таблице Менделеева. Элементы упорядочены по атомному номеру и разделены на три основные группы: металлы, неметаллы и металлоиды (полуметаллы). Некоторые группы носят несистематические названия, такие как щелочные металлы, галогены и благородные газы.[2]
. Каждый столбец таблицы называется группой, а каждая строка — периодом.- Если вы знаете, в какой группе или периоде находится нужный элемент, вам будет легче найти его.
- Если вы знаете только символ элемента, просто просмотрите таблицу и найдите в ней этот символ.
-

3
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[3]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
Реклама
-

1
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[4]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, то нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
-

2
Выясните заряд иона. Если добавить или удалить электрон из атома, элемент не поменяется на другой, но зато изменится его заряд. В этом случае получится ион, такой как K+, Ca2+ или N3-. Обычно заряд указывается сверху справа от символа элемента.
- Электрон — это частица с отрицательным зарядом, поэтому если в атом добавить электрон, получится ион с отрицательным зарядом.
- Если из атома удалить электрон, получится ион с положительным зарядом.
- Например, заряд N3- равен -3, а заряд Ca2+ равен +2.
-

3
Если дан ион с положительным зарядом, вычтите заряд из атомного номера. Если ион имеет положительный заряд, атом потерял электроны. Чтобы определить оставшееся количество электронов, вычтите заряд из атомного номера. У иона с положительным зарядом протонов больше, чем электронов.
- Например, заряд Ca2+ равен +2, то есть у этого иона на 2 электрона меньше, чем у нейтрального атома кальция. Атомный номер кальция равен 20, поэтому у этого иона 18 электронов.
-

4
Если дан ион с отрицательным зарядом, прибавьте заряд к атомному номеру. Если ион имеет отрицательный заряд, атом получил дополнительные электроны. Чтобы определить получившееся количество электронов, прибавьте заряд к атомному номеру. У иона с отрицательным зарядом протонов меньше, чем электронов.
- Например, заряд N3- равен -3, то есть у этого иона на 3 электрона больше, чем у нейтрального атома азота. Атомный номер азота равен 7, поэтому у этого иона 10 электронов.
Реклама
Об этой статье
Эту страницу просматривали 46 270 раз.
Была ли эта статья полезной?
Download Article
Download Article
All basic elements are made up of electrons, protons, and neutrons. An electron is a negatively charged particle that makes up part of an atom. A fundamental concept in chemistry is the ability to determine how many electrons an atom contains. By using a periodic table of elements, this can easily be determined. Other important concepts involve how to find the number of neutrons and valence electrons (number of electrons in its outermost shell) in an element.
-

1
Obtain a periodic table of elements. This is a color-coded table that organizes all the known elements by atomic structure. Each element has a 1, 2, or 3-letter abbreviation and is listed along with its atomic weight and atomic number.[1]
- Periodic tables can easily be found in chemistry books as well as online.
-

2
Find the element in question on the periodic table. The elements are ordered by atomic number and separated into three main groups: metals, non-metals, and metalloids (semi-metals). They are further grouped into families including alkali metals, halogens, and noble gases.[2]
Every column of the table is called a group and every row is called a period.- If you know the details of your element, such as what group or period it is in, it will be easier to locate.
- If you don’t know anything about the element in question, just search the table for its symbol until you find it.
Advertisement
-

3
Find the atomic number of an element. The atomic number appears in the upper left-hand corner or centrally above the element symbol in the square. The atomic number defines the number of protons present in that particular element.[3]
Protons are the particles in an element that provide a positive charge. Because electrons are negatively charged, when an element is in its neutral state, it will have the same number of protons as electrons.- For instance, boron (B) has an atomic number of 5, meaning that it has 5 protons and 5 electrons.
Advertisement
-

1
Identify the charge of the ion. Adding and removing electrons from an atom does not change its identity, but it changes its charge. In these cases, you now have an ion, such as K+, Ca2+, or N3-. Usually, the charge is expressed in a superscript to the right of the atom abbreviation.
- Because an electron has a negative charge, when you add extra electrons, the ion becomes more negative.
- When you remove electrons, the ion becomes more positive.
- For example, N3- has a -3 charge while Ca2+ has a +2 charge.
-

2
Subtract the charge from the atomic number if the ion is positive. If the charge is positive, the ion has lost electrons. To determine how many electrons are left, subtract the amount of charge from the atomic number. In this case, there are more protons than electrons.
- For example, Ca2+ has a +2 charge, therefore, it has 2 fewer electrons than a neutral calcium atom. Calcium’s atomic number is 20, therefore this ion has 18 electrons.
-

3
Add the charge to the atomic number if the charge is negative. If the charge is negative, the ion has gained electrons. To determine how many total electrons there are, add the amount of charge to the atomic number. In this case, there are fewer protons than electrons.
- For example, N3- has a -3 charge which means it has 3 more electrons than a neutral nitrogen atom. Nitrogen’s atomic number is 7, therefore this ion has 10 electrons.
Advertisement
Add New Question
-
Question
What if the charge has no number?

If the charge has no number (is 0), then the number of electrons is the same as the number of protons.
-
Question
How do I calculate the number of electrons by looking at a periodic table?

It is the atomic number. However, if it has positive ion, then this electron number will go down (ie +2 charge means two electrons have been lost, so the electron/atomic number will go down by two) and vice versa.
-
Question
How do I figure out the number of valence electrons?

Valence electrons are the electrons contained in the outermost shell. If you look at the periodic table and at the period numbers, that is the number of valence electrons. If the number is larger than 10, subtract 10 so you get two valence electrons. Example: Oxygen is in the 16th period. If we subtract 10 from 16, we get 6; therefore, oxygen has six valence electrons.
See more answers
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
Video
References
About This Article
Article SummaryX
To find the number of electrons an atom has, start by looking up the element you’re working with on the periodic table and locating its atomic number, which will be in the upper left-hand corner of the square. Then, identify the charge of the ion, which will be written as a superscript to the right of the element. Finally, subtract the charge from the atomic number if the ion is positive or add the charge to the atomic number if the ion is negative. To learn how to read and use a periodic table, keep reading!
Did this summary help you?
Thanks to all authors for creating a page that has been read 364,498 times.
Reader Success Stories
-

Jeff Rodniklaem
Apr 18, 2016
“The article really informed me about finding the electrons as my school teacher struggled to help me a bit. I am…” more
Did this article help you?
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
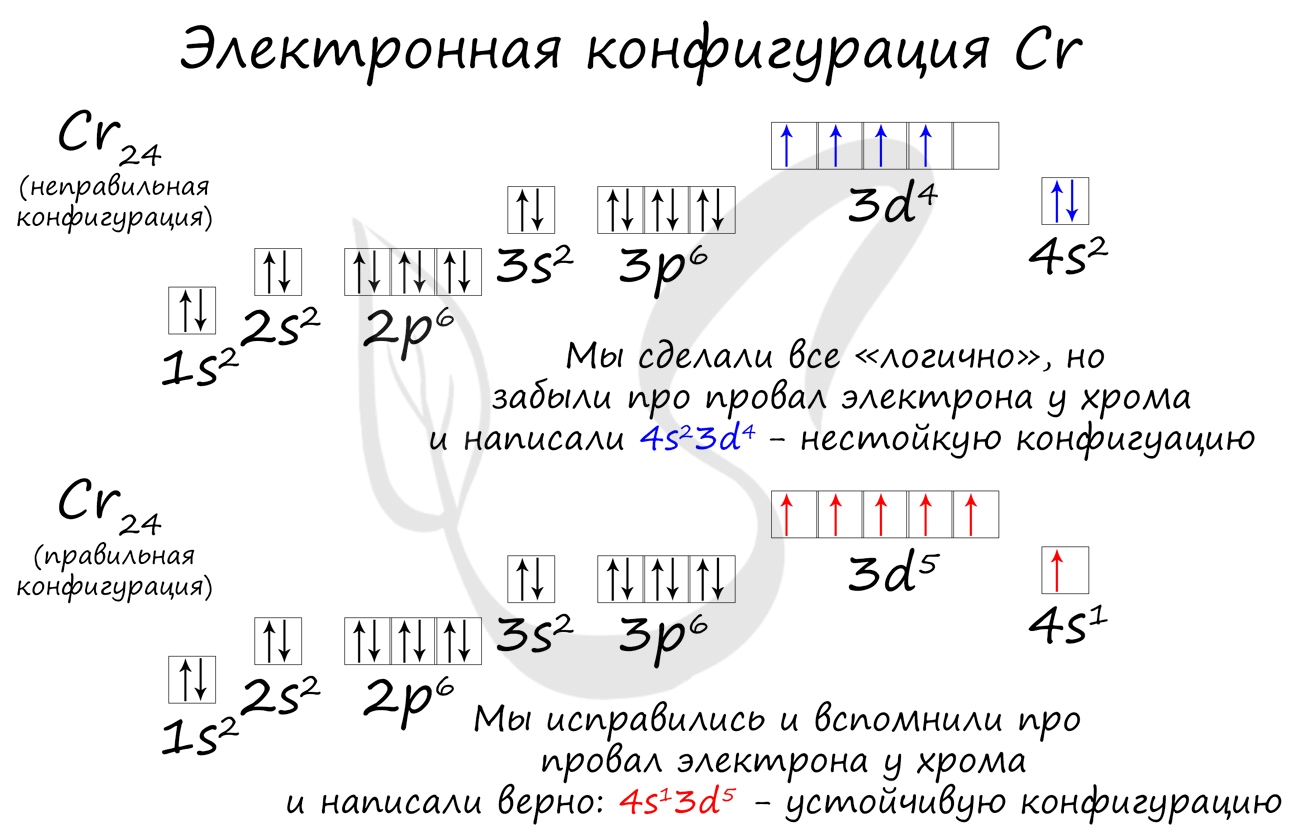
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
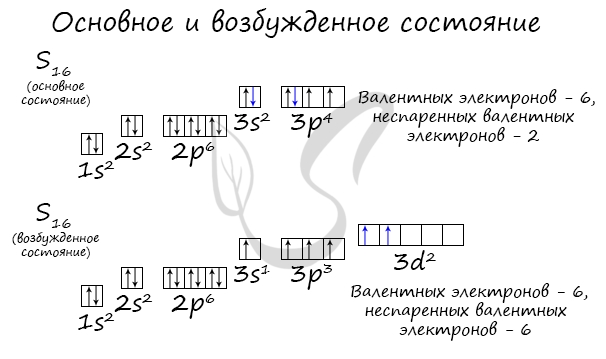
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Химия. Как найти электроны атома?
Знаток
(317),
закрыт
9 лет назад
Лиана Аминева
Ученик
(124)
9 лет назад
Смотришь по таблице какой порядковый номер, столько и будет электронов.
Напирмер: Литий, порядковый номер 3 и значит электрона тоже 3.
Алюминий: 13поряд. номер и электронов столько же
Фосфор- 15 электронов
Алексей Белоусов
Мастер
(1293)
9 лет назад
Например: Литий третий по счёту в таблице Менделеева, а весит он 7.Это значит что у него 3 электрона и 3 протона, а нейтронов у него: 7-3=4.Алюминий 13 в таблице, весит он 27.Следовательно у него 13 электронов и 13 протонов, а нейтронов 27-13=14.
Автор:
Tamara Smith
Дата создания:
28 Январь 2021
Дата обновления:
18 Май 2023

Содержание
- меры
Все основные химические элементы состоят из электронов, протонов и нейтронов. Электрон – это отрицательно заряженная частица, содержащаяся в атоме. Один из фундаментальных принципов химии – это возможность узнать, сколько электронов находится внутри атома. Для этого достаточно воспользоваться периодической таблицей элементов. Другие фундаментальные принципы – найти количество нейтронов и валентных электронов или количество электронов во внешнем слое атома элемента.
меры
Метод 1 из 2: определение количества электронов в нейтральных атомах
-

Возьмите периодическую таблицу. Периодическая таблица – это цветная таблица, в которой все известные элементы организованы в соответствии с атомной структурой. Каждый элемент имеет сокращение из одной, двух или трех букв и появляется вместе с атомной массой и соответствующим атомным номером.
- Таблицу Менделеева легко найти в книгах по химии и в Интернете.
-

Найдите нужный элемент на периодическая таблица. Элементы упорядочены по атомным номерам и разделены на три основные группы: металлы, металлы и полуметаллы. Эти группы делятся на семейства, такие как щелочные металлы, галогены и благородные газы. Каждый столбец в таблице – это семейство, а каждая строка – точка.
- Если вы знаете, в какой семье или периоде находится желаемый элемент или какая-либо другая деталь этого типа, у вас будет гораздо меньше проблем с его поиском.
- Если вы ничего не знаете об элементе, просматривайте таблицу, пока не найдете соответствующий символ.
-

Найдите атомный номер элемента. Атомный номер – это номер, который появляется в верхнем левом углу или чуть выше символа элемента в соответствующем поле. Он определяет количество протонов или положительно заряженных частиц, присутствующих в этом конкретном элементе. Поскольку электроны являются отрицательными частицами, нейтральный элемент будет иметь такое же количество протонов и электронов.
- Например, атомный номер бора (B) равен пяти, что означает, что он имеет пять протонов и пять электронов.
Метод 2 из 2: определение количества электронов в положительном или отрицательном ионе
-

Откройте для себя заряд иона. Добавление и удаление электронов не изменяет идентичность элемента, но влияет на заряд атома, образуя ион, такой как K, Ca или N. Как правило, заряд иона отображается выше и справа от аббревиатуры названия элемента. ,
- Поскольку электроны имеют отрицательный заряд, атом нейтрализуется добавлением электронов.
- Когда вы удаляете электроны из атома, это считается положительным.
- N, например, имеет заряд -3, а Ca имеет заряд +2.
-

Вычтите заряд из атомного номера, если ион положительный. Если заряд положительный, это означает, что ион потерял электроны, поэтому протонов стало больше. Чтобы узнать, сколько электронов осталось, вычтите заряд из атомного номера элемента.
- Ca, например, имеет заряд +2, поэтому у него на два электрона меньше, чем у нейтрального атома кальция. Атомный номер кальция 20, поэтому у положительного иона 18 электронов.
-

Добавьте заряд и атомный номер, если ион отрицательный. Если заряд иона отрицательный, это означает, что он приобрел электроны, в результате чего количество протонов стало меньше. Чтобы найти полное количество электронов, присутствующих в ионе, добавьте заряд к атомному номеру.
- N, например, имеет заряд -3, что означает, что у него на три электрона больше, чем у нейтрального атома азота. Атомный номер азота равен семи, поэтому положительный ион имеет десять электронов.
