S (сера) – элемент с прядковым номером 16 в периодической системе.
Находится в III периоде. Температура плавления: 113 ℃. Плотность: 2.06 г/см3.
Электронная формула атома серы:
1s2 2s2 2p6 3s2 3p4
Сокращенная электронная конфигурация S:
[Ne] 3s2 3p4
Ниже приведена электронно-графическая схема атома серы
Распределение электронов по энергетическим уровням в атоме S
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 6
Валентные электроны серы
Количество валентных электронов в атоме серы – 6.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 3 | 0 | 0 | +1/2 |
| s | 3 | 0 | 0 | -1/2 |
| p | 3 | 1 | -1 | +1/2 |
| p | 3 | 1 | 0 | +1/2 |
| p | 3 | 1 | 1 | +1/2 |
| p | 3 | 1 | -1 | -1/2 |
Степени окисления, которые может проявлять сера: -2, -1, +1, +2, +3, +4, +5, +6
Сера в таблице менделеева занимает 16 место, в 3 периоде.
| Символ | S |
| Номер | 16 |
| Атомный вес | 32.0590000 |
| Латинское название | Sulfur, Sulphur |
| Русское название | Сера |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема серы
S: 1s2 2s2 2p6 3s2 3p4
Короткая запись:
S: [Ne]3s2 3p4
Одинаковую электронную конфигурацию имеют
атом серы и
Si-2, P-1, Cl+1
Порядок заполнения оболочек атома серы (S) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Сера имеет 16 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
4 электрона на 3p-подуровне
Степень окисления серы
Атомы серы в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы серы
Валентность S
Атомы серы в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность серы характеризует способность атома S к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа S
Квантовые числа определяются последним электроном в конфигурации,
для атома S эти числа имеют значение N = 3, L = 1, Ml = 2, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации S:
Eo = 1000 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где S в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
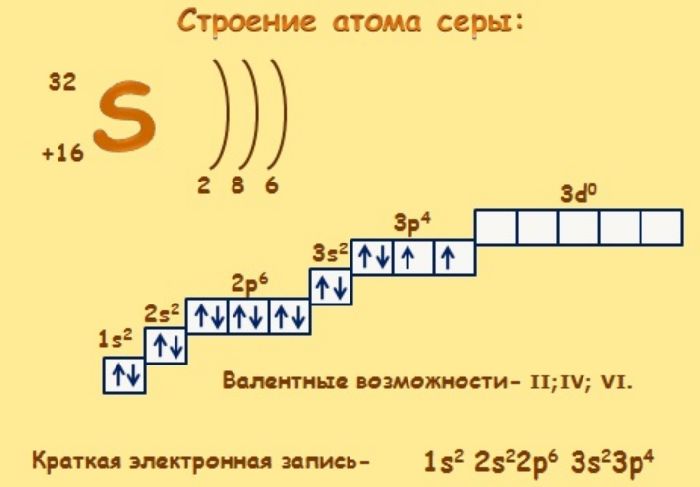
Электронное строение атома серы
Электронное строение нейтрального атома серы в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме серы.
S
+16
2
8
6
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме серы.
| 3 | ↑↓ | ↑↓ | ↑ | ↑ | ||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома серы выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома серы.
16S 1s2 2s2 2p6 3s2 3p4
Сокращённая электронная конфигурация атома серы.
16S [Ne] 3s2 3p4
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома серы.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3s | 3 | 0 | 0 | +½ |
| -½ | ||||
| 3p | 3 | 1 | -1 | +½ |
| -½ | ||||
| 1 | +½ | |||
| 2 | +½ |
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,653 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,904 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
Строение атома серы

4.6
Средняя оценка: 4.6
Всего получено оценок: 272.
4.6
Средняя оценка: 4.6
Всего получено оценок: 272.
Сера (S) – неметалл, относящийся к группе халькогенов. Строение атома серы легко определить, обратившись к периодической таблице Менделеева.
Строение
Сера в периодической таблице находится под 16 номером в третьем периоде, VI группе. Относительная атомная масса элемента – 32.
Природная сера имеет несколько изотопов:
- 32S;
- 33S;
- 34S;
- 36S.
Кроме этого, искусственно получено 20 радиоактивных изотопов.
Сера – элемент р-семейства. Атом серы включает ядро с положительным зарядом +16 (16 протонов, 16 нейронов) и 16 электронов, расположенных на трёх электронных оболочках. На внешнем энергетическом уровне находится 6 электронов, которые определяют валентность элемента. До завершения внешнего р-уровня не хватает двух электронов, что определяет степень окисления серы как -2.
Атом серы может переходить в возбуждённое состояние за счёт вакантных 3d-орбиталей (всего пять d-орбиталей). Поэтому атом может проявлять степень окисления +4 и +6.
Отрицательную степень окисления сера проявляет в составе солей – Al2S3, SiS2, Na2S. Четвёртая степень окисления проявляется в реакциях с галогенами (SCl4, SBr4, SF4) и при взаимодействии с кислородом (SO2). Наивысшая степень окисления (+6) проявляется с наиболее электроотрицательными элементами – H2SO4, SF6, SO3.
Электронное строение атома серы – 1s22s22p63s23p4 или +16 S)2)8)6.
Физические свойства
Сера – кристаллическое соединение, которое при нагревании приобретает пластичную форму. Цвет неметалла варьирует от ярко-жёлтого до коричневого. Модификации серы зависят от количества атомов серы в молекуле.
Сера – слабый проводник тепла и электрического тока. Не взаимодействует с водой, но хорошо растворяется в органических растворителях – феноле, бензоле, аммиаке, сероуглероде.
В природе сера встречается в виде самородков и в составе руд, минералов, горных пород. Сера находится в сульфидах, сульфатах, каменном угле, нефти, газе. Серу накапливают бактерии, перерабатывающие сероводород.
Химические свойства
Сера – активный элемент, реагирующий при нагревании практически со всеми элементами, кроме инертных газов и N2, I2, Au, Pt. Сера не взаимодействует с соляной кислотой. Основные реакции серы с элементами описаны в таблице.
|
Взаимодействие |
Продукты реакции |
Пример |
|
С металлами |
Сульфиды |
Cu + S → CuS |
|
С кислородом при 280°С |
Оксид серы |
– S + O2 → SO2; – 2S + 3O2 → 2SO3 |
|
С водородом при нагревании |
Сероводород |
H2 + S → H2S |
|
С фосфором при нагревании в отсутствии воздуха |
Сульфид фосфора |
2P + 3S → P2S3 |
|
С фтором |
Фторид серы |
S + 3F2 → SF6 |
|
С углеродом |
Сероуглерод |
2S + C → CS2 |
|
С кислотами |
Кислота |
S + 2HNO3 → 2NO + H2SO4 |
|
Со щёлочью |
Сульфиды и сульфиты |
3S + 6KOH → K2SO3 + 2K2S + 3H2O |
Сера входит в состав белков. Большое количество серы накапливается в волосах.
Что мы узнали?
Сера – кристаллический неметалл жёлтого цвета. Схема строения атома – +16 S)2)8)6. Проявляет три степени окисления: -2, +4, +6. Известно 24 изотопа серы. Это активный элемент, вступающий в реакцию с металлами и неметаллами. Образует соли – сульфиты и сульфиды, а также серную кислоту. Сера нерастворима в воде и соляной кислоте. Входит в состав живых организмов. В природе находится в свободном и связанном виде.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Александр Котков
5/5
-
Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 272.
А какая ваша оценка?