U (уран) – элемент с прядковым номером 92 в периодической системе.
Находится в VII периоде. Температура плавления: 1132.4 ℃. Плотность: 18.97 г/см3.
Порядок заполнения орбиталей электронами в атоме U является исключением из правила Клечковского.
Ожидаемая электронная формула
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f4
Но в реальности происходит проскок одного электрона с орбитали 5f пред-пред-внешнего слоя
на орбиталь 6d пред-внешнего слоя:
Электронная формула атома урана в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f3 6d1
Электронная формула атома урана в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6p6 6d1 7s2
Сокращенная электронная конфигурация U:
[Rn] 5f3 6d1 7s2
Ниже приведена электронно-графическая схема атома урана

Распределение электронов по энергетическим уровням в атоме U
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 18
4-й уровень (N): 32
5-й уровень (O): 21
6-й уровень (P): 9
7-й уровень (Q): 2

Степени окисления, которые может проявлять уран: +3, +4, +5, +6
Уран в таблице менделеева занимает 92 место, в 9 периоде.
| Символ | U |
| Номер | 92 |
| Атомный вес | 238.0289100 |
| Латинское название | Uranium |
| Русское название | Уран |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема урана
U: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f3 6d1
Короткая запись:
U: [Xe]6s2 4f14 5d10 6p6 7s2 5f3 6d1
Одинаковую электронную конфигурацию имеют
атом урана и
Pu+2, Am+3, Cm+4
Порядок заполнения оболочек атома урана (U) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Уран имеет 92 электрона,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
10 электронов на 3d-подуровне
6 электронов на 4p-подуровне
2 электрона на 5s-подуровне
10 электронов на 4d-подуровне
6 электронов на 5p-подуровне
2 электрона на 6s-подуровне
14 электронов на 4f-подуровне
10 электронов на 5d-подуровне
6 электронов на 6p-подуровне
2 электрона на 7s-подуровне
3 электрона на 5f-подуровне
1 электрон на 6d-подуровне
Степень окисления урана
Атомы урана в соединениях имеют степени окисления 6, 5, 4, 3, 2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы урана
Валентность U
Атомы урана в соединениях проявляют валентность VI, V, IV, III, II.
Валентность урана характеризует способность атома U к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа U
Квантовые числа определяются последним электроном в конфигурации,
для атома U эти числа имеют значение N = 6, L = 2, Ml = -2, Ms = +½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации U:
Eo = 598 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где U в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме урана.
U
+92
2
8
18
32
21
9
2
Распределение электронов по атомным орбиталям в атоме урана.
| 7 | ↑↓ | |||||||||||||||||||
| 6 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | |||||||||||||||
| 5 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ||||||||
| 4 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | |||||||||||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||||||||||
| 1 | ↑↓ | |||||||||||||||||||
| s | p | d | f |
Валентные орбитали атома урана выделены фиолетовым цветом.
Полная электронная конфигурация атома урана.
92U 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d10 5f3 6s2 6p6 6d1 7s2
Сокращённая электронная конфигурация атома урана.
92U [Rn] 5f3 6d1 7s2
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,651 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,896 -
разное
16,900
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
У этого термина существуют и другие значения, см. Уран.
| Уран | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ← Протактиний | Нептуний → | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| Внешний вид простого вещества | |||||||||||||||||||||||||||||||||||||||||||||||||

Образец урана |
|||||||||||||||||||||||||||||||||||||||||||||||||
| Свойства атома | |||||||||||||||||||||||||||||||||||||||||||||||||
| Название, символ, номер | Уран / Uranium (U), 92 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Группа, период, блок |
3, 7, f-элемент |
||||||||||||||||||||||||||||||||||||||||||||||||
| Атомная масса (молярная масса) |
238,02891(3)[1] а. е. м. (г/моль) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электронная конфигурация | [Rn] 5f36d17s2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус атома | 138 пм | ||||||||||||||||||||||||||||||||||||||||||||||||
| Химические свойства | |||||||||||||||||||||||||||||||||||||||||||||||||
| Ковалентный радиус | 196 пм | ||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус Ван-дер-Ваальса | 186 пм | ||||||||||||||||||||||||||||||||||||||||||||||||
| Радиус иона | (+6e) 80 (+4e) 97 пм | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электроотрицательность | 1,38 (шкала Полинга) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Электродный потенциал |
U←U4+ −1,38 В U←U3+ −1,66 В U←U2+ −0,1 В |
||||||||||||||||||||||||||||||||||||||||||||||||
| Степени окисления | +2, +3, +4, +5, +6[2] | ||||||||||||||||||||||||||||||||||||||||||||||||
| Энергия ионизации (первый электрон) |
686,4(7,11) кДж/моль (эВ) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Термодинамические свойства простого вещества | |||||||||||||||||||||||||||||||||||||||||||||||||
| Плотность (при н. у.) | 19,05 г/см³ | ||||||||||||||||||||||||||||||||||||||||||||||||
| Температура плавления | 1405,5 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Температура кипения | 4404,2 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Уд. теплота плавления | 12,6 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| Уд. теплота испарения | 417 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| Молярная теплоёмкость | 27,67[2] Дж/(K·моль) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Молярный объём | 12,5 см³/моль | ||||||||||||||||||||||||||||||||||||||||||||||||
| Кристаллическая решётка простого вещества | |||||||||||||||||||||||||||||||||||||||||||||||||
| Структура решётки | Орторомбическая | ||||||||||||||||||||||||||||||||||||||||||||||||
| Параметры решётки |
a = 2,854 Å; b = 5,870 Å; c = 4,955 Å[3] |
||||||||||||||||||||||||||||||||||||||||||||||||
| Прочие характеристики | |||||||||||||||||||||||||||||||||||||||||||||||||
| Теплопроводность | (300 K) 27,5 Вт/(м·К) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Скорость звука | 3155 м/с | ||||||||||||||||||||||||||||||||||||||||||||||||
| Номер CAS | 7440-61-1 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Эмиссионный спектр | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| Наиболее долгоживущие изотопы | |||||||||||||||||||||||||||||||||||||||||||||||||
|
Основная статья: Изотопы урана
|
Ура́н (U, лат. Uranium; устар. название — ура́ний[4]) — химический элемент 3-й группы (по устаревшей классификации — побочной подгруппы третьей группы, IIIB) седьмого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 92.
Относится к семейству актиноидов.
Простое вещество уран — слаборадиоактивный металл серебристо-белого цвета.
Уран не имеет стабильных изотопов. Самыми распространёнными изотопами урана являются уран-238 (имеет 146 нейтронов, в природном уране составляет 99,2742 %) и уран-235 (143 нейтрона, содержание в природном уране 0,7204 %[5]).
История[править | править код]
Ещё в древнейшие времена природная окись урана использовалась для изготовления жёлтой посуды. Так, возле Неаполя найден осколок жёлтого стекла, содержащий 1 % оксида урана и датируемый 79 годом н. э.[6] Первая важная дата в истории урана — 1789 год, когда немецкий натурфилософ и химик Мартин Генрих Клапрот восстановил извлечённую из саксонской руды настурана золотисто-жёлтую «землю» до чёрного металлоподобного вещества. В честь самой далёкой из известных тогда планет (открытой Гершелем восемью годами раньше) Клапрот, считая новое вещество элементом, назвал его ураном (этим он хотел поддержать предложение Иоганна Боде назвать новую планету «Уран» вместо «Звезда Георга», как предложил Гершель). Пятьдесят лет уран Клапрота числился металлом. Только в 1841 году французский химик Эжен Пелиго (1811—1890) доказал, что, несмотря на характерный металлический блеск, уран Клапрота не элемент, а оксид UO2. В 1840 году Пелиго удалось получить простое вещество уран — тяжёлый металл серо-стального цвета — и определить его атомный вес. Следующий важный шаг в изучении урана сделал в 1874 году Д. И. Менделеев. Опираясь на разработанную им периодическую систему, он поместил уран в самой дальней клетке своей таблицы. Прежде атомный вес урана считали равным 120. Менделеев удвоил это значение. Через 12 лет его предвидение было подтверждено опытами немецкого химика Циммермана (J. Zimmermann)[7].
В 1804 году немецкий химик Адольф Гелен открыл светочувствительность раствора хлорида уранила в эфире[8]; это свойство французский изобретатель Абель Ньепс де Сен-Виктор в 1857 году пытался использовать в фотографии, однако обнаружил, что соли урана испускают некое невидимое излучение, экспонирующее светочувствительные материалы; на тот момент это наблюдение осталось незамеченным.
В 1896 году, исследуя уран, французский учёный Антуан Анри Беккерель случайно открыл радиоактивный распад. В это же время французскому химику Анри Муассану удалось разработать способ получения чистого металлического урана. В 1899 году Эрнест Резерфорд обнаружил, что излучение урановых препаратов неоднородно, что есть два вида излучения — альфа- и бета-лучи. Они несут различный электрический заряд; далеко не одинаковы их пробег в веществе и ионизирующая способность. В мае 1900 года, Поль Вийяр открыл третий вид излучения — гамма-лучи.
Резерфорд провёл в 1907 году первые опыты по определению возраста минералов при изучении радиоактивных урана и тория на основе созданной им совместно с Фредериком Содди теории радиоактивности.
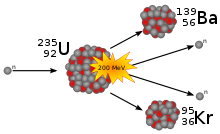
В 1938 году немецкие физики Отто Ган и Фриц Штрассман открыли непредсказанное явление, происходящее с ядром урана при облучении его нейтронами. Захватывая свободный нейтрон, ядро изотопа урана 235U делится, при этом выделяется (в расчёте на одно ядро урана) достаточно большая энергия, в основном в виде кинетической энергии осколков и излучения. Позднее теория этого явления была обоснована Лизой Мейтнер и Отто Фришем и независимо от них Готтфридом фон Дросте и Зигфридом Флюгге[9]. Данное открытие явилось истоком как мирного, так и военного использования внутриатомной энергии.
В 1939—1940 годах Ю. Б. Харитон и Я. Б. Зельдович впервые теоретически показали, что при небольшом обогащении природного урана ураном-235 можно создать условия для непрерывного деления атомных ядер, то есть придать процессу цепной характер.
2 декабря 1942 года в США была экспериментально доказана гипотеза о возможности процесса превращения урана в плутоний.
Физические свойства[править | править код]
Полная электронная конфигурация атома урана: 1s22s22p63s23p64s23d104p65s24d105p66s24f145d106p65f36d17s2.
Уран — очень тяжёлый, слабо радиоактивный глянцевитый металл серебристо-белого цвета. В чистом виде он немного мягче стали, ковкий, гибкий, обладает небольшими парамагнитными свойствами. Температура плавления 1132,3 °C[10][11].
Уран имеет три кристаллические модификации:
- α-U (стабильна до 667,7 °C), ромбическая сингония, пространственная группа C mcm, параметры ячейки a = 0,2858 нм, b = 0,5877 нм, c = 0,4955 нм, Z = 4;
- β-U (стабильна от 667,7 °C до 774,8 °C), тетрагональная сингония, пространственная группа P 42/mnm, параметры ячейки a = 1,0759 нм, c = 0,5656 нм, Z = 30;
- γ-U (существует от 774,8 °C до точки плавления при 1132,2 °C), кубическая сингония (объёмно-центрированная решётка), пространственная группа I m3m, параметры ячейки a = 0,3524 нм, Z = 2.
Химические свойства[править | править код]
Уран как химический элемент имеет следующие свойства[12][13]:
Характерные степени окисления[править | править код]
Уран может проявлять в водных растворах степени окисления от +3 до +6, вне контакта с водой наблюдается также степень окисления +2[2]. Наиболее характерны степени окисления +4 и +6.
| Степень окисления | Оксид | Гидроксид | Характер | Форма | Примечание |
|---|---|---|---|---|---|
| +3 | Не существует | Не существует | — | U3+, UH3 | Сильный восстановитель, вытесняет водород из воды[2] |
| +4 | UO2 | Не существует | Основный | UO2, галогениды | |
| +5 | Не существует | Не существует | — | Галогениды | В воде диспропорционирует |
| +6 | UO3 | UO2(OH)2 | Амфотерный | UO22+ (уранил) UO42− (уранат) U2O72− (диуранат) |
Устойчив на воздухе и в воде |
Кроме того, существует оксид U3O8. Степень окисления в нём формально дробная, а реально он представляет собой смешанный оксид урана(IV) и (VI).
Нетрудно видеть, что по набору степеней окисления и характерных соединений уран близок к элементам 4-й (VIB) подгруппы (хрому, молибдену, вольфраму). Из-за этого его длительное время относили к этой подгруппе («размывание периодичности»).
Свойства простого вещества[править | править код]
Химически уран весьма активен. Он быстро окисляется на воздухе и покрывается радужной плёнкой оксида. Мелкий порошок урана пирофорен — самовоспламеняется на воздухе, он загорается при температуре 150—175 °C, образуя U3O8. Реакции металлического урана с другими неметаллами приведены в таблице.
| Неметалл | Условия | Продукт |
|---|---|---|
| F2 | +20 °C, бурно | UF6 |
| Cl2 | 180 °C для измельчённого, 500—600 °C для компактного |
Смесь UCl4, UCl5, UCl6 |
| Br2 | 650 °C, спокойно | UBr4 |
| I2 | 350 °C, спокойно | UI3, UI4 |
| S | 250—300 °C спокойно 500 °C горит |
US2, U2S3 |
| Se | 250—300 °C спокойно 500 °C горит |
USe2, U2Se3 |
| N2 | 450—700 °C то же под давлением N 1300 °C |
U4N7 UN2 UN |
| P | 600—1000 °C | U3P4 |
| C | 800—1200 °C | UC, UC2 |
Взаимодействует с водой, вытесняя водород, медленно при низкой температуре, и быстро при высокой, а также при мелком измельчении порошка урана:
В кислотах-неокислителях уран растворяется, образуя UO2 или соли U4+ (при этом выделяется водород). С кислотами-окислителями (азотной, концентрированной серной) уран образует соответствующие соли уранила UO22+.
С растворами щелочей уран не взаимодействует.
При сильном встряхивании металлические частицы урана начинают светиться.
Соединения урана(III)[править | править код]
Соли урана(III) (преимущественно галогениды) — восстановители. На воздухе при комнатной температуре они обычно устойчивы, однако при нагревании окисляются до смеси продуктов. Хлор окисляет их до UCl4. Образуют неустойчивые растворы красного цвета, в которых проявляют сильные восстановительные свойства:
Галогениды урана(III) образуются при восстановлении галогенидов урана(IV) водородом:
-
(550—590 °C)
или иодоводородом:
-
(500 °C)
а также при действии галогеноводорода на гидрид урана UH3.
Кроме того, существует гидрид урана(III) UH3. Его можно получить, нагревая порошок урана в водороде при температурах до 225 °C, а выше 350 °C он разлагается. Бо́льшую часть его реакций (например, реакцию с парами воды и кислотами) можно формально рассматривать как реакцию разложения с последующей реакцией металлического урана:
Соединения урана(IV)[править | править код]
Уран(IV) образует легко растворимые в воде соли зелёного цвета (исключение составляют оксалаты и карбонаты). Они легко окисляются до урана(VI).
Соединения урана(V)[править | править код]
Соединения урана(V) неустойчивы и легко диспропорционируют в водном растворе:
Хлорид урана V при стоянии частично диспропорционирует:
а частично отщепляет хлор:
Соединения урана(VI)[править | править код]
Степени окисления +6 соответствует оксид UO3. В кислотах он растворяется с образованием соединений катиона уранила UO22+:
C основаниями UO3 (аналогично CrO3, MoO3 и WO3) образует различные уранат-анионы (в первую очередь, диуранат U2O72-). Последние, однако, чаще получают действием оснований на соли уранила:
Из соединений урана(VI), не содержащих кислород, известны только гексахлорид UCl6 и фторид UF6. Последний играет важнейшую роль в разделении изотопов урана.
На воздухе и в водных растворах наиболее устойчивы среди соединений урана именно соединения урана(VI).
Ураниловые соли, такие, как уранилхлорид, распадаются на ярком свету или в присутствии органических соединений.
Уран также образует ураноорганические соединения.
Изотопы[править | править код]
Радиоактивные свойства некоторых изотопов урана (жирным выделены природные изотопы)[14]:
| Массовое число | Период полураспада | Основной тип распада |
|---|---|---|
| 233 | 1,59⋅105 лет | α |
| 234 | 2,45⋅105 лет | α |
| 235 | 7,13⋅108 лет | α |
| 236 | 2,39⋅107 лет | α |
| 237 | 6,75 сут. | β− |
| 238 | 4,47⋅109 лет | α |
| 239 | 23,54 минуты | β− |
| 240 | 14 часов | β− |
Природный уран состоит из смеси трёх изотопов: 238U (изотопная распространённость 99,2745 %, период полураспада T1/2 = 4,468⋅109 лет), 235U (0,7200 %, T1/2 = 7,04⋅108 лет) и 234U (0,0055 %, T1/2 = 2,455⋅105 лет)[14]. Последний изотоп является не первичным, а радиогенным, он входит в состав радиоактивного ряда 238U[15].
Радиоактивность природного урана обусловлена в основном изотопами 238U и его дочерним нуклидом 234U. В равновесии их удельные активности равны. Удельная активность изотопа 235U в природном уране в 21 раз меньше активности 238U.
На данный момент известно 25 искусственных радиоактивных изотопов урана с массовыми числами от 214 до 242. Наиболее важный из них — 233U (T1/2 = 1,59⋅105лет), он получается при облучении тория-232 нейтронами и способен к делению под воздействием тепловых нейтронов, что делает его перспективным топливом для ядерных реакторов. Наиболее долгоживущим из изотопов урана, не встречающихся в природе, является 236U с периодом полураспада 2,39⋅107 лет.
Изотопы урана 238U и 235U являются родоначальниками двух радиоактивных рядов. Конечными элементами этих рядов являются изотопы свинца 206Pb и 207Pb.
В природных условиях распространены в основном изотопы 234U, 235U и 238U с относительным содержанием 234U : 235U : 238U = 0,0054 : 0,711 : 99,283. Почти половина радиоактивности природного урана обусловлена изотопом 234U, который, как уже отмечено, образуется в ходе распада 238U. Для отношения содержаний 235U : 238U, в отличие от других пар изотопов и независимо от высокой миграционной способности урана, характерно географическое постоянство: 238U/235U = 137,88. Величина этого отношения в природных образованиях не зависит от их возраста. Многочисленные натурные измерения показали его незначительные колебания. Так, в роллах величина этого отношения относительно эталона изменяется в пределах 0,9959—1,0042[16], в солях — 0,996—1,005[17]. В урансодержащих минералах (настуран, урановая чернь, циртолит, редкоземельные руды) величина этого отношения колеблется в пределах 137,30—138,51, причём различие между формами UIV и UVI не установлено[18]; в сфене — 138,4[19]. В отдельных метеоритах выявлен недостаток изотопа 235U. Наименьшая его концентрация в земных условиях найдена в 1972 году французским исследователем Бужигесом в местечке Окло в Африке (месторождение в Габоне). Так, в природном уране содержится 0,720 % урана 235U, а в Окло оно составляет 0,557 %[20]. Это послужило подтверждением гипотезы о существовании природного ядерного реактора, который стал причиной выгорания изотопа 235U. Гипотеза была высказана американскими учёными Джорджем Ветрилломruen, Марком Ингрэмомruen и Полом Курода, ещё в 1956 г. описавшим процесс[21]. Кроме этого, в этих же округах найдены природные ядерные реакторы: Окелобондо, Бангомбе (Bangombe) и другие. В настоящее время известно 17 природных ядерных реакторов, которые обычно объединяют под общим названием «Природный ядерный реактор в Окло».
Нахождение в природе[править | править код]

Уран является элементом с самым большим номером из встречающихся в природе в весовых количествах[22]. Содержание в земной коре составляет 0,00027 % (вес.), концентрация в морской воде — 3,2 мкг/л[5] (по другим данным, 3,3·10-7%[23]). Количество урана в литосфере оценивается в 3 или 4·10−4%[24].
Основная масса урана находится в кислых породах с высоким содержанием кремния. Значительная масса урана сконцентрирована в осадочных породах, особенно богатых органикой. В больших количествах как примесь уран присутствует в ториевых и редкоземельных минералах (алланит (Ca,LREE,Th)2(Al,Fe+3)3[SiO4][Si2O7]OOH, монацит (La,Ce)PO4, циркон ZrSiO4, ксенотим YPO4 и др.). Важнейшими урановыми рудами являются настуран (урановая смолка, уранинит) и карнотит. Основными минералами-спутниками минералов урана являются молибденит MoS2, галенит PbS, кварц SiO2, кальцит CaCO3, гидромусковит и др.
| Минерал | Основной состав минерала | Содержание урана, % |
|---|---|---|
| Уранинит | UO2, UO3 + ThO2, CeO2 | 65-74 |
| Карнотит | K2(UO2)2(VO4)2·2H2O | ~50 |
| Казолит | PbO2·UO3·SiO2·H2O | ~40 |
| Самарскит | (Y, Er, Ce, U, Ca, Fe, Pb, Th)·(Nb, Ta, Ti, Sn)2O6 | 3,15-14 |
| Браннерит | (U, Ca, Fe, Y, Th)3Ti5O15 | 40 |
| Тюямунит | CaO·2UO3·V2O5·nH2O | 50-60 |
| Цейнерит | Cu(UO2)2(AsO4)2·nH2O | 50-53 |
| Отенит | Ca(UO2)2(PO4)2·nH2O | ~50 |
| Шрекингерит | Ca3NaUO2(CO3)3SO4(OH)·9H2O | 25 |
| Уранофан | CaO·UO2·2SiO2·6H2O | ~57 |
| Фергюсонит | (Y, Ce)(Fe, U)(Nb, Ta)O4 | 0,2-8 |
| Торбернит | Cu(UO2)2(PO4)2·nH2O | ~50 |
| Коффинит | U(SiO4)(OH)4 | ~50 |
Основными формами нахождений урана в природе являются уранинит, настуран (урановая смолка) и урановые черни. Они отличаются только формами нахождения; имеется возрастная зависимость: уранинит присутствует преимущественно в древних (докембрийских) породах, настуран — вулканогенный и гидротермальный — преимущественно в палеозойских и более молодых высоко- и среднетемпературных образованиях; урановые черни — в основном в молодых — кайнозойских и моложе — образованиях преимущественно в низкотемпературных осадочных породах.
Месторождения[править | править код]
См. также раздел добыча урана ![]() .
.
Количество урана в земной коре примерно в 1000 раз превосходит количество золота, в 30 раз — серебра, при этом данный показатель приблизительно равен аналогичному показателю у свинца и цинка. Немалая часть урана рассеяна в почвах, горных породах и морской воде. Только относительно небольшая часть концентрируется в месторождениях, где содержание данного элемента в сотни раз превышает его среднее содержание в земной коре[25]. По оценке 2015 года разведанные мировые запасы урана в месторождениях составляют более 5,7 млн тонн[26][27].
Крупнейшие запасы урана, с учётом резервных месторождений, имеют: Австралия, Казахстан (первое место в мире по добыче), Канада (второе место по добыче), Россия. По оценке 2015 года, в месторождениях России содержится около 507 800 тонн запасов урана (9 % его мировых запасов)[26][27]; около 63 % их сосредоточено в Республике Саха (Якутия). Основными месторождениями урана в России являются: Стрельцовское, Октябрьское, Антей, Мало-Тулукуевское, Аргунское молибден-урановые в вулканитах (Забайкальский край), Далматовское урановое в песчаниках (Курганская область), Хиагдинское урановое в песчаниках (Республика Бурятия), Южное золото-урановое в метасоматитах и Северное урановое в метасоматитах (Республика Якутия)[28]. Кроме того, выявлено и оценено множество более мелких урановых месторождений и рудопроявлений[29].
| № | Название месторождения | Страна | Запасы, т | Оператор месторождения | начало разработки |
|---|---|---|---|---|---|
| 1 | Северный Хорасан | 200 000 | Казатомпром | 2008 | |
| 2 | Мак-Артур-Ривер | 160 000 | Cameco | 1999 | |
| 3 | Сигар-Лейк | 135 000 | Cameco | ||
| 4 | Южное Эльконское | 112 600 | Атомредметзолото | ||
| 5 | Инкай | 75 900 | Казатомпром | 2007 | |
| 6 | Стрельцовское | 50 000 | Атомредметзолото | ||
| 7 | Зоовч Овоо | 50 000 | AREVA | ||
| 8 | Моинкум | 43 700 | Казатомпром, AREVA | ||
| 9 | Мардай | 22 000 | Khan Resources, Атомредметзолото, Правительство Монголии | ||
| 10 | Ирколь | 18 900 | Казатомпром, China Guangdong Nuclear Power Co | 2009 | |
| 11 | Жёлтые Воды | 12 000 | ВостГок | 1959 | |
| 12 | Олимпик-Дэм | 1988 | |||
| 13 | Россинг | 1976 | |||
| 13 | Доминион | 2007 | |||
| 13 | Рейнджер | 1980 |
Получение[править | править код]
Самая первая стадия уранового производства — концентрирование. Породу дробят и смешивают с водой. Тяжёлые компоненты взвеси осаждаются быстрее. Если порода содержит первичные минералы урана, то они осаждаются быстро: это тяжёлые минералы. Вторичные минералы урана легче, в этом случае раньше оседает тяжёлая пустая порода. (Впрочем, далеко не всегда она действительно пустая; в ней могут быть многие полезные элементы, в том числе и уран).
Следующая стадия — выщелачивание концентратов, перевод урана в раствор. Применяют кислотное и щелочное выщелачивание. Первое — дешевле, поскольку для извлечения урана используют серную кислоту. Но если в исходном сырьё, как, например, в урановой смолке, уран находится в четырёхвалентном состоянии, то этот способ неприменим: четырёхвалентный уран в серной кислоте практически не растворяется. В этом случае нужно либо прибегнуть к щелочному выщелачиванию, либо предварительно окислять уран до шестивалентного состояния.
Не применяют кислотное выщелачивание и в тех случаях, если урановый концентрат содержит доломит или магнезит, реагирующие с серной кислотой. В этих случаях пользуются едким натром (гидроксидом натрия).
Проблему выщелачивания урана из руд решает кислородная продувка. В нагретую до 150 °C смесь урановой руды с сульфидными минералами подают поток кислорода. При этом из сернистых минералов образуется серная кислота, которая и вымывает уран.
На следующем этапе из полученного раствора нужно избирательно выделить уран. Современные методы — экстракция и ионный обмен — позволяют решить эту проблему.
Раствор содержит не только уран, но и другие катионы. Некоторые из них в определённых условиях ведут себя так же, как уран: экстрагируются теми же органическими растворителями, оседают на тех же ионообменных смолах, выпадают в осадок при тех же условиях. Поэтому для селективного выделения урана приходится использовать многие окислительно-восстановительные реакции, чтобы на каждой стадии избавляться от того или иного нежелательного попутчика. На современных ионообменных смолах уран выделяется весьма селективно.
Методы ионного обмена и экстракции хороши ещё и тем, что позволяют достаточно полно извлекать уран из бедных растворов (содержание урана — десятые доли грамма на литр).
После этих операций уран переводят в твёрдое состояние — в один из оксидов или в тетрафторид UF4. Но этот уран ещё надо очистить от примесей с большим сечением захвата тепловых нейтронов — бора, кадмия, гафния. Их содержание в конечном продукте не должно превышать стотысячных и миллионных долей процента. Для удаления этих примесей технически чистое соединение урана растворяют в азотной кислоте. При этом образуется уранилнитрат UO2(NO3)2, который при экстракции трибутил-фосфатом и некоторыми другими веществами дополнительно очищается до нужных кондиций. Затем это вещество кристаллизуют (или осаждают пероксид UO4·2H2O) и начинают осторожно прокаливать. В результате этой операции образуется трёхокись урана UO3, которую восстанавливают водородом до UO2.
На диоксид урана UO2 при температуре от 430 до 600 °C воздействуют газообразным фтористым водородом для получения тетрафторида UF4[30]. Из этого соединения восстанавливают металлический уран с помощью кальция или магния.
Применение[править | править код]
Ядерное топливо[править | править код]
Наибольшее применение имеет изотоп урана 235U, в котором возможна самоподдерживающаяся цепная ядерная реакция деления ядра тепловыми нейтронами. Поэтому этот изотоп используется как топливо в ядерных реакторах, а также в ядерном оружии. Выделение изотопа 235U из природного урана — сложная технологическая проблема (см. разделение изотопов).
Приведём некоторые цифры для реактора мощностью 1000 МВт, работающего с нагрузкой в 80 % и вырабатывающего 7000 ГВт·ч в год. Работа одного такого реактора в течение года требует 20 тонн уранового топлива с содержанием 3,5 % 235U, который получают после обогащения примерно 153 тонн природного урана.
Изотоп 238U способен делиться под влиянием бомбардировки высокоэнергетическими нейтронами, эту его особенность используют для увеличения мощности термоядерного оружия (используются нейтроны, порождённые термоядерной реакцией).
В результате захвата нейтрона с последующим β-распадом 238U может превращаться в 239Pu, который затем используется как ядерное топливо.
Уран-233, искусственно получаемый в реакторах из тория (торий-232 захватывает нейтрон и превращается в торий-233, который распадается в протактиний-233 и затем в уран-233), может в будущем стать распространённым ядерным топливом для атомных электростанций (уже сейчас существуют реакторы, использующие этот нуклид в качестве топлива, например, KAMINI в Индии) и производства атомных бомб (критическая масса около 16 кг).
Уран-233 также является наиболее перспективным топливом для газофазных ядерных ракетных двигателей.
Тепловыделяющая способность урана[править | править код]
Полное использование заключённой в уране потенциальной энергии пока технически невозможно. Величина выделившейся в ядерном реакторе полезной энергии урана характеризуется понятием глубины выгорания. Глубина выгорания — это суммарная энергия, отданная килограммом урана за все время работы в реакторе, от свежего топлива до утилизации. Измеряют глубину выгорания обычно в таких единицах как мегаватт-часы выделившейся тепловой энергии на килограмм топлива (МВт·час/кг). Иногда её приводят в пересчёте к реакторному урану того обогащения, которое загружается в реактор, не учитывая обеднённый уран в отвалах обогатительных производств, а иногда в пересчёте на природный уран.
Глубина выгорания ограничена особенностями конкретного типа реактора, конструктивной целостностью топливной матрицы и накоплением паразитных продуктов ядерных реакций. Глубина выгорания в пересчёте на природный уран в современных энергетических реакторах достигает 10 МВт·сутки/кг и более (то есть 240 МВт·час/кг и более). Для сравнения, типичное тепловыделение природного газа 0,013 МВт·час/кг, то есть примерно в 20 000 раз меньше.
Существуют проекты значительно более полного использования урана за счёт трансмутации урана-238 в плутоний. Наиболее проработанным является проект так называемого замкнутого топливного цикла на основе реакторов на быстрых нейтронах. Также развиваются проекты на основе гибридных термоядерных реакторов.
Производство искусственных изотопов[править | править код]
Изотопы урана являются исходным веществом для синтеза многих искусственных (нестабильных) изотопов, применяемых в промышленности и медицине. Наиболее известными искусственными изотопами, синтезируемыми из урана, являются изотопы плутония. Многие другие трансурановые элементы также получают из урана.
В медицине широкое применение нашёл изотоп молибден-99, одним из способов получения которого является выделение из продуктов деления урана, появляющихся в облучённом ядерном топливе.
Геология[править | править код]
Основное применение урана в геологии — определение возраста минералов и горных пород с целью выяснения последовательности протекания геологических процессов. Этим занимается раздел геохронологии, носящий название радиоизотопное датирование. Существенное значение имеет также решение задачи о смешении и источниках вещества.
В основе решения задачи лежат уравнения радиоактивного распада:
где 



Весьма важной является их комбинация:
-
.
Здесь
-
— современное отношение концентраций изотопов урана.
В связи с тем, что горные породы содержат различные концентрации урана, они обладают различной радиоактивностью. Это свойство используется при анализе горных пород геофизическими методами. Наиболее широко этот метод применяется в нефтяной геологии при геофизических исследованиях скважин, в этот комплекс входит, в частности, гамма-каротаж или нейтронный гамма-каротаж, гамма-гамма-каротаж и так далее[31]. С их помощью происходит выделение коллекторов и флюидоупоров[32].
Другие сферы применения[править | править код]
- Небольшая добавка урана придаёт красивую жёлто-зелёную флуоресценцию стеклу (см. Урановое стекло)[33].
- Уранат натрия Na2U2O7 использовался как жёлтый пигмент в живописи[33].
- Соединения урана применялись как краски для живописи по фарфору и для керамических глазурей и эмалей (окрашивают в цвета: жёлтый, бурый, зелёный и чёрный, в зависимости от степени окисления)[33].
- Некоторые соединения урана светочувствительны[33].
- В начале XX века уранилнитрат широко применялся для усиления негативов и окрашивания (тонирования) позитивов (фотографических отпечатков) в бурый цвет[33].
- Карбид урана-235 в сплаве с карбидом ниобия и карбидом циркония применяется в качестве топлива для ядерных реактивных двигателей (рабочее тело — водород + гексан).
- Сплавы железа и обеднённого урана (уран-238) применяются как мощные магнитострикционные материалы.
- Ацетат уранила UO2(CH3COO)2 и ацетат цинка-уранила Zn[(UO2)3(CH3COO)8] применяются в аналитической химии при проведении качественного и количественного анализа катионов лития и натрия.
Обеднённый уран[править | править код]
После извлечения 235U и 234U из природного урана, оставшийся материал (уран-238) носит название «обеднённый уран», так как он обеднён 235-м изотопом. По некоторым данным, в США хранится около 560 000 тонн обеднённого гексафторида урана (UF6). Обеднённый уран в два раза менее радиоактивен, чем природный уран, в основном за счёт удаления из него 234U.
Из-за того, что основное использование урана — производство энергии, обеднённый уран — малополезный продукт с низкой экономической ценностью.
Сколь-нибудь эффективным ядерным топливом обеднённый уран может служить только в редких экстремальных условиях, например, в пучке быстрых нейтронов. В таком качестве обеднённый уран используется в реакторах на быстрых нейтронах, в реакторах-размножителях, а также в термоядерном оружии — обеднённые урановые элементы в составе термоядерного заряда, не являясь необходимыми для, собственно, реакции ядерного синтеза, могут обеспечивать до 80 % суммарной энергии заряда.
В обычных же условиях использование обеднённого урана связано в основном с его большой плотностью и относительно низкой стоимостью. Обеднённый уран используется для радиационной защиты благодаря чрезвычайно высокому сечению захвата. Обеднённый уран применяется также в качестве балластной массы в аэрокосмических приложениях, таких как рулевые поверхности летательных аппаратов. В первых экземплярах самолёта «Боинг-747» содержалось от 300 до 500 кг обеднённого урана для этих целей (с 1981 года «Боинг» применяет вольфрам)[34]. Кроме того, этот материал применяется в высокоскоростных роторах гироскопов, больших маховиках, как балласт в космических спускаемых аппаратах и гоночных яхтах, болидах «Формулы-1», при бурении нефтяных скважин.
Сердечники бронебойных снарядов[править | править код]

Сердечник (вкладыш) снаряда калибра 30 мм (пушки GAU-8 самолёта A-10) диаметром около 20 мм из обеднённого урана
Самое известное применение обеднённого урана — в качестве сердечников для бронебойных снарядов. Большая плотность (в два с половиной раза тяжелее стали) делает закалённую урановую болванку чрезвычайно эффективным средством для пробивания брони, аналогичным по эффективности более дорогому и ненамного более тяжёлому вольфраму. Тяжёлый урановый наконечник также изменяет распределение масс в снаряде, улучшая его аэродинамическую устойчивость.
Подобные сплавы типа «Стабаллой[en]» применяются в стреловидных оперённых снарядах танковых и противотанковых артиллерийских орудий.
Процесс разрушения брони сопровождается измельчением в пыль урановой болванки и воспламенением её на воздухе с другой стороны брони (см. Пирофорность). Около 300 тонн обеднённого урана остались на поле боя во время операции «Буря в Пустыне» (по большей части это остатки снарядов 30-мм пушки GAU-8 штурмовых самолётов A-10, каждый снаряд содержит 272 г уранового сплава). Усовершенствованные американские танки M1A1, снабжённые 120-мм орудиями, сражались с иракскими Т-72. В этих боях американские силы применяли снаряды с обеднённым ураном M829A1, которые показали высокую эффективность. Снаряд, прозванный «серебряной пулей», был способен пробить эквивалент 570-мм брони с расстояния в 2000 метров, что делало его на стандартной дистанции эффективным даже против Т-80[35].
Такие снаряды были использованы войсками НАТО в боевых действиях на территории Косово[36]. После их применения обсуждалась экологическая проблема радиационного загрязнения территории страны.
В Советском Союзе также были разработаны и поставлены на вооружение бронебойные снаряды с сердечником из обеднённого урана (например, «Свинец»).
Обеднённый уран используется в современной танковой броне, например, танка M-1 «Абрамс».
По заявлению начальника войск радиационной, химической и биологической защиты РФ генерал-лейтенанта Игоря Кириллова, основным видом онкологических заболеваний лиц, пострадавших в результате применения боеприпасов с обеднённым ураном, является рак лёгких[37].
Физиологическое действие[править | править код]
В микроколичествах (10−5—10−8 %) обнаруживается в тканях растений, животных и человека. В наибольшей степени накапливается некоторыми грибами и водорослями. Соединения урана всасываются в желудочно-кишечном тракте (около 1 %), в лёгких — 50 %. Основные депо в организме: селезёнка, почки, скелет, печень, лёгкие и бронхо-лёгочные лимфатические узлы. Содержание в органах и тканях человека и животных не превышает 10−7 г.
Уран и его соединения токсичны. Особенно опасны аэрозоли урана и его соединений. Для аэрозолей растворимых в воде соединений урана ПДК в воздухе 0,015 мг/м³, для нерастворимых форм урана ПДК 0,075 мг/м³. При попадании в организм уран действует на все органы, являясь общеклеточным ядом. Уран, как и многие другие тяжёлые металлы, практически необратимо связывается с белками, прежде всего с сульфидными группами аминокислот, нарушая их функцию. Молекулярный механизм действия урана связан с его способностью подавлять активность ферментов. В первую очередь поражаются почки (появляются белок и сахар в моче, олигурия). При хронической интоксикации возможны нарушения кроветворения и нервной системы.
Химическая токсичность обеднённого урана в естественных условиях представляет примерно в миллион раз большую опасность, чем его радиоактивность.
Добыча урана[править | править код]

10 стран, дающих 94 % мировой добычи урана
Согласно «Красной книге по урану»[27], выпущенной ОЭСР, в 2005 г. добыто 41 250 тонн урана (в 2003 — 35 492 тонны). Согласно данным ОЭСР, в мире функционирует 440 реакторов коммерческого назначения и около 60 научных, которые потребляли в год 67 тысяч тонн урана. Это означает, что его добыча из месторождений обеспечивала лишь 60 % объёма его потребления (на 2009 год эта доля возросла до 79 %[38]). Остальной уран, потребляемый энергетикой, или 17,7 %, поступал из вторичных источников. На 2016—2017 год потребность в ядерном топливе, 449 действующих[комм. 1][39] реакторов составляла те же 65 000 тонн урана. Первичные источники обеспечили около 85 %, а вторичные источники 15 % (оружейный уран, запасы от переработки отработанного топлива, а также за счёт повторного обогащения хвостов (остатков от первоначального обогащения)[40].
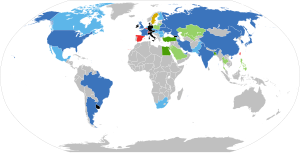
Страны с АЭС: Эксплуатируются АЭС, строятся новые энергоблоки. Эксплуатируются АЭС, планируется строительство новых энергоблоков. Нет АЭС, станции строятся. Нет АЭС, планируется строительство. Эксплуатируются АЭС, строительство новых пока не планируется. Эксплуатируются АЭС, рассматривается сокращение их количества. Гражданская ядерная энергетика запрещена законом. Нет АЭС.
Добыча по странам[править | править код]
Распределение добычи по странам (в тоннах) выглядит следующим образом[41]:
| № | Страна | 2005 год | Страна | 2009 год | Страна | 2012 год | Страна | 2015 год | Страна | 2017 год |
|---|---|---|---|---|---|---|---|---|---|---|
| 1 | 11 628 | 14 020 | 19 451 | 23 800 | 23 391 | |||||
| 2 | 9516 | 10 173 | 9145 | 13 325 | 13 116 | |||||
| 3 | 4020 | 7982 | 5983 | 5654 | 5882 | |||||
| 4 | 3570 | 4626 | 4351 | 4116 | 4224 | |||||
| 5 | 3147 | 3564 | 3258 | 2993 | 3449 | |||||
| 6 | 3093 | 3234 | 3000 | 3055 | 2917 | |||||
| 7 | 2300 | 2429 | 2993 | 2385 | 2404 | |||||
| 8 | 1039 | 1453 | 1537 | 1616 | 1885 | |||||
| 9 | 800 | 1200 | 1500 | 1256 | 940 | |||||
| 10 | 750 | 840 | 890 | 1200 | 550 | |||||
| 11 | Другие страны | 1387 | Другие страны | 1251 | Другие страны | 6385 | Другие страны | 904 | Другие страны | 704 |
| Итого | 41250 | 50772 | 58493 | 60304 | 59462 |
Добыча по компаниям[править | править код]
Распределение добычи по компаниям (в тоннах) выглядит следующим образом[41][42]:
| № | Страна | Компания | 2006 год | Страна | Компания | 2009 год | Страна | Компания | 2011 год | Страна | Компания | 2018 год |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1 | Cameco | 8100 (24 %) | Areva | 8600 ▲ (19 %) | Казатомпром | 8884 ▲ (19 %) | Казатомпром | 11074 ▲ (26 %) | ||||
| 2 | Rio Tinto | 7000 (21 %) | Cameco | 8000▼ (18 %) | Areva | 8790▲(19 %) | АРМЗ[комм. 2] | 7289▲ (16 %) | ||||
| 3 | Areva | 5000 (15 %) | Rio Tinto | 7900▲(18 %) | Cameco | 8630▲ (19 %) | Orano/Areva[комм. 3] | 5809▼ (13 %) | ||||
| 4 | Казатомпром | 3800 (11 %) | Казатомпром | 7500▲ (17 %) | АРМЗ[комм. 4] | 7088▲ (15 %) | Cameco | 4613▼ (11 %) | ||||
| 5 | АРМЗ | 3500 (10 %) | АРМЗ | 4600▲ (10 %) | Rio Tinto | 4061▼ (9 %) | CGN | 3185▲ (7 %) | ||||
| 6 | BHP Billiton | 3000 (9 %) | BHP Billiton | 2900▼ (6 %) | BHP Billiton | 3353▲(7 %) | BHP Billiton | 3159▼ (7 %) | ||||
| 7 | Навоийский ГМК | 2100 (4 %) | Навоийский ГМК | 2400▲ (5 %) | Навоийский ГМК | 3000▲ (6 %) | Rio Tinto | 2602▼ (6 %) | ||||
| 8 | Uranium One | 1000 (3 %) | Uranium One | 1400▲ (3 %) | Paladin Energy | 2282▲ (5 %) | Navoi | 2404▼ (5 %) | ||||
| 9 | Heathgate | 800 (2 %) | Paladin Energy | 1200▲ (3 %) | SOPamin | Н/Д▲(менее 1 %) | Energy Asia | 2204▲ (5 %) | ||||
| 10 | Denison Mines | 500 (1 %) | General Atomics | 600▲ (1 %) | CNNC | Н/Д▲ (менее 1 %) | CNNC | 1983▬ (4 %) | ||||
| Итого | 34 800 (100 %) | 45 100 (100 %) | более 46 088 (100 %) | 44 322 (100 %) |
В 2012 году появилась информация о возможном слиянии урановых подразделений BHP Billiton и Rio Tinto ![]()
![]() и доведения совместной добычи до 8000 тонн в год.
и доведения совместной добычи до 8000 тонн в год.
Уран из вторичных источников[править | править код]
Вторичными источниками традиционно считаются — запасы из ядерного оружия, от переработки отработанного топлива и повторного обогащения хвостов (остатков от первоначального обогащения). Повторное обогащение отвалов, критично (взаимно и неотъемлемо) для использования оружейного урана в мирных целях[45].
В конце июля 1991 года в Москве СССР и США подписали Договор СНВ-I.
Преемником СССР в декабре 1991 года стала Россия, но ядерное вооружение находилось и в других бывших республиках СССР.
На начало 1992 года на территории России размещалась 961 пусковая установка (73 % от общего количества).
23 мая 1992 года в Лиссабоне Россией, США, Украиной, Казахстаном и Белоруссией был подписан дополнительный протокол к СНВ-1 (Лиссабонский протокол), в соответствии с которым к договору СНВ-1 присоединились Украина, Казахстан и Белоруссия. Все имеющиеся на их территории боеголовки они обязались ликвидировать или передать России.
В конце 1992, Россия, в связи с нежеланием Украины выполнять Лиссабонский протокол, обязалась демонтировать почти половину своих запасов ядерного оружия (около 35 % от запасов СССР) и переработать высвободившийся оружейный уран в металл топливного сорта. США, в свою очередь, обязались приобрести этот материал по рыночным ценам[46].
К концу 1996 года на всём постсоветском пространстве Россия осталась единственной страной, входящей в ядерный клуб, а все запасы СССР были сосредоточены на eё территории для последующей переработки в соответствии с договором СНВ-1.
Вместе с тем, началось повторное обогащение урановых отвалов и переработка ОЯТ. План по переработке предусматривал начало работ с отвалов уровня месторождений III категории (рядовые) от 0,05 до 0,1 % аффинаж менее 60 %. Однако, в середине и конце 1990-х годов обогащающие предприятия начали повторно обогащать отвалы для производства разбавителя по соглашению ВОУ-НОУ, в связи с нестабильностью получаемого топлива из отвалов.[45].
Соглашение ВОУ-НОУ было рассчитано на 20 лет, закончило действовать в 2013 году. Всего, в рамках программы, из России в США было вывезено 14 446 тонн низкообогащённого урана:
- по договору СНВ-II 352 тонны — из оговорённых 500 (несмотря на то, что договор не вступил в силу, в связи с выходом России из договора 14 июня 2002);
- по договору СНВ-I (вступил в силу 5 декабря 1994 года, истёк 5 декабря 2009 года) с российской стороны 500 тонн;
- по договору СНВ-III (ДСНВ) — договор подписан 8 апреля 2010 года в Праге. Договор сменил истёкший в декабре 2009 года СНВ-I и действует до 2021 года.
Добыча в СССР[править | править код]
В СССР основными уранорудными регионами были Украинская ССР (месторождение Желтореченское, Первомайское и другие), Казахская ССР (Северный — Балкашинское рудное поле и другие; Южный — Кызылсайское рудное поле и другие; Восточный; все они принадлежат преимущественно вулканогенно-гидротермальному типу); Забайкалье (Антей, Стрельцовское и другие); регион Кавказских Минеральных Вод (Рудник № 1 в горе Бештау и Рудник № 2 в горе Бык); Средняя Азия, в основном Узбекская ССР с оруденениями в чёрных сланцах с центром в городе Учкудук. Имеется масса мелких рудопроявлений и проявлений.
Добыча в России[править | править код]
В России основным урановорудным регионом осталось Забайкалье. На месторождении в Забайкальском крае (около города Краснокаменска) добывается около 93 % российского урана. Добычу осуществляет шахтным способом «Приаргунское производственное горно-химическое объединение» (ППГХО), входящее в состав ОАО «Атомредметзолото» (Урановый холдинг).
Остальные 7 % получают методом подземного выщелачивания ЗАО «Далур» (Курганская область) и ОАО «Хиагда» (Бурятия).
Полученные руды и урановый концентрат перерабатываются на Чепецком механическом заводе.
На 2008 г по годовому производству урана (около 3,3 тысячи тонн) Россия занимала 4-е место после Казахстана. Годовое же потребление урана в России составляло 16 тысяч тонн и складывалось из расходов на собственные АЭС в объёме 5,2 тысячи тонн, а также на экспорт тепловыделяющих средств (5,5 тысячи тонн) и низкообогащённого урана (6 тысяч тонн)[47].
Добыча в Казахстане[править | править код]
В Казахстане сосредоточена примерно пятая часть мировых запасов урана (21 % и 2-е место в мире). Общие ресурсы урана порядка 1,5 млн тонн, из них около 1,1 млн тонн можно добывать методом подземного выщелачивания[48].
В 2009 году Казахстан вышел на первое место в мире по добыче урана (добыто 13 500 тонн)[49].
Добыча на Украине[править | править код]
Основное предприятие по добыче и переработке — Восточный горно-обогатительный комбинат в городе Жёлтые Воды.
Стоимость и аффинаж[править | править код]
Горнодобывающие компании поставляют уран в виде закиси-окиси урана U3O8. В 1990-е годы стоимость урана природного изотопного состава колебалась вокруг отметки 20 USD за килограмм[50]. С 2004 года цена начала активно расти и кратковременно достигла пиковых $300 в середине 2007 года, столь же резко обвалившись до $100 к 2009 году. Обновив в 2011 году кратковременный локальный максимум в $140, цена начала снижаться. С 2017 году цена стабилизировалась на отметке около $40 за килограмм закиси-окиси природного урана.
По мнению вице-председателя урановой группы Александра Бойцова, в мире месторождения I категории с себестоимостью добычи до 40 долл./кг уже почти исчерпаны (2010 год). К 2030 году будут исчерпаны известные крупные месторождения II категории, с себестоимостью до 80 долл./кг, и в освоение начнут вовлекаться труднодоступные месторождения III категории с себестоимостью добычи до 130 долл./кг и выше[51].
На всех этапах переработки урановых руд происходит очистка урана от сопутствующих ему примесей — элементов, обладающих большим сечением захвата нейтронов (гафний, бор, кадмий и т. д.). Наилучшие концентраты содержат 95—96 %, другие всего 60-80 % оксида урана, а остальное более 60 % различных примесей. «В чистом виде» такой уран непригоден в качестве ядерного топлива[52].
В целом по возможности аффинажа урановые руды делятся на следующие (жирным выделены категории, пригодные для производства топлива)[53]:
- I категория — супербогатые, содержание свыше 0,3 %, аффинаж 95—96 %;
- II категория — богатые, содержание от 0,1 до 0,3 %, аффинаж 60—80 %;
- III категория — рядовые, содержание от 0,05 до 0,1 %, аффинаж менее 60 %;
- IV категория — убогие, содержание от 0,03 до 0,05 %;
- V категория — забалансовые, содержание менее 0,03 %.
См. также[править | править код]
- Разделение изотопов
- Ядерное топливо
- Урановое стекло
- Ядерная силовая установка
- Урановые минералы
Примечания[править | править код]
Комментарии[править | править код]
- ↑ Не включая 5 судов Атомфлота с 7 реакторами и 129 судов ВМФ различных стран со 177 реакторами на борту.
- ↑ С учётом приобретения Uranium One. См. примечание к компании АРМЗ в столбце за 2011 год.
- ↑ «Оrano SA» до 2018 года именовалось «Areva». Переименование было произведено после того, как Areva оказалась на грани банкротства, контрольный пакет остался у правительства Франции[43].
- ↑ Данные по АРМЗ даны с учётом приобретённой в 2010 году компании Uranium One (Канада). Основным способом добычи урана с 2010 года стало скважинное подземное выщелачивание. С целью гарантированного долгосрочного сырьевого обеспечения отраслевых потребностей в уране «Росатом» приобрёл канадскую компанию Uranium One и консолидировал на её основе высокоэффективные урановые активы в Казахстане и других странах. За последние 8 лет производство Uranium One выросло почти в 5 раз, что позволило выйти на четвёртое место в мире среди урановых компаний[44].
Источники[править | править код]
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — doi:10.1351/PAC-REP-13-03-02. Архивировано 5 февраля 2014 года.
- ↑ 1 2 3 4 Мясоедов Б. Ф., Раков Э. Г. Уран // Химическая энциклопедия : в 5 т. / Гл. ред. Н. С. Зефиров. — М.: Большая Российская энциклопедия, 1998. — Т. 5: Триптофан — Ятрохимия. — С. 41—43. — 783 с. — 10 000 экз. — ISBN 5-85270-310-9.
- ↑ Uranium crystal structures (англ.). WebElements. Дата обращения: 10 августа 2010. Архивировано 29 августа 2010 года.
- ↑ Уран // Толковый словарь русского языка / под ред. Ушакова.
- ↑ 1 2 The Element Uranium (англ.). Thomas Jefferson National Accelerator Facility – Office of Science Education. Дата обращения: 15 марта 2018. Архивировано 17 марта 2018 года.
- ↑ Lide, 2004, p. 4—33.
- ↑ Grenthe I., Drożdżyński J., Fujino T., Buck E. C., Albrecht-Schmitt T. E., Wolf S. F. Uranium (англ.). Дата обращения: 16 марта 2018. Архивировано 18 января 2012 года.
- ↑ Gehlen A. F. Ueber die Farbenveränderungen der in Aether aufgelösten salzsauren Metallsalze durch das Sonnenlicht (О вызванных солнечным светом изменениях цвета хлоридов металлов, растворённых в эфире) (нем.) // Neues allgemeines Journal der Chemie. — 1804. — Bd. 3, H. 5. — S. 566—574. Архивировано 2 августа 2018 года.
- ↑ Siegfried Flügge, Gottfried von Droste. Energetische Betrachtungen zu der Entstehung von Barium bei der Neutronenbestrahlung von Uran // Zeitschrift für Physikalische Chemie B. — 1939. — Vol. 4. — P. 274—280.
- ↑ Изотопы: свойства, получение, применение. В 2 т / Под ред. В. Ю. Баранова. — М.: ФИЗМАТЛИТ, 2005. — Т. 2. — ISBN 5-9221-0523-X.
- ↑ Уран. Свойства химических элементов. Архивировано 11 июня 2009 года.
- ↑ Неорганическая химия. — М.: Мир, 1966. — Т. 2. — С. 206—223.
- ↑ Кац Дж., Рабинович Е. Химия урана. — М.: Изд-во иностранной литературы, 1954.
- ↑ 1 2 Audi G., Bersillon O., Blachot J., Wapstra A. H. The NUBASE evaluation of nuclear and decay properties // Nuclear Physics A. — 2003. — Т. 729. — С. 3—128. — doi:10.1016/j.nuclphysa.2003.11.001. — Bibcode: 2003NuPhA.729….3A.

- ↑ В урановых рудах в следовых количествах присутствует уран-236, образующийся из урана-235 при нейтронном захвате; в ториевых рудах имеются следы урана-233, возникающего из тория-232 после нейтронного захвата и двух последовательных бета-распадов. Однако содержание этих изотопов урана настолько мало, что может быть обнаружено лишь в специальных высокочувствительных измерениях.
- ↑ Rosholt J. N. Isotopic fractionatio of uranium related to role feature in Sandstone, Shirley Basin, Wyoming // Economic Geology. — 1964. — Vol. 59, № 4. — P. 570—585.
- ↑ Rosholt J. N. Evolution of the isotopic composition of uranium and thorium in Soil profiles // Bull.Geol.Soc.Am.. — 1966. — Vol. 77, № 9. — P. 987—1004.
- ↑ Чалов П. И. Изотопное фракционирование природного урана. — Фрунзе: Илим, 1975.
- ↑ Tilton G. R. Isotopic composition and distribution of lead, uranium, and thorium in a precambrian granite // Bull. Geol. Soc. Am.. — 1956. — Vol. 66, № 9. — P. 1131—1148.
- ↑ Шуколюков Ю. А. Изотопные исследования «природного ядерного реактора» // Геохимия. — 1977. — № 7. — С. 976—991.
- ↑ Мешик А. Древний ядерный реактор // В мире науки. Геофизика. — 2006. — № 2. Архивировано 20 октября 2007 года.
- ↑ В урановых рудах обнаружены следовые количества более тяжёлых элементов, в частности плутония; они возникают в природе в результате некоторых ядерных реакций, например при захвате нейтронов ядрами урана, а также при очень редком двойном бета-распаде урана-238.
- ↑ Technical data for the element Uranium in the Periodic Table (англ.). Дата обращения: 17 марта 2018. Архивировано 17 марта 2018 года.
- ↑ Гайсинский М., Адлов Ж. Уран // Радиохимический словарь элементов. — Атомиздат, 1968.
- ↑ Добыча урана в мире. Дата обращения: 13 декабря 2011. Архивировано из оригинала 12 мая 2012 года.
- ↑ 1 2 World Uranium Mining 2016 (англ.). World Nuclear Association. Дата обращения: 3 ноября 2018. Архивировано 20 июня 2016 года.
- ↑ 1 2 3 OECD NEA & IAEA, Uranium 2016: Resources, Production and Demand (‘Red Book’).
- ↑ Уран. Информационно-аналитический центр «Минерал». Дата обращения: 14 декабря 2010. Архивировано 16 мая 2013 года.
- ↑ Наумов С. С. Сырьевая база урана // Горный журнал. — 1999. — № 12. Архивировано 9 октября 2006 года.
- ↑ Уран // Популярная библиотека химических элементов : [сборник] : в 2 кн. Кн. 2. Серебро – нильсборий и далее / [ред.-сост. В. В. Станцо, М. Б. Черненко]. — Изд. 2-е, испр. и доп.. — М.: Наука, 1977. — 519 с.
- ↑ Хмелевской В. К. Геофизические методы исследования земной коры. Международный университет природы, общества и человека «Дубна», 1997.
- ↑ Справочник по геологии нефти и газа / Под ред. Еременко Н. А. — М.: Недра, 1984.
- ↑ 1 2 3 4 5 Уран // Техническая энциклопедия. — Т. 24. столб. 596…597
- ↑ 747 Tail Assembly Counterweights (англ.). Боинг (1994). Дата обращения: 29 сентября 2015. Архивировано 4 марта 2016 года.
- ↑ Урановые «серебряные пули»: почему никто не любит сражаться с американскими танками (рус.), ИноСМИ.Ru (28 марта 2017). Архивировано 28 марта 2017 года. Дата обращения: 28 марта 2017.
- ↑ Pöllänen D., Ikäheimonen T. K., Klemola S., Vartti V.-P., Vesterbacka K., Ristonmaa S., Honkamaa T., Sipilä P., Jokelainen I., Kosunen A., Zilliacus R., Kettunen M., Hokkanen M. Characterisation of projectiles composed of depleted uranium // Jounal of Environmental Radioactivity. — 2003. — Vol. 64. — P. 133—142. Архивировано 20 июля 2004 года.
- ↑ Чем опасны боеприпасы с обеднённым ураном?. Российская газета, 24.03.2023
- ↑ World Nuclear Association. Supply of Uranium. Архивная копия от 9 мая 2008 на Wayback Machine 2011.
- ↑ IAEA — Power Reactor Information System. Дата обращения: 1 сентября 2019. Архивировано 23 июля 2018 года.
- ↑ Uranium Supplies: Supply of Uranium — World Nuclear Association. Дата обращения: 1 сентября 2019. Архивировано 12 февраля 2013 года.
- ↑ 1 2 World Uranium Mining (англ.). World Nuclear Association (2017). Дата обращения: 12 марта 2013. Архивировано 13 июня 2014 года.
- ↑ World Uranium Mining – World Nuclear Association. Дата обращения: 1 сентября 2019. Архивировано 23 октября 2020 года.
- ↑ Areva devient Orano pour garder les pieds dans l’atome. Libération. Дата обращения: 1 сентября 2019. Архивировано 12 июня 2018 года.
- ↑ Всероссийский институт научной и технической информации Российской академии наук, Москва, Россия. А. В. Балихин. МИНЕРАЛЬНО-СЫРЬЕВАЯ БАЗА УРАНА: СОВРЕМЕННОЕ СОСТОЯНИЕ И ПЕРСПЕКТИВЫ РАЗВИТИЯ. ОБЗОР // Kompleksnoe ispolʹzovanie mineralʹnogo syrʹâ/Complex Use of Mineral Resources/Mineraldik shikisattardy Keshendi Paidalanu. — 2019-03-15. — Т. 1, вып. 308. — С. 36—50. — doi:10.31643/2019/6445.05. Архивировано 22 января 2021 года.
- ↑ 1 2 PRoAtom — Понимание российского комплекса обогащения урана (часть 2). Дата обращения: 1 сентября 2019. Архивировано 29 августа 2019 года.
- ↑ Переработка урана в мире — производство, методы и степень обогащения, химические свойства. Где используется уран? — ТеплоЭнергоРемонт. Дата обращения: 1 сентября 2019. Архивировано 17 июня 2021 года.
- ↑ Машковцев Г. А., Мигута А. К., Щёточкин В. Н. Минерально-сырьевая база и производство урана в Восточной Сибири и на Дальнем Востоке // Минеральные ресурсы России. Экономика и управление. — 2008. — № 1. Архивировано 28 февраля 2012 года.
- ↑ Добыча урана в Казахстане. Доклад Мухтара Джакишева. Дата обращения: 1 декабря 2009. Архивировано из оригинала 15 мая 2013 года.
- ↑ Конырова, К. Казахстан вышел на первое место по добыче урана в мире (рус.), Информационное агентство TREND (30 декабря 2009). Архивировано 31 декабря 2009 года. Дата обращения: 30 декабря 2009.
- ↑ Historical Ux Price Table (англ.). Ux Consulting – The Nuclear Fuel Price Reporter. Дата обращения: 24 августа 2018. Архивировано 25 августа 2018 года. Цены на сайте приведены в долларах за фунт
- ↑ Бойцов А. В. Устойчивое развитие мировой урановой промышленности: вызов времени. Дата обращения: 23 декабря 2011. Архивировано 13 мая 2012 года.
- ↑ Амирова У. К., Урузбаева Н. А. Обзор развития мирового рынка урана // Universum: Экономика и юриспруденция : электрон. научн. журн. 2017. № 6(39). URL: http://7universum.com/ru/economy/archive/item/4802 Архивная копия от 30 декабря 2018 на Wayback Machine (дата обращения: 29.12.2018)
- ↑ Урановая руда: свойства, применение, добыча Архивная копия от 30 декабря 2018 на Wayback Machine 8 декабря 2017
Литература[править | править код]
- Уран, химический элемент // Энциклопедический словарь Брокгауза и Ефрона : в 86 т. (82 т. и 4 доп.). — СПб., 1890—1907.
- Handbook of chemistry and physics / Editor-in-Chief David R. Lide. — 84th edition 2003-2004. — CRC Press, 2004.
- Emsley J. Uranium // Nature’s Building Blocks: An A to Z Guide to the Elements (англ.). — Oxford: Oxford University Press, 2001. — P. 476—482. — ISBN 978-0-19-850340-8.
- Seaborg G. T. Uranium // The Encyclopedia of the Chemical Elements (англ.). — Skokie, Illinois: Reinhold Book Corporation, 1968. — P. 773—786.
Ссылки[править | править код]
- Бекман, И. Н. Уран : [арх. 25 июня 2011]. — Вена, 2008.
- Uranium. the essentials (англ.). WebElements.
- Уран // Популярная библиотека химических элементов. — Электронная библиотека Наука и техника.
- Section 6.0 Nuclear Materials. Nuclear Weapons Frequently Asked Questions (англ.). Nuclear Weapon Archive (20 февраля 1999).
- Леонов, Николай. Россия продала США значительные запасы оружейного урана. — Столетие, 2011. — 9 марта.[неавторитетный источник?]
- «What is Uranium?» (англ.). World Nuclear Association.












