Загрузить PDF
Загрузить PDF
Электрон является частицей с отрицательным зарядом и входит в состав атома. Все основные элементы состоят из электронов, протонов и нейтронов. В химии важно уметь определять, сколько электронов содержит атом. Это можно сделать с помощью периодической системы химических элементов (таблицы Менделеева). Также необходимо знать, как найти число нейтронов и валентных электронов (электронов на внешней оболочке атома).
-

1
Возьмите таблицу Менделеева. Это цветная таблица, в которой все известные элементы упорядочены согласно их атомной структуре. Каждый элемент обозначается символом в виде одной, двух или трех латинских букв, наряду с атомным весом и атомным номером элемента.[1]
- Таблицу Менделеева можно найти в учебниках по химии или в интернете.
-

2
Найдите нужный элемент в таблице Менделеева. Элементы упорядочены по атомному номеру и разделены на три основные группы: металлы, неметаллы и металлоиды (полуметаллы). Некоторые группы носят несистематические названия, такие как щелочные металлы, галогены и благородные газы.[2]
. Каждый столбец таблицы называется группой, а каждая строка — периодом.- Если вы знаете, в какой группе или периоде находится нужный элемент, вам будет легче найти его.
- Если вы знаете только символ элемента, просто просмотрите таблицу и найдите в ней этот символ.
-

3
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[3]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
Реклама
-

1
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[4]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, то нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
-

2
Выясните заряд иона. Если добавить или удалить электрон из атома, элемент не поменяется на другой, но зато изменится его заряд. В этом случае получится ион, такой как K+, Ca2+ или N3-. Обычно заряд указывается сверху справа от символа элемента.
- Электрон — это частица с отрицательным зарядом, поэтому если в атом добавить электрон, получится ион с отрицательным зарядом.
- Если из атома удалить электрон, получится ион с положительным зарядом.
- Например, заряд N3- равен -3, а заряд Ca2+ равен +2.
-

3
Если дан ион с положительным зарядом, вычтите заряд из атомного номера. Если ион имеет положительный заряд, атом потерял электроны. Чтобы определить оставшееся количество электронов, вычтите заряд из атомного номера. У иона с положительным зарядом протонов больше, чем электронов.
- Например, заряд Ca2+ равен +2, то есть у этого иона на 2 электрона меньше, чем у нейтрального атома кальция. Атомный номер кальция равен 20, поэтому у этого иона 18 электронов.
-

4
Если дан ион с отрицательным зарядом, прибавьте заряд к атомному номеру. Если ион имеет отрицательный заряд, атом получил дополнительные электроны. Чтобы определить получившееся количество электронов, прибавьте заряд к атомному номеру. У иона с отрицательным зарядом протонов меньше, чем электронов.
- Например, заряд N3- равен -3, то есть у этого иона на 3 электрона больше, чем у нейтрального атома азота. Атомный номер азота равен 7, поэтому у этого иона 10 электронов.
Реклама
Об этой статье
Эту страницу просматривали 46 555 раз.
Была ли эта статья полезной?
Электронная формула химического элемента показывает то, как происходит распределение электронов на орбиталях в атоме по энергетическим уровням и подуровням.
Вот что нужно обязательно знать, чтобы правильно составить электронную формулу элемента:
I.
Все орбитали и находящееся на ней электроны характеризуют несколько квантовых чисел.
Среди них в первую очередь стоит выделить числа n и l.
- n – главное квантовое число, определяет общую энергию электрона на орбитали. Это число характеризует энергетический уровень и может принимать значение от 1 до 7.
- l – орбитальное квантовое число. Это число характеризует форму орбитали и энергетический подуровень.
Существует 4 вида орбиталей, различающихся своей формой и направленностью в пространстве.
- s-орбитали (l = 0),
- p-орбитали (l = 1),
- d-орбитали (l = 2),
- f-орбитали (l = 3).
Самое простое строение у s-орбитали, самое сложное – у f-орбитали.
II.
Каждый энергетический уровень содержит n подуровней (то есть чем больше главное квантовое число, тем больше подуровней).
Количество орбиталей, которое может быть на том или ином подуровне, определяется по формуле 2l + 1.
Согласно принципу Паули на одной орбитали может быть максимум 2 электрона (если находится 1 электрон, то он называется неспаренным, если 2 электрона – то это электронная пара).
Таким образом, будет нетрудно посчитать, сколько орбиталей и электронов может включать в себя каждый подуровень.
-
s-подуровень включает 2 * 0 + 1 = 1 орбиталь и 1 * 2 = 2 электрона.
-
p-подуровень включает 2 * 1 + 1 = 3 орбитали и 3 * 2 = 6 электронов.
-
d-подуровень включает 2 * 2 + 1 = 5 орбиталей и 5 * 2 = 10 электронов.
-
f-подуровень включает 2 * 3 + 1 = 7 орбиталей и 7 * 2 = 14 электронов.
III.
Заполнение орбиталей электронами осуществляется по правилу Клечковского (в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n).
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d и т.д.
Здесь действует принцип минимума энергии, при котором электроны заполняют орбитали начиная с подуровня с наименьшей энергией.
IV.
Максимальное количество электронов на энергетическом уровне определяется по формуле N = 2n².
Эта формула вытекает из принципа из принципа Паули.
Исходя из формулы на первом уровне может быть максимум 2 электрона (s2), на втором уровне – максимум 8 электронов (2s2 2p6), на третьем уровне – максимум 18 электронов (3s2 3p6 3d10).
V.
Заполнение орбиталей внутри одного подуровня происходит по правилу Хунда.
Согласно этому правилу каждая орбиталь подуровня заполняется сначала одним электроном, а после исчерпания свободных орбиталей к имеющемуся электрону на орбитали добавляется парный электрон.
**
При составлении электронных формул элементов также понадобится периодическая система Д.И. Менделеева.
С её помощью можно определить:
-
Количество электронов в атоме – оно равно порядковому номеру элемента в периодической таблице.
-
Число энергетических уровней – оно равно номеру периода данного элемента.
-
Число электронов на последнем уровне – оно равно номеру группы.
**
Пример.
Сера (S).
Это 16 элемент по счёту: количество электронов в атоме будет равно 16.
Находится в 3 периоде: всего будет 3 уровня.
Сначала заполняем 1 уровень: 1s2, на нём будет только 2 электрона.
Далее заполняем 2 уровень: 2s2 2p6, на нём будет 8 электронов.
Оставшиеся 6 электронов будет на 3 уровне (а это как раз номер группы): 3s2 3p4.
В результате получаем следующее:
1s2 2s2 2p6 3s2 3p4.
Здравствуйте, уважаемые читатели!
Обучение школьников составлению электронных формул химических элементов в большинстве случае производится в соответствии со следующим алгоритмом: (https://www.calc.ru/Elektronnaya-Formula-Elementa.html).
1. Определите число электронов в атоме, используя Периодическую таблицу химических элементов Д.И. Менделеева.
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей:
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s2, на втором – максимум 8 (два s и шесть р: 2s22p6), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s2 3p6 3d10).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
Как правило, использование этого алгоритма подразумевает распределение электронов по уровням и подуровням с помощью расчетов, т. е на основе постоянного сравнения количества уже учтенных в электронной формуле электронов с общим количеством электронов в атомов. Использование же таблицы Менделеева при этом минимально.
Это можно проследить на множестве обучающих видеоматериалов, в которых авторы обращаются к ТМ практически только за порядковым номером элемента:
или используют ее раскраску:
Проанализировав более 20 видеоматериалов на данную тему, я смогла найти только один, в котором в качестве основы составления формул использовались не расчеты и не искусственные подсказки в виде разной раскраски знаков элементов, а сама структура таблицы Менделеева (10-12 минуты видео):
Преподавание – творческий процесс, каждый преподаватель выбирает те приемы и алгоритмы, которые близки его психологическим характеристикам. Сказывается также и первоначальное знакомство с данным материалом на уроках химии, когда сам преподаватель был школьником.
Ни в коей мере не претендуя на навязывание алгоритмов, по которым работаю, хочу познакомить (или напомнить), как составлять полные и сокращенные электронные формулы с помощью таблицы Менделеева. С данным приемом я познакомилась на уроках моей мамы в далекие советские годы, а затем – на лекциях и семинарах по неорганике в МИТХТ. Об эффективности этого приема может свидетельствовать то, что электронные формулы элементов четырех периодов легко составляли даже те мои одноклассники, которые с трудом могли посчитать молярную массу.
На приведенном ниже видео я попыталась показать, как, используя 2 источника – алгоритм заполнения электронами орбиталей и таблицу Менделеева, можно легко составлять полные и сокращенные электронные формулы любого химического элемента. Заранее прошу прощения за технические и терминологические ляпы (например, “элемент” вместо “атом”), а также за “жаргонные” словечки (вроде “прощелкать по клеткам”). Дело в том, что это видео -мой первый опыт в создании видеоматериалов.
Всего доброго!
Электронные формулы химических элементов


4.6
Средняя оценка: 4.6
Всего получено оценок: 650.
4.6
Средняя оценка: 4.6
Всего получено оценок: 650.
Расположение электронов на энергетических оболочках или уровнях записывают с помощью электронных формул химических элементов. Электронные формулы или конфигурации помогают представить структуру атома элемента.
Строение атома
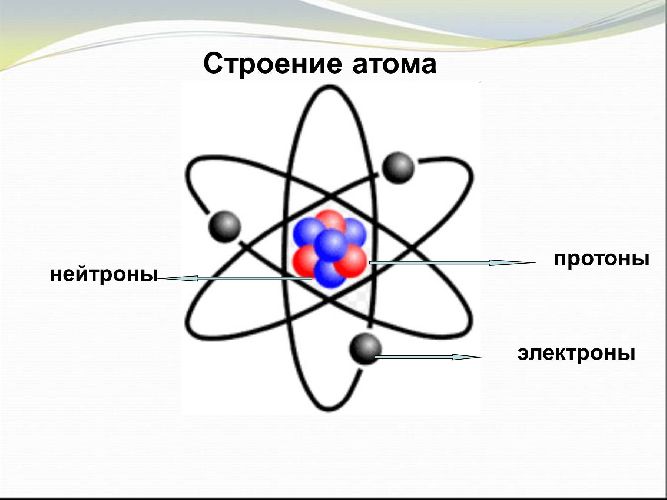
Чтобы читать электронные формулы, необходимо понять строение атома.
Атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронов, которые располагаются вокруг ядра.
Электроны находятся на разных энергетических уровнях. Чем дальше электрон находится от ядра, тем большей энергией он обладает. Размер энергетического уровня определяется размером атомной орбитали или орбитального облака. Это пространство, в котором движется электрон.
Орбитали могут иметь разную геометрическую конфигурацию:
- s-орбитали – сферические;
- р-, d и f-орбитали – гантелеобразные, лежащие в разных плоскостях.
На первом энергетическом уровне любого атома всегда располагается s-орбиталь с двумя электронами (исключение – водород). Начиная со второго уровня, на одном уровне находятся s- и р-орбитали.
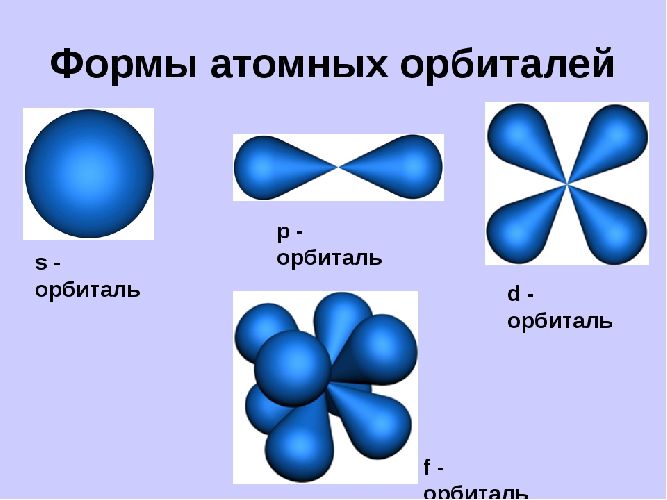
Орбитали существуют вне зависимости от нахождения на них электронов и могут быть заполненными или вакантными.
Запись формулы
Электронные конфигурации атомов химических элементов записываются по следующим принципам:
- каждому энергетическому уровню соответствует порядковый номер, обозначаемый арабской цифрой;
- за номером следует буква, означающая орбиталь;
- над буквой пишется верхний индекс, соответствующий количеству электронов на орбитали.
Примеры записи:
- кальций –
1s22s22p63s23p64s2;
- кислород –
1s22s22p4;
- углерод –
Записать электронную формулу помогает таблица Менделеева. Количеству энергетических уровней соответствует номер периода. На заряд атома и количество электронов указывает порядковый номер элемента. Номер группы показывает, сколько валентных электронов находится на внешнем уровне.
Для примера возьмём Na. Натрий находится в первой группе, в третьем периоде, под 11 номером. Это значит, что атом натрия имеет положительно заряженное ядро (содержит 11 протонов), вокруг которого на трёх энергетических уровнях располагается 11 электронов. На внешнем уровне находится один электрон.
Вспомним, что первый энергетический уровень содержит s-орбиталь с двумя электронами, а второй – s- и р-орбитали. Остаётся заполнить уровни и получить полную запись:
+11 Na )2)8)1 или 1s22s22p63s1.
Для удобства созданы специальные таблицы электронных формул элемента. В длинной периодической таблице формулы также указываются в каждой клетке элемента.
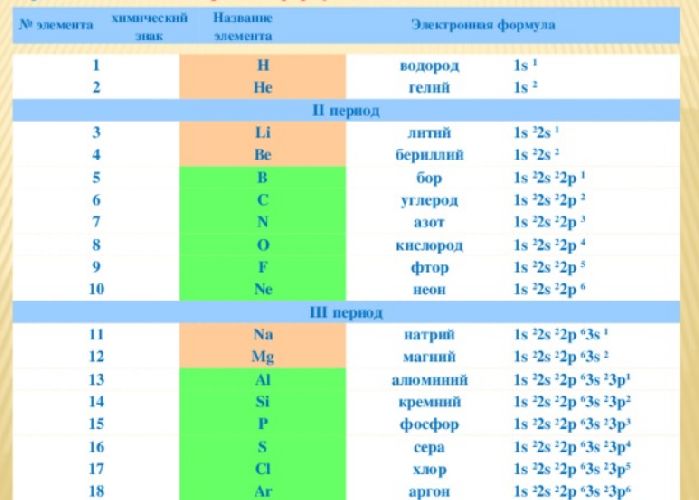
Для краткости в квадратных скобках записаны элементы, электронная формула которых совпадает с началом формулы элемента. Например, электронная формула магния – [Ne]3s2, неона – 1s22s22p6. Следовательно, полная формула магния – 1s22s22p63s2.

Что мы узнали?
Электронные формулы элементов отражают расположение электронов в атоме на разных орбиталях. Количество электронов равно порядковому номеру элемента, количество уровней – номеру периода. На последнем уровне находятся валентные электроны, соответствующие номеру группы элемента. Цифры в электронной формуле показывают уровень, буквы – орбиталь, индексы – количество электронов на уровне.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5
-

Александр Котков
5/5
-

Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 650.
А какая ваша оценка?
Атомно-молекулярное учение
Мы приступаем к изучению химии – мира молекул и атомов. В этой статье мы рассмотрим базисные понятия и разберемся с электронными
формулами элементов.
Атом (греч. а – отриц. частица + tomos – отдел, греч. atomos – неделимый) – электронейтральная частица вещества микроскопических
размеров и массы, состоящая из положительно заряженного ядра (протонов) и отрицательно заряженных электронов (электронные орбитали).
Описываемая модель атома называется “планетарной” и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом

Протон (греч. protos – первый) – положительно заряженная (+1) элементарная частица, вместе с нейтронами образует ядра атомов
элементов. Нейтрон (лат. neuter – ни тот, ни другой) – нейтральная (0) элементарная частица, присутствующая в ядрах всех
химических элементов, кроме водорода.
Электрон (греч. elektron – янтарь) – стабильная элементарная частица с отрицательным электрическим зарядом (-1), заряд атома –
порядковый номер в таблице Менделеева – равен числу электронов (и, соответственно, протонов).
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20)
в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.

Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило:
порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим
электроны занимают различные энергетические уровни.
Энергетические уровни подразделяются на несколько подуровней:
- Первый уровень
- Второй уровень
- Третий уровень
- Четвертый уровень
Состоит из s-подуровня: одной “1s” ячейки, в которой помещаются 2 электрона (заполненный электронами – 1s2)
Состоит из s-подуровня: одной “s” ячейки (2s2) и p-подуровня: трех “p” ячеек (2p6), на которых
помещается 6 электронов
Состоит из s-подуровня: одной “s” ячейки (3s2), p-подуровня: трех “p” ячеек (3p6) и d-подуровня:
пяти “d” ячеек (3d10), в которых помещается 10 электронов
Состоит из s-подуровня: одной “s” ячейки (4s2), p-подуровня: трех “p” ячеек (4p6), d-подуровня:
пяти “d” ячеек (4d10) и f-подуровня: семи “f” ячеек (4f14), на которых помещается 14
электронов

Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число
электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а
также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: “s”, “p” и “d”, которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или
атомным орбиталям, движутся электроны, создавая определенный “рисунок”.
S-орбиталь похожа на сферу, p-орбиталь напоминает песочные часы, d-орбиталь – клеверный лист.

Правила заполнения электронных орбиталей и примеры
Существует ряд правил, которые применяют при составлении электронных конфигураций атомов:
- Сперва следует заполнить орбитали с наименьшей энергией, и только после переходить к энергетически более высоким
- На орбитали (в одной “ячейке”) не может располагаться более двух электронов
- Орбитали заполняются электронами так: сначала в каждую ячейку помещают по одному электрону, после чего орбитали дополняются
еще одним электроном с противоположным направлением - Порядок заполнения орбиталей: 1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было
бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Без практики теория мертва, так что приступает к тренировке. Нам нужно составить электронную конфигурацию атомов углерода и
серы. Для начала определим их порядковый номер, который подскажет нам число их электронов. У углерода – 6, у серы – 16.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.

Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил.
А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся
одним электроном дополнили первую ячейку.
Таким образом, электронные конфигурации наших элементов:
- Углерод – 1s22s22p2
- Серы – 1s22s22p63s23p4
Внешний уровень и валентные электроны
Количество электронов на внешнем (валентном) уровне – это число электронов на наивысшем энергетическом уровне, которого достигает элемент. Такие электроны называются валентными: они могут быть спаренными или неспаренными. Иногда
для наглядного представления конфигурацию внешнего уровня записывают отдельно:
- Углерод – 2s22p2 (4 валентных электрона)
- Сера -3s23p4 (6 валентных электронов)
Неспаренные валентные электроны способны к образованию химической связи. Их число соответствует количеству связей, которые данный атом может образовать с другими атомами. Таким образом неспаренные валентные электроны тесно связаны с валентностью – способностью атомов образовывать определенное число химических связей.

- Углерод – 2s22p2 (2 неспаренных валентных электрона)
- Сера -3s23p4 (2 неспаренных валентных электрона)
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных
электронов. Ниже будет дано наглядное объяснение этой задаче.

Запишем получившиеся электронные конфигурации магния и скандия:
- Магний – 1s22s22p63s2
- Скандий – 1s22s22p63s23p64s23d1
В целом несложная и интересная тема электронных конфигураций отягощена небольшим исключением – провалом электрона, которое только подтверждает общее
правило: любая система стремится занять наименее энергозатратное состояние.
Провал электрона
Провалом электрона называют переход электрона с внешнего, более высокого энергетического уровня, на предвнешний, энергетически более
низкий. Это связано с большей энергетической устойчивостью получающихся при этом электронных конфигураций.
Подобное явление характерно лишь для некоторых элементов: медь, хром, серебро, золото, молибден. Для примера выберем хром, и рассмотрим
две электронных конфигурации: первую “неправильную” (сделаем вид, будто мы не знаем про провал электрона) и вторую правильную, написанную
с учетом провала электрона.
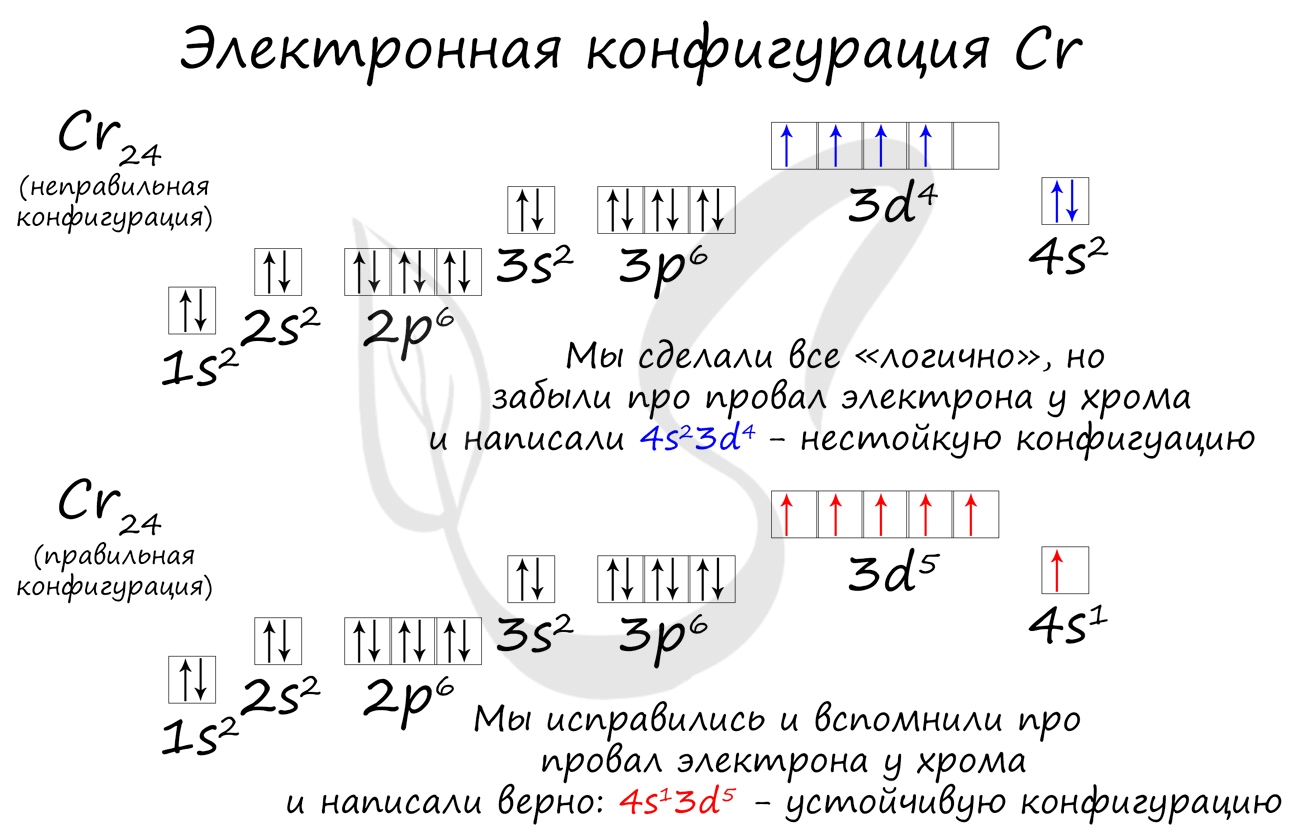
Теперь вы понимаете, что кроется под явлением провала электрона. Запишите электронные конфигурации хрома и меди самостоятельно еще раз и
сверьте с представленными ниже.

Основное и возбужденное состояние атома
Основное и возбужденное состояние атома отражаются на электронных конфигурациях. Возбужденное состояние связано с движением электронов
относительно атомных ядер. Говоря проще: при возбуждении пары электронов распариваются и занимают новые ячейки.
Возбужденное состояние является для атома нестабильным, поэтому долгое время в нем он пребывать не может. У некоторых атомов: азота,
кислорода , фтора – возбужденное состояние невозможно, так как отсутствуют свободные орбитали (“ячейки”) – электронам некуда перескакивать, к тому
же d-орбиталь у них отсутствует (они во втором периоде).
У серы возможно возбужденное состояние, так как она имеет свободную d-орбиталь, куда могут перескочить электроны. Четвертый энергетический
уровень отсутствует, поэтому, минуя 4s-подуровень, заполняем распаренными электронами 3d-подуровень.
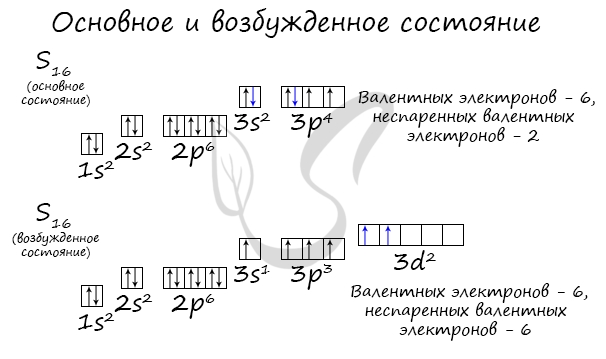
По мере изучения основ общей химии мы еще не раз вернемся к этой теме, однако хорошо, если вы уже сейчас запомните, что возбужденное состояние
связано с распаривание электронных пар.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
