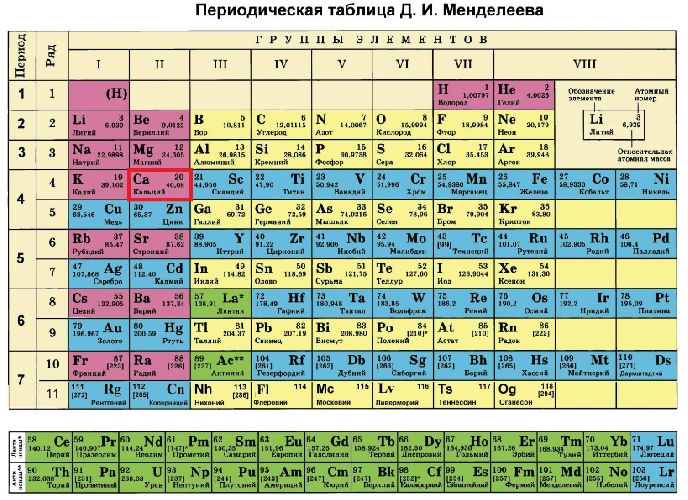
Ca (кальций) – элемент с прядковым номером 20 в периодической системе.
Находится в IV периоде. Температура плавления: 839 ℃. Плотность: 1.54 г/см3.
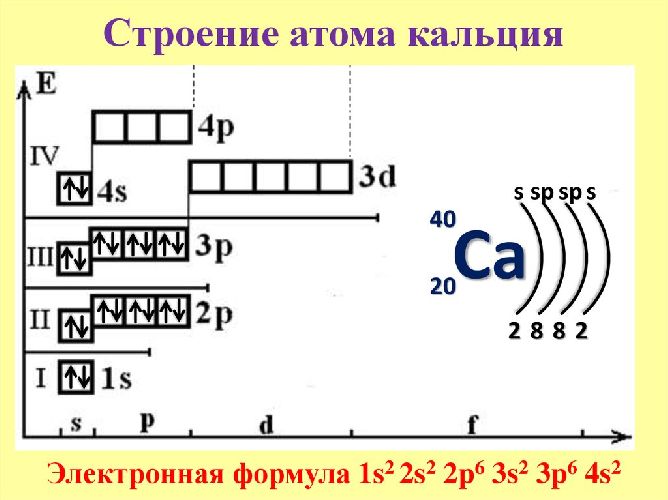
Электронная формула атома кальция:
1s2 2s2 2p6 3s2 3p6 4s2
Сокращенная электронная конфигурация Ca:
[Ar] 4s2
Ниже приведена электронно-графическая схема атома кальция
Распределение электронов по энергетическим уровням в атоме Ca
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 8
4-й уровень (N): 2
Валентные электроны кальция
Количество валентных электронов в атоме кальция – 2.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
Степени окисления, которые может проявлять кальций: +2
Электронное строение атома кальция
Электронное строение нейтрального атома кальция в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме кальция.
Ca
+20
2
8
8
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме кальция.
| 4 | ↑↓ | |||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||
| 1 | ↑↓ | |||||
| s | p |
Валентные орбитали атома кальция выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома кальция.
20Ca 1s2 2s2 2p6 3s2 3p6 4s2
Сокращённая электронная конфигурация атома кальция.
20Ca [Ar] 4s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома кальция.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 4s | 4 | 0 | 0 | +½ |
| -½ |
Строение атома кальция

4.4
Средняя оценка: 4.4
Всего получено оценок: 196.
4.4
Средняя оценка: 4.4
Всего получено оценок: 196.
Кальций (Ca) – щелочноземельный металл, входящий в состав минералов. Из-за строения атома кальций проявляет активные восстановительные свойства. Играет важную роль в метаболизме и постройке организма.
Строение
Кальций – 20 элемент периодической таблицы. Находится во второй группе, четвёртом периоде. Относится к элементам s-семейства. Электронное строение атома кальция – 1s22s22p63s23p64s2 или +20 Ca)2)8)8)2.
Ядро атома содержит 20 протонов и 20 нейронов, имеет положительный заряд +20. Вокруг ядра по четырём орбитам движется 20 электронов. Последний энергетический s-уровень содержит два спаренных электрона, поэтому постоянная валентность кальция – II.
В соединениях атом кальция отдаёт два электрона, выполняя функцию восстановителя. Степень окисления кальция – +2.
Кальций не может переходить в возбуждённое состояние.
Общее описание
Основным источником кальция является карбонат кальция – CaCO3, который является главным соединением известняка, мела, мрамора. Также кальций входит в состав доломита, гипса, апатита, шпата и других минералов.
Кальций – металл серебристого цвета с температурой плавления 854°С. При высоком давлении проявляет свойства полупроводника. Легко окисляется на воздухе.
Кальций получают электролизом расплавленного хлорида кальция – CaCl2.
Химические свойства
Схема строения атома определяет химические свойства элемента. Кальций активно реагирует с простыми и сложными веществами. Из-за способности быстро присоединять кислород, образуя на поверхности оксидную плёнку, кальций хранят под слоем парафина или керосина в плотно закрытой таре. Основные реакции кальция с элементами и соединения приведены в таблице.
|
Взаимодействие |
Продукты |
Уравнение |
|
С кислородом при нагревании (реакция горения) |
Оксид кальция (негашёная известь) |
2Ca + O2 → 2CaO |
|
С большинством неметаллов при нагревании |
Соли |
– Ca + S → CaS; – Ca + Br2 → CaBr2; – 3Ca + N2 → Ca3N2; – Ca + 2C → CaC2; – 2Ca + Si → Ca2Si; – Ca + Cl2 → CaCl2 |
|
С фтором даже на холоде |
Фторид кальция |
Ca + F2 → CaF2 |
|
С водой |
Гидроксид кальция (гашёная или едкая известь) выпадает в осадок, выделяется водород |
Ca + 2H2O → Ca(OH)2↓ + H2↑ |
|
С кислотами |
Соли |
Ca + 2HCl → CaCl2 + H2↑ |
Большинство солей кальция (фторид, сульфат, карбонад кальция) не растворяются в воде. Хорошо растворимы бромид (CaBr2), хлорид (CaCl2), йодид (CaI2), нитрат (Ca(NO3)2) кальция.
Элемент в составе соединений используется в строительстве, пищевой и химической промышленности, медицине.
Что мы узнали?
Кальций – активный щелочноземельный металл, являющийся восстановителем. На внешнем энергетическом уровне атома находится два электрона, определяющие валентность. Кальций входит в состав минералов, быстро окисляется на воздухе, реагирует с неметаллами при нагревании, водой и кислотами. Оксид кальция называется негашёной известью, гидроксид – гашёной известью. Большинство солей кальция плохо растворяются в воде. Кальций входит в состав костей, крови, участвует в метаболизме, применяется в промышленности, строительстве и медицине.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-
Александр Котков
5/5
-
Алексей Беляев
4/5
-
Александр Котков
5/5
-
Александр Котков
5/5
Оценка доклада
4.4
Средняя оценка: 4.4
Всего получено оценок: 196.
А какая ваша оценка?
Кальций в таблице менделеева занимает 20 место, в 4 периоде.
| Символ | Ca |
| Номер | 20 |
| Атомный вес | 40.0780000 |
| Латинское название | Calcium |
| Русское название | Кальций |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема кальция
Ca: 1s2 2s2 2p6 3s2 3p6 4s2
Короткая запись:
Ca: [Ar]4s2
Одинаковую электронную конфигурацию имеют
атом кальция и
K-1, Sc+1, Ti+2, V+3, Mn+5, Fe+6
Порядок заполнения оболочек атома кальция (Ca) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Кальций имеет 20 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
Степень окисления кальция
Атомы кальция в соединениях имеют степени окисления 2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы кальция
Валентность Ca
Атомы кальция в соединениях проявляют валентность II.
Валентность кальция характеризует способность атома Ca к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Ca
Квантовые числа определяются последним электроном в конфигурации,
для атома Ca эти числа имеют значение N = 4, L = 0, Ml = 1, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Ca:
Eo = 590 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Ca в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Загрузить PDF
Загрузить PDF
Электрон является частицей с отрицательным зарядом и входит в состав атома. Все основные элементы состоят из электронов, протонов и нейтронов. В химии важно уметь определять, сколько электронов содержит атом. Это можно сделать с помощью периодической системы химических элементов (таблицы Менделеева). Также необходимо знать, как найти число нейтронов и валентных электронов (электронов на внешней оболочке атома).
-
1
Возьмите таблицу Менделеева. Это цветная таблица, в которой все известные элементы упорядочены согласно их атомной структуре. Каждый элемент обозначается символом в виде одной, двух или трех латинских букв, наряду с атомным весом и атомным номером элемента.[1]
- Таблицу Менделеева можно найти в учебниках по химии или в интернете.
-
2
Найдите нужный элемент в таблице Менделеева. Элементы упорядочены по атомному номеру и разделены на три основные группы: металлы, неметаллы и металлоиды (полуметаллы). Некоторые группы носят несистематические названия, такие как щелочные металлы, галогены и благородные газы.[2]
. Каждый столбец таблицы называется группой, а каждая строка — периодом.- Если вы знаете, в какой группе или периоде находится нужный элемент, вам будет легче найти его.
- Если вы знаете только символ элемента, просто просмотрите таблицу и найдите в ней этот символ.
-
3
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[3]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
Реклама
-
1
Выясните атомный номер элемента. Атомный номер указывается в верхнем левом углу (над символом элемента). Атомный номер равен количеству протонов в атоме элемента.[4]
Протоны являются частицами с положительным зарядом. Так как электроны — это частицы с отрицательным зарядом, то нейтральный атом включает равное количество протонов и электронов.- Например, атомный номер бора (B) равен 5, то есть в атоме бора 5 протонов и 5 электронов.
-
2
Выясните заряд иона. Если добавить или удалить электрон из атома, элемент не поменяется на другой, но зато изменится его заряд. В этом случае получится ион, такой как K+, Ca2+ или N3-. Обычно заряд указывается сверху справа от символа элемента.
- Электрон — это частица с отрицательным зарядом, поэтому если в атом добавить электрон, получится ион с отрицательным зарядом.
- Если из атома удалить электрон, получится ион с положительным зарядом.
- Например, заряд N3- равен -3, а заряд Ca2+ равен +2.
-
3
Если дан ион с положительным зарядом, вычтите заряд из атомного номера. Если ион имеет положительный заряд, атом потерял электроны. Чтобы определить оставшееся количество электронов, вычтите заряд из атомного номера. У иона с положительным зарядом протонов больше, чем электронов.
- Например, заряд Ca2+ равен +2, то есть у этого иона на 2 электрона меньше, чем у нейтрального атома кальция. Атомный номер кальция равен 20, поэтому у этого иона 18 электронов.
-
4
Если дан ион с отрицательным зарядом, прибавьте заряд к атомному номеру. Если ион имеет отрицательный заряд, атом получил дополнительные электроны. Чтобы определить получившееся количество электронов, прибавьте заряд к атомному номеру. У иона с отрицательным зарядом протонов меньше, чем электронов.
- Например, заряд N3- равен -3, то есть у этого иона на 3 электрона больше, чем у нейтрального атома азота. Атомный номер азота равен 7, поэтому у этого иона 10 электронов.
Реклама
Об этой статье
Эту страницу просматривали 46 270 раз.