Fe (железо) – элемент с прядковым номером 26 в периодической системе.
Находится в IV периоде. Температура плавления: 1535 ℃. Плотность: 7.87 г/см3.
Электронная формула атома железа в порядке возрастания энергий орбиталей:
1s2 2s2 2p6 3s2 3p6 4s2 3d6
Электронная формула атома железа в порядке следования уровней:
1s2 2s2 2p6 3s2 3p6 3d6 4s2
Сокращенная электронная конфигурация Fe:
[Ar] 3d6 4s2
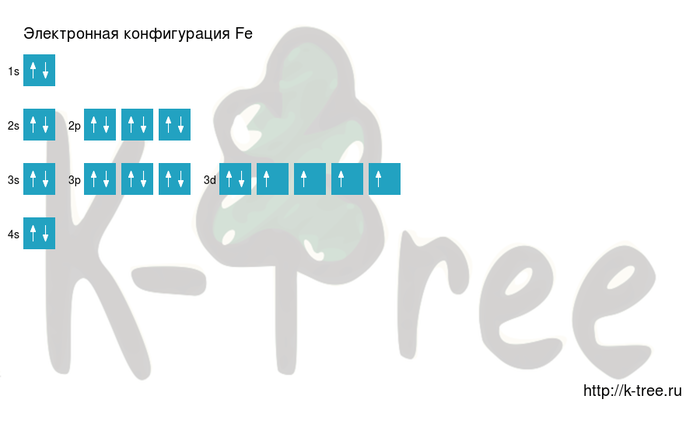
Ниже приведена электронно-графическая схема атома железа

Распределение электронов по энергетическим уровням в атоме Fe
1-й уровень (K): 2
2-й уровень (L): 8
3-й уровень (M): 14
4-й уровень (N): 2

Валентные электроны железа
Количество валентных электронов в атоме железа – 8.
Ниже приведены их квантовые числа (N – главное, L – орбитальное, M – магнитное, S – спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | 0 | 0 | +1/2 |
| s | 4 | 0 | 0 | -1/2 |
| d | 3 | 2 | -2 | +1/2 |
| d | 3 | 2 | -1 | +1/2 |
| d | 3 | 2 | 0 | +1/2 |
| d | 3 | 2 | 1 | +1/2 |
| d | 3 | 2 | 2 | +1/2 |
| d | 3 | 2 | -2 | -1/2 |
Степени окисления, которые может проявлять железо: +1, +2, +3, +4, +5, +6
Железо в таблице менделеева занимает 26 место, в 4 периоде.
| Символ | Fe |
| Номер | 26 |
| Атомный вес | 55.8450000 |
| Латинское название | Ferrum |
| Русское название | Железо |
Как самостоятельно построить электронную конфигурацию? Ответ здесь
Электронная схема железа
Fe: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Короткая запись:
Fe: [Ar]4s2 3d6
Одинаковую электронную конфигурацию имеют
атом железа и
Mn-1, Co+1, Ni+2
Порядок заполнения оболочек атома железа (Fe) электронами:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d →
5p → 6s → 4f → 5d → 6p → 7s → 5f → 6d → 7p.
На подуровне ‘s’ может находиться до 2 электронов, на ‘s’ – до 6, на
‘d’ – до 10 и на ‘f’ до 14
Железо имеет 26 электронов,
заполним электронные оболочки в описанном выше порядке:
2 электрона на 1s-подуровне
2 электрона на 2s-подуровне
6 электронов на 2p-подуровне
2 электрона на 3s-подуровне
6 электронов на 3p-подуровне
2 электрона на 4s-подуровне
6 электронов на 3d-подуровне
Степень окисления железа
Атомы железа в соединениях имеют степени окисления 6, 5, 4, 3, 2, 1, 0, -1, -2.
Степень окисления – это условный заряд атома в соединении: связь в молекуле
между атомами основана на разделении электронов, таким образом, если у атома виртуально увеличивается
заряд, то степень окисления отрицательная (электроны несут отрицательный заряд), если заряд уменьшается,
то степень окисления положительная.
Ионы железа
Валентность Fe
Атомы железа в соединениях проявляют валентность VI, V, IV, III, II, I.
Валентность железа характеризует способность атома Fe к образованию хмических связей.
Валентность следует из строения электронной оболочки атома, электроны, участвующие в образовании
химических соединений называются валентными электронами. Более обширное определение валентности это:
Число химических связей, которыми данный атом соединён с другими атомами
Валентность не имеет знака.
Квантовые числа Fe
Квантовые числа определяются последним электроном в конфигурации,
для атома Fe эти числа имеют значение N = 3, L = 2, Ml = 3, Ms = -½
Видео заполнения электронной конфигурации (gif):
Результат:
Энергия ионизации
Чем ближе электрон к центру атома – тем больше энергии необходимо, что бы его оторвать.
Энергия, затрачиваемая на отрыв электрона от атома называется энергией ионизации и обозначается Eo.
Если не указано иное, то энергия ионизации – это энергия отрыва первого электрона, также существуют энергии
ионизации для каждого последующего электрона.
Энергия ионизации Fe:
Eo = 763 кДж/моль
— Что такое ион читайте в статье.
Перейти к другим элементам таблицы менделеева
Где Fe в таблице менделеева?
Таблица Менделеева
Скачать таблицу менделеева в хорошем качестве
Электронное строение атома железа
Электронное строение нейтрального атома железа в основном состоянии.
Схема строения электронных оболочек
Распределение электронов по энергетическим уровням (или по электронным слоям) в атоме железа.
Fe
+26
2
8
14
2
Электронно-графическая схема
Распределение электронов по атомным орбиталям в атоме железа.
| 4 | ↑↓ | |||||||||||
| 3 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ↑ | ↑ | ↑ | ↑ | |||
| 2 | ↑↓ | ↑↓ | ↑↓ | ↑↓ | ||||||||
| 1 | ↑↓ | |||||||||||
| s | p | d |
Валентные орбитали атома железа выделены фиолетовым цветом.
Электронная конфигурация
Полная электронная конфигурация атома железа.
26Fe 1s2 2s2 2p6 3s2 3p6 3d6 4s2
Сокращённая электронная конфигурация атома железа.
26Fe [Ar] 3d6 4s2
Квантовые числа валентных электронов
Главное (n), орбитальное (l), магнитное (m) и спиновое (s) квантовые числа валентных электронов атома железа.
| Орбиталь | Квантовое число | |||
|---|---|---|---|---|
| n | l | m | s | |
| 3d | 3 | 2 | -2 | +½ |
| -½ | ||||
| 0 | +½ | |||
| 1 | +½ | |||
| 2 | +½ | |||
| 3 | +½ | |||
| 4s | 4 | 0 | 0 | +½ |
| -½ |

Построение структурно-электронной формулы элементов B-подгрупп
Материал по химии
Элементы побочной подгруппы еще называют d-элементами или переходными металлами. Они отличаются тем, что их валентные электроны расположены не только на s-подуровне внешнего энергетического слоя, но и на d-подуровне предвнешнего слоя. Валентными электронами называют те, что способны участвовать в образовании химической связи.
Что бы построить модель атома такого элемента, нам необходимо знать одно важное отличие этих элементов от элементов А-подгрупп: если у элементов главных (А) подгрупп количество электронов на внешнем уровне определяется по номеру группы (например, у лития один электрон на внешнем слое, у бериллия – два, у бора – три и так далее), то у элементов побочных подгрупп это количество не зависит от номера группы.
Для определения количества электронов на внешнем уровне, легче всего просто запомнить несколько распространённых примеров (они выделены красным):
|
Количество электронов на внешнем уровне |
Примеры элементов |
|---|---|
|
1 |
Cu, Ag, Au, Nb, Cr, Mo, Ru, Rh, Pt, Ds |
|
2 |
Все остальные элементы B-подгрупп, кроме палладия. |
Остальные правила работают как с элементами А-подгрупп, так и с элементами Б-подгрупп. Например, заряд ядра определяется по порядковому номеру элемента, количество энергетических уровней по расположению в определенном периоде.
Рассмотрим конфигурацию нескольких элементов побочных подгрупп:
Построение структурно-электронной формулы элементов B-подгрупп
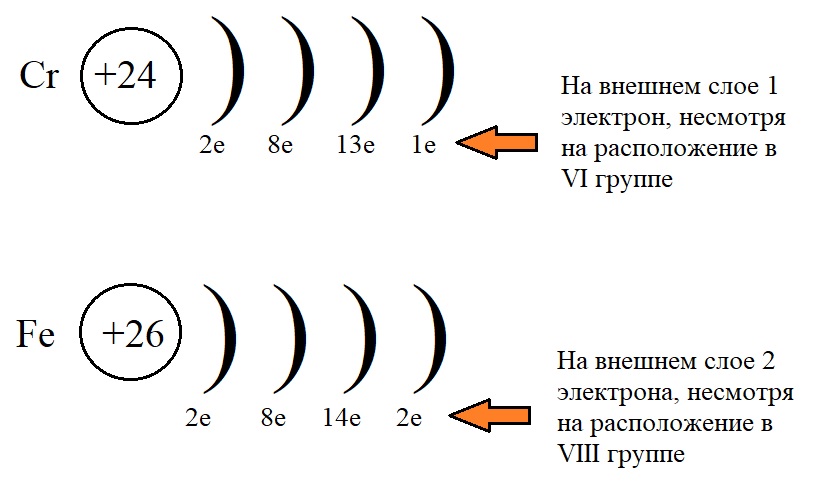
Конфигурация хрома и железа
На рисунке показано, что несмотря на положение элементов в определенных подгруппах, количество электронов у них не равно этой группе.
Для сравнения изучим еще один рисунок, на котором мы можем сравнить элементы А- и Б-подгрупп одной и той же группы:
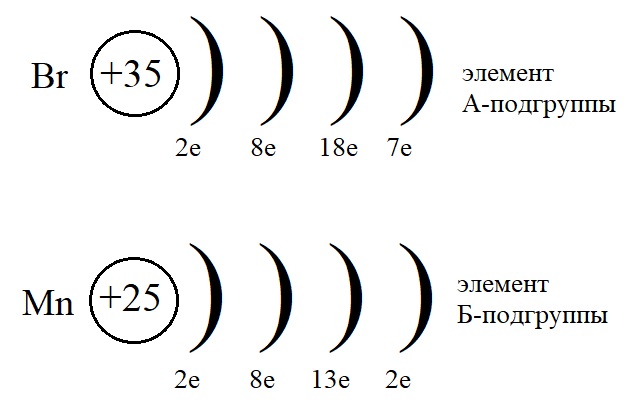
На этом рисунке мы снова можем убедиться, что элементы, находящиеся в одной и той же группе. В одном и том же периоде, но в разных подгруппах имеют разное строение.
Что бы разобраться, почему эти элементы называются d-элементами, разберем структурно-электронные формулы некоторых из них, например, хрома, железа и марганца, строение которых описывалось выше. Как уже было сказано, у этих элементов валентными являются не только внешний. Но и предвнешний уровень.
|
Cr |
3s2 3p6 3d5 4s1 |
↓↑ |
|
|
↑ |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
3s |
3p |
3d |
4s |
|
Fe |
3s2 3p6 3d6 4s2 |
↓↑ |
|
|
↑↓ |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
3s |
3p |
3d |
4s |
|
Mn |
3s2 3p6 3d5 4s2 |
↓↑ |
|
|
↑↓ |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
3s |
3p |
3d |
4s |
d-орбиталь содержит неспаренные электроны, которые могут вступать в химическую связь. Поэтому высшая валентность хрома равна не двум (по количеству электронов на внешнем уровне), а шести – по общему количеству электронов внешнего энергетического уровня и d-электронов предвнешнего уровня.
Вы можете встретить немного измененный порядок заполнения орбиталей, например, у марганца: 3s2 3p6 4s2 3d5. s- и d-подуровень поменялись местами, в таких формулах учтен уровень энергии орбиталей: чем меньшей энергией обладает орбиталь, тем быстрее она будет заполняться электронами.
Правильнее будет заполнять электроны в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p…
Тренировочные задания ЕГЭ
Задание 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
|
|
|
|
|
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных элементов имеют электронную конфигурацию внешнего энергетического уровня ns2(n-1) d10
Решение задания:
Для начала разберемся со страшной формулой ns2(n-1) d10. Попробуем заменить переменную n на любое число, например, на 4, тогда мы получим 4s2(4-1)d10 или 4s23d10. Эта формула отображает порядок распределения электронов согласно их энергии. Если для нас такой порядок непривычен, то мы можем поменять его местами, тогда получим 3d104s2. Получившаяся формула приблизительна, вместо нее может быть 4d105s2 или 5d106s2 , но по этой формуле мы понимаем, что должны искать элемент с двумя электронами на внешнем энергетическом уровне (это приводит к тому, что медь выбывает из списка претендентов на правильный ответ), и элемент должен иметь d-орбиталь на внешнем уровне (кальций и стронций выпадают)
Верный ответ: 23
Задание 2.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
|
|
|
|
|
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных в ряду элементов не имеют на внешнем энергетическом уровне неспаренных электронов.
Решение: построим электронные конфигурации данных атомов.
|
Сурьма – Sb, элемент главной подгруппы пятой группы (А), у таких элементов валентные электроны находятся только на внешнем слое: 5s25p3, что соответствует структурно-электронной формуле: Элемент имеет три неспаренных p-электрона. |
Последовательность расположения электронов на энергетических уровнях выражается следующим рядом чисел:
|
||||||||||||||||
|
Магний – Mg, элемент главной подгруппы второй группы (А). поэтому его внешний энергетический слой будет имеет следующую формулу: 3s2 Не имеет неспаренных электронов. |
|
||||||||||||||||
|
Железо – Fe, элемент побочной подгруппы (Б), у таких элементов валентными являются как электроны внешнего уровня, так и d-электроны предвнешнего уровня. 3d64s2
Есть четыре неспаренных электрона на d-подуровне. |
|
||||||||||||||||
|
Титан -Ti, 3d24s2
Есть два неспаренных электрона на d-подуровне. |
|
||||||||||||||||
|
Цинк – Zn, 3d104s2
Нет неспаренных электронов. |
|
Верный ответ: 45
поделиться знаниями или
запомнить страничку
- Все категории
-
экономические
43,655 -
гуманитарные
33,653 -
юридические
17,917 -
школьный раздел
611,944 -
разное
16,904
Популярное на сайте:
Как быстро выучить стихотворение наизусть? Запоминание стихов является стандартным заданием во многих школах.
Как научится читать по диагонали? Скорость чтения зависит от скорости восприятия каждого отдельного слова в тексте.
Как быстро и эффективно исправить почерк? Люди часто предполагают, что каллиграфия и почерк являются синонимами, но это не так.
Как научится говорить грамотно и правильно? Общение на хорошем, уверенном и естественном русском языке является достижимой целью.
