На чтение 23 мин Просмотров 11 Опубликовано 26 марта 2023 Обновлено 26 марта 2023
Содержание
- Электронная формула элемента.
- Электронные формулы химических элементов
- Строение атома
- Запись формулы
- Что мы узнали?
- Электронная конфигурация атома
- Теория к заданию 1 из ЕГЭ по химии
- Строение электронных оболочек атомов элементов первых четырех периодов: $s-$, $p-$ и $d-$элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
- Электроны
- Состояние электронов в атоме
- Ядро атома
- Протоны и нейтроны
- Изотопы
- Строение электронных оболочек атомов элементов первых четырех периодов
- Электронная конфигурация атома. Основное и возбужденное состояние атомов
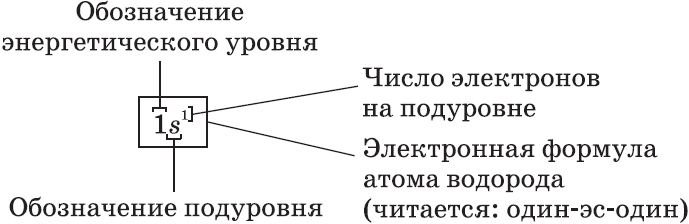
Электронная формула элемента.
Алгоритм составления электронной формулы элемента:
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей:
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s 2 , на втором – максимум 8 (два s и шесть р: 2s 2 2p 6 ), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s 2 3p 6 3d 10 ).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.


Энергетическая диаграмма азота.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.

Энергетическая диаграмма аргона.
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.

Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 – это электронная формула аргона.
Электронную формулу цинка можно представить в виде:
Источник
Электронные формулы химических элементов


Всего получено оценок: 416.
Всего получено оценок: 416.
Расположение электронов на энергетических оболочках или уровнях записывают с помощью электронных формул химических элементов. Электронные формулы или конфигурации помогают представить структуру атома элемента.
Строение атома
Чтобы читать электронные формулы, необходимо понять строение атома.
Атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронов, которые располагаются вокруг ядра.
Электроны находятся на разных энергетических уровнях. Чем дальше электрон находится от ядра, тем большей энергией он обладает. Размер энергетического уровня определяется размером атомной орбитали или орбитального облака. Это пространство, в котором движется электрон.
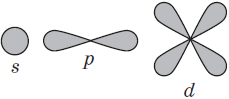
Орбитали могут иметь разную геометрическую конфигурацию:
- s-орбитали – сферические;
- р-, d и f-орбитали – гантелеобразные, лежащие в разных плоскостях.
На первом энергетическом уровне любого атома всегда располагается s-орбиталь с двумя электронами (исключение – водород). Начиная со второго уровня, на одном уровне находятся s- и р-орбитали.
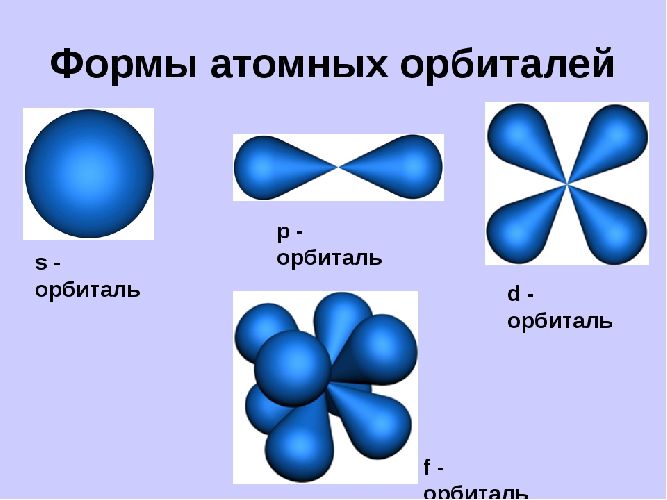 Рис. 2. s-, р-, d и f-орбитали.
Рис. 2. s-, р-, d и f-орбитали.
Орбитали существуют вне зависимости от нахождения на них электронов и могут быть заполненными или вакантными.
Запись формулы
Электронные конфигурации атомов химических элементов записываются по следующим принципам:
- каждому энергетическому уровню соответствует порядковый номер, обозначаемый арабской цифрой;
- за номером следует буква, означающая орбиталь;
- над буквой пишется верхний индекс, соответствующий количеству электронов на орбитали.
Записать электронную формулу помогает таблица Менделеева. Количеству энергетических уровней соответствует номер периода. На заряд атома и количество электронов указывает порядковый номер элемента. Номер группы показывает, сколько валентных электронов находится на внешнем уровне.
Для примера возьмём Na. Натрий находится в первой группе, в третьем периоде, под 11 номером. Это значит, что атом натрия имеет положительно заряженное ядро (содержит 11 протонов), вокруг которого на трёх энергетических уровнях располагается 11 электронов. На внешнем уровне находится один электрон.
Вспомним, что первый энергетический уровень содержит s-орбиталь с двумя электронами, а второй – s- и р-орбитали. Остаётся заполнить уровни и получить полную запись:
Для удобства созданы специальные таблицы электронных формул элемента. В длинной периодической таблице формулы также указываются в каждой клетке элемента.
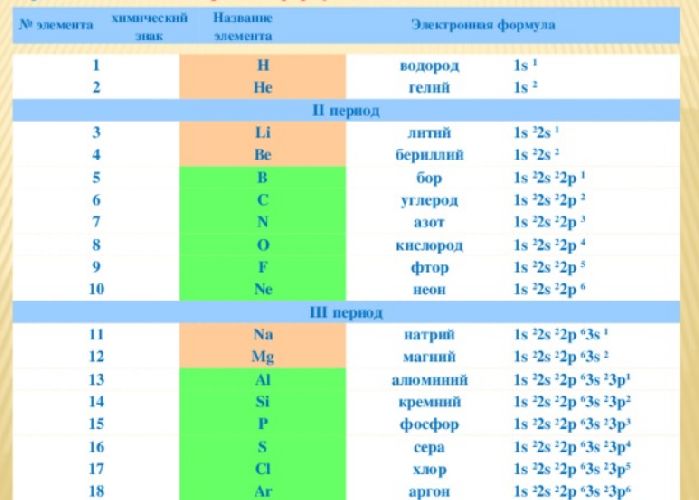 Рис. 3. Таблица электронных формул.
Рис. 3. Таблица электронных формул.
Для краткости в квадратных скобках записаны элементы, электронная формула которых совпадает с началом формулы элемента. Например, электронная формула магния – [Ne]3s 2 , неона – 1s 2 2s 2 2p 6 . Следовательно, полная формула магния – 1s 2 2s 2 2p 6 3s 2 .

Что мы узнали?
Электронные формулы элементов отражают расположение электронов в атоме на разных орбиталях. Количество электронов равно порядковому номеру элемента, количество уровней – номеру периода. На последнем уровне находятся валентные электроны, соответствующие номеру группы элемента. Цифры в электронной формуле показывают уровень, буквы – орбиталь, индексы – количество электронов на уровне.
Источник
Электронная конфигурация атома
Теория к заданию 1 из ЕГЭ по химии
Строение электронных оболочек атомов элементов первых четырех периодов: $s-$, $p-$ и $d-$элементы. Электронная конфигурация атома. Основное и возбужденное состояние атомов
Понятие атом возникло еще в античном мире для обо значения частиц вещества. В переводе с греческого атом означает «неделимый».
Электроны
Ирландский физик Стони на основании опытов пришел к выводу, что электричество переносится мельчайшими частицами, существующими в атомах всех химических элементов. В $1891$ г. Стони предложил эти частицы назвать электронами, что по-гречески означает «янтарь».
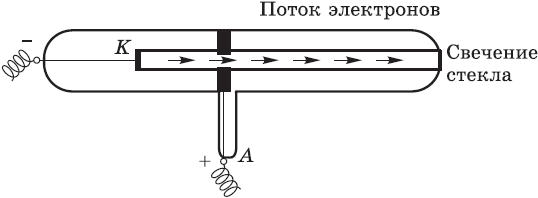
Через несколько лет после того, как электрон получил свое название, английский физик Джозеф Томсон и французский физик Жан Перрен доказали, что электроны несут на себе отрицательный заряд. Это наименьший отрицательный заряд, который в химии принят за единицу $(–1)$. Томсон даже сумел определить скорость движения электрона (она равна скорости света — $300 000$ км/с) и массу электрона (она в $1836$ раз меньше массы атома водорода).
Томсон и Перрен соединяли полюса источника тока с двумя металлическими пластинами — катодом и анодом, впаянными в стеклянную трубку, из которой был откачан воздух. При подаче на пластины-электроды напряжения около 10 тысяч вольт в трубке вспыхивал светящийся разряд, а от катода (отрицательного полюса) к аноду (положительному полюсу) летели частицы, которые ученые сначала назвали катодными лучами, а затем выяснили, что это был поток электронов. Электроны, ударяясь об особые вещества, нанесенные, например, на экран телевизора, вызывают свечение.
Был сделан вывод: электроны вырываются из атомов материала, из которого сделан катод.
Свободные электроны или поток их можно получить и другими способами, например, при накаливании металлической проволоки или при падении света на металлы, образованные элементами главной подгруппы I группы таблицы Менделеева (например, цезий).
Состояние электронов в атоме
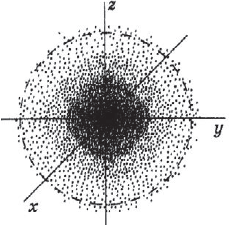
Под состоянием электрона в атоме понимают совокупность информации об энергии определенного электрона в пространстве, в котором он находится. Мы уже знаем, что электрон в атоме не имеет траектории движения, т.е. можно говорить лишь о вероятности нахождения его в пространстве вокруг ядра. Он может находиться в любой части этого пространства, окружающего ядро, и совокупность различных положений его рассматривают как электронное облако с определенной плотностью отрицательного заряда. Образно это можно представить себе так: если бы удалось через сотые или миллионные доли секунды сфотографировать положение электрона в атоме, как при фотофинише, то электрон на таких фотографиях был бы представлен в виде точки. При наложении бесчисленного множества таких фотографий получилась бы картина электронного облака с наибольшей плотностью там, где этих точек больше всего.
На рисунке показан «разрез» такой электронной плотности в атоме водорода, проходящей через ядро, а штриховой линией ограничена сфера, внутри которой вероятность обнаружения электрона составляет $90%$. Ближайший к ядру контур охватывает область пространства, в которой вероятность обнаружения электрона — $10%$, вероятность обнаружения электрона внутри второго от ядра контура составляет $20%$, внутри третьего — $≈30%$ и т.д. В состоянии электрона есть некая неопределенность. Чтобы охарактеризовать это особое состояние, немецкий физик В. Гейзенберг ввел понятие о принципе неопределенности, т.е. показал, что невозможно определить одновременно и точно энергию и местоположение электрона. Чем точнее определена энергия электрона, тем неопределеннее его положение, и наоборот, определив положение, нельзя определить энергию электрона. Область вероятности обнаружения электрона не имеет четких границ. Однако можно выделить пространство, где вероятность нахождения электрона максимальна.
Пространство вокруг атомного ядра, в котором наиболее вероятно нахождение электрона, называется орбиталью.
В нем заключено приблизительно $90%$ электронного облака, и это означает, что около $90%$ времени электрон находится в этой части пространства. По форме различают $4$ известных ныне типа орбиталей, которые обозначаются латинскими буквами $s, p, d$ и $f$. Графическое изображение некоторых форм электронных орбиталей представлено на рисунке.
Важнейшей характеристикой движения электрона на определенной орбитали является энергия его связи с ядром. Электроны, обладающие близкими значениями энергии, образуют единый электронный слой, или энергетический уровень. Энергетические уровни нумеруют, начиная от ядра: $1, 2, 3, 4, 5, 6$ и $7$.
Целое число $n$, обозначающее номер энергетического уровня, называют главным квантовым числом.
Оно характеризует энергию электронов, занимающих данный энергетический уровень. Наименьшей энергией обладают электроны первого энергетического уровня, наиболее близкого к ядру. По сравнению с электронами первого уровня электроны последующих уровней характеризуются большим запасом энергии. Следовательно, наименее прочно связаны с ядром атома электроны внеш него уровня.
Число энергетических уровней (электронных слоев) в атоме равно номеру периода в системе Д. И. Менделеева, к которому принадлежит химический элемент: у атомов элементов первого периода один энергетический уровень; второго периода — два; седьмого периода — семь.
Наибольшее число электронов на энергетическом уровне определяется по формуле:
где $N$ — максимальное число электронов; $n$ — номер уровня, или главное квантовое число. Следовательно: на первом, ближайшем к ядру энергетическом уровне может находиться не более двух электронов; на втором — не более $8$; на третьем — не более $18$; на четвертом — не более $32$. А как, в свою очередь, устроены энергетические уровни (электронные слои)?
Начиная со второго энергетического уровня $(n = 2)$, каждый из уровней подразделяется на подуровни (подслои), несколько отличающиеся друг от друга энергией связи с ядром.
Число подуровней равно значению главного квантового числа: первый энергетический уровень имеет один под уровень; второй — два; третий — три; четвертый — четыре. Подуровни, в свою очередь, образованы орбиталями.
Каждому значению $n$ соответствует число орбиталей, равное $n^2$. По данным, представленным в таблице, можно проследить связь главного квантового числа $n$ с числом подуровней, типом и числом орбиталей и максимальным числом электронов на подуровне и уровне.
Главное квантовое число, типы и число орбиталей, максимальное число электронов на подуровнях и уровнях.
| Энергетический уровень $(n)$ | Число подуровней, равное $n$ | Тип орбитали | Число орбиталей | Максимальное число электронов | ||
| в подуровне | в уровне, равное $n^2$ | в подуровне | на уровне, равное $n^2$ | |||
| $K(n=1)$ | $1$ | $1s$ | $1$ | $1$ | $2$ | $2$ |
| $L(n=2)$ | $2$ | $2s$ | $1$ | $4$ | $2$ | $8$ |
| $2p$ | $3$ | $6$ | ||||
| $M(n=3)$ | $3$ | $3s$ | $1$ | $9$ | $2$ | $18$ |
| $3p$ | $3$ | $6$ | ||||
| $3d$ | $5$ | $10$ | ||||
| $N(n=4)$ | $4$ | $4s$ | $1$ | $16$ | $2$ | $32$ |
| $4p$ | $3$ | $6$ | ||||
| $4d$ | $5$ | $10$ | ||||
| $4f$ | $7$ | $14$ |
Подуровни принято обозначать латинскими буквами, равно как и форму орбиталей, из которых они состоят: $s, p, d, f$. Так:
- $s$-подуровень — первый, ближайший к ядру атома подуровень каждого энергетического уровня, состоит из одной $s$-орбитали;
- $р$-подуровень — второй подуровень каждого, кроме первого, энергетического уровня, состоит из трех $р$-орбиталей;
- $d$-подуровень — третий подуровень каждого, начиная с третьего, энергетического уровня, состоит из пяти $d$-орбиталей;
- $f$-подуровень каждого, начиная с четвертого, энергетического уровня, состоит из семи $f$-орбиталей.
Ядро атома
Но не только электроны входят в состав атомов. Физик Анри Беккерель обнаружил, что природный минерал, содержащий соль урана, тоже испускает неведомое излучение, засвечивая фотопленки, закрытые от света. Это явление было названо радиоактивностью.
Различают три вида радиоактивных лучей:
- $α$-лучи, которые состоят из $α$-частиц, имеющих заряд в $2$ раза больше заряда электрона, но с положительным знаком, и массу в $4$ раза больше массы атома водорода;
- $β$-лучи представляют собой поток электронов;
- $γ$-лучи — электромагнитные волны с ничтожно малой массой, не несущие электрического заряда.
Следовательно, атом имеет сложное строение — состоит из положительно заряженного ядра и электронов.
В 1910 г. в Кембридже, близ Лондона, Эрнест Резерфорд со своими учениками и коллегами изучал рассеяние $α$-частиц, проходящих через тоненькую золотую фольгу и падаюших на экран. Альфа-частицы обычно отклонялись от первоначального направления всего на один градус, подтверждая, казалось бы, равномерность и однородность свойств атомов золота. И вдруг исследователи заметили, что некоторые $α$-частицы резко меняли направление своего пути, будто наталкиваясь на какую-то преграду.
Разместив экран перед фольгой, Резерфорд сумел обнаружить даже те редчайшие случаи, когда $α$-частицы, отразившись от атомов золота, летели в противоположном направлении.
Расчеты показали, что наблюдаемые явления могли произойти, если бы вся масса атома и весь его положительный заряд были сосредоточены в крохотном центральном ядре. Радиус ядра, как выяснилось, в 100 000 раз меньше радиуса всего атома, той его области, в которой находятся электроны, имеющие отрицательный заряд. Если применить образное сравнение, то весь объем атома можно уподобить стадиону в Лужниках, а ядро — футбольному мячу, расположенному в центре поля.
Атом любого химического элемента сравним с крохотной Солнечной системой. Поэтому такую модель атома, предложенную Резерфордом, называют планетарной.
Протоны и нейтроны
Оказывается, и крошечное атомное ядро, в котором сосредоточена вся масса атома, состоит из частиц двух видов — протонов и нейтронов.
Протоны имеют заряд, равный заряду электронов, но противоположный по знаку $(+1)$, и массу, равную массе атома водорода (она принята в химии за единицу). Обо значаются протоны знаком $↙<1>↖<1>p$ (или $р+$). Нейтроны не несут заряда, они нейтральны и имеют массу, равную массе протона, т.е. $1$. Обозначают нейтроны знаком $↙<0>↖<1>n$ (или $n^0$).
Протоны и нейтроны вместе называют нуклонами (от лат. nucleus — ядро).
Сумма числа протонов и нейтронов в атоме называется массовым числом. Например, массовое число атома алюминия:
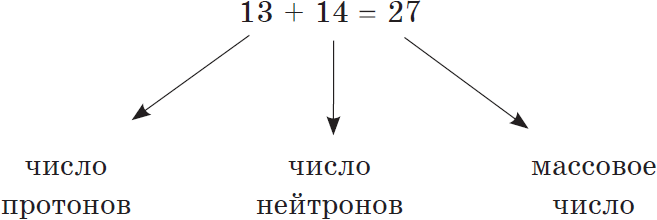
Так как массой электрона, ничтожно малой, можно пренебречь, то очевидно, что в ядре сосредоточена вся масса атома. Электроны обозначают так: $e↖<->$.
Поскольку атом электронейтрален, также очевидно, что число протонов и электронов в атоме одинаково. Оно равно порядковому номеру химического элемента, присвоенному ему в Периодической системе. Например, в ядре атома железа содержится $26$ протонов, а вокруг ядра вращается $26$ электронов. А как определить число ней тронов?
Как известно, масса атома складывается из массы протонов и нейтронов. Зная порядковый номер элемента $(Z)$, т.е. число протонов, и массовое число $(А)$, равное сумме чисел протонов и нейтронов, можно найти число нейтронов $(N)$ по формуле:
Например, число нейтронов в атоме железа равно:
В таблице представлены основные характеристики элементарных частиц.
Основные характеристики элементарных частиц.
| Частица и ее обозначение | Масса | Заряд | Примечание |
| Протон — $p^+$ | $1$ | $+1$ | Число протонов равно порядковому номеру элемента |
| Нейтрон — $n^0$ | $1$ | $0$ | Число нейтронов находят по формуле: $N=A-Z$ |
| Электрон — $e↖<->$ | $<1>/<1837>$ | $-1$ | Число электронов равно порядковому номеру элемента |
Изотопы
Разновидности атомов одного и того же элемента, имеющие одинаковый заряд ядра, но разное массовое число, называются изотопами.
Слово изотоп состоит из двух греческих слов: isos — одинаковый и topos — место, обозначает «занимающий одно место» (клетку) в Периодической системе элементов.
Химические элементы, встречающиеся в природе, являются смесью изотопов. Так, углерод имеет три изотопа с массой $12, 13, 14$; кислород — три изотопа с массой $16, 17, 18$ и т. д.
Обычно приводимая в Периодической системе относительная атомная масса химического элемента является средним значением атомных масс природной смеси изотопов данного элемента с учетом их относительного содержания в природе, поэтому значения атомных масс довольно часто являются дробными. Например, атомы природного хлора представляют собой смесь двух изотопов — $35$ (их в природе $75%$) и $37$ (их $25%$); следовательно, относительная атомная масса хлора равна $35.5$. Изотопы хлора записываются так:
Химические свойства изотопов хлора совершенно одинаковы, как и изотопов большинства химических элементов, например калия, аргона:
Однако изотопы водорода сильно различаются по свойствам из-за резкого кратного увеличения их относительной атомной массы; им даже присвоены индивидуальные названия и химические знаки: протий — $↖<1>↙<1>$; дейтерий — $↖<2>↙<1>$, или $↖<2>↙<1>$; тритий — $↖<3>↙<1>$, или $↖<3>↙<1>$.
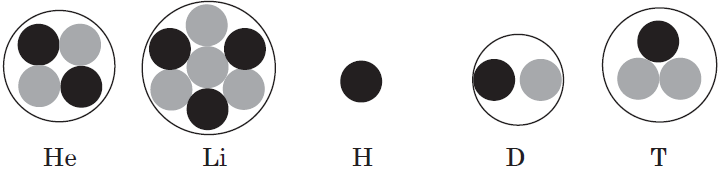
Теперь можно дать современное, более строгое и научное определение химическому элементу.
Химический элемент — это совокупность атомов с одинаковым зарядом ядра.
Строение электронных оболочек атомов элементов первых четырех периодов
Рассмотрим отображение электронных конфигураций атомов элементов по периодам системы Д. И. Менделеева.
Схемы электронного строения атомов показывают распределение электронов по электронным слоям (энергетическим уровням).
Электронные формулы атомов показывают распределение электронов по энергетическим уровням и под уровням.
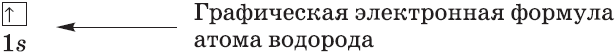
Графические электронные формулы атомов показывают распределение электронов не только по уровням и под уровням, но и по орбиталям.

В атоме гелия первый электронный слой завершен — в нем $2$ электрона.
Водород и гелий — $s$-элементы, у этих атомов заполняется электронами $s$-орбиталь.
У всех элементов второго периода первый электронный слой заполнен, и электроны заполняют $s-$ и $р$-орбитали второго электронного слоя в соответствии с принципом наименьшей энергии (сначала $s$, а затем $р$) и правилами Паули и Хунда.
В атоме неона второй электронный слой завершен — в нем $8$ электронов.
Элементы третьего периода.
У атомов элементов третьего периода первый и второй электронные слои завершены, поэтому заполняется третий электронный слой, в котором электроны могут занимать 3s-, 3р- и 3d-под уровни.
Строение электронных оболочек атомов элементов третьего периода.
У атома магния достраивается $3,5$-электронная орбиталь. $Na$ и $Mg$ — $s$-элементы.
У алюминия и последующих элементов заполняется электронами $3d$-подуровень.
В атоме аргона на внешнем слое (третьем электронном слое) $8$ электронов. Как внешний слой завершен, но всего в третьем электронном слое, как вы уже знаете, может быть 18 электронов, а это значит, что у элементов третьего периода остаются незаполненными $3d$-орбитали.
Все элементы от $Al$ до $Ar$ — $р$-элементы.
$s-$ и $р$-элементы образуют главные подгруппы в Периодической системе.
Элементы четвертого периода.
У атомов калия и кальция появляется четвертый электронный слой, заполняется $4s$-подуровень, т.к. он имеет меньшую энергию, чем $3d$-подуровень. Для упрощения графических электронных формул атомов элементов четвертого периода:
- обозначим условно графическую электронную формулу аргона так: $Ar$;
- не будем изображать подуровни, которые у этих атомов не заполняются.
$К, Са$ — $s$-элементы, входящие в главные подгруппы. У атомов от $Sc$ до $Zn$ заполняется электронами 3d-подуровень. Это $3d$-элементы. Они входят в побочные подгруппы, у них заполняется предвнешний электронный слой, их относят к переходным элементам.
Обратите внимание на строение электронных оболочек атомов хрома и меди. В них происходит «провал» одного электрона с $4s-$ на $3d$-подуровень, что объясняется большей энергетической устойчивостью образующихся при этом электронных конфигураций $3d^5$ и $3d^<10>$:
$↙<24>$ $1s^<2>2s^<2>2p^<6>3s^<2>3p^<6>3d^ <4>4s^<2>…$ 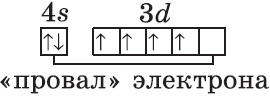
$↙<29>$ $1s^<2>2s^<2>2p^<6>3s^<2>3p^<6>3d^<9>4s^<2>…$ 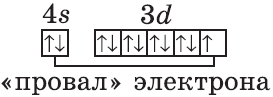
| Символ элемента, порядковый номер, название | Схема электронного строения | Электронная формула | Графическая электронная формула |
| $↙<19>$ Калий | 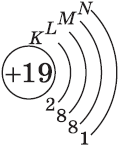 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^1$ | 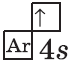 |
| $↙<20>$ Кальций | 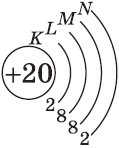 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^2$ | 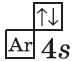 |
| $↙<21>$ Скандий | 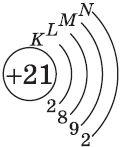 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^1<3>d^1$ или $1s^2<2>s^2<2>p^6<3>p^6<3>d^1<4>s^1$ | 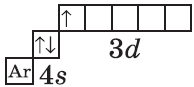 |
| $↙<22>$ Титан | 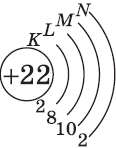 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^2<3>d^2$ или $1s^2<2>s^2<2>p^6<3>p^6<3>d^2<4>s^2$ | 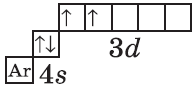 |
| $↙<23>$ Ванадий | 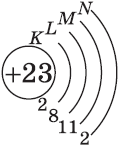 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^2<3>d^3$ или $1s^2<2>s^2<2>p^6<3>p^6<3>d^3<4>s^2$ | 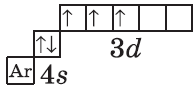 |
| $↙<24><Сr>$ Хром | 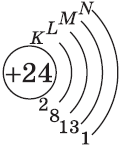 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^1<3>d^5$ или $1s^2<2>s^2<2>p^6<3>p^6<3>d^5<4>s^1$ | 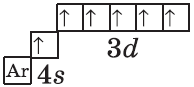 |
| $↙<29><Сu>$ Хром | 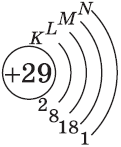 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^1<3>d^<10>$ или $1s^2<2>s^2<2>p^6<3>p^6<3>d^<10><4>s^1$ | 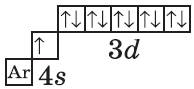 |
| $↙<30>$ Цинк | 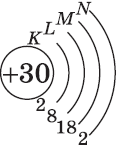 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^2<3>d^<10>$ или $1s^2<2>s^2<2>p^6<3>p^6<3>d^<10><4>s^2$ | 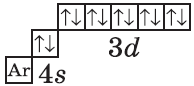 |
| $↙<31>$ Галлий | 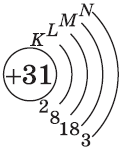 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^2<3>d^<10>4p^<1>$ или $1s^2<2>s^2<2>p^6<3>p^6<3>d^<10><4>s^<2>4p^<1>$ | 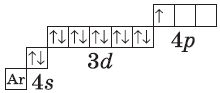 |
| $↙<36>$ Криптон | 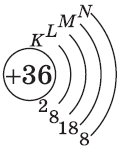 |
$1s^2<2>s^2<2>p^6<3>p^6<4>s^2<3>d^<10>4p^6$ или $1s^2<2>s^2<2>p^6<3>p^6<3>d^<10><4>s^<2>4p^6$ | 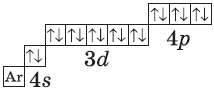 |
В атоме цинка третий электронный слой завершен — в нем заполнены все подуровни $3s, 3р$ и $3d$, всего на них $18$ электронов.
У следующих за цинком элементов продолжает заполняться четвертый электронный слой, $4р$-подуровень. Элементы от $Ga$ до $Кr$ — $р$-элементы.
У атома криптона внешний (четвертый) слой завершен, имеет $8$ электронов. Но всего в четвертом электронном слое, как вы знаете, может быть $32$ электрона; у атома криптона пока остаются незаполненными $4d-$ и $4f$-подуровни.
У элементов пятого периода идет заполнение подуровней в следующем порядке: $5s → 4d → 5р$. И также встречаются исключения, связанные с «провалом» электронов, у $↙<41>Nb$, $↙<42>Мо$, $↙<44>Ru$, $↙<45>Rh$, $↙<46>Pd$, $↙<47>Ag$. В шестом и седьмом периодах появляются $f$-элементы, т.е. элементы, у которых идет заполнение соответственно $4f-$ и $5f$-подуровней третьего снаружи электронного слоя.
$4f$-элементы называют лантаноидами.
$5f$-элементы называют актиноидами.
Порядок заполнения электронных подуровней в атомах элементов шестого периода: $↙<55>Cs$ и $↙<56>Ва$ — $6s$-элементы; $↙<57>La . 6s^<2>5d^<1>$ — $5d$-элемент; $↙<58>Се$ – $↙<71>Lu — 4f$-элементы; $↙<72>Hf$ – $↙<80>Hg — 5d$-элементы; $↙<81>Т1$ – $↙<86>Rn — 6d$-элементы. Но и здесь встречаются элементы, у которых нарушается порядок заполнения электронных орбиталей, что, например, связано с большей энергетической устойчивостью наполовину и полностью заполненных $f$-подуровней, т.е. $nf^7$ и $nf^<14>$.
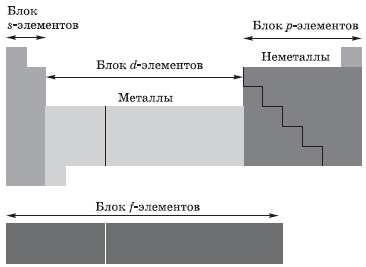
В зависимости от того, какой подуровень атома заполняется электронами последним, все элементы, как вы уже поняли, делят на четыре электронных семейства, или блока:
- $s$-элементы; электронами заполняется $s$-подуровень внешнего уровня атома; к $s$-элементам относятся водород, гелий и элементы главных подгрупп I и II групп;
- $р$-элементы; электронами заполняется $р$-подуровень внешнего уровня атома; к $р$-элементам относятся элементы главных подгрупп III–VIII групп;
- $d$-элементы; электронами заполняется $d$-подуровень предвнешнего уровня атома; к $d$-элементам относятся элементы побочных подгрупп I–VIII групп, т.е. элементы вставных декад больших периодов, расположенных между $s-$ и $р-$элементами. Их также называют переходными элементами;
- $f$-элементы; электронами заполняется $f-$подуровень третьего снаружи уровня атома; к ним относятся лантаноиды и актиноиды.
Электронная конфигурация атома. Основное и возбужденное состояние атомов
Швейцарский физик В. Паули в $1925$ г. установил, что в атоме на одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины (в переводе с английского — веретено), т.е. обладающих такими свойствами, которые условно можно представить себе как вращение электрона вокруг своей воображаемый оси по часовой стрелке или против. Этот принцип носит название принципа Паули.
Если на орбитали находится один электрон, то он называется неспаренным, если два, то это спаренные электроны, т.е. электроны с противоположными спинами.
На рисунке показана схема деления энергетических уровней на подуровни.
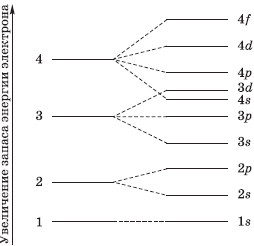
$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия Не, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s$-орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$.$s-$Орбиталь, как вы уже знаете, имеет сферическую форму. Электрон атома водорода $(n = 1)$ располагается на этой орбитали и неспарен. По этому его электронная формула, или электронная конфигурация, записывается так: $1s^1$. В электронных формулах номер энергетического уровня обозначается цифрой, стоящей перед буквой $(1…)$, латинской буквой обозначают подуровень (тип орбитали), а цифра, которая записывается справа сверху от буквы (как показатель степени), показывает число электронов на подуровне.
Для атома гелия $Не$, имеющего два спаренных электрона на одной $s-$орбитали, эта формула: $1s^2$. Электронная оболочка атома гелия завершена и очень устойчива. Гелий — это благородный газ. На втором энергетическом уровне $(n = 2)$ имеются четыре орбитали, одна $s$ и три $р$. Электроны $s-$орбитали второго уровня ($2s$-орбитали) обладают более высокой энергией, т.к. находятся на большем расстоянии от ядра, чем электроны $1s$-орбитали $(n = 2)$. Вообще для каждого значения $n$ существует одна $s-$орбиталь, но с соответствующим запасом энергии электронов на нем и, следовательно, с соответствующим диаметром, растущим по мере увеличения значения $n$. 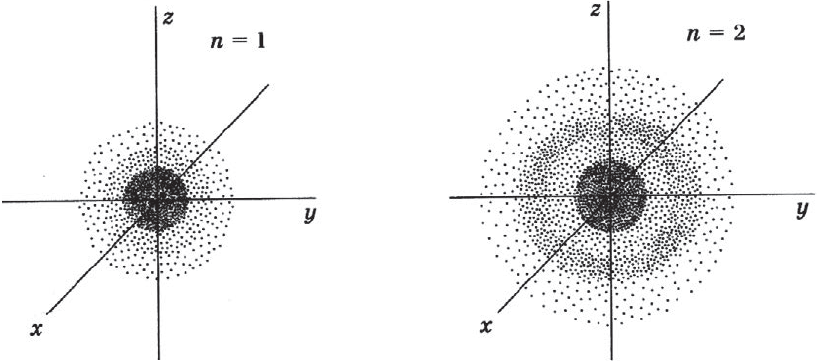
$р-$Орбиталь имеет форму гантели, или объемной восьмерки. Все три $р$-орбитали расположены в атоме взаимно перпендикулярно вдоль пространственных координат, проведенных через ядро атома. Следует подчеркнуть еще раз, что каждый энергетический уровень (электронный слой), начиная с $n= 2$, имеет три $р$-орбитали. С увеличением значения $n$ электроны занимают $р$-орбитали, расположенные на больших расстояниях от ядра и направленные по осям $x, y, z$.
У элементов второго периода $(n = 2)$ заполняется сначала одна $s$-орбиталь, а затем три $р$-орбитали; электронная формула $Li: 1s^<2>2s^<1>$. Электрон $2s^1$ слабее связан с ядром атома, поэтому атом лития может легко отдавать его (как вы, очевидно, помните, этот процесс называется окислением), превращаясь в ион лития $Li^+$.
В атоме бериллия Be четвертый электрон также размещается на $2s$-орбитали: $1s^<2>2s^<2>$. Два внешних электрона атома бериллия легко отрываются — $В^0$ при этом окисляется в катион $Ве^<2+>$.
У атома бора пятый электрон занимает $2р$-орбиталь: $1s^<2>2s^<2>2p^<1>$. Далее у атомов $C, N, O, F$ идет заполнение $2р$-орбиталей, которое заканчивается у благородного газа неона: $1s^<2>2s^<2>2p^<6>$.
У элементов третьего периода заполняются соответственно $3s-$ и $3р$-орбитали. Пять $d$-орбиталей третьего уровня при этом остаются свободными:
Иногда в схемах, изображающих распределение электронов в атомах, указывают только число электронов на каждом энергетическом уровне, т.е. записывают сокращенные электронные формулы атомов химических элементов, в отличие от приведенных выше полных электронных формул, например:
$↙<11>Na 2, 8, 1;$ $↙<17>Cl 2, 8, 7;$ $↙<18>Ar 2, 8, 8$.
У элементов больших периодов (четвертого и пятого) первые два электрона занимают соответственно $4s-$ и $5s$-орбитали: $↙<19>K 2, 8, 8, 1;$ $↙<38>Sr 2, 8, 18, 8, 2$. Начиная с третьего элемента каждого большого периода, последующие десять электронов поступят на предыдущие $3d-$ и $4d-$орбитали соответственно (у элементов побочных подгрупп): $↙<23>V 2, 8, 11, 2;$ $↙<26>Fr 2, 8, 14, 2;$ $↙<40>Zr 2, 8, 18, 10, 2;$ $↙<43>Tc 2, 8, 18, 13, 2$. Как правило, когда будет заполнен предыдущий $d$-подуровень, начнет заполняться внешний (соответственно $4р-$ и $5р-$) $р-$подуровень: $↙<33>As 2, 8, 18, 5;$ $↙<52>Te 2, 8, 18, 18, 6$.
У элементов больших периодов — шестого и незавершенного седьмого — электронные уровни и подуровни заполняются электронами, как правило, так: первые два электрона поступают на внешний $s-$подуровень: $↙<56>Ba 2, 8, 18, 18, 8, 2;$ $↙<87>Fr 2, 8, 18, 32, 18, 8, 1$; следующий один электрон (у $La$ и $Са$) на предыдущий $d$-подуровень: $↙<57>La 2, 8, 18, 18, 9, 2$ и $↙<89>Ac 2, 8, 18, 32, 18, 9, 2$.
Затем последующие $14$ электронов поступят на третий снаружи энергетический уровень, на $4f$ и $5f$-орбитали соответственно лантоноидов и актиноидов: $↙<64>Gd 2, 8, 18, 25, 9, 2;$ $↙<92>U 2, 8, 18, 32, 21, 9, 2$.
Затем снова начнет застраиваться второй снаружи энергетический уровень ($d$-подуровень) у элементов побочных подгрупп: $↙<73>Ta 2, 8, 18, 32, 11, 2;$ $↙<104>Rf 2, 8, 18, 32, 32, 10, 2$. И, наконец, только после полного заполнения десятью электронами $d$-подуровня будет снова заполняться $р$-под уровень: $↙<86>Rn 2, 8, 18, 32, 18, 8$.
Очень часто строение электронных оболочек атомов изображают с помощью энергетических, или квантовых ячеек — записывают так называемые графические электронные формулы. Для этой записи используют следующие обозначения: каждая квантовая ячейка обозначается клеткой, которая соответствует одной орбитали; каждый электрон обозначается стрелкой, соответствующей направлению спина. При записи графической электронной формулы следует помнить два правила: принцип Паули, согласно которому в ячейке (орбитали) может быть не более двух электронов, но с антипараллельными спинами, и правило Ф. Хунда, согласно которому электроны занимают свободные ячейки сначала по одному и имеют при этом одинаковое значение спина, и лишь затем спариваются, но спины при этом, по принципу Паули, будут уже противоположно направленными.
Источник
Загрузить PDF
Загрузить PDF
Электронная конфигурация атома — это численное представление его электронных орбиталей. Электронные орбитали — это области различной формы, расположенные вокруг атомного ядра, в которых математически вероятно нахождение электрона. Электронная конфигурация помогает быстро и с легкостью сказать читателю, сколько электронных орбиталей есть у атома, а также определить количество электронов, находящихся на каждой орбитали. Прочитав эту статью, вы освоите метод составления электронных конфигураций.
-
1
Найдите атомный номер вашего атома. Каждый атом имеет определенное число электронов, связанных с ним. Найдите символ вашего атома в таблице Менделеева. Атомный номер — это целое положительное число, начинающееся от 1 (у водорода) и возрастающее на единицу у каждого последующего атома. Атомный номер — это число протонов в атоме, и, следовательно, это еще и число электронов атома с нулевым зарядом.
-
2
Определите заряд атома. Нейтральные атомы будут иметь столько же электронов, сколько показано в таблице Менделеева. Однако заряженные атомы будут иметь большее или меньшее число электронов — в зависимости от величины их заряда. Если вы работаете с заряженным атомом, добавляйте или вычитайте электроны следующим образом: добавляйте один электрон на каждый отрицательный заряд и вычитайте один на каждый положительный.
- Например, атом натрия с зарядом -1 будет иметь дополнительный электрон в добавок к своему базовому атомному числу 11. Иначе говоря, в сумме у атома будет 12 электронов.
- Если речь идет об атоме натрия с зарядом +1, от базового атомного числа 11 нужно отнять один электрон. Таким образом, у атома будет 10 электронов.
-
3
Запомните базовый список орбиталей. По мере того, как у атома увеличивается число электронов, они заполняют различные подуровни электронной оболочки атома согласно определенной последовательности. Каждый подуровень электронной оболочки, будучи заполненным, содержит четное число электронов. Имеются следующие подуровни:
- s-подуровень (любое число в электронной конфигурации, которое стоит перед буквой “s”) содержит единственную орбиталь, и, согласно Принципу Паули, одна орбиталь может содержать максимум 2 электрона, следовательно, на каждом s-подуровне электронной оболочки может находиться 2 электрона.
- p-подуровень содержит 3 орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
- g-, h-, i- и k-подуровни являются теоретическими. Атомы, содержащие электроны в этих орбиталях, неизвестны. g-подуровень содержит 9 орбиталей, поэтому теоретически в нем может быть 18 электронов. В h-подуровне может быть 11 орбиталей и максимум 22 электрона; в i-подуровне —13 орбиталей и максимум 26 электронов; в k-подуровне — 15 орбиталей и максимум 30 электронов.
- Запомните порядок орбиталей с помощью мнемонического приема:[1]
Sober Physicists Don’t Find Giraffes Hiding In Kitchens (трезвые физики не находят жирафов, скрывающихся на кухнях).
-
4
Разберитесь в записи электронной конфигурации. Электронные конфигурации записываются для того, чтобы четко отразить количество электронов на каждой орбитали. Орбитали записываются последовательно, причем количество атомов в каждой орбитали записывается как верхний индекс справа от названия орбитали. Завершенная электронная конфигурация имеет вид последовательности обозначений подуровней и верхних индексов.
- Вот, например, простейшая электронная конфигурация: 1s2 2s2 2p6. Эта конфигурация показывает, что на подуровне 1s имеется два электрона, два электрона — на подуровне 2s и шесть электронов на подуровне 2p. 2 + 2 + 6 = 10 электронов в сумме. Это электронная конфигурация нейтрального атома неона (атомный номер неона — 10).
-
5
Запомните порядок орбиталей. Имейте в виду, что электронные орбитали нумеруются в порядке возрастания номера электронной оболочки, но располагаются по возрастанию энергии. Например, заполненная орбиталь 4s2 имеет меньшую энергию (или менее подвижна), чем частично заполненная или заполненная 3d10, поэтому сначала записывается орбиталь 4s. Как только вы будете знать порядок орбиталей, вы сможете с легкостью заполнять их в соответствии с количеством электронов в атоме. Порядок заполнения орбиталей следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Электронная конфигурация атома, в котором заполнены все орбитали, будет иметь следующий вид: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p6
- Обратите внимание, что приведенная выше запись, когда заполнены все орбитали, является электронной конфигурацией элемента Uuo (унуноктия) 118, атома периодической системы с самым большим номером. Поэтому данная электронная конфигурация содержит все известные в наше время электронные подуровни нейтрально заряженного атома.
-
6
Заполняйте орбитали согласно количеству электронов в вашем атоме. Например, если мы хотим записать электронную конфигурацию нейтрального атома кальция, мы должны начать с поиска его атомного номера в таблице Менделеева. Его атомный номер — 20, поэтому мы напишем конфигурацию атома с 20 электронами согласно приведенному выше порядку.
- Заполняйте орбитали согласно приведенному выше порядку, пока не достигнете двадцатого электрона. На первой 1s орбитали будут находится два электрона, на 2s орбитали — также два, на 2p — шесть, на 3s — два, на 3p — 6, и на 4s — 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Иными словами, электронная конфигурация кальция имеет вид: 1s2 2s2 2p6 3s2 3p6 4s2.
- Обратите внимание: орбитали располагаются в порядке возрастания энергии. Например, когда вы уже готовы перейти на 4-й энергетический уровень, то сначала записывайте 4s орбиталь, а затем 3d. После четвертого энергетического уровня вы переходите на пятый, на котором повторяется такой же порядок. Это происходит только после третьего энергетического уровня.
-
7
Используйте таблицу Менделеева как визуальную подсказку. Вы, вероятно, уже заметили, что форма периодической системы соответствует порядку электронных подуровней в электронных конфигурациях. Например, атомы во второй колонке слева всегда заканчиваются на “s2“, а атомы на правом краю тонкой средней части оканчиваются на “d10” и т.д. Используйте периодическую систему как визуальное руководство к написанию конфигураций — как порядок, согласно которому вы добавляете к орбиталям соответствует вашему положению в таблице. Смотрите ниже:
- В частности, две самые левые колонки содержат атомы, чьи электронные конфигурации заканчиваются s-орбиталями, в правом блоке таблицы представлены атомы, чьи конфигурации заканчиваются p-орбиталями, а в нижней части атомы заканчиваются f-орбиталями.
- Например, когда вы записываете электронную конфигурацию хлора, размышляйте следующим образом: “Этот атом расположен в третьем ряду (или “периоде”) таблицы Менделеева. Также он располагается в пятой группе орбитального блока p периодической системы. Поэтому, его электронная конфигурация будет заканчиваться на …3p5
- Обратите внимание: элементы в области орбиталей d и f таблицы характеризуются энергетическими уровнями, которые не соответствуют периоду, в котором они расположены. Например, первый ряд блока элементов с d-орбиталями соответствует 3d орбиталям, хотя и располагается в 4 периоде, а первый ряд элементов с f-орбиталями соответствует орбитали 4f, несмотря на то, что он находится в 6 периоде.
-
8
Выучите сокращения написания длинных электронных конфигураций. Атомы на правом краю периодической системы называются благородными газами. Эти элементы химически очень устойчивы. Чтобы сократить процесс написания длинных электронных конфигураций, просто записывайте в квадратных скобках химический символ ближайшего благородного газа с меньшим по сравнению с вашим атомом числом электронов, а затем продолжайте писать электронную конфигурацию последующих орбитальных уровней. Смотрите ниже:
- Чтобы понять эту концепцию, полезно будет написать пример конфигурации. Давайте напишем конфигурацию цинка (атомный номер 30), используя сокращение, включающее благородный газ. Полная конфигурация цинка выглядит так: 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Однако мы видим, что 1s2 2s2 2p6 3s2 3p6 — это электронная конфигурация аргона, благородного газа. Просто замените часть записи электронной конфигурации цинка химическим символом аргона в квадратных скобках ([Ar].)
- Итак, электронная конфигурация цинка, записанная в сокращенном виде, имеет вид: [Ar]4s2 3d10.
- Учтите, если вы пишете электронную конфигурацию благородного газа, скажем, аргона, писать [Ar] нельзя! Нужно использовать сокращение благородного газа, стоящего перед этим элементом; для аргона это будет неон ([Ne]).
Реклама
-

1
Освойте периодическую таблицу ADOMAH. Данный метод записи электронной конфигурации не требует запоминания, однако требует наличия переделанной периодической таблицы, поскольку в традиционной таблице Менделеева, начиная с четвертого периода, номер периода не соответствует электронной оболочке. Найдите периодическую таблицу ADOMAH — особый тип периодической таблицы, разработанный ученым Валерием Циммерманом. Ее легко найти посредством короткого поиска в интернете.[2]
- В периодической таблице ADOMAH горизонтальные ряды представляют группы элементов, такие как галогены, инертные газы, щелочные металлы, щелочноземельные металлы и т.д. Вертикальные колонки соответствуют электронным уровням, а так называемые “каскады” (диагональные линии, соединяющие блоки s,p,d и f) соответствуют периодам.
- Гелий перемещен к водороду, поскольку оба этих элемента характеризуются орбиталью 1s. Блоки периодов (s,p,d и f) показаны с правой стороны, а номера уровней приведены в основании. Элементы представлены в прямоугольниках, пронумерованных от 1 до 120. Эти номера являются обычными атомными номерами, которые представляют общее количество электронов в нейтральном атоме.
-
2
Найдите ваш атом в таблице ADOMAH. Чтобы записать электронную конфигурацию элемента, найдите его символ в периодической таблице ADOMAH и вычеркните все элементы с большим атомным номером. Например, если вам нужно записать электронную конфигурацию эрбия (68), вычеркните все элементы от 69 до 120.
- Обратите внимание на номера от 1 до 8 в основании таблицы. Это номера электронных уровней, или номера колонок. Игнорируйте колонки, которые содержат только вычеркнутые элементы. Для эрбия остаются колонки с номерами 1,2,3,4,5 и 6.
-
3
Посчитайте орбитальные подуровни до вашего элемента. Смотря на символы блоков, приведенные справа от таблицы (s, p, d, and f), и на номера колонок, показанные в основании, игнорируйте диагональные линии между блоками и разбейте колонки на блоки-колонки, перечислив их по порядку снизу вверх. И снова игнорируйте блоки, в которых вычеркнуты все элементы. Запишите блоки-колонки, начиная от номера колонки, за которым следует символ блока, таким образом: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (для эрбия).
- Обратите внимание: Приведенная выше электронная конфигурация Er записана в порядке возрастания номера электронного подуровня. Ее можно также записать в порядке заполнения орбиталей. Для этого следуйте по каскадам снизу вверх, а не по колонкам, когда вы записываете блоки-колонки: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12.
-
4
Посчитайте электроны для каждого электронного подуровня. Подсчитайте элементы, в каждом блоке-колонке которые не были вычеркнуты, прикрепляя по одному электрону от каждого элемента, и запишите их количество рядом с символом блока для каждого блока-колонки таким образом: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2. В нашем примере это электронная конфигурация эрбия.
-
5
Учитывайте неправильные электронные конфигурации. Существует восемнадцать типичных исключений, относящихся к электронным конфигурациям атомов в состоянии с наименьшей энергией, также называемом основным энергетическим состоянием. Они не подчиняются общему правилу только по последним двум-трем положениям, занимаемым электронами. При этом действительная электронная конфигурация предполагает нахождение электронов в состоянии с более низкой энергией в сравнении со стандартной конфигурацией атома. К атомам-исключениям относятся:
- Cr (…, 3d5, 4s1); Cu (…, 3d10, 4s1); Nb (…, 4d4, 5s1); Mo (…, 4d5, 5s1); Ru (…, 4d7, 5s1); Rh (…, 4d8, 5s1); Pd (…, 4d10, 5s0); Ag (…, 4d10, 5s1); La (…, 5d1, 6s2); Ce (…, 4f1, 5d1, 6s2); Gd (…, 4f7, 5d1, 6s2); Au (…, 5d10, 6s1); Ac (…, 6d1, 7s2); Th (…, 6d2, 7s2); Pa (…, 5f2, 6d1, 7s2); U (…, 5f3, 6d1, 7s2); Np (…, 5f4, 6d1, 7s2) и Cm (…, 5f7, 6d1, 7s2).
Реклама
Советы
- Чтобы найти атомный номер атома, когда он записан в форме электронной конфигурации, просто сложите все числа, которые идут за буквами (s, p, d, и f). Это работает только для нейтральных атомов, если вы имеете дело с ионом, то ничего не получится — вам придется добавить или вычесть количество дополнительных или потерянных электронов.
- Число, идущее за буквой — это верхний индекс, не сделайте ошибку в контрольной.
- “Стабильности полузаполненного” подуровня не существует. Это упрощение. Любая стабильность, которая относится к “наполовину заполненным” подуровням, имеет место из-за того, что каждая орбиталь занята одним электроном, поэтому минимизируется отталкивание между электронами.
- Каждый атом стремится к стабильному состоянию, а самые стабильные конфигурации имеют заполненные подуровни s и p (s2 и p6). Такая конфигурация есть у благородных газов, поэтому они редко вступают в реакции и в таблице Менделеева расположены справа. Поэтому, если конфигурация заканчивается на 3p4, то для достижения стабильного состояния ей необходимо два электрона (чтобы потерять шесть, включая электроны s-подуровня, потребуется больше энергии, поэтому потерять четыре легче). А если конфигурация оканчивается на 4d3, то для достижения стабильного состояния ей необходимо потерять три электрона. Кроме того, полузаполненные подуровни (s1, p3, d5..) являются более стабильными, чем, например, p4 или p2; однако s2 и p6 будут еще более устойчивыми.
- Когда вы имеете дело с ионом, это значит, что количество протонов не равно количеству электронов. Заряд атома в этом случае будет изображен сверху справа (как правило) от химического символа. Поэтому атом сурьмы с зарядом +2 имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1. Обратите внимание, что 5p3 изменилось на 5p1. Будьте внимательны, когда конфигурация нейтрального атома заканчивается на подуровни, отличные от s и p. Когда вы забираете электроны, вы можете забрать их только с валентных орбиталей (s и p орбиталей). Поэтому, если конфигурация заканчивается на 4s2 3d7 и атом получает заряд +2, то конфигурация будет заканчиваться 4s0 3d7. Обратите внимание, что 3d7 не меняется, вместо этого теряются электроны s-орбитали.
- Существуют условия, когда электрон вынужден “перейти на более высокий энергетический уровень”. Когда подуровню не хватает одного электрона до половинной или полной заполненности, заберите один электрон из ближайшего s или p- подуровня и переместите его на тот подуровень, которому необходим электрон.
- Имеется два варианта записи электронной конфигурации. Их можно записывать в порядке возрастания номеров энергетических уровней или в порядке заполнения электронных орбиталей, как было показано выше для эрбия.
- Также вы можете записывать электронную конфигурацию элемента, записав лишь валентную конфигурацию, которая представляет собой последний s и p подуровень. Таким образом, валентная конфигурация сурьмы будет иметь вид 5s2 5p3.
- Ионы не то же самое. С ними гораздо сложнее. Пропустите два уровня и действуйте по той же схеме в зависимости от того, где вы начали, и от того, насколько велико количество электронов.
Реклама
Об этой статье
Эту страницу просматривали 482 905 раз.
Была ли эта статья полезной?
Электронная формула химического элемента показывает то, как происходит распределение электронов на орбиталях в атоме по энергетическим уровням и подуровням.
Вот что нужно обязательно знать, чтобы правильно составить электронную формулу элемента:
I.
Все орбитали и находящееся на ней электроны характеризуют несколько квантовых чисел.
Среди них в первую очередь стоит выделить числа n и l.
- n – главное квантовое число, определяет общую энергию электрона на орбитали. Это число характеризует энергетический уровень и может принимать значение от 1 до 7.
- l – орбитальное квантовое число. Это число характеризует форму орбитали и энергетический подуровень.
Существует 4 вида орбиталей, различающихся своей формой и направленностью в пространстве.
- s-орбитали (l = 0),
- p-орбитали (l = 1),
- d-орбитали (l = 2),
- f-орбитали (l = 3).
Самое простое строение у s-орбитали, самое сложное – у f-орбитали.
II.
Каждый энергетический уровень содержит n подуровней (то есть чем больше главное квантовое число, тем больше подуровней).
Количество орбиталей, которое может быть на том или ином подуровне, определяется по формуле 2l + 1.
Согласно принципу Паули на одной орбитали может быть максимум 2 электрона (если находится 1 электрон, то он называется неспаренным, если 2 электрона – то это электронная пара).
Таким образом, будет нетрудно посчитать, сколько орбиталей и электронов может включать в себя каждый подуровень.
-
s-подуровень включает 2 * 0 + 1 = 1 орбиталь и 1 * 2 = 2 электрона.
-
p-подуровень включает 2 * 1 + 1 = 3 орбитали и 3 * 2 = 6 электронов.
-
d-подуровень включает 2 * 2 + 1 = 5 орбиталей и 5 * 2 = 10 электронов.
-
f-подуровень включает 2 * 3 + 1 = 7 орбиталей и 7 * 2 = 14 электронов.
III.
Заполнение орбиталей электронами осуществляется по правилу Клечковского (в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n).
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d и т.д.
Здесь действует принцип минимума энергии, при котором электроны заполняют орбитали начиная с подуровня с наименьшей энергией.
IV.
Максимальное количество электронов на энергетическом уровне определяется по формуле N = 2n².
Эта формула вытекает из принципа из принципа Паули.
Исходя из формулы на первом уровне может быть максимум 2 электрона (s2), на втором уровне – максимум 8 электронов (2s2 2p6), на третьем уровне – максимум 18 электронов (3s2 3p6 3d10).
V.
Заполнение орбиталей внутри одного подуровня происходит по правилу Хунда.
Согласно этому правилу каждая орбиталь подуровня заполняется сначала одним электроном, а после исчерпания свободных орбиталей к имеющемуся электрону на орбитали добавляется парный электрон.
**
При составлении электронных формул элементов также понадобится периодическая система Д.И. Менделеева.
С её помощью можно определить:
-
Количество электронов в атоме – оно равно порядковому номеру элемента в периодической таблице.
-
Число энергетических уровней – оно равно номеру периода данного элемента.
-
Число электронов на последнем уровне – оно равно номеру группы.
**
Пример.
Сера (S).
Это 16 элемент по счёту: количество электронов в атоме будет равно 16.
Находится в 3 периоде: всего будет 3 уровня.
Сначала заполняем 1 уровень: 1s2, на нём будет только 2 электрона.
Далее заполняем 2 уровень: 2s2 2p6, на нём будет 8 электронов.
Оставшиеся 6 электронов будет на 3 уровне (а это как раз номер группы): 3s2 3p4.
В результате получаем следующее:
1s2 2s2 2p6 3s2 3p4.
Общее число электронов в атоме равно порядковому номеру химического элемента в Периодической таблице.
Каждый электрон находится на своей орбитали. Чем больше энергия электрона, тем больше по размеру его орбиталь, и тем дальше он находится от ядра.
Электроны с близкими значениями энергии образуют энергетический уровень (электронный слой).
Энергетический уровень (электронный слой) — совокупность электронов с близкими значениями энергии.
Энергетические уровни нумеруют, начиная с самого близкого к ядру.
Установлено, что максимальное число электронов на энергетическом уровне равно (2n²), где (n )— его номер. Значит, на первом уровне может находиться не более (2) электронов, на втором — не более (8), на третьем — не более (18) и т. д.
В атоме водорода — один электрон, и он располагается на первом энергетическом уровне:
В атоме гелия — два электрона. Первый энергетический уровень у гелия завершён, так как он не может содержать более двух электронов:
В атоме лития — три электрона. Два из них находятся на первом уровне. Третий электрон имеет большую энергию и движется дальше от ядра. В атоме лития появляется второй энергетический уровень:
У следующих элементов второго периода электроны добавляются на второй уровень:
;
B5)2)3
;
C6)2)4
;
N7)2)5
;
O8)2)6
;
F9)2)7
;
Ne10)2)8
.
У неона второй электронный слой завершён, так как содержит (8) электронов — максимально возможное число.
Заполнение третьего энергетического уровня начинается у атома натрия и завершается у атома аргона:
;
Mg12)2)8)2
;
Al13)2)8)3
;
Si14)2)8)4
;
P15)2)8)5
;
S16)2)8)6
;
Cl17)2)8)7
;
Ar18)2)8)8
.
Максимальное количество электронов на третьем слое равно (18), но у элементов третьего периода его заполнение не происходит, потому что внешний электронный слой не может содержать более (8) электронов.
Обрати внимание!
На внешнем электронном слое не может быть более (8) электронов.
У элементов четвёртого периода начинается заполнение четвёртого энергетического уровня:
;
Ca20)2)8)8)2
.
Полностью четвёртый электронный слой заполняется, как и в малых периодах, у инертного газа криптона.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 сентября 2018 года; проверки требуют 22 правки.
На этой странице показаны электронные конфигурации нейтральных атомов в их основных состояниях. Для каждого атома подоболочки даны сначала в краткой форме, затем со всеми выписанными подоболочками, за которыми следует число электронов на оболочку.
Электронная конфигурация[править | править код]
|
|
Литература[править | править код]
Все данные, представленные выше, согласуются с традиционными источниками, кроме случаев, перечисленных ниже.
NIST[править | править код]
- Американский институт стандартов. Проверено 1 июля 2005, (элемента 1-104) основано на:
- Atomic Spectroscopy, by W.C. MarОлово and W.L. Wiese in Atomic, Molecular, & Optical Physics Handbook, ed. by G.W.F. Drake (AIP, Woodbury, NY, 1996) Chapter 10, pp. 135—153.
Этот веб-сайт также процитирован в CRC руководстве (англ. CRC Handbook) как источник секции 1, подсекции электронная конфигурация нейтральных атомов в основном состоянии.
- 91 Pa : [Rn] 5f2(3H4) 6d 7s2
- 92 U : [Rn] 5f3(4Io9/2) 6d 7s2
- 93 Np : [Rn] 5f4(5I4) 6d 7s2
- 103 Lr : [Rn] 5f14 6d1 7s2
- 104 Rf : [Rn] 5f14 6d2 7s2
CRC[править | править код]
- David R. Lide (ed), CRC Handbook of Chemistry and Physics, 84th Edition, online version. CRC Press. Boca Raton, Florida, 2003; Section 1, Basic Constants, Units, and Conversion Factors; Electron Configuration of Neutral Atoms in the Ground State. (elements 1-104)
- Также подсекция периодической таблицы элементов, (элементы 1-103) основана на:
- G. J. Leigh, Editor, Nomenclature of Inorganic Chemistry, Blackwell Scientific Publications, Oxford, 1990.
- Chemical and Engineering News, 63(5), 27, 1985.
- Atomic Weights of the Elements, 1999, Pure & Appl. Chem., 73, 667, 2001.
WebElements[править | править код]
- Periodic Table of the Elements by WebElements. Проверено 1 июля 2005, электронные конфигурации основаны на:
- Atomic, Molecular, & Optical Physics Handbook, Ed. Gordon W. F. Drake, American Institute of Physics, Woodbury, New York, USA, 1996.
- J.E. Huheey, E.A. Keiter, and R.L. Keiter in Inorganic Chemistry : Principles of Structure and Reactivity, 4th edition, HarperCollins, New York, USA, 1993.
- R.L. DeKock and H.B. Gray in Chemical Structure and bonding, Benjamin/Cummings, Menlo Park, California, USA, 1980.
- A.M. James and M.P. Lord in Macmillan’s Chemical and Physical Data, Macmillan, London, UK, 1992.
- 103 Lr : [Rn].5f14.6d1.7s2. точно; 2.8.18.32.32.9.2
- 104 Rf : [Rn].5f14.6d2.7s2 предварительная; 2.8.18.32.32.10.2 (возможно)
- 105 Db : [Rn].5f14.6d3.7s2 (догадка, основанная на электронной конфигурации тантала) ; 2.8.18.32.32.11.2 (возможно)
- 106 Sg : [Rn].5f14.6d4.7s2 (догадка, основанная на электронной конфигурации вольфрама) ; 2.8.18.32.32.12.2 (возможно)
- 107 Bh : [Rn].5f14.6d5.7s2 (догадка, основанная на электронной конфигурации рения) ; 2.8.18.32.32.13.2 (возможно)
- 108 Hs : [Rn].5f14.6d6.7s2 (догадка, основанная на электронной конфигурации осмия) ; 2.8.18.32.32.14.2 (возможно)
- 109 Mt : [Rn].5f14.6d7.7s2 (догадка, основанная на электронной конфигурации иридия) ; 2.8.18.32.32.15.2 (возможно)
- 110 Ds : [Rn].5f14.6d9.7s1 (догадка, основанная на электронной конфигурации никеля) ; 2.8.18.32.32.16.2 (возможно)
- 111 Rg : [Rn].5f14.6d10.7s1 (догадка, основанная на электронной конфигурации золота) ; 2.8.18.32.32.17.2 (возможно)
- 112 Cn : [Rn].5f14.6d10.7s2 (догадка, основанная на электронной конфигурации ртути) ; 2.8.18.32.32.18.2 (точно)
- 113 Nh : [Rn].5f14.6d10.7s2.7p1 (догадка, основанная на электронной конфигурации таллия) ; 2.8.18.32.32.18.3 (точно)
- 114 Fl : [Rn].5f14.6d10.7s2.7p2 (догадка, основанная на электронной конфигурации свинца) ; 2.8.18.32.32.18.4 (точно)
- 115 Mc : [Rn].5f14.6d10.7s2.7p3 (догадка, основанная на электронной конфигурации висмута) ; 2.8.18.32.32.18.5 (точно)
- 116 Lv : [Rn].5f14.6d10.7s2.7p4 (догадка, основанная на электронной конфигурации полония) ; 2.8.18.32.32.18.6 (точно)
- 117 Ts : [Rn].5f14.6d10.7s2.7p5 (догадка, основанная на электронной конфигурации астата) ; 2.8.18.32.32.18.7 (точно)
- 118 Og : [Rn].5f14.6d10.7s2.7p6 (догадка, основанная на электронной конфигурации радона) ; 2.8.18.32.32.18.8 (точно)
Lange[править | править код]
- J.A. Dean (ed), Lange’s Handbook of Chemistry (15th Edition), online version, McGraw-Hill, 1999; Section 4, Table 4.1 Electronic Configuration and Properties of the Elements. (Elements 1-103)
- 97 Bk : [Rn] 5f8 6d1 7s2
- 103 Lr : [Rn] 5f14 6d1 7s2
Hill and Petrucci[править | править код]
- Hill and Petrucci, General Chemistry: An Integrated Approach (3rd edition), Prentice Hall. (Elements 1-106)
- 58 Ce : [Xe] 4f1 5d1 6s2
- 103 Lr : [Rn] 5f14 6d1 7s2
- 104 Rf : [Rn] 5f14 6d2 7s2
- 105 Db : [Rn] 5f14 6d3 7s2
- 106 Sg : [Rn] 5f14 6d4 7s2
Ссылки[править | править код]
- jeries rihani ptable – Orbital – Динамическая Таблица Менделеева
