Вы хотите изучать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
А вы знаете, что такое аффирмация?
Аффирмация – это короткая фраза, содержащая словесную формулу (лингвистический код), которая при многократном повторении закрепляет требуемую установку в подсознании.
Как работает аффирмация?
Если сосредоточить свое внимание на действиях (целях, установках), в головном мозге включаются интересные процессы. Между лимбической системой и корой больших полушарий формируются нейронные связи, определяющие конкретные чувства и действия человека. В результате, когда вы думаете о конкретных действиях (установках, целях), мозг начинает вырабатывать особые химические вещества – нейромедиаторы, которые активируют программу достижения ваших целей. Если вы натренируете свой мозг таким образом, чтобы он ассоциировал ваши действия по достижению результата с позитивными чувствами, вы каждый раз будете испытывать чувство радости и удовлетворения, вспоминая о целях, о действиях по достижению целей, о результатах работы. Таким образом, ваше подсознание будет ставить важные цели и действия на первое место среди остальных приоритетов.
Совет психолога
Возьмите ручку в руки и напишите три аффирмации, определяющие ваши цели и действия на ближайшие месяцы. Например:
1) Я хорошо себя чувствую и уверен в своих силах
2) Я буду изучать химию и решать задачи по химии каждый день
3) Я сдам ЕГЭ по химии на очень высокий балл
Прикрепите ваши аффирмации на видное место, например, над компьютером. Каждый день в течение пяти минут вы должны стать перед зеркалом и вслух произнести эти фразы. Произносите слова уверенно, так, словно вы уже достигли поставленных целей. Если вы чувствуете в своем теле дискомфорт, связанный с определенной аффирмацией, поместите свою руку на эту область тела и, в момент произношения фразы, мысленно направьте энергию руки в эту область.
Наверняка, у вас возник вопрос: “Откуда репетитор по химии Богунова В.Г. так хорошо знает психотерапевтические техники?” Отвечу. У меня есть советник. Мой психолог-консультант – Кристина. Это она знакомит меня с тайнами практик психотерапии. Чуть позже я расскажу о Кристине много интересного, а пока вернемся к основной теме статьи – Вывод формулы вещества по массовым долям. Итак, поехали!
Алгоритм решения лучше разобрать на конкретной задаче. Все задачи, конечно, решаются по Четырем Заповедям. Но если алгоритм решения – очень специфичный, лучше акцентировать внимание именно на нем.
Задача 1
Найти простейшую формулу соединения, содержащего 43,4% натрия, 11,3% углерода и 45,3% кислорода.
Выписываем данные в разделе Дано.
Выписываем формулу вещества в общем виде (по данным задачи) и определяем основную логическую структуру алгоритма
Выясняем происхождение каждой составляющей структуры (Как рассчитать количества вещества?). Это – логические рассуждения, как бы мои мысли вслух (т.е. на бумаге), поэтому я их обвела другим цветом.
Количества вещества можно рассчитать, например, из масс, а в задаче предлагаются только относительные данные (массовые доли), поэтому мы имеем право ввести свободный параметр – абсолютное значение массы. Зная массу элемента, легко рассчитать его количество вещества.
Поскольку максимальное значение массовой доли 100%, лучше ввести значение массы 100 г, тогда абсолютные значение массы элемента и его массовой доли в % – равны (по модулю).
Дальнейшее решение задачи лучше проводить в таблице, куда выписываем массы (бывшие массовые доли в %), молярные массы, рассчитанные количества вещества. Нужно как можно точнее рассчитать значение количество вещества (не менее трех знаков после запятой).
Теперь начинается Копперфильд, т.е. самое интересное и загадочное. Нам нужно привести к целым значениям соотношения количества вещества каждого элемента. Как это сделать? Внимательно слушаем и повторяем за мной на калькуляторе.
Как получить целые значения в дробных соотношениях?
Каждый показатель количества вещества делим на самое маленькое число из всех полученных значений
В нашем случае, самое маленькое число 0,9417. Делим каждый показатель на это число и получаем целые значения соотношений. После этого выводим простейшую формулу вещества. В представленных задачах простейшая формула является окончательной. Называем вещество.
Иногда (не часто) с первого раза не удается добиться целого результата. Тогда нужно умножить каждый показатель на наименьшее целое число, чтобы получить целые соотношения. Все вопросы – к математике.
Если делимое и делитель умножить (или разделить) на одно и тоже число, то частное не изменится
Попробуем решить еще одну задачу на закрепление мастерства.
Задача 2
Найти простейшую формулу соединения, содержащего 27,38% натрия, 1,19% водорода, 14,29% углерода и 57,14% кислорода.
Последовательность действий:
1) Выписать данные в разделе Дано
2) Составить логическую структуру алгоритма
3) Выяснить источник для расчета количества вещества атомов элемента
4) Ввести свободный параметр (Пусть было 100 г вещества)
5) Составить таблицу (масса, молярная масса, количество вещества)
6) Рассчитать целые значения соотношений количества вещества
7) Вывести простейшую формулу вещества
Надеюсь, вы поняли, как работать с алгоритмом Вывод формул вещества по массовым долям элементов? Если нет, пишите в комментариях или ВКонтакте в личку. Я обязательно отвечу на все ваши вопросы, замечания и пожелания.
Вернемся к моему другу, психотерапевту Кристине. Звонит мне как-то моя хорошая знакомая. С ее сыном случилась страшная беда – наркотики. Правда, не очень тяжелые, но все же… Из дома начали пропадать вещи, сын стал грубить, успеваемость съехала до нижнего предела. Что делать?! Не хочется выносить сор из избы (элитная школа, папа занимает солидную должность, мама – достаточно известная личность). Она не просила меня ни о чем, позвонила больше для того, чтобы выплакаться. Я, конечно, как могла, поддержала ее. Но одного моего сочувствия мало. И тут я вспомнила о Кристине. Я давно знаю эту уже взрослую девочку. Знаю ее непростую судьбу, ее серьезную психологическую практику. Я дала своей знакомой телефон Кристины. Они созвонились.
Пол-года я не получала никакой информации ни от одной, ни от другой. Сама боялась позвонить и услышать о самом страшном. Однажды утром раздался звонок и счастливый голос подруги радостно сообщил мне о том, что ее сын стал студентом престижного московского ВУЗа! Именно Кристина спасла “тонущего” мальчика и всю семью. “Я каждое воскресенье хожу в церковь и ставлю свечки за здравие всех родных, в том числе, за здравие нашей спасительницы Кристины!” – сказала мне знакомая. С тех пор я советую Кристину всем своим близким и знакомым.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7 (903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Содержание
- Способы определения молекулярной формулы оксида и элемента металла, образующего данный оксид
- Секретная шпаргалка по химии. 5.2. Вывод формулы вещества по массовой доле элементов
- Секретная шпаргалка по химии. 3.1 Массовая доля элемента в соединении
- Массовая доля элемента в соединении: задачи
- Пример 1.
- Пример 2.
- Пример 3.
- Как найти массовую долю вещества по формуле
- Нахождение массовой доли химического элемента
- Нахождение массовой доли вещества в смесях и растворах
- Массовая доля примесей
- Видео
Способы определения молекулярной формулы оксида и элемента металла, образующего данный оксид
Задача 115.
Некоторый элемент образует оксид вида Э2О3, где Э — неизвестный элемент. Массовая доля кислорода в нем составляет 30,08% . Определите элемент и формулу оксида.
Дано: формула оксида: Э2О3; массовая доля кислорода в оксиде: (О) = 30,08%.
(О) = 30,08%.
Найти: элемент и формулу оксида.
Решение:
Для выявления неизвестного элемента необходимо определить его молярную массу, по которой, пользуясь Периодической системой Д.И.Менделеева, возможно найти неизвестный элемент.
I способ (последовательно-разветвленный алгоритм).
Схематично этот алгоритм можно изобразить так:
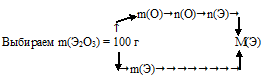
1) Произвольно выбираем некоторую массу образца. Наиболее удобная масса — 100 г, т.к. в условии фигурирует массовая доля. Тогда в 100 г Э2О3 содержится 30,08 г кислорода.
2) По разности находим массу неизвестного элемента:
m(Э) = 100 – m(О) = 100 – 30,08 = 69,92 г содержится в выбранном образце Э2О3.
3) Находим количество вещества атомарного кислорода:
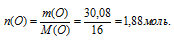
4) По известной общей формуле Э2О3 вычисляем количество вещества атомов неизвестного элемента. На каждые 3 моль атомов кислорода приходится 2 моль атомов неизвестного элемента.
Составим пропорцию:
3 моль атомов кислорода приходится на 2 моль атомов Э
1,88 моль атомов кислорода приходится на х моль атомов Э.
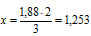 атомов элемента содержится в выбранном образце Э2О3.
атомов элемента содержится в выбранном образце Э2О3.
5) Теперь находим молярную массу атомов неизвестного элемента:
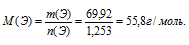
По таблице Д. И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
II способ (встречный алгоритм).
Схематично алгоритм можно изобразить таким образом:
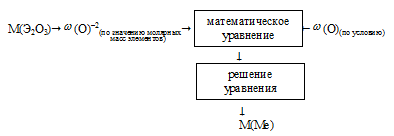
Применим предложенный алгоритм.
1) Записываем выражение для молярной массы Э2О3:
М(Э2О3) = М(Э) . 2 + М(О) . 3 = (М(Э) . 2 + 48) г/моль.
2) Выбираем массу образца Э2О3, соответствующую 1 моль вещества. Она составит m(Э2О3) = (M(Э) . 2 + 48) г. Масса кислорода в этом образце будет 48 г.
3) Записываем выражение для массовой доли кислорода в выбранном образце:
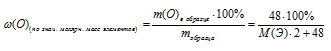
4) Приравниваем полученное выражение к значению массовой доли кислорода из условия:
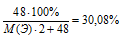
Получили одно уравнение с одним неизвестным М(Э). Решаем его и получаем М(Э) = 55,8 г/моль.
По таблице Д.И. Менделеева находим элемент, имеющий молярную массу 55,8 г/моль. Подходит железо. Этот элемент действительно проявляет степень окисления (+3) и образует оксид Fе2О3.
Ответ: искомый элемент — железо, формула Fе2О3.
Источник
Секретная шпаргалка по химии. 5.2. Вывод формулы вещества по массовой доле элементов
Вы хотите изучать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
А вы знаете, что такое аффирмация?
Аффирмация — это короткая фраза, содержащая словесную формулу (лингвистический код), которая при многократном повторении закрепляет требуемую установку в подсознании.
Как работает аффирмация?
Если сосредоточить свое внимание на действиях (целях, установках), в головном мозге включаются интересные процессы. Между лимбической системой и корой больших полушарий формируются нейронные связи, определяющие конкретные чувства и действия человека. В результате, когда вы думаете о конкретных действиях (установках, целях), мозг начинает вырабатывать особые химические вещества — нейромедиаторы, которые активируют программу достижения ваших целей. Если вы натренируете свой мозг таким образом, чтобы он ассоциировал ваши действия по достижению результата с позитивными чувствами, вы каждый раз будете испытывать чувство радости и удовлетворения, вспоминая о целях, о действиях по достижению целей, о результатах работы. Таким образом, ваше подсознание будет ставить важные цели и действия на первое место среди остальных приоритетов.
Возьмите ручку в руки и напишите три аффирмации , определяющие ваши цели и действия на ближайшие месяцы. Например:
1) Я хорошо себя чувствую и уверен в своих силах
2) Я буду изучать химию и решать задачи по химии каждый день
3) Я сдам ЕГЭ по химии на очень высокий балл
Прикрепите ваши аффирмации на видное место, например, над компьютером. Каждый день в течение пяти минут вы должны стать перед зеркалом и вслух произнести эти фразы. Произносите слова уверенно, так, словно вы уже достигли поставленных целей. Если вы чувствуете в своем теле дискомфорт, связанный с определенной аффирмацией , поместите свою руку на эту область тела и, в момент произношения фразы, мысленно направьте энергию руки в эту область.
Наверняка, у вас возник вопрос: «Откуда репетитор по химии Богунова В.Г. так хорошо знает психотерапевтические техники?» Отвечу. У меня есть советник. Мой психолог-консультант — Кристина . Это она знакомит меня с тайнами практик психотерапии. Чуть позже я расскажу о Кристине много интересного, а пока вернемся к основной теме статьи — Вывод формулы вещества по массовым долям . Итак, поехали!
Алгоритм решения лучше разобрать на конкретной задаче. Все задачи, конечно, решаются по Четырем Заповедям. Но если алгоритм решения — очень специфичный, лучше акцентировать внимание именно на нем.
Найти простейшую формулу соединения, содержащего 43,4% натрия, 11,3% углерода и 45,3% кислорода.
Источник
Секретная шпаргалка по химии. 3.1 Массовая доля элемента в соединении
За окном — дождь и пронизывающий ветер. Холодно. В такую погоду музы особенно активны. Они слетаются в гости и садятся ко мне на плечо. На правое. Сразу все. И, свесив ноги, начинают болтать друг с другом. Я им уже не нужна. Ребята, о чем это вы? Мне, как и вам, тоже хочется чая с имбирем. И шоколада. И венских вафель. Но я обещала написать статью (и не одну) о массовой доле элемента. Такие расчеты очень важны для развития логических основ алгоритмики. Умение определять массовую долю (или компоненты системы по известной массовой доле) пригодится и во время учебы в медицинском, и во врачебной практике. Поэтому, берем тетрадку, ручку, карандаш и ластик, читаем статью и записываем вместе со мной решение задач. Вначале, как всегда, теория практики. Разберемся с основными понятиями.
Доля — часть чего-нибудь (толковый словарь С.И. Ожегова)
Массовая доля — число, показывающее отношение массы части к общей массе целого или по-другому, отношение массы компонента системы к массе всей системы. Эта величина обозначается греческой буквой «омега» и может выражаться в долях единицы или в процентах.
Например, мы купили у бабули на рынке ведро яблок и груш общей массой 10 кг. Дома разделили фрукты на две кучки. Масса груш составила 3 кг. Значит, массовая доля груш 3/10 = 0,3 (30%). Вспомнили, как рассчитать массовую долю? Отлично! Поехали дальше.
Массовая доля элемента в соединении — число, показывающее, какую часть составляет масса всех атомов данного элемента в молекуле вещества от общей массы молекулы, определяется отношением массы атомов к массе молекулы. Разберемся на примере конкретной задачи
Определите массовую долю железа в оксиде железа (III)
Записываем формулу массовой доли в общем виде, затем конкретизируем ее. Читаем внимательно и следим за моими руками. Массовая доля элемента в соединении определяется отношением массы атомов (числитель) к массе молекулы (знаменатель), то есть:
1) в числителе мы работаем с атомами того элемента, чью массовую долю определяем, для этого умножаем атомную массу элемента (молярная масса атомов) на число атомов этого элемента
2) в знаменателе мы записываем молярную массу вещества
Это очень легкая прямая задача. Попробуем решить обратные задачи — по известной массовой доле определяем неизвестный элемент (вернее, его атомную массу), либо неизвестное число атомов углерода в общей формуле класса органических веществ.
Соединение элемента имеет формулу Э2О3, массовая доля элемента в нем 68,42%. Установите элемент.
Для определения неизвестного элемента необходимо рассчитать его атомную массу (молярную массу атомов), а затем по Периодической системе химических элементов Д.И. Менделеева по атомной массе определяем химический элемент.
Алгоритм решения задачи строим на основании алгебраической формулы определения массовой доли элемента в соединении. Атомную массу элемента обозначаем как неизвестное Х. В числителе записываем массу атомов того элемента, чья массовая доля представлена в условии, в знаменателе — молярную массу вещества в общем виде. Решаем уравнение. По рассчитанной атомной массе определяем элемент. Это хром. Записываем формулу и называем вещество.
Оксид неизвестного пятивалентного элемента содержит 56,34% кислорода. Определите этот элемент.
Массовая доля водорода в алкине CnH2n-2 составляет 12,2 %. Определите число атомов углерода
Алгоритм решения задачи строим на основании алгебраической формулы определения массовой доли элемента в соединении. В числителе записываем массу атомов того элемента, чья массовая доля представлена в условии, в знаменателе — молярную массу вещества в общем виде. Решаем уравнение, определяем неизвестное n, записываем формулу, называем вещество. Это гексин.
Массовая доля водорода в молекуле алкина CnH2n-2 равна 11,11 %. Определите число атомов углерода
Если вы думаете, что все так просто, вы очень и очень ошибаетесь. То ли еще будет! Гораздо более веселые задачи вас ожидают в следующей статье — «Массовая доля элемента в соединении». Но это будет завтра. Сегодня музы устали от пустой болтовни и улетели в теплые края. А я, довольная проделанной работой, иду пить чай с имбирем, лимоном и медом! Чего и вам желаю.
Приходите ко мне на занятия, и вы будете поражены тем, что всего за ТРИ ЧАСА сможете усвоить объем знаний, намного превышающий тот, который вам вкладывали в голову на протяжении ТРЕХ ЛЕТ! Занятие будет проходить динамично, интересно, весело, но главное, РЕЗУЛЬТАТИВНО! Вы блестяще сдадите ЕГЭ по химии и станете студентом престижного медицинского ВУЗа!
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии http://repetitor-him.ru . Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7(903) 186-74-55. Приходите ко мне на курс, на Мастер-классы «Решение задач по химии» — и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте, или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Источник
Массовая доля элемента в соединении: задачи
Массовая доля элемента в соединении показывает, какую долю составляет масса данного элемента в соединении . Для того, чтобы рассчитывать массовую долю , нужно правильно рассчитывать молекулярную массу и обязательно учитывать число атомов каждого элемента. Кстати, иногда требуется решить по химии и обратную задачу: зная массовую долю, составлять формулы. Теперь потренируемся на примерах.
Пример 1.
Определите массовые доли элементов в сульфате натрия.
Формула сульфата натрия Na2SO4 . Молекулярная масса Na2SO4 2*23+32+4*16=142 (мы взяли атомные массы элементов из таблицы Менделеева и умножили их на нужные индексы: атомов натрия в формуле 2, атом серы 1, атомов кислорода 4).
Рассчитываем массовые доли, составляя пропорции.
Массовая доля натрия:
142 (молекулярная масса Na2SO4) – 100%
2*23 (берём атомную массу натрия, умноженную на 2, потому что у нас 2 атома Na) – X%
Массовая доля серы:
142 (молекулярная масса Na2SO4) – 100%
32 (берём атомную S) –Y%
Массовая доля кислорода:
142 (молекулярная масса Na2SO4) – 100%
4*16 (берём атомную массу кислорода, умноженную на 4, потому что у нас 4 атома О) –Z%
Ответ: в сульфате натрия массовая доля натрия 32,4%, массовая доля серы 22,5%, массовая доля кислорода 45,1% (проверим себя. При сложении всех массовых долей должно получиться 100%. У нас 32,4+22,5+45,1=100).
Пример 2.
Это сложный пример, который может встретиться на огэ по химии. Но, разобравшись в нём без репетитора по химии, вы точно поймёте, что такое массовая доля. Итак, нужно определить массовые доли в нитрате меди (II).
Формула нитрата меди (II) Cu(NO3)2. Обратите внимание, что здесь имеется кислотный остаток NO3, заключённый в скобки. Индекс 2 относится ко всему кислотному остатку! Это крайне важно для правильного расчёта! То есть в нашем соединении Cu(NO3)2 есть 1 атом меди Cu и два кислотных остатка NO3, то есть 2 атома азота и 2*3=6 атомов кислорода. Обязательно поймите это!
Теперь переходим к расчёту молекулярной массы Cu(NO3)2 (как всегда, берём атомные массы элементов из таблицы Менделеева). Она составляет 64+2*14+6*16=188. Далее рассчитываем массовые доли.
Ответ: в нитрате меди (II) массовая доля меди 34,0%, массовая доля азота 14,9%, массовая доля кислорода 51,1% (для проверки сложим все массовые доли 34,0+14,9+51,1=100, всё верно).
Пример 3.
Обратная задача. По массовым долям элементов в соединении нужно определить формулу. Известно, что в соединение входят калий К, марганец Mn и кислород О. Массовая доля калия 24,7%, массовая доля марганца 34,8%, массовая доля кислорода 40,5%. Определите формулу.
Нам нужно найти Х, Y и Z. Для начала найдём в периодической таблице атомные массы элементов: атомная масса калия 39, марганца 55, кислорода 16. Теперь вспомним, что массовая доля показывает нам вклад каждого элемента в массу вещества. Отсюда следует, что, разделив массовую долю на атомную массу, мы получим число атомов в соединении. То есть здесь:
· атомов калия 27,4/39=0,6 (27,4 – массовая доля калия, она дана в условии. 39 – атомная масса калия, взятая из таблицы Менделеева)
· атомов марганца 34,8/55=0,6 (34,8 – массовая доля марганца, она дана в условии. 55 – атомная масса марганца, взятая из таблицы Менделеева).
· атомов кислорода 40,5/16=2,5 (40,5 – массовая доля кислорода, она дана в условии. 16 – атомная масса кислорода, взятая из таблицы Менделеева)
Таким образом, у нас получились индексы Х, Y и Z, которые нам были нужны: Х=0,6, Y=0,6 и Z=2,5. Но индексы не могут быть нецелыми, ведь они показывают, сколько атомов элемента входит в вещества. А число атомов всегда целое. Поэтому наши дробные Х, Y и Z нужно привести к целому виду. Для этого мы просто разделим их все на наименьшее число (у нас это 0,6). Тогда получаем:
Z=2,5/0,6=4 (тут получается чуть больше, но округляем до целого числа).
Теперь мы знаем индексы и можем сказать, что соединение входит 1 атом калия, 1 атом марганца и 4 атома кислорода.
Ответ: формула соединения KMnO4.
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Источник
Как найти массовую долю вещества по формуле
Массовая доля — один из важных параметров, который активно используется для расчетов и не только в химии. Приготовление сиропов и рассолов, расчет внесения удобрений на площадь под ту или иную культуру, приготовление и назначение лекарственных препаратов. Для всех этих расчетов нужна массовая доля. Формула для ее нахождения будет дана ниже.
В химии она рассчитывается:
- для компонента смеси, раствора;
- для составной части соединения (химического элемента);
- для примесей к чистым веществам.
Раствор — это тоже смесь, только гомогенная.
Массовая доля — это отношение массы компонента смеси (вещества) ко всей его массе. Выражают в обычных числах или в процентах.
Формула для нахождения такая:
? = (m (сост. части) · m (смеси, в-ва)) / 100% .
Нахождение массовой доли химического элемента
Массовая доля химического элемента в веществе находится по отношению атомной массы химического элемента, умноженной на количество его атомов в этом соединении, к молекулярной массе вещества.
Например, для определения w кислорода (оксигена) в молекуле углекислого газа СО2 вначале найдем молекулярную массу всего соединения. Она составляет 44. В молекуле содержится 2 атома кислорода. Значит w кислорода рассчитываем так:
w(O) = (Ar(O) · 2 ) / Mr(СО2)) х 100%,
w(O) = ((16 · 2) / 44) х 100% = 72,73%.
Аналогичным образом в химии определяют, например, w воды в кристаллогидрате — комплексе соединения с водой. В таком виде в природе находятся многие вещества в минералах.
Например, формула медного купороса CuSO4 · 5H2O. Чтобы определить w воды в этом кристаллогидрате, нужно в уже известную формулу подставить, соответственно, Mr воды (в числитель) и общую m кристаллогидрата (в знаменатель). Mr воды 18, а всего кристаллогидрата — 250.
w( H2O ) = ((18 · 5) / 250 ) · 100% = 36%

Нахождение массовой доли вещества в смесях и растворах
Массовая доля химического соединения в смеси или растворе определяется по той же формуле, только в числителе будет масса вещества в растворе (смеси), а в знаменателе — масса всего раствора (смеси):
? = (m (в-ва) · m (р-ра)) / 100% .
Следует обратить внимание, что массовая концентрация — это отношение массы вещества к массе всего раствора, а не только растворителя.
Например, растворили 10 г поваренной соли в 200 г воды. Нужно найти процентную концентрацию соли в полученном растворе.
Для определения концентрации соли нам нужна m раствора. Она составляет:
m (р-ра) = m (соли) + m (воды) = 10 + 200 = 210 (г).
Находим массовую долю соли в растворе:
? = ( 10 · 210) / 100% = 4,76%
Таким образом, концентрация поваренной соли в растворе составит 4,76%.
Если в условии задачи дается не m, а объем раствора, то его нужно перевести в массу. Делается это обычно через формулу для нахождения плотности:
где m — масса вещества (раствора, смеси), а V — его объем.
Такую концентрацию используют чаще всего. Именно ее имеют в виду (если нет отдельных указаний), когда пишут о процентном содержании веществ в растворах и смесях.

Массовая доля примесей
В задачах часто дается концентрация примесей в веществе или вещества в его минералах. Следует обратить внимание на то, что концентрация (массовая доля) чистого соединения будет определяться путем вычитания из 100% доли примеси.
Например, если говорится, что из минерала получают железо, а процент примесей 80%, то чистого железа в минерале 100 — 80 = 20%.
Соответственно, если написано, что в минерале содержится только 20% железа, то во все химические реакции и в химическом производстве будут участвовать именно эти 20%.
Например, для реакции с соляной кислотой взяли 200 г природного минерала, в котором содержание цинка 5%. Для определения массы взятого цинка пользуемся той же формулой:
? = (m (в-ва) · m (р-ра)) / 100% ,
из которой находим неизвестную m раствора:
m (Zn) = ( w · 100% ) / m (минер.)
m (Zn) = (5 · 100) / 200 = 10 (г)
То есть, в 200 г взятого для реакции минерала содержится 5% цинка.
Задача. Образец медной руды массой 150 г содержит сульфид меди одновалентной и примеси, массовая доля которых составляет 15%. Вычислите массу сульфида меди в образце.
Решение задачи возможно двумя способами. Первый — это найти по известной концентрации массу примесей и вычесть ее из общей m образца руды. Второй способ — это найти массовую долю чистого сульфида и по ней уже рассчитать его массу. Решим обоими способами.
Вначале найдем m примесей в образце руды. Для этого воспользуемся уже известной формулой:
? = ( m (примесей) · m (образца)) / 100% ,
m(примес.) = (w · m (образца)) · 100% , (А)
m(примес.) = (15 · 150) / 100% = 22,5 (г).
Теперь по разности найдем количество сульфида в образце:
150 — 22,5 = 127,5 г
Вначале находим w соединения:
А теперь по ней, воспользовавшись той же формулой, что и в первом способе (формула А), найдем m сульфида меди:
m(Cu2S) = (w · m (образца)) / 100% ,
m(Cu2S) = (85 · 150) / 100% = 127,5 (г).
Ответ: масса сульфида меди одновалентного в образце составляет 127,5 г.
Видео
Из видео вы узнаете, как правильно производить рассчеты по химическим формулам и как найти массовую долю.
Источник
Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
-
Образовательные:
-
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
-
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
-
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
-
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
-
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
-
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
-
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
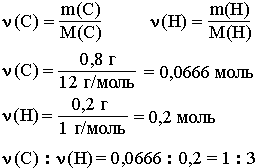
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.

2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
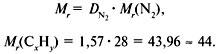
3. Найти индексы х и y по отношению ![]() :
:
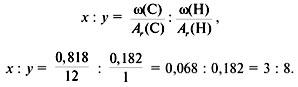
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.

2. Найти массовую долю водорода:
![]() (Н) = 100% – 83,3% = 16,7%.
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
![]()
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
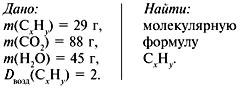
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
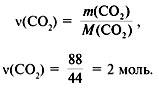
4. Найти количество вещества углерода в сожженном веществе:
![]() (C) =
(C) = ![]() (CO2) = 2 моль.
(CO2) = 2 моль.
5. Найти количество вещества воды:
![]() (H2O) = 45/18 = 2,5 моль.
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
![]() (H) = 2
(H) = 2![]() (H2O),
(H2O),
![]() (H) = 2,5•2 = 5 моль.
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
![]() (C) :
(C) : ![]() (Н) = 2 : 5,
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.

2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
![]() (CO2) = 16,8/22,4 = 0,75 моль,
(CO2) = 16,8/22,4 = 0,75 моль,
![]() (C) = 0,75 моль.
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
![]() (H2O) = 13,5/18 = 0,75 моль,
(H2O) = 13,5/18 = 0,75 моль,
![]() (H) = 0,75•2 = 1,5 моль.
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
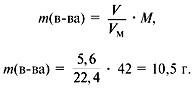
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
![]() (C) :
(C) : ![]() (H) = 0,75 : 1,5 = 1 : 2,
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
-
Общая формула алканов CnH2n+2, общая формула монохлоралканов CnH2n+1Cl
-
Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(CnH2n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
-
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
-
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
-
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
-
Уравнения реакций:
CnH2n + Н Сl = CnH2n+1Cl
CnH2n + Н Br = CnH2n+1Br
-
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(CnH2n+1Cl) = n(CnH2n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
-
Находим количество вещества алкена:
n(CnH2n) = 1,012/22,4 = 0,045 моль
-
По уравнению реакции
CnH2n +Сl2 = CnH2nCl2
n(CnH2nCl2)= n(CnH2n) =0,045 моль
-
М(CnH2nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
|
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. |
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
|
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. |
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
|
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. |
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
|
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. |
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
|
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода |
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
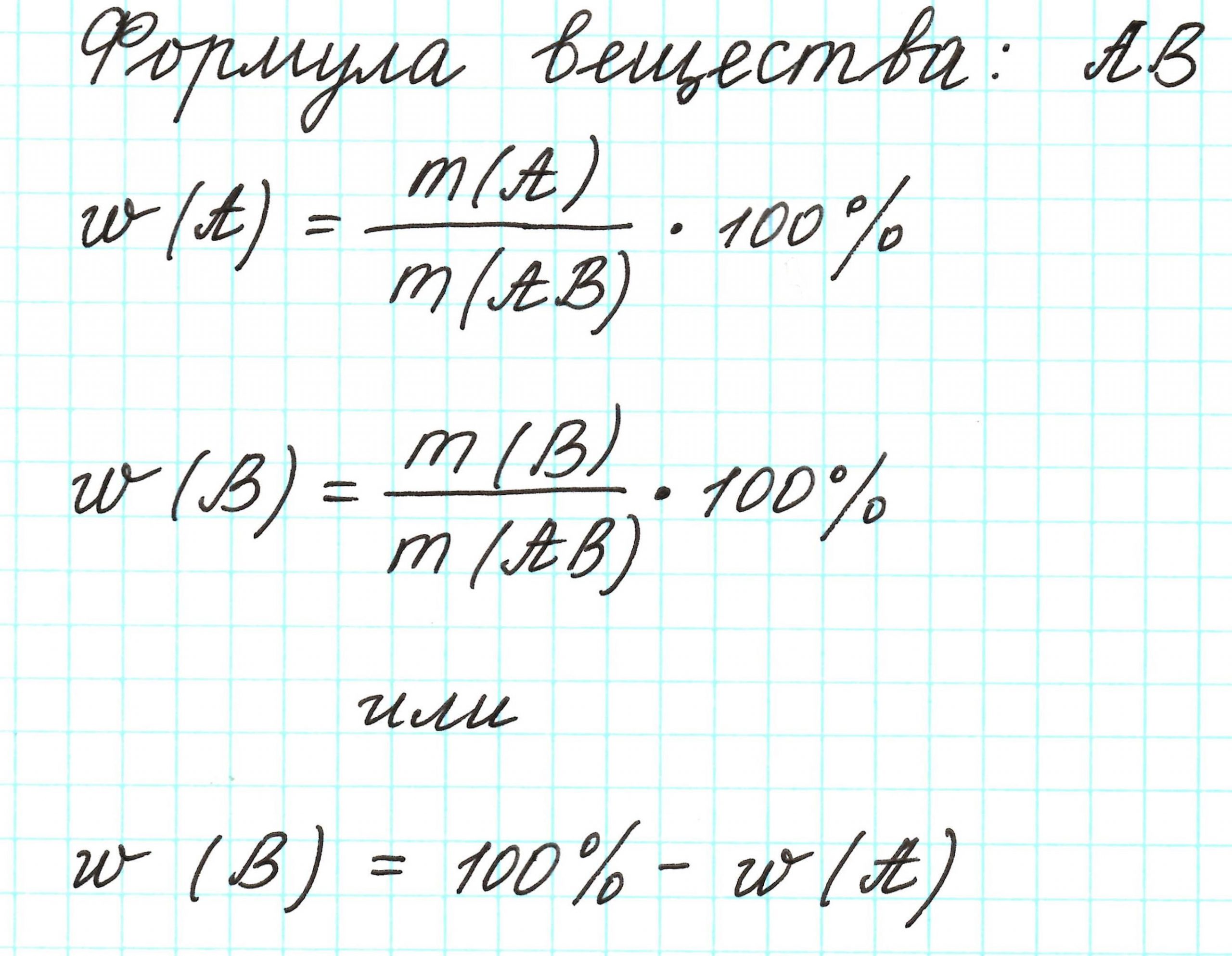
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
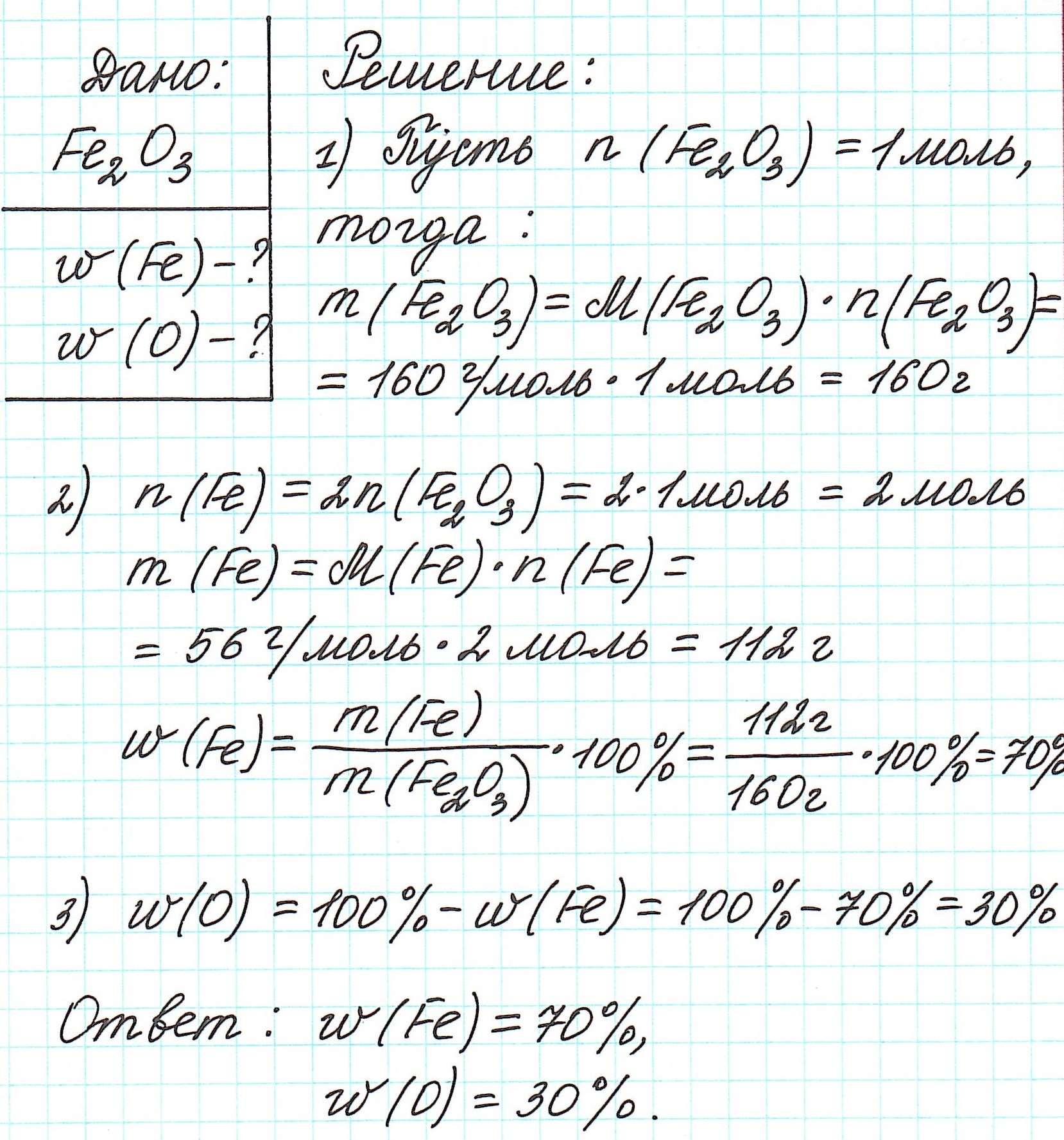
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
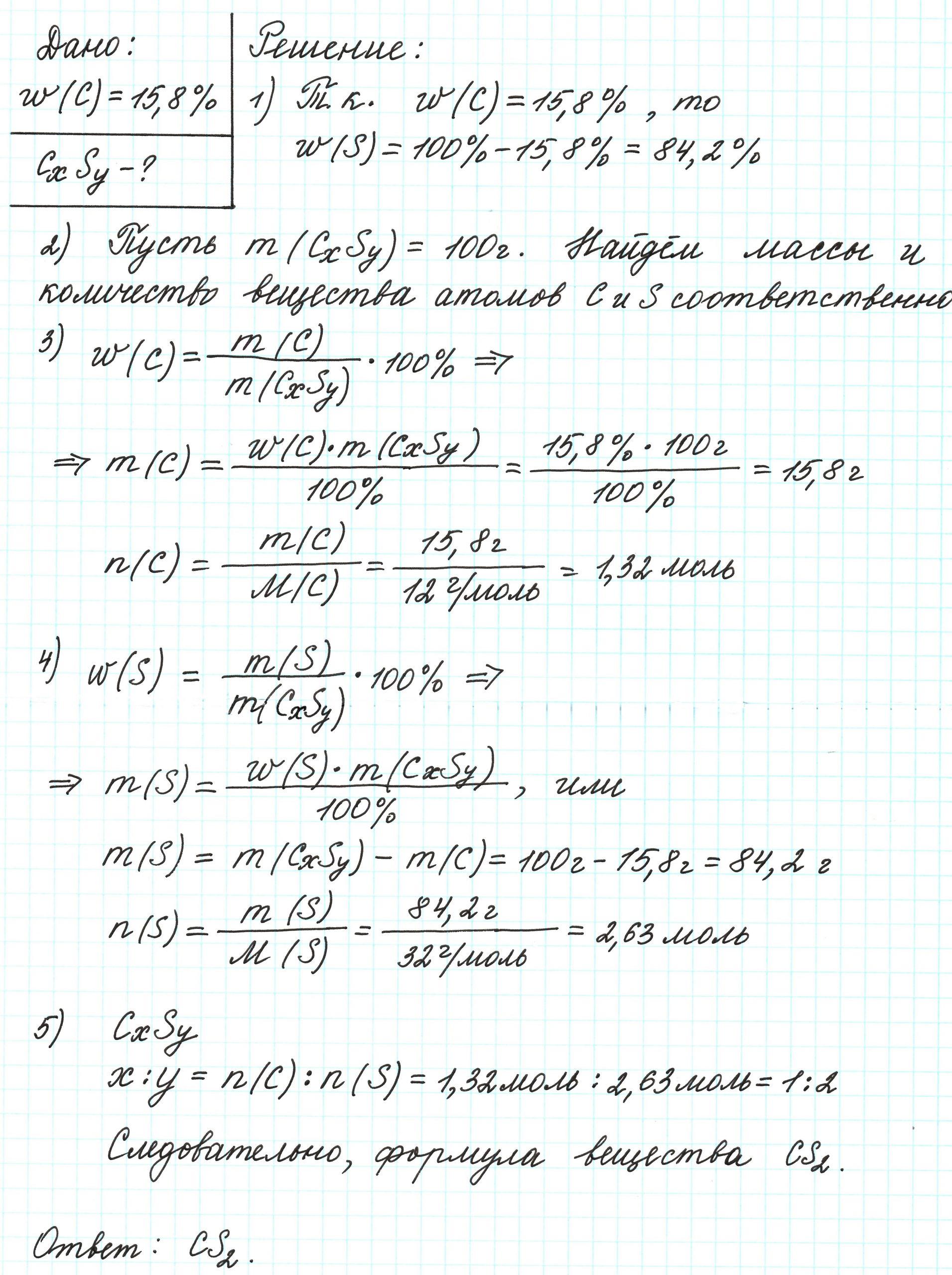
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.

Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
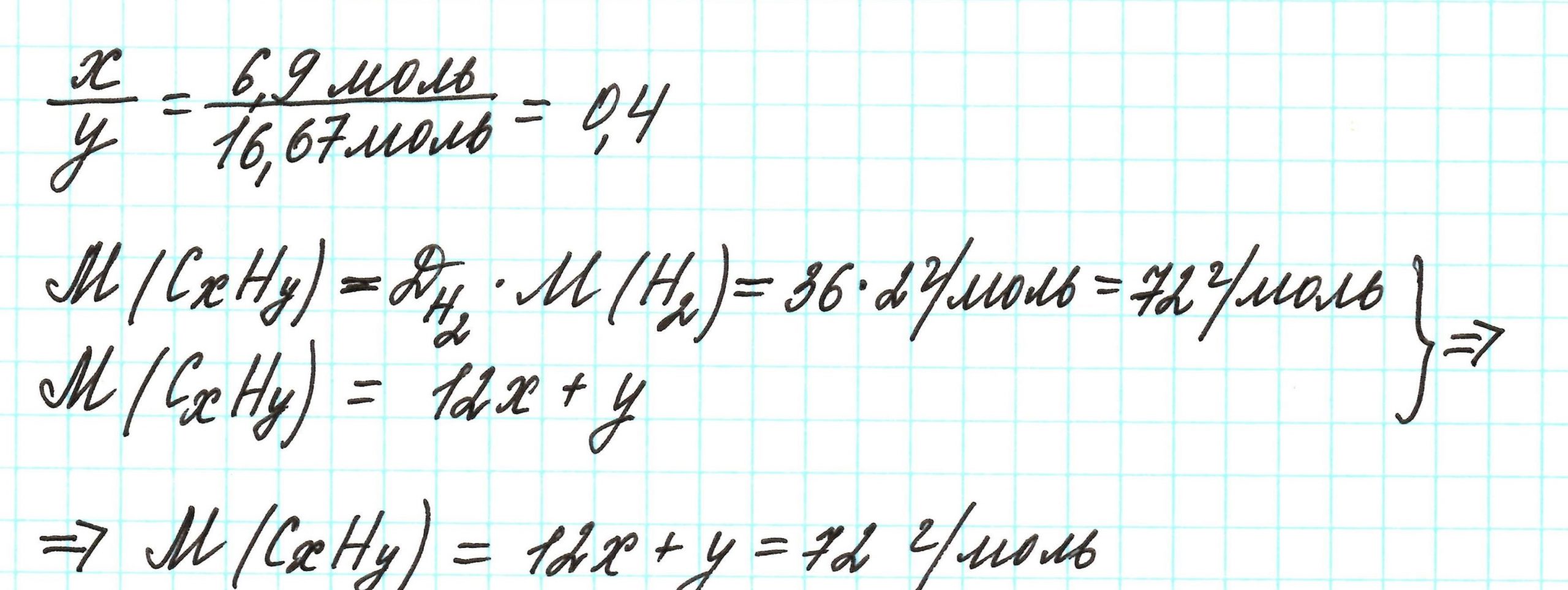

Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
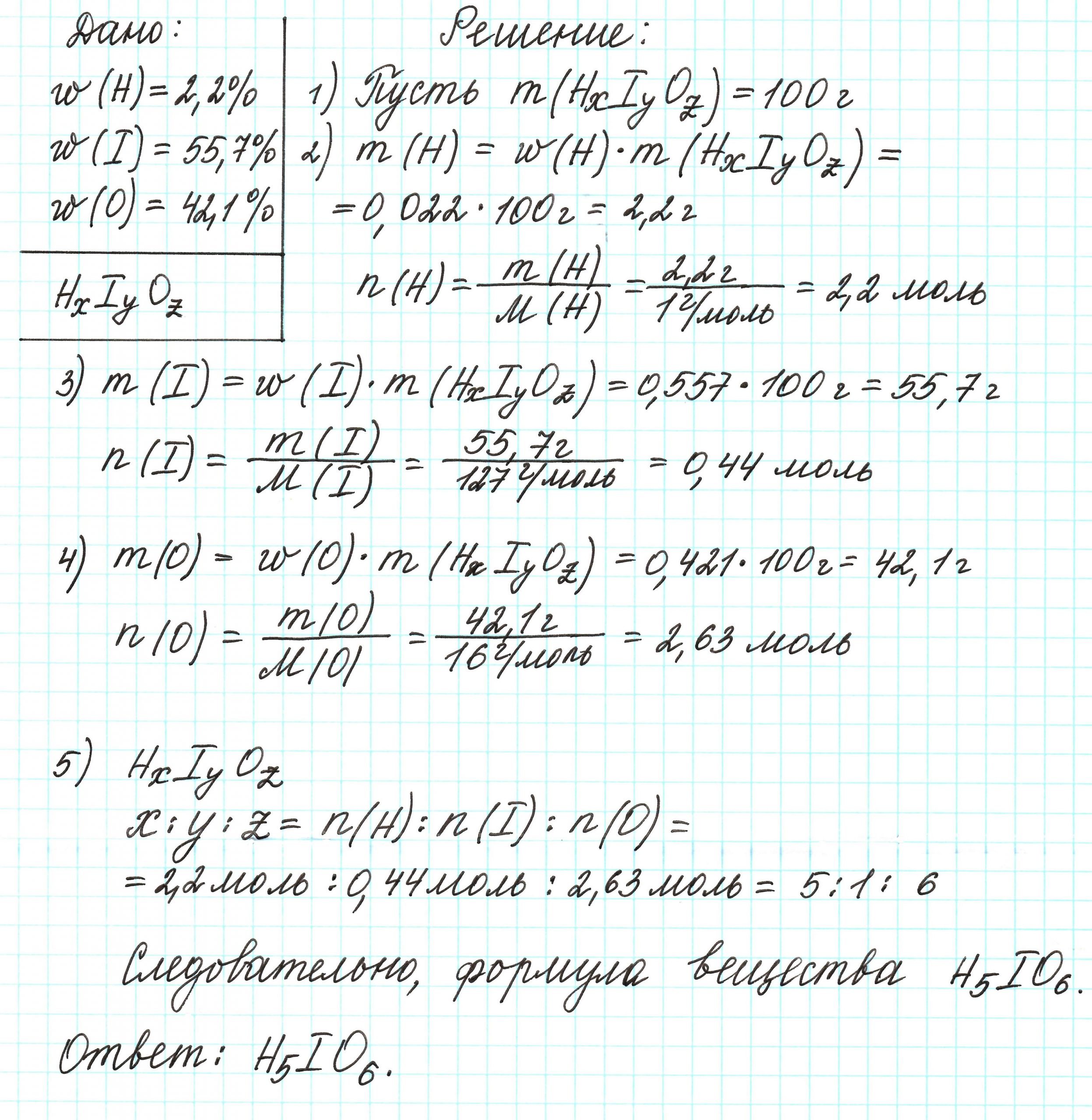
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
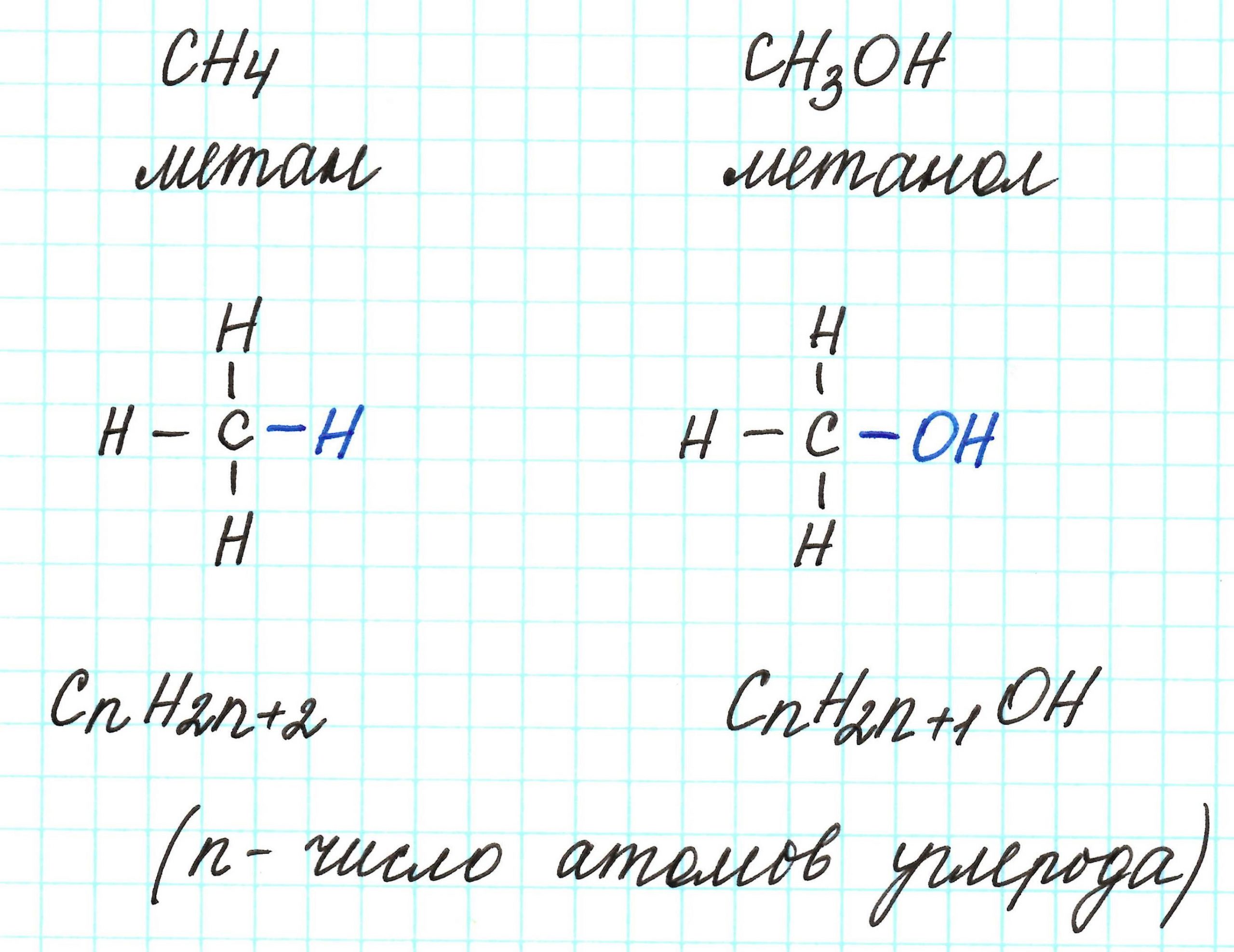
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
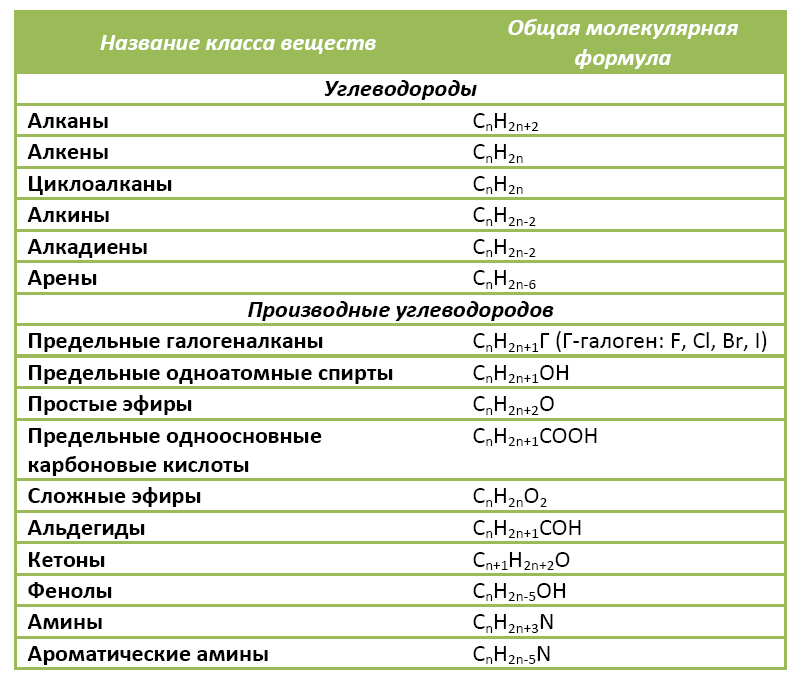
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
 Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?

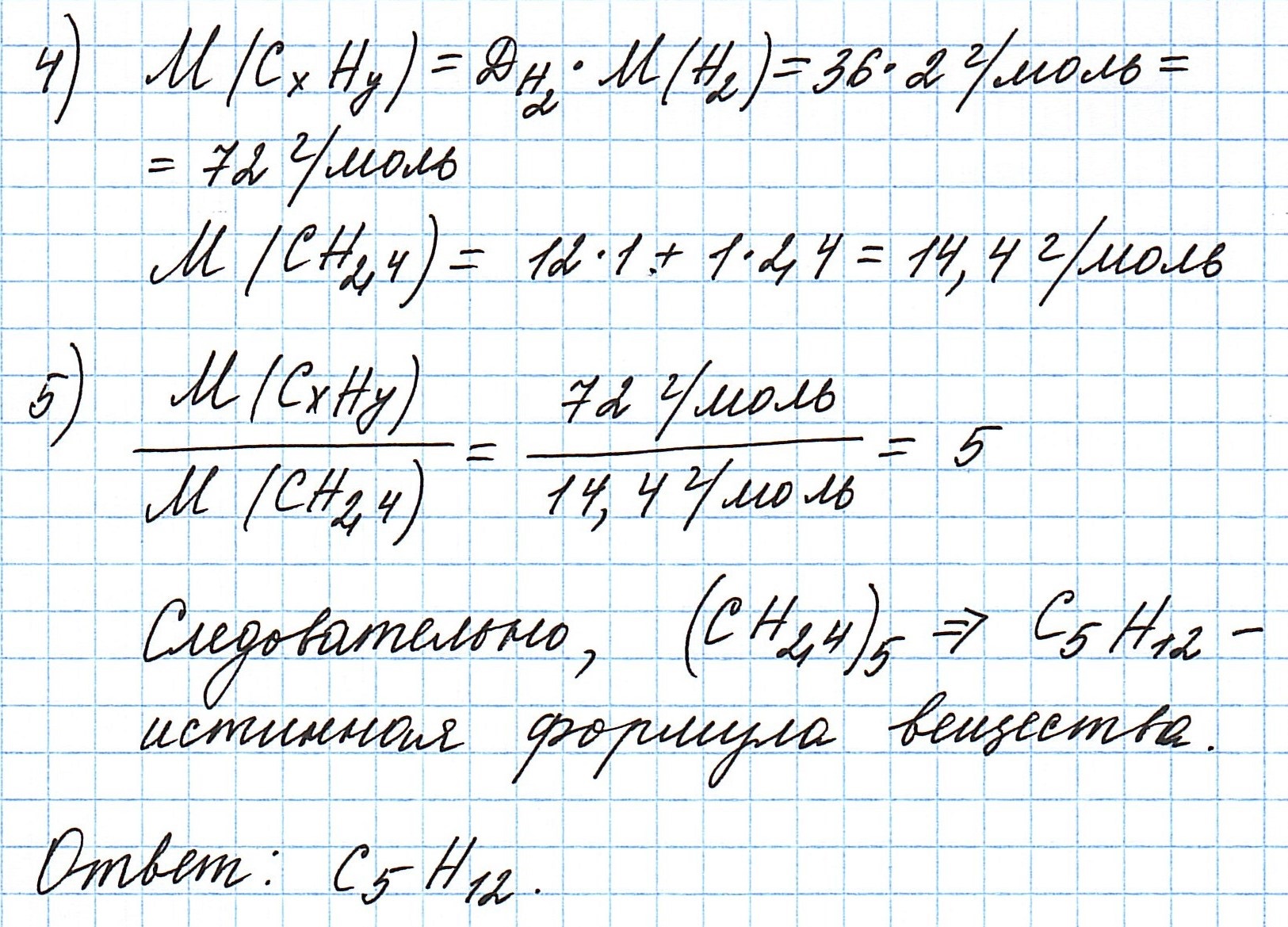
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.


Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.


5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.

Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.

Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.

Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.

Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Подготовка к ЕГЭ:
-
выполнение заданий высокого уровня
сложности, задачи на вывод формул.
Задачи на вывод формул соединений –
это задания С5 из 3 части экзаменационной
работы ЕГЭ.
При выводе формул нужно различать
простейшую и
истинную
формулы.
Простейшая формула показывает соотношение
числа атомов каждого элемента.
Истинная формула показывает точный
количественный состав. Например,
простейшая формула бензола СН, она
показывает, что на один атом углерода
в молекуле бензола приходится один атом
водорода. Истинная формула бензола,
показывающая точный количественный
состав молекулы – С6Н6.
Чтобы установить истинную формулу,
нужно знать истинную молекулярную
(молярную) массу, она в целое число раз
больше массы, найденной по простейшей
формуле. На это число нужно умножить
индексы в простейшей формуле, чтобы
получить истинную формулу. Если в условии
задачи нет данных для нахождения истинной
молярной массы, а найденная простейшая
формула явно не соответствует истинной,
то полученные индексы нужно увеличить
в два раза. Например, получилась простейшая
формула С3Н7, значит истинная
будет С6Н14
При всём многообразии задач на вывод
формул можно выделить несколько основных
типов. Рассмотрим алгоритмы решений
этих задач наиболее простыми способами.
-
Написать формулу вещества, обозначив
индексы через x, y,
z. -
Если неизвестна массовая доля одного
из элементов, то её находят, отняв от
100 % известные массовые доли.
3. Найти соотношение индексов, для
этого массовую долю каждого элемента
(лучше в %) разделить на его атомную массу
(округлить до тысячных долей)
x : y: z
= ω1 / Ar1
: ω2 / Ar2
: ω3 / Ar3
4. Полученные числа
привести к целым. Для этого разделить
их на наименьшее из полученных чисел.
При необходимости (если опять получилось
дробное число) после этого домножить
до целого числа на 2, 3, 4 … .
5. Получится простейшая формула.
Для большинства неорганических веществ
она совпадает с истинной, для органических,
наоборот, не совпадает.
Задача № 1.
Массовая доля азота в оксиде азота равна
36,84 % . Найти формулу данного оксида.
Дано:
ω
(N)
= 36,84 % Решение:

1. Напишем формулу:
NxOy
М.Ф. = ? 2. Найдём
массовую долю кислорода:
ω(О) = 100 % – 36,84 % =
61,16 %
3. Найдём соотношение
индексов:
x : y
= 36,84 / 14 : 61,16 / 16 = 2,631: 3,948 =
2,631 / 2,631: 3,948 / 2,631 = 1:
1,5 =
= 1 ∙ 2 : 1,5 ∙ 2 = 2 : 3
N2O3
Ответ: N2O3.
Задача № 2.
Установите формулу неорганического
соединения, содержащего 20 % магния, 53,33
% кислорода и 26,67 % некоторого элемента.
Дано:
ω
(Mg)
= 20 % Решение:
ω(O) = 53,33 %
1. Напишем формулу: Mgx
Эy Оz.
ω(э) = 26,67 % 2. Найдём
соотношение индексов магния и кислорода:

х : у = 20 / 24 : 53,33 / 16 =
0,83 : 3,33 = 1 : 4.
М.Ф. = ? 3. Найдём молекулярную
массу вещества, исходя из значения
массовой доли магния:
ω(Mg) = Ar(Mg)
∙ индекс / Mr
Mr = Ar(Mg) ∙
индекс / ω
= 24 ∙ 1 / 0,2 = 120.
4. Найдём
атомную массу неизвестного элемента:
ω(Э) = Ar(Э)
∙ индекс / Mr
Ar(Э) ∙ индекс =
= ω(Э) ∙ Мr
= 0,2667 ∙ 120 = 32 элемент
– сера.
Ответ: MgSO4.
Задача № 3.
Массовая доля углерода в углеводороде
равна 83,72 %. Найти молекулярную формулу
углеводорода.
Д
ано:
Решение:
ω(С) = 83,72 % 1. Напишем формулу –
СхНу
2. Найдём массовую
долю водорода:
М.Ф. = ? ω(Н) = 100 % – 83,72 % = 16,28 %
3. Найдём соотношение
индексов:
х : у = 83,72 / 12 : 16,28 / 1
= 6,977 : 16,28 = 1 : 2,333 = 3 : 7
4. Простейшая
формула – С3Н7, но
она не соответствует истинной.
Выход – увеличить
индексы в 2 раза
С6Н14.
Ответ: С6Н14.
Задача № 4.
Массовая доля фосфора в его оксиде
равна 43,66 %. Какова формула оксида?
Ответ: Р2О5.
Задача № 5.
Определить формулу вторичного
амина, массовые доли углерода, водорода
и азота, в котором составляют 61; 15,3 и
23,7 % соответственно.
Ответ: CH3
– NH – C2H5.
Задача № 6.
Массовая доля углерода в диеновом
углеводороде составляет 88,89 %. Найти
молекулярную формулу диена.
Ответ: С4Н6.
II. Вывод формул
веществ по массовым долям элементов и
данным для нахождения истинной молярной
массы (плотности,
массе и объёму газа или относительной
плотности).
-
Найти истинную молярную массу:
-
если известна плотность:
= m / V = M
/ Vm
M
= ∙
Vm
= г/л
∙ 22,4 л/моль
если известна масса и объём
газа, молярную массу можно найти двумя
способами:
– через плотность
= m / V, M
= ∙ Vm;
– через количество вещества:
= V / Vm, M
= m / .
-
если известна относительная плотность
первого газа по другому:
D21
= M1
/ M2
M1
= D2
∙ M2
M =
DH2
∙ 2 M = DO2
∙ 32
M
= Dвозд. ∙
29 M = DN2
∙ 28 и т.д.
2. Найти простейшую формулу вещества
(см. предыдущий алгоритм) и его молярную
массу.
3. Сравнить истинную молярную массу
вещества с простейшей и увеличить
индексы в нужное число раз.
Задача № 1.
Найти формулу углеводорода, в котором
содержится 14,29 % водорода, а его
относительная плотность по азоту равна
2.
Дано:
ω
(Н)
= 14,29 % Решение:
D(N2)
= 2 1. Найдём истинную молярную
массу СхНу :
М = DN2
∙ 28 = 2 ∙ 28 = 56 г/моль.
М.Ф. = ? 2. Найдём массовую
долю углерода:
ω(С) = 100 % – 14,29 % = 85,71 %.
3. Найдём простейшую
формулу вещества и его молярную массу:
х : у = 85,7 / 12 : 14,29 / 1 = 7,142 : 14,29 = 1 :
2 СН2
М(СН2) = 12 + 1 ∙ 2 = 14 г/моль
4. Сравним молярные
массы:
М(СхНу)
/ М(СН2) = 56 / 14 = 4
истинная формула – С4Н8.
Ответ: С4Н8.
Задача № 2.
Массовая доля углерода в углеводороде
– 87,5 %, а относительная плотность
углеводорода по воздуху равна 3,31.
Определить формулу вещества.
Ответ: C7H12.
Задача № 3.
Определить молекулярную формулу амина,
массовые доли углерода, азота и водорода
в котором составляют 38,7; 45,15 и 16,15 %
соответственно. Относитель-
ная плотность его паров по воздуху равна
1,069.
Ответ: CH3NH2.
Задача № 4.
Определите формулу углеводорода,
массовая доля водорода в котором
составляет 14,3 %. Относительная плотность
этого вещества по водороду равна 21.
Ответ: С3Н6.
Задача № 5.
Относительная плотность паров
углеводорода по воздуху равна 3,31, а
массовая доля водорода в нём равна 12,5
%. Определите молекулярную формулу
углеводорода.
Ответ: С7Н12.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
12.02.2015398.43 Кб285.pdf
- #
- #
- #
- #
- #
- #
- #
- #
