Атом — это наименьшая частица химического элемента, сохраняющая все его химические свойства. Атом состоит из ядра и вращающихся вокруг него электронов. Ядро также имеет сложное строение и состоит из нейтронов и электронов.
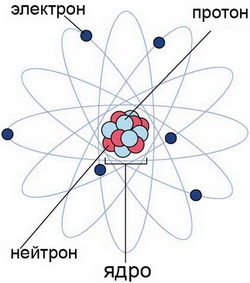
Число электронов равно числу протонов в атоме и определяется порядковым номером. В связи с этим атом в целом электронейтрален, так как электроны заряжены отрицательно, а протоны положительно. Заряд ядра также равен порядковому номеру. Число нейтронов рассчитывается по формуле N = A – Z, где N — общее число нейтронов, А — массовое число, Z — заряд ядра. Число энергетических уровней в атоме определяется номером периода. Число электронов на последнем внешнем уровне равно номеру группы.
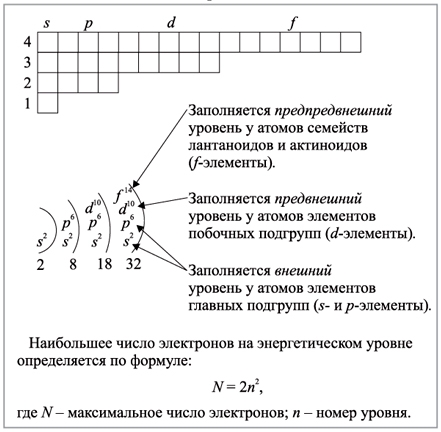
Максимальное число электронов на энергетическом уровне определяется формулой N = 2 * n^2 , где N — общее число электронов на энергетическом уровне, n – номер уровня.
В связи с этим максимальное число электронов на первом (n = 1) уровне равно 2 (так как N = 2 * 1^2), на втором (n = 2) уровне — 8 (так как N = 2 * 2^2), на третьем (n = 3) уровне — 18 (так как N = 2 * 3^2) и т.д.
Каждый энергетический уровень делится на подуровни. На первом уровне только один подуровень — s. На втором уровне два подуровня — s и p. на третьем — s, p и d. На четвертом — s, p, d и f.
Максимальное число электронов на подуровнях
- 2 — максимальное число электронов на s-подуровне.
- 6 — максимальное число электронов на p-подуровне.
- 10 — максимальное число электронов на d-подуровне.
- 14 — максимальное число электронов на f-подуровне.
Максимальное число электронов на подуровне не зависит от номера уровня.
Заполнение энергетических уровней
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
Геометрия орбиталей
Примеры
Полезные ссылки
Источник материала
Электронная оболочка атома (видео)
Строение атома (Часть 1) (видео)
Строение атома (Часть 2) (видео)
Строение атома. Ядерные силы (видео)
Дополнительные материалы
Модели строения атома (видео)
Строение атома: Атомное ядро (видео)
Химия. Строение атома: Строение электронных оболочек (видео)
Строение атома (видео)
Строение электронных оболочек атомов
На этом уроке вы узнаете, как устроена электронная оболочка атома, и сможете объяснить явление периодичности. Познакомитесь с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
I. Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя. Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако –электронное облако, форма и размер которого зависят от энергии электрона.
Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собойэлектронное облако.
II. Электронное облако
Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
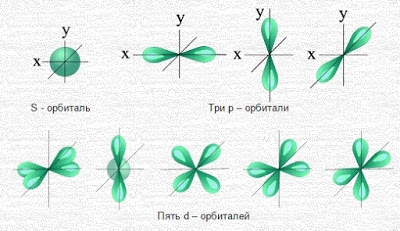
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (~90%), называется орбиталью.
|
Виды электронных орбиталей |
Форма орбитали в пространстве |
Количество орбиталей в атоме. Условное обозначение орбитали – клетка: |
|||||||
|
s – орбиталь (электронное облако s – электрона) |
сфера (шар) |
Электронное облако такой формы может занимать в атоме одно положение (условное обозначение) |
|||||||
|
p – орбиталь (электронное облако p – электрона) |
гантель (восьмёрка) |
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. (условное обозначение) |
|||||||
|
d – орбиталь (электронное облако d – электрона) |
четырёхлепестковая форма |
Все d-орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре. (условное обозначение) |
|||||||
|
f – орбиталь (электронное облако f – электрона) |
сложная форма |
Электронное облако такой формы может занимать в атоме семь положений. (условное обозначение) |
Условное обозначение электрона – стрелка, направленная вверх↑ (электрон вращается вокруг собственной оси по часовой стрелке) или стрелка, направленная вниз↓ (электрон вращается вокруг собственной оси против часовой стрелки).
Число электронов в атоме определяют по порядковому номеру
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
Cледовательно, на s – орбитали максимально может разместиться два электрона (s2); на p – орбитали максимально может разместиться шесть электронов (p6) на d – орбитали максимально может разместиться десять электронов (d10); f – четырнадцать электронов (f14).
Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Условное обозначение уровня – скобка: )
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
О – 2 уровня, S – три уровня.

Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
III. Формулы отражающие строение атомов первого и второго периодов
H +1 )1e
– схема строения атома, отображает распределение электронов по энергоуровням.
+1 Н 1s1
– электронная формула, отображает число электронов по орбиталям.
+1 Н
– электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.


У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.

Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
IV. Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ
1. Порядок заполнения уровней и подуровней электронами
Электронные формулы атомов химических элементов составляют в следующем порядке:
- Сначала по номеру элемента в таблице Д. И. Менделеева определяют общее число электронов в атоме;
- Затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
- Уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии Принципом наименьшей энергии
- Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что:
- У элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
- У элементов побочных подгрупп на внешнем уровне обычно дваэлектрона (исключение составляют атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне нольэлектронов);
- Число электронов на предпоследнем уровне равно общему числу электронов в атоме минус число электронов на всех остальных уровнях.
Порядок заполнения электронами атомных орбиталей определяется:
Принципом наименьшей энергии
Шкала энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…

2. Семейства химических элементов
Элементы, в атомах которых происходит заполнение электронами s-подуровня внешнегоэнергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
Элементы, в атомах которых электронами заполняется p-подуровень внешнегоэнергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III–VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.

В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).

«Проскок» или «провал» электрона
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди, исходя из вышенаписанного, должна иметь вид: Cu 1s22s22p63s23p64s23d9. Однако в действительности один из двух 4s-электронов «проваливается» на 3d-подуровень, и атом меди имеет следующую конфигурацию: 1s22s22p63s23p64s13d10.
Для элементов IБ-подгруппы характерна конфигурация внешнего слоя: ns1(n−1)d10.
Для элементов Cr и Mo характерна конфигурация внешнего слоя: ns1(n−1)d5.
Особо следует отметить палладий, у которого «проваливаются» два электрона:
Pd1s22s22p63s23p64s23d104p65s04d10
V. Тест
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
а) +30
б) +31
в) +15
г) +5
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента;
б) номеру группы;
в) заряду ядра атома;
г) номеру периода
3. Число нейтронов в атоме цинка равно
а) 30
б) 35
в) 4
г) 2
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
а) убывают;
б) возрастают;
в) не изменяются;
г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
а) Li
б) Br
в) C
г) N
6. Электронная формула строения атома меди, это-
а) 1s22s22p63s23p64s23d10;
б) 1s22s22p63s23p64s23d9;
в) 1s22s22p63s13p64s23d10;
г) 1s22s22p63s23p64s23d11.
7. Заряд ядра атома кальция равен
а) 20
б) 2
в) 40
г) 41
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
а) номеру периода;
б) номеру группы;
в) порядковому номеру элемента;
г) атомной массе.
9. Число нейтронов в атоме железа равно
а) 26
б) 55
в) 56
г) 30
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
а) уменьшается;
б) не изменяется;
в) увеличивается;
г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
а) RH4;
б) RH3;
в) RH2;
г) RH.
12. Электронная формула строения атома мышьяка, это-
а) 1s22s22p63s23p64s13d114p3;
б) 1s22s22p63s23p64s23d94p4;
в) 1s22s22p63s23p64s13d104p4;
г) 1s22s22p63s23p64s23d104p4.
Тренажер №1
Тренажер №2
Урок № 76: «Электронная
оболочка атома: понятие об энергетическом уровне (электронном слое), его
ёмкости. Заполнение электронных слоёв у атомов первых 20 химических элементов».
Цели урока: Образовательные
сформировать знания о закономерностях заполнения электронных
оболочек атомов; ввести понятия о завершенности и незавершенности электронного
уровня; раскрыть связи между строением электронной оболочки и номером периода,
в котором находится химический элемент;
Развивающие развитие способности анализировать, делать выводы; развитие
коммуникативных навыков через групповую работу; развитие умения работать с
текстом;
формирование познавательного интереса к химии;
Воспитательные: способствование
формированию у учащихся уважения к научному познанию и убеждения в ценности
научных знаний для разных областей человеческой деятельности, для повседневной
жизни человека; формирование умения слушать своих товарищей, работать в
коллективе.
Тип урока: урок
усвоения новых знаний.
Педагогические технологии: элементы
личностно-ориентированного, проблемного обучения, ИКТ, обучения в
сотрудничестве, игровой технологии, элементы технология сотрудничества.
Методы: частично-поисковые,
практические, наглядные.
Форма организации учебной деятельности: сочетание
фронтальной работы и работы в группах.
Основные понятия. Энергетический
уровень (электронный слой), атомная орбиталь.
Планируемые
результаты обучения
Предметные
Усвоить
современную формулировку Периодического закона, значение физического смысла
порядкового номера химического элемента, номеров периода и группы, уметь
объяснять причину периодичности изменения свойств веществ в свете теории
строения атомов, составлять схемы строения атомов.
Метапредметные. Развивать
умения создавать обобщения, устанавливать аналогии, причинно-следственные
связи, строить логические рассуждения и делать выводы.
Личностные. Формировать
мировоззрение, соответствующее современному уровню развития науки.
Оборудование:
компьютер, мультимедийный комплекс, презентация «Строение электронных оболочек
атома», таблицы Д.И. Менделеева; дидактические карточки.
Структура урока
1. Проверка домашнего задания,
воспроизведение и коррекция опорных знаний учащихся (5 мин.).
2. Мотивация учебной
деятельности учащихся. Сообщения темы, цели, задач урока и мотивация учебной
деятельности школьников (до 2 мин.).
3. Восприятие и первичное
осознание нового материала, осмысление связей и отношений в объектах изучения
(15 мин).
4. Первичная проверка
понимания усвоенного, первичное закрепление усвоенного. (10-15 мин.).
5. Подведение итогов урока
(рефлексия) и сообщение домашнего задания (до 5 мин.).
Ход
урока.
I. Организационный
момент.
– проверка
подготовленности учащихся к учебному занятию, раскрытие учителем общих целей
учебного занятия.
II.
Актуализация опорных знаний и
практического опыта учащихся.
-Проверка
Д/З
-Дайте
ответы на поставленные вопросы (обсуждение вопросов, индивидуальный опрос)
Задание
1: (приложение 1)
1. Из
каких элементарных частиц состоит атом?
2.
Какие элементарные частицы называют протонами?
3.
Какие элементарные частицы называют нейтронами?
4.Какие
элементарные частицы называют электронами?
5.
Почему модель строения атома называют планетарной?
III.Этап целеполагания.
На
данном уроке мы должны ответить на вопросы: «Где находится и каково поведение
электрона в атоме? Какая связь существует между строением атома и физическими и
химическими свойствами веществ.
Записывают
тему урока «Строение электронных оболочек атомов».
IV.
Восприятие и первичное осознание нового материала.
Химические
реакции между веществами протекают при условии, что электроны с внешних уровней
одних атомов одних химических элементов, переходят на внешние уровни атомов
других химических элементов. Элементарные частицы-электроны находятся в
непрерывном движении, иначе они бы упали бы на ядро атома.
Электронная
оболочка атома – это совокупность всех электронов, окружающих ядро. Электроны
расположены вокруг ядра на различном расстоянии. Каждый электрон в атоме
характеризуется своим уровнем энергией. Электроны располагаются вокруг ядра
согласно увеличению их энергии. Чем меньше энергия электрона, чем ближе он
расположен к ядру, тем прочнее с ним связан. Чем больше его энергия, тем дальше
он располагается от ядра и тем легче его оторвать.
Вывод:
каждый электрон атома в зависимости от своей энергии будет находиться на
определенном расстоянии от ядра.
Энергетические
уровни – это электронные слои, на которых располагаются электроны с
различным запасом энергии. Количество энергетических уровней в атоме
соответствует номеру периода, в котором находится данный химический элемент.
Осмысление
связей и отношений в объектах изучения.
– Как узнать
число электронов и число энергетических уровней в атоме того или иного химического
элемента.
– Число
электронов равно числу протонов в ядре и соответствует порядковому номеру
химического элемента.
Задание
2. Заполните пропущенные слова в предложениях (приложение 2).
У алюминия____(
3) энергетических уровня, т.к. он находится в______(третьем) периоде.
У
азота _____( 2) энергетических уровня, – ________(второй) период.
У калия
_____(4) энергетических уровня, – _______четвертый период.
Вывод: Число
энергетических уровней соответствует номеру периода, в котором находится химический
элемент.
Число электронов,
которые могут находиться на каждом энергетическом уровне можно определить при
помощи формулы: N=
2n2 .
Задание
3. (работа у доски) Рассчитайте максимальное число электронов для каждого уровня по
формуле N=
2n2 (где
n –номер электронного слоя).
Запишите:
1
энергетический уровень – максимально 2 электронов.
2 энергетический
уровень – максимально 8 электронов.
3 энергетический
уровень – максимально 18 электронов (у элементов 3 периода заполняется до 8
электронов).
4 энергетический
уровень – максимально 32 электронов.
Вывод:
мы видим, что чем дальше от ядра атома, тем больше число е на
энергетическом уровне.
Распределение
электронов по энергетическим уровням отражается в схеме строения атома.
Пример:
+15
P
) ) )
2 8 5
Работа
в парах. (приложение 3)
Задание
4. Запишите схему распределения
электронов по энергетическим уровням атомов магния, алюминия, фосфора, хлора.
Задание
5 Назовите, какие элементы
имеют такое распределение электронов в атомах: а)2е,1е______; б)2е,8е,8е,2е________;
в)2е,4е________; г) 2е,8е,9е,2е_________.
Физкультминутка: «Интеллектуальная разминка»
Подвижная игра. Учащиеся хлопают столько раз в ладоши,
сколько:
1)
Сколько энергетических уровней у алюминия?
2)
Сколько Электронов на внешнем уровне у натрия?
3)
Сколько валентен кальций?
4)
Сколько протонов у водорода?
5)
Какая масса атома гелия?
Работа
у доски.
Электроны,
находящиеся на одном энергетическом уровне, отличаются друг от друга. Каждый
электрон движется вокруг ядра по определенной траектории с огромной скоростью. Область
пространства, где движется электрон, называется атомной орбиталью.
Электронная
формула атома или электронная конфигурация показывает распределение электронов
по подуровням.
1 энергетический уровень – s- подуровень,
2 энергетический уровень – s- и p- подуровни,
3 энергетический уровень – s-, p- и d- подуровни,
4 энергетический уровень – s-, p-, d- и f- подуровни.
–
Сколько s, p, d, f электронов может находиться на одном энергетическом уровне?
Правило Паули: на одной атомной орбитали могут находиться
только два электрона, которые вращаются вокруг своей оси в противоположных
направлениях (условно: по часовой стрелке и против часовой стрелки), обладающие
противоположными спинами.
В пределах подуровня орбитали заполняются одиночными
электронами с параллельными спинами, и когда все орбитали данного подуровня
будут заняты, происходит спаривание электронов.
Просмотр видеофрагмента «Электронные оболочки атомов» / После
просмотра фрагмента, учащиеся выполняют:
Пример записи электронной формулы:
+16 S ) ) )
286
+16 S 1s22s22p63s2 3p4
Работа в
парах.
Запишите
электронную формулу атомов бериллия, бора, углерода и азота. Укажите характер
элемента и образуемого им оксида.
Как
изменяются свойства простых веществ и их соединений (металличность и
неметалличность, основные и кислотные свойства) по периоду? Объясните причины
этих изменений (заряд ядра атома является главной характеристикой химического
элемента).
Современная формулировка периодического закона Д.
И. Менделеева.
V. Первичная проверка понимания усвоенного,
первичное закрепление усвоенного. Предлагаю
тест для самопроверки. 3
минуты. (выполняют работу, после этого сверяют свои ответы с правильными).
Тестовая
работа (приложение 4)
1.
В атоме магния число электронов на внешнем уровне
равно:
1) 5
2) 3 3) 2 4) 7
2. Заряд
ядра атома хлора равен
1) +35
2) +3 3) +7 4) +17
3. Шесть
электронов на внешнем уровне в атоме
1) Кислорода
2) фосфора 3) азота 4) калия
4. Схема
распределения электронов по уровням 2,8,5 соответствует атому
1)
серы 2) фосфора 3) калия 4) хлора
5. В атоме азота распределение электронов по электронным уровням соответствует
ряду чисел
1) 2,8,5 2)2,6 3) 2,5 4) 2,8,7
6. Электронная формула внешнего электронного уровня 2 s2
2p5
соответствует атому
1) углерода 2) фтор 3) азота 4) кислорода
7. Химический знак элемента, электронная формула которого 1s2
2s2
2p6
3s2
3p4
1) металл
2) неметалл 3) амфотерный элемент.
Взаимопроверка.
ФИО_________________________________
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
ответ |
3 |
4 |
1 |
2 |
3 |
2 |
2 |
Итого:_________
VI. Подведение итогов урока (рефлексия) и сообщение домашнего
задания.
Подсчитайте правильные ответы и выставьте себе отметку
Взаимооценка (учащиеся одной группы оценивают работу своих товарищей на уроке).
Мир един, а в нем – одни и те же законы, явления, под каким бы углом мы их не
рассматривали на уроках физики и химии.
VII. Рефлексия.
VIII. Домашнее задание.
Прочитать
§53, Стр. 188 №1, задание в тетради письменно.
Запишите электронную формулу атомов
натрия, магния, алюминия, кремния. Укажите характер элемента и образуемого им
оксида.
Творческое задание: Придумать занимательные вопросы по биографии Д. И.
Менделеева
Приложение 1
Задание
1 Ответьте на вопросы:
1. Из
каких элементарных частиц состоит атом?
2.
Какие элементарные частицы называют протонами?
3.
Какие элементарные частицы называют нейтронами?
4. Какие
элементарные частицы называют электронами?
5.
Почему модель строения атома называют планетарной? При изучении какого предмета
кроме химии, вы встречались со строением атома?
Приложение 2
Задание
2. Заполните пропущенные слова в предложениях.
У алюминия____(
3) энергетических уровня, т.к. он находится в______(третьем) периоде.
У
азота _____( 2) энергетических уровня, – ________(второй) период.
У калия
_____(4) энергетических уровня, – _______четвертый период.
Вывод: Число
энергетических уровней=_______________________________
Приложение 3
Работа
в парах.
Задание
4. Запишите схему распределения
электронов по энергетическим уровням атомов к магния, алюминия, фосфора, хлора.
+14
Si
) ) ) + Mg) ) ) + Al ) ) ) + P ) )
) + Cl ) ) )
2 8 4
Задание
5 Укажите, какие элементы имеют
такое распределение электронов в атомах:
а)2е,1е___________
б)2е,8е,8е,2е__________ в)2е,4е__________ г)2е,8е,9е,2е___________
Приложение 4
Задание № 5: Тестовая работа
1.
В атоме магния число электронов на внешнем уровне
равно:
2) 5
2) 3 3) 2 4) 7
2. Заряд
ядра атома хлора равен
2) +35
2) +3 3) +7 4) +17
3. Шесть
электронов на внешнем уровне в атоме
2) Кислорода
2) фосфора 3) азота 4) калия
4. Схема
распределения электронов по уровням 2,8,5 соответствует атому
1)
серы 2) фосфора 3) калия 4) хлора
5. В атоме азота распределение электронов по электронным уровням соответствует
ряду чисел
1) 2,8,5 2)2,6 3) 2,5 4) 2,8,7
6. Электронная формула внешнего электронного уровня 2 s2
2p5
соответствует атому
1) углерода 2) фтор 3) азота 4) кислорода
7. Химический знак элемента, электронная формула которого 1s2
2s2
2p6
3s2
3p4
1) металл
2) неметалл 3) амфотерный элемент.
ФИО_________________________________
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
ответ |
Самооценка
________________
Правильные ответы
к приложению 4:
|
№ |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
ответ |
3 |
4 |
1 |
2 |
3 |
2 |
2 |
Оценивание
на уроке ученика (цы)___________________________________Дата:__________
|
№ |
№1 (0-1) |
№2 (0-3) балла |
№3 (0-1) балла |
№4 (0-4) балла |
№5 (0-4) балла |
№6 (0-7) балла |
Дополни- тельные |
Итог |
|
Баллы |
«3» -7-10 баллов
«4» -11-15 баллов
«5» -16 и более балла.
В предыдущих частях мы с Вами научились определять состав атома, то есть, научились определять число протонов, электронов и нейтронов в составе любого атома (смотрите предыдущие серии), но атом помимо этого скрывает в своём строении ещё много интересного!
И если представление о ядре у нас вполне определено – это очень маленькая по размерам, в сравнении с размерами всего атома, совокупность протонов и нейтронов (ядро по отношению к атому как футбольный мяч по отношению к стадиону), то с электронной оболочкой всё далеко не так просто, её мы и будем рассматривать в ближайших выпусках.
Почему строение электронной оболочки приобретает в химии столь высокое значение? Дело в том, что в образовании химической связи участвуют именно электроны (такие электроны называют ! валентными).
! Валентные электроны – электроны, участвующие в образовании химической связи
А какие электроны чаще всего становятся валентными, мы узнаем позднее.
Итак, электроны, входящие в состав электронной оболочки атома, расположены в ней не стихийно и не случайным образом, а в определённом порядке, то есть электронная оболочка имеет своё строение. Элементами данной системы являются энергетические уровни и электронные орбитали (об электронных орбиталях после).
То есть, электроны в составе электронной оболочки атома определённым образом заполняют энергетические уровни и эл. орбитали.
Попробуем подобраться к данным понятиям. Для этого нужно охарактеризовать электрон, то есть, попробуем определить, чем один электрон в составе электронной оболочки отличается от другого. Так вот основными характеристиками электрона в составе электронной оболочки являются: удалённость электрона от ядра и его свободная энергия. Причём, чем ближе электрон к ядру, тем меньше у него свободная энергия и тем выше его энергия связи с ядром.
Это легко понять, если представить себе, что учитель – это ядро, а дети, сидящие за партами – это электроны. Учитель лучше контролирует тех детей, которые расположены ближе к нему, то есть, дети за первыми партами обладают наименьшей свободой, тогда как дети, сидящие позади могут позволить себе больше – могут пересаживаться или даже покинуть класс. Так же и электроны: если электрон лежит близко к ядру, то его свободная энергия минимальна, а энергия связи с ядром – наибольшая, тот же электрон, что лежит дальше всех от ядра, обладает таким запасом свободной энергии, что может покинуть электронную оболочку, ведь его энергия связи с ядром – наименьшая.
Дети обычно сидят в классе рядами. Первый ряд парт с расположенными за ними учениками образует одну символическую совокупность примерно равноудалённых от учителя (ядра) детей (электронов). Следующий ряд парт – другую. И т.д. К чему это мы? А вот к чему!
Совокупность электронов, приблизительно одинаково удалённых от ядра, то есть обладающих близкими запасами свободной энергии называют ! энергетическим уровнем (электронным слоем)!
Энергетические уровни (электронные слои) кроме того, что отличаются друг от друга по удалённости от ядра и по запасу свободной энергии электронов, входящих в их состав, характеризуются так же разным числом электронов, которые могут на них разместиться. Это можно отразить следующим образом:
По отложенной на рисунке вертикальной шкале мы можем видеть, что электроны на первом энергетическом уровне, число которых не может превышать 2, обладают минимальным запасом свободной энергии, то есть наиболее прочно связаны с ядром, тогда как электроны на последующих энергетических уровнях, удаляясь от ядра, увеличивают свой запас свободной энергии, тем самым становясь менее прочно связанными с ядром.
На этом наша пятая серия подошла к концу. В следующем выпуске мы узнаем, как строение электронной оболочки атома связано с его расположением в таблице Менделеева.
Содержание:
Строение атома:
Атом — наименьшая составная часть простых и сложных веществ. Говоря об атомах, мы подчёркивали, что это химически неделимые частицы, не исчезающие и не возникающие при химических реакциях.
В течение многих веков атом считался элементарной, т. е. далее неделимой частицей. И только открытия, сделанные физиками в XIX веке, дали весомые доказательства сложности строения атома. К этим открытиям относятся прежде всего: а) изучение электролиза, т. е. процесса разложения веществ электрическим током; б) открытие катодных лучей — потока отрицательно заряженных частиц, которые впоследствии получили название электроны; и, наконец, в) обнаружение явления радиоактивности, которое представляет собой самопроизвольный распад атомов одних элементов с образованием атомов других элементов.
Ядерная модель строения атома
В начале XX века на основе исследований многих учёных и прежде всего английского физика Э. Резерфорда была установлена принципиальная модель строения атома, получившая название ядерная (планетарная). Согласно этой модели атом состоит из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов. Почти вся масса атома (более 99,96 %) сосредоточена в его ядре. Диаметр ядра приблизительно в 100 000 раз меньше диаметра всего атома (порядка 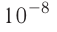
Состав атомных ядер
Согласно современным представлениям ядра атомов состоят из двух видов частиц: протонов и нейтронов, имеющих общее название нуклоны (от лат. nucleus — ядро).
Протоны и нейтроны имеют практически одинаковую массу, равную примерно lu, т. е. одной атомной единице массы (см. § 4). Протон (его символ р) имеет заряд 1+, а нейтрон (символ n) электронейтрален.
Заряд электрона (символическое обозначение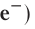
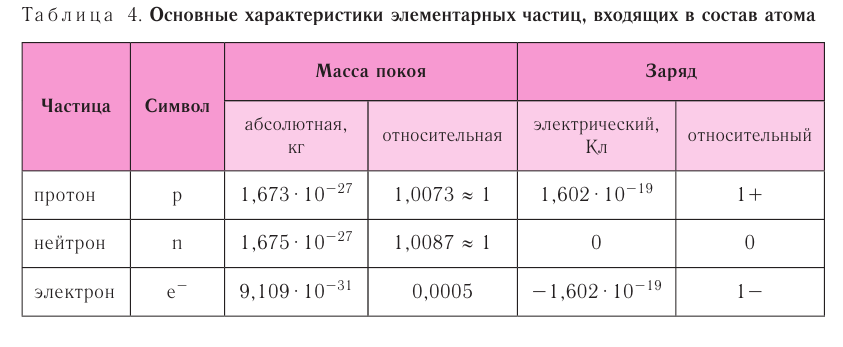
В таблице 4 приведены основные характеристики элементарных частиц, входящих в состав атома.
Протоны и нейтроны удерживаются в ядре особыми силами, которые так и называются ядерные силы. Ядерные силы действуют только на очень малых расстояниях (порядка 10-13 см), но их величина в сотни и тысячи раз превышает силу отталкивания одноимённо заряженных протонов. Энергия связи нуклонов в ядрах атомов в миллион раз превышает энергию химической связи. Поэтому при химических реакциях ядра атомов не разрушаются, а происходит лишь перегруппировка атомов.
Число протонов (Z) в ядре атома носит название протонное число. Оно равно атомному номеру элемента и определяет его место в периодической системе. В этом заключается физический смысл атомного номера. Атомный номер определяет место элемента в периодической системе и поэтому его часто называют порядковым номером.
Заряд ядра определяется числом протонов, и поскольку атом в целом электроцентралей, то очевидно, что число протонов в его ядре равно числу электронов.
Общее число протонов (Z) и нейтронов (N) называется массовым (или нуклонным) числом (A):
A=Z + N.
Массовое число практически определяет массу атома в атомных единицах, так как масса электронов составляет ничтожную часть общей массы атома.
Заряд ядра атома (протонное число) и его массовое число указывают числовыми индексами слева от символа химического элемента 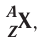 , например:
, например: 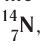
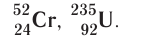
Вид атомов с определёнными значениями атомного номера и массового числа называется нуклидом.
Для обозначения нуклидов используют названия элементов или их символы, указывая массовые (нуклонные) числа: углерод-12, или 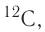 кислород-17, или
кислород-17, или 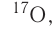 хлор-35, или
хлор-35, или 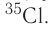
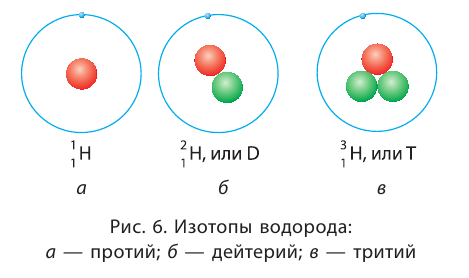
Изотопы
Большинство элементов существуют в виде нескольких нуклидов, которые отличаются друг от друга своими массовыми числами. Это объясняется тем, что в их ядрах при одном и том же числе протонов может находиться разное число нейтронов. Так, природный кислород (Z = 18), кроме атомов, в ядрах которых находится 8 нейтронов 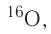 имеет нуклиды с числом нейтронов 9 и 10 —
имеет нуклиды с числом нейтронов 9 и 10 — 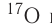 и
и 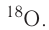 Такие нуклиды являются изотопами (от греч. изос — равный, топос — место), т. е. «занимающими одно место» в таблице периодической системы.
Такие нуклиды являются изотопами (от греч. изос — равный, топос — место), т. е. «занимающими одно место» в таблице периодической системы.
Изотопы — нуклиды, имеющие одинаковый атомный номер, но различные массовые числа.
Другими словами, изотопы — это нуклиды одного и того же элемента. Поэтому термин «изотопы» следует употреблять только во множественном числе. Изотопы любого элемента действительно занимают одно место в периодической системе, так как принадлежат одному и тому же элементу. Следовательно, и химические свойства изотопов данного элемента также будут практически одинаковы.
Теперь мы можем дать более точное определение химического элемента.
Химический элемент — это совокупность всех нуклидов, имеющих одинаковый атомный номер (т. е. одинаковый заряд ядра).
Названия и символы изотопов совпадают с названиями и символами соответствующих элементов.
Только изотопы водорода имеют собственные названия и символы: протий —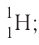 дейтерий — D, или
дейтерий — D, или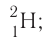 тритий — Т, или
тритий — Т, или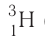 (рис. 6).
(рис. 6).
Так как большинство химических элементов в природе существует в виде смеси нуклидов, то относительная атомная масса данного элемента является средней величиной массовых чисел нуклидов с учётом доли каждого из них в природной смеси. Это объясняет тот факт, что относительные атомные массы большинства элементов не являются целочисленными величинами.
Например, углерод существует в природе в виде двух нуклидов —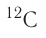 (его доля в природной смеси равна 0,9889) и
(его доля в природной смеси равна 0,9889) и 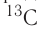 (доля которого равна 0,0111). Относительная атомная масса этого элемента составляет:
(доля которого равна 0,0111). Относительная атомная масса этого элемента составляет:
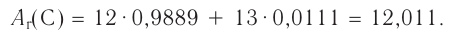
Явление радиоактивности
Все нуклиды делятся на два типа: стабильные и радиоактивные (радионуклиды). Стабильные нуклиды могут существовать без изменения состава ядер неограниченно долго. Поэтому большинство природных нуклидов, входящих в состав окружающих нас веществ, стабильны.
Устойчивому состоянию ядер атомов соответствуют определённые соотношения чисел протонов и нейтронов: для лёгких элементов (с атомными номерами от 1 до 20) — 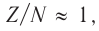 для тяжёлых — около 0,6. При нарушении протонно-нейтронного соотношения ядро (а вместе с ним и атом) становится радиоактивным.
для тяжёлых — около 0,6. При нарушении протонно-нейтронного соотношения ядро (а вместе с ним и атом) становится радиоактивным.
Радиоактивностью называется самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц.
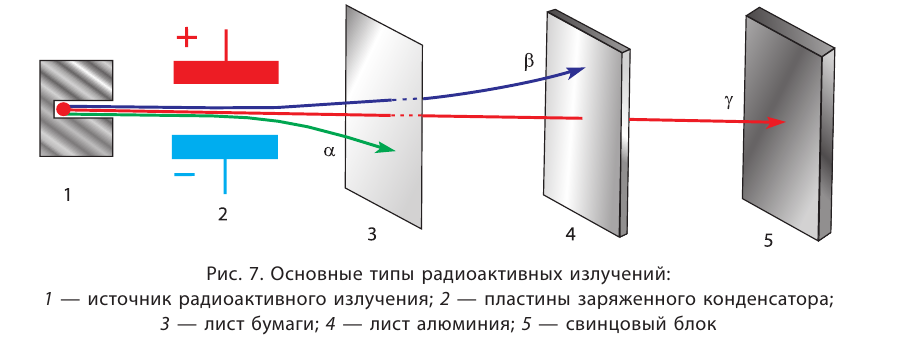
Основными типами радиоактивных превращений являются (рис. 7):
1) а-распад:
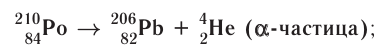
а-частицы представляют собой ядра атомов нуклида 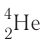 с положительным зарядом 2 + ;
с положительным зарядом 2 + ;
2) 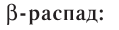 :
: 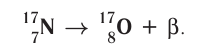
В данном случае 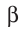 частица является фактически электроном, образующимся в ядре атома в результате превращения нейтрона в протон:
частица является фактически электроном, образующимся в ядре атома в результате превращения нейтрона в протон:
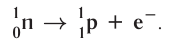
Радиоактивный распад часто сопровождается испусканием 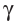 –лучей — потока квантов жёсткого электромагнитного излучения, не имеющих заряда (см. рис. 7).
–лучей — потока квантов жёсткого электромагнитного излучения, не имеющих заряда (см. рис. 7).
Устойчивость радионуклида характеризуется периодом полураспада 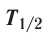 — временем, за которое число ядер уменьшается в результате распада вдвое. Для разных радионуклидов оно колеблется от долей секунды до миллиардов лет. Так, для
— временем, за которое число ядер уменьшается в результате распада вдвое. Для разных радионуклидов оно колеблется от долей секунды до миллиардов лет. Так, для 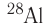 период полураспада равен 2,2 минуты, для
период полураспада равен 2,2 минуты, для 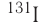 — 8 суток, для
— 8 суток, для 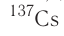 — 30,17 года, а для
— 30,17 года, а для 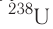 — почти 4,5 млрд лет.
— почти 4,5 млрд лет.
После открытия явления радиоактивности стало возможным искусственное превращение одних химических элементов в другие, синтез ядер элементов, которые не существуют на Земле. Так были получены элементы, находящиеся в периодической системе после урана U. Конечно, такие процессы, хотя и называются ядерными реакциями, не являются химическими реакциями, при которых атомы не исчезают и не возникают вновь.
Изучение радиоактивности привело к созданию ядерной энергетики и, к сожалению, ядерного оружия. Явление радиоактивности широко применяется в науке, медицине, промышленности и сельском хозяйстве. Вместе с тем перед человечеством возникли проблемы, связанные с вредным воздействием радиации на живые организмы. Поэтому использование ядерных процессов и радиоактивных веществ должно осуществляться в строго контролируемых условиях, с соблюдением строжайших мер безопасности.
Атом является электронейтральной микросистемой, состоящей из положительно заряженного ядра и отрицательно заряженных электронов.
Атомный номер химического элемента равен относительному заряду ядра его атома, числу протонов в ядре и числу электронов в атоме. Вид атомов с определёнными значениями атомного номера и массового числа называется нуклидом. Радиоактивность — самопроизвольное превращение неустойчивых атомных ядер в другие ядра, сопровождающееся испусканием различных частиц.
Состояние электрона в атоме
Химические свойства атомов проявляются только при химических реакциях. Так как состав ядер атомов при этом не меняется, то очевидно, что все изменения, происходящие с данным атомом в процессе химического превращения, являются результатом изменения его электронного состояния.
Большинство свойств атома определяется его электронным строением. Как оно влияет на конкретные свойства атома, на свойства веществ, в составе которых атом находится, можно понять, только правильно представляя состояние электрона в атоме.
Электронное облако
Основой современной теории строения атома являются законы и положения квантовой волновой механики — раздела физики, изучающего движение микрообъектов (электронов, протонов, нейтронов и других частиц).
Согласно квантово-механическим представлениям движущемуся электрону присуща двойственная природа. Он является частицей (имеет определённую массу, заряд), но его движение вблизи ядра имеет волновой характер (отсутствует определённая траектория движения, точное местоположение в пространстве и др.). Следовательно, микрообъекты, в том числе и электрон, обладают одновременно корпускулярными и волновыми свойствами.
Поскольку у движущегося электрона в атоме отсутствует траектория, то для описания такого движения используется вероятностный подход. Математически определяется не точное положение электрона в атоме, а вероятность его нахождения в той или иной области около ядерного пространства.
Состояние (в квантовой механике синоним слова движение) электрона в атоме описывается с помощью квантово-механической модели — электронного облака (рис. 8). Электрон движется возле ядра с огромной скоростью, при которой его отрицательный заряд как бы «размазывается» в пространстве. Получается, что ядро окружено трёхмерным электронным облаком. Плотность такого электронного облака оказывается различной в разных местах. В тех местах, где чаще находится электрон, образуется зона большей электронной плотности.

Поскольку существует вероятность нахождения электрона даже на относительно большом расстоянии от ядра, электронное облако не имеет определённых границ. Поэтому обычно его ограничивают условной поверхностью, которая охватывает примерно 90 % электронного облака. Такую область околоядерного пространства называют атомной электронной орбиталью или просто орбиталью.
Орбиталь — область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона.
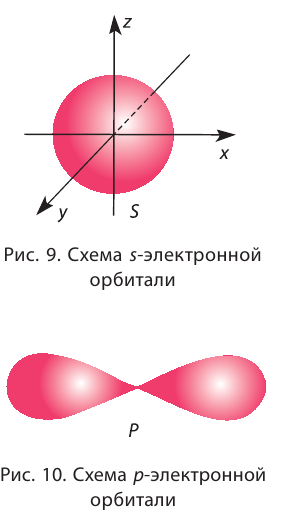
Орбитали, в зависимости от энергии электронов, имеют различные формы и размеры. Так, орбиталь единственного электрона атома водорода имеет сферическую (шарообразную) форму. Такие орбитали, имеющие шарообразную форму, обозначаются буквой s, а электроны, которые занимают эти орбитали, называются s-электронами (рис. 9).
Чем выше энергия электрона в атоме, тем слабее он притягивается к ядру, тем больше по размеру его орбиталь (электронное облако). Электронная плотность с увеличением размера орбитали уменьшается.
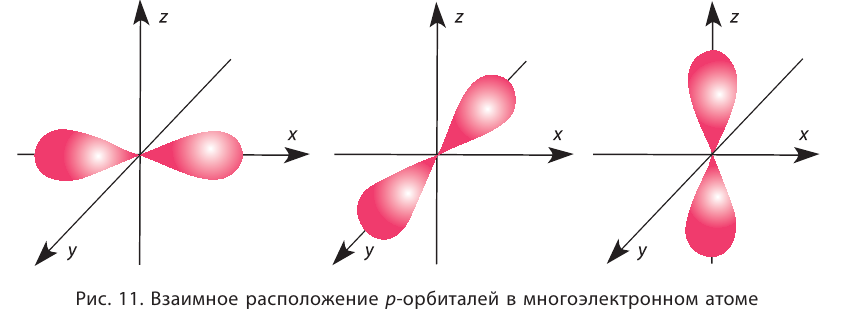
Орбитали в многоэлектронных атомах могут иметь и другие формы, например форму гантели («объёмной восьмёрки») (рис. 10). Такие орбитали обозначают буквой р, а электроны, которым они соответствуют, называют р-электронами.
Три р-орбитали располагаются (ориентируются) в околоядерном пространстве взаимно перпендикулярно вдоль каждой из трёх осей системы координат (рис. 11).
Более сложную форму имеют орбитали d-типа и f-типа.
Графически орбиталь изображают в виде клеточки (квантовой ячейки), а электрон — в виде стрелки. Так, орбиталь атома водорода с его единственным электроном можно изобразить следующим образом:
Кроме движения вокруг ядра, каждый электрон характеризуется собственным моментом движения, который называется спином. Упрощённо спин (от англ, spin — вращение) можно представить как вращение электрона вокруг собственной оси. Спиновое вращение электрона возможно только по часовой или против часовой стрелки. На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины. В этом случае два электрона называются спаренными:
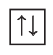
Такое их состояние в атоме энергетически выгодно, в отличие от состояния с одинаковыми спинами:
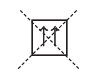
Если на орбитали находится один электрон, то он является неспаренным.
Энергетические уровни
Электроны в атоме различаются своей энергией. Чем выше энергия электрона в атоме, тем дальше он находится от ядра, следовательно, тем больше размер электронного облака (орбитали). И наоборот, электроны, обладающие относительно небольшой энергией, находятся большую часть времени вблизи ядра, заслоняя (экранируя) его от других электронов, которые притягиваются к ядру слабее и находятся на большем удалении от него. Так образуются как бы оболочки из электронов с близкими значениями энергии. Можно сказать, что электроны с близкими значениями энергии составляют в атоме единый электронный слой, или энергетический уровень.
Энергетический уровень (электронный слой, электронная оболочка) — это совокупность электронов с близкими значениями энергий.
Число энергетических уровней в атоме, на которых находятся электроны, равно номеру периода, в котором располагается химический элемент в периодической системе. Каждый энергетический уровень обозначается своим номером: n = 1, 2, 3, 4, … , 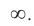 Чем больше номер уровня, тем выше энергия электронов, которые находятся на этом уровне, и тем слабее они притягиваются к ядру. При n = оо электрон обладает таким запасом энергии, который позволяет ему покинуть атом, при этом атом превращается в положительно заряженный ион.
Чем больше номер уровня, тем выше энергия электронов, которые находятся на этом уровне, и тем слабее они притягиваются к ядру. При n = оо электрон обладает таким запасом энергии, который позволяет ему покинуть атом, при этом атом превращается в положительно заряженный ион.
Число орбиталей 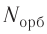 на данном энергетическом уровне равно:
на данном энергетическом уровне равно:
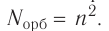 Так как на каждой орбитали не может быть больше двух электронов, то максимальное число электронов
Так как на каждой орбитали не может быть больше двух электронов, то максимальное число электронов 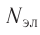 на энергетическом уровне равно удвоенному квадрату номера уровня:
на энергетическом уровне равно удвоенному квадрату номера уровня:
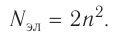
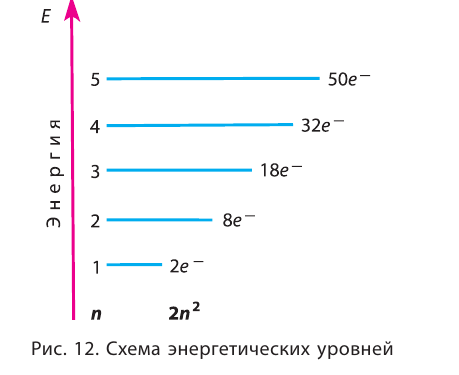
На рисунке 12 приведена схема энергетических уровней и их электронной ёмкости.
Энергетические подуровни
Электроны одного и того же энергетического уровня могут немного различаться значениями энергии. Они образуют в пределах данного уровня энергетические подуровни. Следовательно, энергетический уровень представляет собой совокупность энергетических подуровней, несколько различающихся по энергиям. Они обозначаются буквами s, р, d, f … . Число подуровней, из которых состоит данный энергетический уровень, равно его номеру.
Первый энергетический уровень (n = 1) состоит из одного подуровня (s), второй (n = 2) — из двух
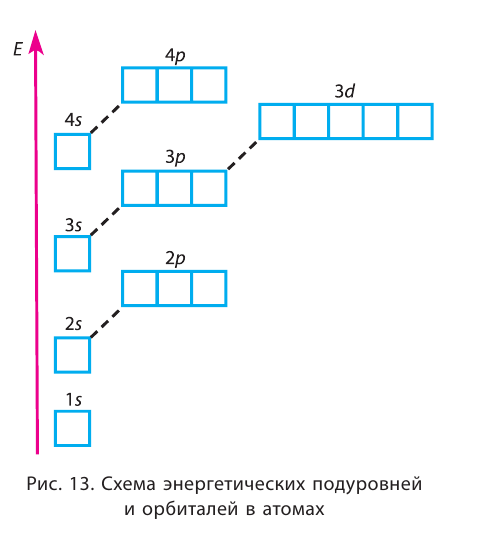
(s, р), третий (п = 3) — из трёх (s, р, d) и т. д. Каждый подуровень, в свою очередь, состоит из определённого числа атомных орбиталей. Так, s-подуровень состоит из одной орбитали, р-подуровень — из трёх, d-подуровень — из пяти орбиталей (рис. 13).
Из приведённой схемы видно, что s-подуровень каждого энергетического уровня обладает наименьшим запасом энергии:
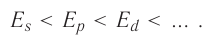
Для того чтобы различать энергетические подуровни и орбитали разных энергетических уровней, их обозначают двумя знаками: 1s, 2р, 3s, 3d. Цифра соответствует номеру энергетического уровня, а буква — типу энергетического подуровня.
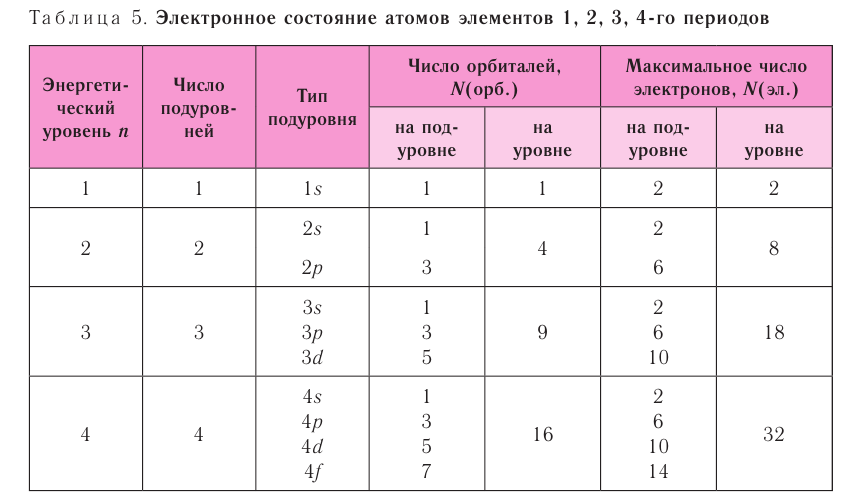
Обобщим сведения об электронном состоянии атомов элементов первых четырёх периодов в виде таблицы 5.
Движущемуся электрону в атоме присуща двойственная природа: он является частицей, имеющей волновой характер движения.
Электронное облако — это квантово-механическая модель движения электрона вокруг ядра.
Атомная орбиталь — область околоядерного пространства, в которой наиболее вероятно нахождение данного электрона.
На одной орбитали может находиться не более двух электронов, имеющих противоположные (антипараллельные) спины.
Совокупность электронов с близкими значениями энергий называется энергетическим уровнем (или, что то же самое, электронным слоем, электронной оболочкой).
Электронные конфигурации атомов
Общее число электронов в атоме определяется зарядом его ядра, т. е. протонным числом. Оно равно атомному номеру элемента. Электроны в зависимости от их энергии распределяются в атоме по энергетическим уровням и подуровням, каждый из которых состоит из определённого числа орбиталей.
Распределение электронов выражается с помощью электронных конфигураций атома. Например, у водорода, элемента с атомным номером 1, электронная конфигурация — 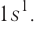 В этой формуле цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.
В этой формуле цифрой слева записывается номер энергетического уровня, затем следует буква, обозначающая подуровень, и, наконец, цифра вверху справа указывает число электронов на этом подуровне.
Схематически электронное строение атома изображается с помощью электронно-графической схемы, в которой орбитали представляются в виде клеточек, а электроны — в виде стрелок. Электронно-графическая схема атома водорода изображается так:
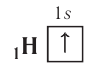
При составлении формул электронных конфигураций атомов необходимо соблюдать следующие правила. 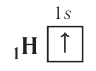 . Распределение электронов в атоме, находящемся в основном (наиболее устойчивом) состоянии, определяется принципом минимума энергии: основному состоянию атома соответствуют наиболее низкие из возможных энергетические уровни и подуровни.
. Распределение электронов в атоме, находящемся в основном (наиболее устойчивом) состоянии, определяется принципом минимума энергии: основному состоянию атома соответствуют наиболее низкие из возможных энергетические уровни и подуровни.
Поэтому орбитали в атомах элементов первых трёх периодов заполняются электронами в порядке увеличения их энергии:
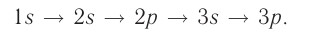
Правило:
На каждой орбитали максимально может находиться не более двух электронов, причём с противоположными спинами.
Таким образом, у следующего за водородом гелия  электронная конфигурация —
электронная конфигурация — 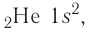 а электронно-графическая схема:
а электронно-графическая схема:
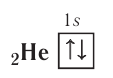
Поскольку на первом электронном слое могут находиться только два электрона, то этот слой в атоме гелия является завершённым и, следовательно, очень устойчивым.
У атомов элементов второго периода заполняется второй энергетический уровень, на котором может находиться не более 8 электронов. Сначала электроны заполняют 2s-орбиталь (у атомов лития и бериллия):
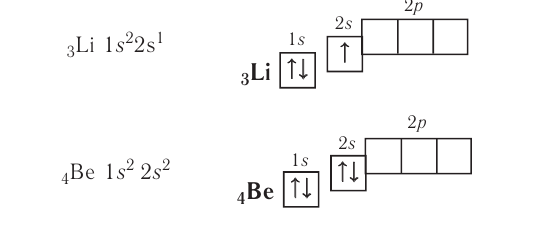
Поскольку 2.s-орбиталь заполнена, то пятый электрон у атома бора В занимает одну из трёх 2р-орбиталей. Электронная конфигурация атома бора —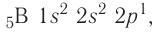 а электронно-графическая схема:
а электронно-графическая схема:
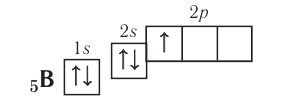
Обратите внимание, что подуровень 2р изображён вплотную к подуровню 2s, но несколько выше. Так подчёркивается его принадлежность к одному и тому же уровню (второму) и одновременно больший запас энергии.
Правило:
Оно устанавливает порядок заполнения орбиталей одного подуровня. Электроны сначала заполняют все пустые орбитали одного подуровня по одному, а если число электронов больше, чем число орбиталей, то по два.
Следовательно, электронные конфигурации атомов углерода и азота: 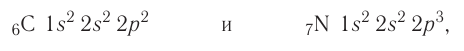
а их электронно-графические схемы:

Электронная конфигурация внешнего слоя 2.S2 2р6 соответствует его полному заполнению и поэтому является весьма устойчивой.
У атомов кислорода, фтора и неона число электронов увеличивается, и они вынуждены размещаться на р-орбиталях второго энергетического уровня по два:
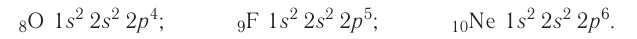
Электронно-графические схемы атомов этих элементов:
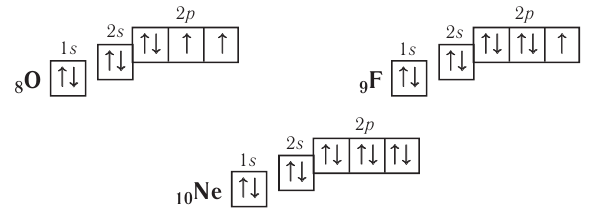
Электронная конфигурация внешнего слоя 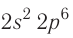 соответствует его полному заполнению и поэтому является весьма устойчивой.
соответствует его полному заполнению и поэтому является весьма устойчивой.
В атомах элементов третьего периода начинает формироваться третий электронный слой. Сначала заполняется электронами s-подуровень у натрия и магния:
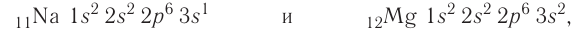
а затем /7-подуровень у алюминия, кремния, хлора и аргона:
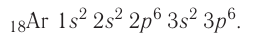
Электронно-графическая схема атома аргона:
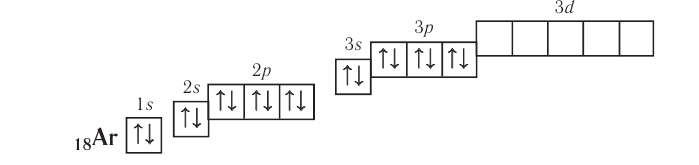
В атоме аргона на внешнем электронном слое находится 8 электронов. Следовательно, он завершён, так как в атоме любого элемента на внешнем энергетическом уровне максимально может находиться не более 8 электронов.
Застраивание третьего электронного слоя этим не исчерпывается. В соответствии с формулой 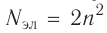 максимально на нём может находиться 18 электронов: 8 на s- и р-подуровнях и 10 — на d-подуровне. Этот подуровень будет формироваться у элементов четвёртого периода. Но сначала у первых двух элементов четвёртого периода — калия и кальция — появляется четвёртый электронный слой, который открывается s-подуровнем (энергия подуровня 4s несколько меньше, чем подуровня 3d, см. рис. 13):
максимально на нём может находиться 18 электронов: 8 на s- и р-подуровнях и 10 — на d-подуровне. Этот подуровень будет формироваться у элементов четвёртого периода. Но сначала у первых двух элементов четвёртого периода — калия и кальция — появляется четвёртый электронный слой, который открывается s-подуровнем (энергия подуровня 4s несколько меньше, чем подуровня 3d, см. рис. 13):
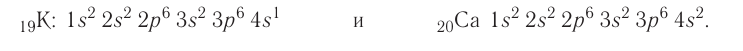
Только после этого начнёт заполняться электронами d-подуровень третьего, теперь уже предвнешнего, энергетического уровня.
Кроме электронных конфигураций и электронно-графических схем иногда используют и электронные схемы атомов, в которых указывают только число электронов на каждом энергетическом уровне (электронном слое):
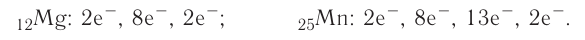
С такими схемами вы познакомились ещё в 8-м классе.
Электронное строение атома определяется зарядом его ядра, который равен атомному номеру элемента в периодической системе.
Распределение электронов по энергетическим уровням, подуровням и орбиталям отображают с помощью электронных конфигураций и электронно-графических схем, а также электронных схем атомов.
На внешнем электронном слое в атоме любого элемента может находиться не более 8 электронов.
Периодический закон и периодическая система химических элементов
Вот уже четвёртый год вы изучаете химию и всё это время пользуетесь таблицей химических элементов, которая представляет собой графическое изображение периодической системы элементов. Периодическая система, в свою очередь, является выражением периодического закона, открытого русским химиком
Д. И. Менделеевым в 1869 году. С тех пор периодический закон — основа современной химии. Физический смысл периодического закона стал понятен только после создания теории строения атома. Но сама эта теория развивалась и развивается на основе периодического закона и периодической системы.
Согласно этой теории главной характеристикой атома является положительный заряд ядра. Заряд ядра определяет число электронов в атоме, его электронное строение и, следовательно, все свойства атомов данного элемента и его положение в периодической системе. Поэтому современная формулировка периодического закона такова:
Свойства атомов химических элементов, а также состав и свойства образуемых ими веществ, находятся в периодической зависимости от зарядов атомных ядер.
Структура периодической системы
Со структурой периодической системы в общих чертах вы уже знакомы. Все химические элементы в ней располагаются в порядке возрастания атомного номера, который поэтому имеет ещё одно название — порядковый номер. Численная величина атомного номера равна положительному заряду ядра атома соответствующего элемента.
В таблице семь горизонтальных рядов элементов, которые называются периодами, а также восемнадцать вертикальных столбцов — групп. Таким образом, каждый химический элемент имеет свой атомный (порядковый) номер, находится в определённом периоде и определённой группе.
Известно около 700 форм графического изображения периодической системы. Но принципиальный подход к построению таблиц единый — элементы располагаются в порядке возрастания зарядов ядер их атомов. По мере увеличения атомного номера происходит постепенная застройка электронной структуры атомов элементов в соответствии с принципами заполнения. Таким образом, структура периодической системы связана с электронной структурой элементов.
В зависимости от того, какой энергетический подуровень заполняется электронами последним, различают четыре типа (семейства) элементов:
- s-элементы — последним заполняется s-подуровень внешнего энергетического уровня;
- р-элементы — последним заполняется p-подуровень внешнего энергетического уровня;
- d-элементы — последним заполняется d-подуровень предвнешнего энергетического уровня;
- f-элементы — последним заполняется f-подуровень третьего снаружи уровня.
Периоды
Периодом в периодической системе называется последовательный ряд элементов, в атомах которых электронная конфигурация внешнего энергетического уровня изменяется от 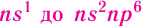 (для первого периода
(для первого периода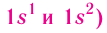 (табл. 6).
(табл. 6).
Таблица 6. Последовательность заполнения энергетических подуровней у элементов различных периодов
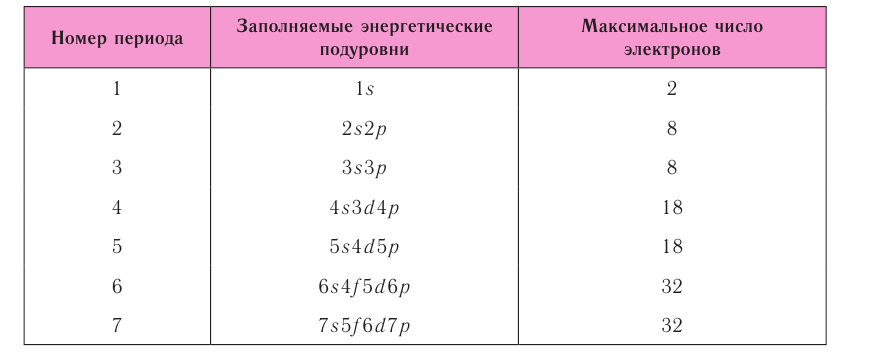
При этом номер периода совпадает с номером п внешнего энергетического уровня.
Другими словами, номер периода указывает на число энергетических уровней, на которых находятся электроны в атомах данного элемента. В этом заключается физический смысл номера периода.
Каждый из периодов (исключая первый) начинается типичным металлом (металл щелочной группы) и заканчивается благородным газом, которому предшествует неметалл, т. е. в периоде с увеличением заряда ядра атомов наблюдается постепенное изменение свойств от металлических к типично неметаллическим, что связывается с увеличением числа электронов на внешнем энергетическом уровне.
Первые три периода содержат только s- и p-элементы. Четвёртый, пятый и последующие периоды включают в свой состав также элементы, у атомов которых происходит заполнение d-подуровня предвнешнего энергетического уровня. У элементов шестого и седьмого периодов, помимо S-, р- и d-подуровней заполняются и f-подуровни третьего снаружи электронного слоя. f-Элементы
объединяются в семейства, называемые лантанидами (4f-элементы) и актинидами (5f-элементы), которые вынесены за пределы таблицы (см. форзац 1).
Группы
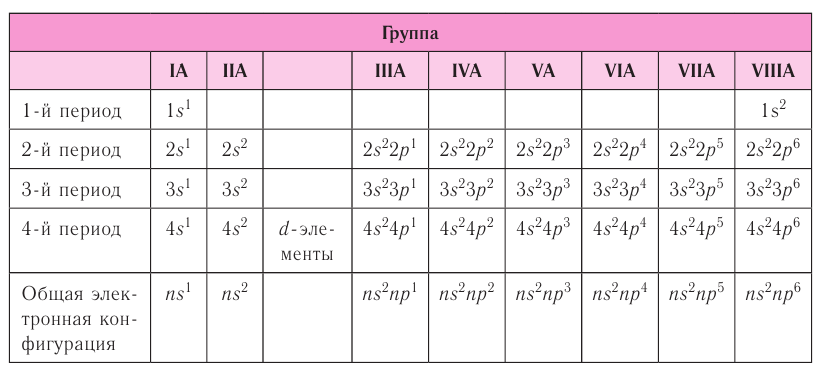
В вертикальных колонках, называемых группами, объединены элементы, атомы которых имеют сходное электронное строение. Всего в таблице 18 групп, пронумерованных арабскими цифрами. Кроме того, группы имеют традиционную нумерацию римскими цифрами от I до VIII с добавлением букв А или В. У атомов элементов групп А последними заполняются s- и р-подуровни внешних энергетических уровней (табл. 7). Элементы, у которых последними заполняются d-подуровни второго снаружи или f-подуровни третьего снаружи энергетического уровня, составляют группы В.
Таблица 7. Электронная конфигурация внешнего энергетического уровня у атомов элементов групп А (1—4-й периоды)
Атомы элементов групп А и В различаются своими химическими свойствами, однако им присуще и общее, что объединяет их в группы с одинаковыми римскими номерами (I, II и т. д.).
Номер группы (римскими цифрами), как правило, указывает число электронов в атоме, которые могут участвовать в образовании химических связей. В этом состоит физический смысл номера группы.
Электроны, которые принимают участие в образовании химических связей, называются валентными. У элементов групп А валентными являются электроны внешнего энергетического уровня, а у элементов групп В — ещё и электроны предпоследних уровней. Это основное различие между элементами групп А и В.
Сейчас мы можем дать более точное определение понятия группа.
Группа — вертикальный столбец элементов с одинаковым числом валентных электронов в атомах.
Таким образом, строгая периодичность расположения химических элементов в периодической системе полностью объясняется последовательным характером заполнения энергетических уровней и подуровней их атомов.
Главной характеристикой атома является положительный заряд ядра, который численно равен атомному номеру элемента. Каждый химический элемент имеет свой атомный (порядковый) номер, находится в определённом периоде и определённой группе. Горизонтальный ряд элементов, расположенных в порядке возрастания их атомных номеров, начинающийся щелочным металлом и заканчивающийся благородным газом, называется периодом. Вертикальный столбец элементов, атомы которых имеют одинаковое строение внешних электронных слоев, называется группой.
Периодичность изменения свойств атомов химических элементов и их соединений
Поскольку электронная конфигурация атомов химических элементов изменяется периодически с ростом заряда их ядер, все их свойства, определяемые электронным строением, закономерно изменяются по периодам и группам периодической системы. К таким свойствам относятся прежде всего различные характеристики атомов: атомные и ионные радиусы, электроотрицательность, степень окисления и др. Периодически изменяются также многие химические и физические свойства простых и сложных веществ, образованных элементами-аналогами.
Атомные и ионные радиусы
С точки зрения квантовой механики атом не имеет строго определённых границ, так как орбитали, на которых расположены его электроны, также не имеют точных размеров. О размерах атомов и ионов судят по экспериментальным данным о расстояниях между соседними атомами в молекулах или кристаллах. Условно форму атома или иона считают шарообразной, поэтому количественной характеристикой их размера служит радиус.
Различают атомные радиусы и ионные радиусы. При этом радиусы положительных ионов (катионов) всегда меньше радиусов атомов соответствующих элементов, так как они образованы в результате отдачи электронов. Радиусы отрицательных ионов (анионов) больше радиусов атомов, поскольку они образовались путём присоединения дополнительных электронов. Например, радиус атома натрия Na — 189 пм, а иона натрия 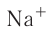 — 99 пм, радиус атома хлора С1 — 99 пм, а его иона
— 99 пм, радиус атома хлора С1 — 99 пм, а его иона 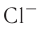 — 181 пм (1 пм (пикометр) =
— 181 пм (1 пм (пикометр) = 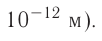
Как изменяются радиусы атомов в группе и в периоде с ростом атомного номера элементов? У элементов, находящихся в одной группе, при переходе сверху вниз от одного элемента к другому увеличивается число электронных слоёв и, следовательно, увеличивается радиус как атомов, так и ионов. Например, в группе щелочных металлов радиусы атомов: Li — 155 пм, Na — 189 пм, К — 236 пм, а ионов: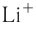 — 68 пм,
— 68 пм, 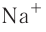 — 99 пм,
— 99 пм, 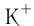 — 138 пм.
— 138 пм.
В периодах периодической системы по мере увеличения заряда ядра атомов увеличивается притяжение к нему электронов, находящихся на одном и том же электронном слое, что приводит к уменьшению радиуса атомов. Например, у элементов третьего периода атомные радиусы уменьшаются от натрия до хлора — от 189 пм до 99 пм.
Электроотрицательность
Проявление металлических или неметаллических свойств у атомов данного элемента связано прежде всего с их способностью терять или приобретать электроны. Отдача или присоединение электронов атомами обычно происходит в процессе их химического взаимодействия. Характеристикой атома, учитывающей его способность смещать к себе валентные электроны, является электроотрицательность. Она обозначается буквой греческого алфавита X (хи).
Электроотрицательность атома — условная величина, характеризующая его способность в химических соединениях смещать к себе электроны от других атомов.
Для практической оценки этой способности атомов введена условная относительная шкала электроотрицательностей. По этой шкале наиболее электроотрицательным среди элементов, способных образовывать химические соединения, является фтор F (X = 4,1), а наименее электроотрицательным — франций Fr (X = 0,86).
У элементов групп А в периодах с ростом атомного номера элементов электроотрицательность возрастает, а в группах, как правило, убывает.
По величине электроотрицательности можно определить принадлежность элемента к металлам или неметаллам. Все неметаллы обычно имеют значение электроотрицательности больше двух.
Они располагаются в правой верхней части периодической таблицы.
У металлов значение электроотрицательности меньше двух. Несколько элементов (В, Si, Ge, As,Те) со значением электроотрицательности, близким к 2, располагаются вдоль диагонали от бора В к астату At. Атомы этих элементов проявляют промежуточные свойства, поэтому их часто называют полуметаллами (рис. 14).
Периодичность изменения свойств соединений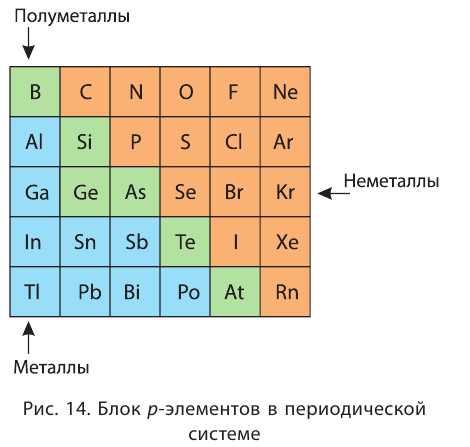
Периодический характер изменения строения, физических и химических свойств присущ также простым и сложным веществам. Рассмотрим в качестве примера закономерности изменения некоторых свойств атомов и соединений элементов 3-го периода (табл. 8).
Таблица 8. Изменение свойств атомов элементов 3-го периода и их соединений
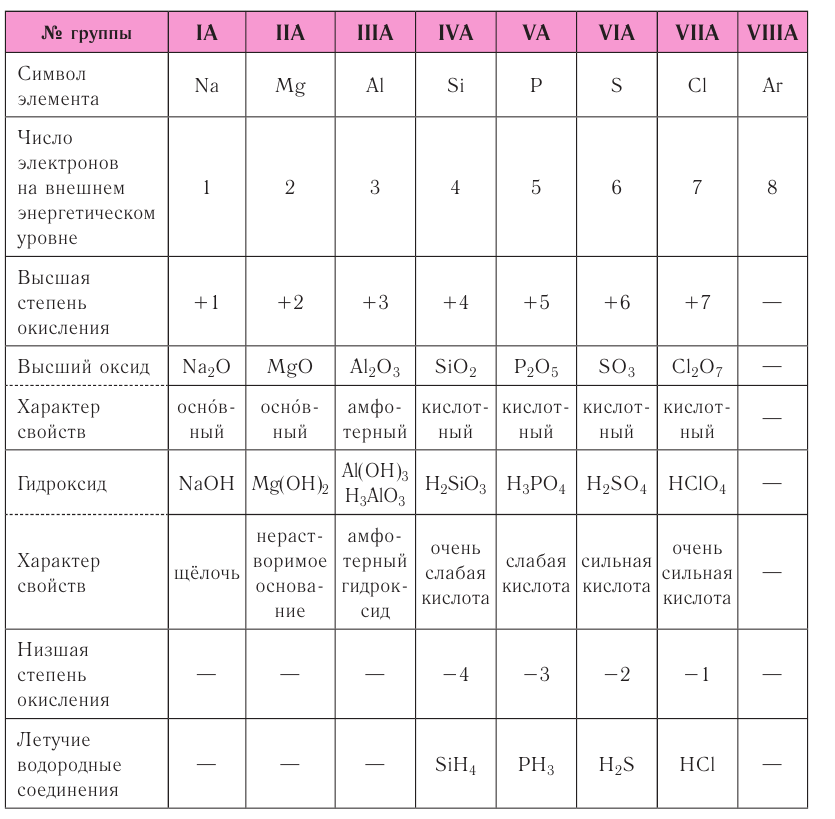
Как следует из таблицы, в периоде при переходе слева направо от одного элемента к другому происходит увеличение высшей степени окисления и понижение (по абсолютной величине) низшей степени окисления. Периоды начинаются щелочными металлами, которые образуют растворимые в воде основные оксиды и гидроксиды. При переходе от одного элемента к другому наблюдается ослабление основных и усиление кислотных свойств высших оксидов и гидроксидов.
Элементы, расположенные в одной группе, имеют одинаковое строение внешних электронных оболочек атомов и поэтому их атомы проявляют сходные химические свойства.
Такой характер изменения свойств в основном повторяется во всех периодах (кроме первого), следовательно, такое изменение свойств называется периодическим.
Таким образом, при последовательном увеличении зарядов атомных ядер периодически повторяется конфигурация внешних электронных оболочек и, как следствие, периодически повторяются химические свойства атомов элементов и их соединений. В этом заключается физический смысл периодического закона.
Атомные и ионные радиусы атомов элементов с ростом атомного номера уменьшаются в периодах слева направо и увеличиваются в группах сверху вниз. С увеличением атомного номера в пределах каждого периода электроотрицательность возрастает, а в группе — уменьшается, т. е. металлические свойства атомов элементов в периоде ослабевают, а в группе — усиливаются. Периодическое изменение свойств атомов химических элементов при увеличении положительного заряда ядер объясняется тем, что периодически повторяется строение внешних электронных слоёв атомов.
Характеристика химического элемента по его положению в периодической системе и строению атома
Периодический закон и отражающая его периодическая система элементов представляют собой как бы краткое обобщение химии элементов и их соединений. Таблица периодической системы содержит сведения, позволяющие описать строение атомов химических элементов, предсказать состав, строение и свойства образованных ими простых веществ и наиболее характерных соединений: оксидов, соответствующих им гидроксидов, солей, летучих водородных соединений и т. д. Именно поэтому таблица периодической системы является непременной составляющей любого учебного и справочного пособия по химии.
В описании любого элемента особую роль играет его атомный номер Z, с которым связано положение элемента в периодической системе. Атомный номер даёт возможность знать не только порядковый номер элемента в периодической системе, но и его место в периоде и группе, а также электронное строение его атомов.
Описание любого химического элемента необходимо проводить по определённому алгоритму, т. е. соблюдая строгую последовательность действий. В этой последовательности главными этапами являются следующие:
- а) общие сведения об элементе;
- б) определение положения элемента в периодической системе;
- в) характеристика состава атомов элемента;
- г) описание электронного строения атомов;
- д) состав и свойства простого вещества;
- е) состав и свойства кислородных и водородных соединений.
Составим более детальный алгоритм такого описания химического элемента.
1. Общие сведения об элементе:
- а) название химического элемента;
- б) его химический знак;
- в) относительная атомная масса.
2. Положение химического элемента в периодической системе:
- а) атомный номер;
- б) номер периода;
- в) номер группы и её тип: А или В.
3. Состав атома:
- а) заряд ядра атома;
- б) число протонов, электронов и нейтронов (для определённого нуклида).
4. Электронное строение атомов элемента:
- а) электронная схема атома;
- б) электронная конфигурация атома;
- в) электронно-графическая схема атома;
- г) электронная конфигурация внешнего энергетического уровня;
- д) электронный тип элемента (s-, р-d.-f-)
5. Состав и свойства простого вещества:
- а) металл — неметалл;
- б) формула простого вещества;
- в) агрегатное состояние при обычных условиях.
6. Степени окисления элемента в высших оксидах и летучих водородных соединениях. Электроотрицательность.
7. Формулы оксидов и соответствующих им гидроксидов. Характеристика кислотно-основных свойств этих соединений.
8. Формула летучего водородного соединения.
Охарактеризуем, согласно приведённому алгоритму, два химических элемента — натрий и фосфор.
Натрий
1. Название химического элемента — натрий, химический знак — Na, относительная атомная масса — 23.
2. Натрий — элемент с атомным номером 11, находится в 3-м периоде, в группе IA.
3. Заряд ядра атома натрия 11+, следовательно, в ядре находится 11 протонов, общее число электронов также 11. В ядре нуклида натрия 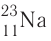 содержатся ещё 12 нейтронов.
содержатся ещё 12 нейтронов.
Кратко состав этого атома выражается так:
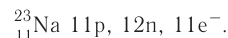
4. Электронная схема атома натрия:
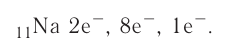
Электронная конфигурация:
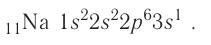
Электронно-графическая схема: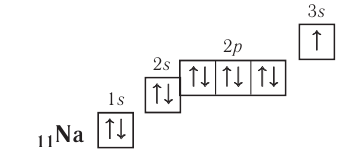
Электронная конфигурация внешнего энергетического уровня: 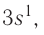 следовательно, это s-элемент.
следовательно, это s-элемент.
5. Так как на внешнем энергетическом уровне у натрия находится 1 электрон, то этот элемент относится к группе металлов. Простое вещество при обычных условиях — твёрдый металл. Формула простого вещества — Na.
6. Степень окисления в высшем оксиде +1. Летучих водородных соединений не образует. Электроотрицательность натрия 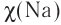 = 1,01.
= 1,01.
7. Формула высшего оксида — 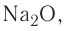 он имеет основный характер. Гидроксид, соответствующий ему, представляет собой основание NaOH, растворимое в воде, т. е. щёлочь.
он имеет основный характер. Гидроксид, соответствующий ему, представляет собой основание NaOH, растворимое в воде, т. е. щёлочь.
8. Летучего водородного соединения не образует.
Следующий элемент — фосфор — проанализируем по тому же алгоритму, но более сжато.
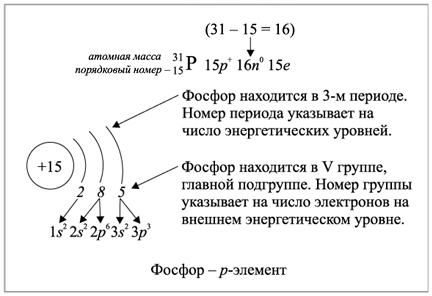
Фосфор
1. Фосфор 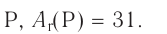
2. Z = 15. Положение в периодической системе: 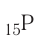 — 3-й период, группа VA.
— 3-й период, группа VA.
3. Состав атома (нуклида 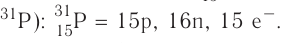
4. Электронная схема: 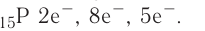
Электронная конфигурация: 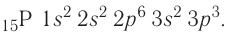 Электронно-графическая схема:
Электронно-графическая схема:
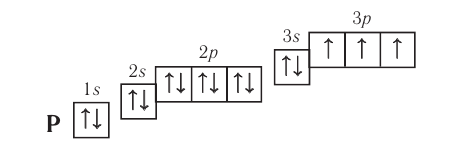
Электронная конфигурация внешнего энергетического уровня:  р-элемент.
р-элемент.
5. Фосфор — неметалл. При обычных условиях — твёрдое вещество; молекулярная формула —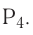
6. Степени окисления:
а) в высших оксидах — +5;
б) в летучих водородных соединениях — —3.
Электроотрицательность: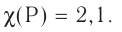
7. Формула высшего оксида — 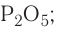 кислотный. Формула высшего гидроксида —
кислотный. Формула высшего гидроксида — 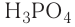 (фосфорная кислота).
(фосфорная кислота).
8. Летучее водородное соединение —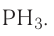
Периодический закон Д. И. Менделеева — один из наиболее общих и фундаментальных законов природы. Он является основой развития не только химии, но и всего естествознания в целом, позволяет раскрывать новые закономерности природы и проникать в их суть.
Периодическая система химических элементов представляет собой естественно-научную классификацию элементов по электронному строению их атомов, на основе которой строится изучение химии и решение её практических задач.
- Кислород как химический элемент
- Водород как химический элемент
- Вода в химии и её элементный состав, молекулярное строение, формула и молярная масса
- Железо как химический элемент
- Основные законы и понятия химии
- Место химии в системе наук
- Перспективы химического производства
- Типы химических реакций в химии
