Построение структурно-электронной формулы элементов B-подгрупп
Материал по химии
Элементы побочной подгруппы еще называют d-элементами или переходными металлами. Они отличаются тем, что их валентные электроны расположены не только на s-подуровне внешнего энергетического слоя, но и на d-подуровне предвнешнего слоя. Валентными электронами называют те, что способны участвовать в образовании химической связи.
Что бы построить модель атома такого элемента, нам необходимо знать одно важное отличие этих элементов от элементов А-подгрупп: если у элементов главных (А) подгрупп количество электронов на внешнем уровне определяется по номеру группы (например, у лития один электрон на внешнем слое, у бериллия – два, у бора – три и так далее), то у элементов побочных подгрупп это количество не зависит от номера группы.
Для определения количества электронов на внешнем уровне, легче всего просто запомнить несколько распространённых примеров (они выделены красным):
|
Количество электронов на внешнем уровне |
Примеры элементов |
|---|---|
|
1 |
Cu, Ag, Au, Nb, Cr, Mo, Ru, Rh, Pt, Ds |
|
2 |
Все остальные элементы B-подгрупп, кроме палладия. |
Остальные правила работают как с элементами А-подгрупп, так и с элементами Б-подгрупп. Например, заряд ядра определяется по порядковому номеру элемента, количество энергетических уровней по расположению в определенном периоде.
Рассмотрим конфигурацию нескольких элементов побочных подгрупп:
Построение структурно-электронной формулы элементов B-подгрупп
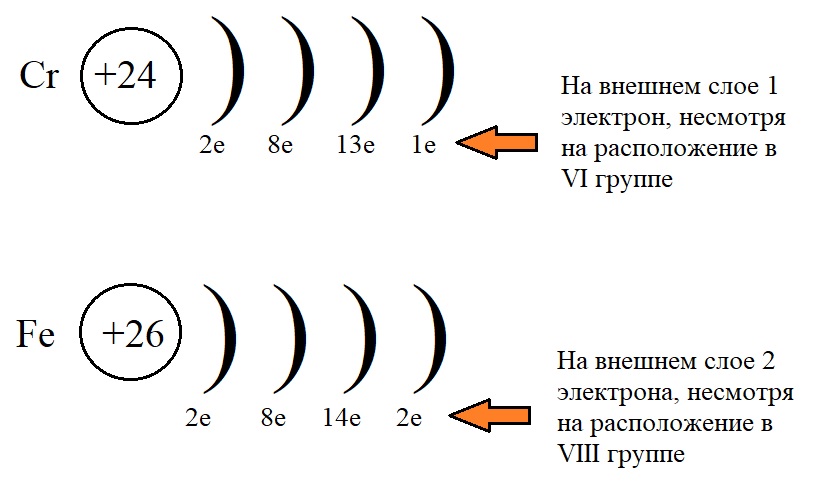
Конфигурация хрома и железа
На рисунке показано, что несмотря на положение элементов в определенных подгруппах, количество электронов у них не равно этой группе.
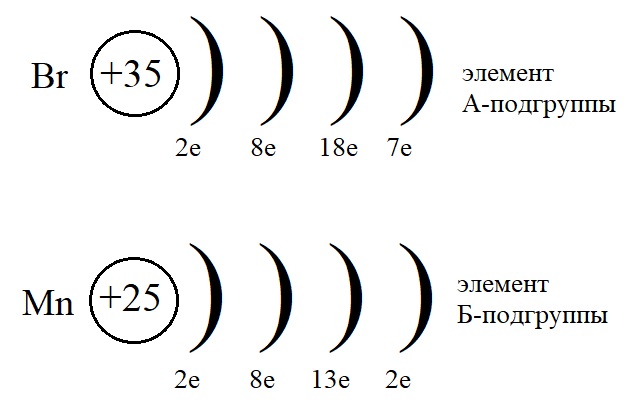
Для сравнения изучим еще один рисунок, на котором мы можем сравнить элементы А- и Б-подгрупп одной и той же группы:
На этом рисунке мы снова можем убедиться, что элементы, находящиеся в одной и той же группе. В одном и том же периоде, но в разных подгруппах имеют разное строение.
Что бы разобраться, почему эти элементы называются d-элементами, разберем структурно-электронные формулы некоторых из них, например, хрома, железа и марганца, строение которых описывалось выше. Как уже было сказано, у этих элементов валентными являются не только внешний. Но и предвнешний уровень.
|
Cr |
3s2 3p6 3d5 4s1 |
↓↑ |
|
|
↑ |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
3s |
3p |
3d |
4s |
|
Fe |
3s2 3p6 3d6 4s2 |
↓↑ |
|
|
↑↓ |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
3s |
3p |
3d |
4s |
|
Mn |
3s2 3p6 3d5 4s2 |
↓↑ |
|
|
↑↓ |
||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
3s |
3p |
3d |
4s |
d-орбиталь содержит неспаренные электроны, которые могут вступать в химическую связь. Поэтому высшая валентность хрома равна не двум (по количеству электронов на внешнем уровне), а шести – по общему количеству электронов внешнего энергетического уровня и d-электронов предвнешнего уровня.
Вы можете встретить немного измененный порядок заполнения орбиталей, например, у марганца: 3s2 3p6 4s2 3d5. s- и d-подуровень поменялись местами, в таких формулах учтен уровень энергии орбиталей: чем меньшей энергией обладает орбиталь, тем быстрее она будет заполняться электронами.
Правильнее будет заполнять электроны в следующем порядке:
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p…
Тренировочные задания ЕГЭ
Задание 1.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
|
|
|
|
|
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных элементов имеют электронную конфигурацию внешнего энергетического уровня ns2(n-1) d10
Решение задания:
Для начала разберемся со страшной формулой ns2(n-1) d10. Попробуем заменить переменную n на любое число, например, на 4, тогда мы получим 4s2(4-1)d10 или 4s23d10. Эта формула отображает порядок распределения электронов согласно их энергии. Если для нас такой порядок непривычен, то мы можем поменять его местами, тогда получим 3d104s2. Получившаяся формула приблизительна, вместо нее может быть 4d105s2 или 5d106s2 , но по этой формуле мы понимаем, что должны искать элемент с двумя электронами на внешнем энергетическом уровне (это приводит к тому, что медь выбывает из списка претендентов на правильный ответ), и элемент должен иметь d-орбиталь на внешнем уровне (кальций и стронций выпадают)
Верный ответ: 23
Задание 2.
Для выполнения заданий 1 – 3 используйте следующий ряд химических элементов:
|
|
|
|
|
Ответом в заданиях 1 – 3 является последовательность цифр, под которыми указаны химические элементы в данном ряду.
Определите, атомы каких из указанных в ряду элементов не имеют на внешнем энергетическом уровне неспаренных электронов.
Решение: построим электронные конфигурации данных атомов.
|
Сурьма – Sb, элемент главной подгруппы пятой группы (А), у таких элементов валентные электроны находятся только на внешнем слое: 5s25p3, что соответствует структурно-электронной формуле: Элемент имеет три неспаренных p-электрона. |
Последовательность расположения электронов на энергетических уровнях выражается следующим рядом чисел:
|
||||||||||||||||
|
Магний – Mg, элемент главной подгруппы второй группы (А). поэтому его внешний энергетический слой будет имеет следующую формулу: 3s2 Не имеет неспаренных электронов. |
|
||||||||||||||||
|
Железо – Fe, элемент побочной подгруппы (Б), у таких элементов валентными являются как электроны внешнего уровня, так и d-электроны предвнешнего уровня. 3d64s2
Есть четыре неспаренных электрона на d-подуровне. |
|
||||||||||||||||
|
Титан -Ti, 3d24s2
Есть два неспаренных электрона на d-подуровне. |
|
||||||||||||||||
|
Цинк – Zn, 3d104s2
Нет неспаренных электронов. |
|
Верный ответ: 45
|
Посмотрим на гениальную таблицу “Периодическая система элементов” от русского ученого Дмитрия Менделеева. Таблица Дмитрия Менделеева весьма стройная и системная. Она отвечает на многие вопросы, в том числе и на заданный вами. Максимальное число электронов на энергетическом уровне: где n – номер энергетического уровня система выбрала этот ответ лучшим Вита75 8 лет назад Таблица Менделеева состоит из 8-ми столбцов, соответственно элементы в 1-ом столбце будут иметь по 1 электрону на внешнем слое , а в 8-ом по 8. Собственно количество электронов и определяет свойства элемента, (например щелчные металлы очень активны, а энертвые газы наоборот фактически не вступают ни в какие реакции). это связано с тем, что чем меньше электронов на внешнем слое тем их легче потерять, и труднее захватить свободный электрон при потере. Так же есть такие элементы как изотопы, которые при одинаковом количестве электронов на внешней оболочке имеют кординально разные свойства. (например дейтерий и тритий) оба имеют по 1-му электрону, но ядро дейтерия состоит из положительно заряженного протона и нейтрального нейтрона, он стабилен и относится скорее к водороду (тяжелый водород), а тритий, состоящий из протона и 2-ух нейтронов, радиактивен и по свойствам ближе к литию. В порироде не встречается из-за короткой живучести (период полураспада примерно 12 лет). Так к слову, есть такой изотоп кальция 48, имеется в виду что у него не 40 нейтронов в ядре как у обычного кальция у нас в костях, а 48, радиактивен, (в природе встречается крайне редко), нарабатывается в атомных реакторах, обстрелом нейтронами, несколько грамм за год. Служит для получения сверхтяжелых элементов (путем обстрела мишени из урана, плутония и т.д.). на данный момент самый дорогой элемент, 1 грамм стоит около 400000 евро. Чосик более года назад Для этого потребуется таблица Менделеева. В ней восемь групп, которые представлены как восемь столбиков. И как раз номер группы указывает, сколько электронов у элемента на последнем внешнем уровне. Например, берем водород – Н. Он относится к первой группе, идет первым. А мы знаем, что порядковый номер элемента совпадает с числом электронов на обиталях и с числом протонов в ядре. И у водорода на s-орбитали один электрон. Теперь берем литий – Li. Он также относится к первой группе, идет третьим. Его s-орбиталь заполнена, там два электрона. А последний, третий, находится на второй s-орбитали. Номер же периода указывается на число энергетических уровней. Литий относится ко второму периоду, потому у него два энергетических уровня. KritikSPb 4 года назад Чтобы определить, сколько электронов на внешнем энергетическом уровне, нужно открыть Периодическую таблицу Менделеева. В ней расположено 8 групп элементов. Номера группы и соответствуют количеству электронов на внешнем уровне. Например, элементы Гелий, аргон, железо, криптон, рутений, ксенон, осмий и радон принадлежат к восьмой группе, значит и электронов на внешнем уровне 8. У лития, натрия и калия – по одному электрону, у берилия, магния и кальция – 2, у алюминия – 3, у кремния и титана – по 4, у серы и хрома – по 6, у хлора и марганца – 7. Далее определяем электронные уровни элементов по аналогии. владсандрович более года назад Для решения данной задачи, нам просто необходимо, будет взглянуть в таблицу Менделеева. Она насчитывает в себе восемь групп. Они расположены в порядке восьми столбиков. Каждая группа имеет свой номер и этот самый номер как раз таки и говорит нам о том , сколько электронов имеет в себе тот или иной элемент, касательно его последнего внешнего уровня. Например железо относится к восьмой группе, а значит электронов на внешнем уровне оно имеет именно 8. Знаете ответ? |
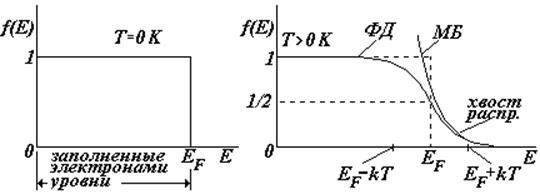
EF – параметр распределения, называемый энергией или уровнем Ферми (см. дальше).
На рисунках показаны графики функции ФД, их часто называют распределением электронов по энергиям. При температуре Т = 0 К вероятность того, что электрон имеет какое-либо значение энергии в пределах 0 ¸ EF равна единице; вероятность обнаружить электрон с энергией > EF равна нулю.
При температуре
Т > 0 К электроны за счет энергии теплового движения «покидают» свои уровни и переходят на более высокие.
Для металлов уровень Ферми (энергия Ферми) определяется следующим образом. (для полупроводников – см. дальше)
1)При Т = 0 К — это уровень энергии, отделяющий заполненные электронами
уровни от незаполненных или это максимальная энергия
электронов при Т = 0 К
2) При Т > 0 К — это энергетический уровень, который занимает электрон с
вероятностью, равной 1/2.
При высоких температурах или малых концентрациях электронов распределение ФД переходит в классическое распределение МБ. Действительно, при Е-ЕF >> кТ можно пренебречь единицей в знаменателе распределения ФД, тогда получим:
Иначе говоря, на хвосте распределения (см. рис.) можно использовать классическую формулу.
|
|
Энергия Ферми при Т = 0 К, не зависит от числа электронов в образце и его объема, а определяется только концентрацией электронов n=N / V .Для одновалентных атомов характерны величины EoF @ 100 кТ @ 2,5 эВ |
|
|
Для металлов энергия Ферми очень слабо зависит от температуры (kT / EoF @ 0,01 при комнатных температурах) |
|
|
средняя энергия электронов в зоне проводимости (см. дальше ) связана с энергией Ферми указанным образом |
Зная энергию Ферми EoF можно оценить скорость vF фермиевских электронов и их температуру ТF. Следует иметь в виду, что это не температура вещества, а температура воображаемого облака электронов, средняя скорость движения которых равна vF .
|
Þ vF |
Þ ТF. |
|
элемент |
EoF (эВ) |
ТF., К |
vF, 106 м/с |
|
калий |
2,1 |
25000 |
0,85 |
|
медь |
7,0 |
82000 |
1,6 |
|
золото |
5,5 |
64000 |
1,4 |
ЭЛЕМЕНТЫ ЗОННОЙ ТЕОРИИ ТВЕРДЫХ ТЕЛ.
Зонная теория – это один из разделов квантовой механики твердых тел – теория валентных электронов в периодическом поле кристаллической решетки.
Аналитически решить уравнение Шрёдингера для электрона, движущегося внутри металла, т. е. в поле, создаваемом множеством заряженных ионов решетки, невозможно. Для решения применяют различные приближенные методы.
Образование энергетических зон в кристаллах.

На рисунке показано символически, как можно представить себе образование зон. Здесь r – расстояние между атомами. При сближении атомов до некоторого расстояния r0 образуется кристалл, и, соответственно, энергетические зоны. В некоторых случаях зоны могут перекрываться, образуя более широкую зону. Чем дальше электрон от ядра, тем шире зона. Верхние зоны имеют ширину 1 эВ и более, нижние – несколько сотых эВ.

Уровни в зоне распределяются неравномерно, в середине зоны они располагаются гуще. Для характеристики распределения уровней пользуются понятием плотности уровней. Если на интервал энергий dE приходится dZ уровней, то
|
|
плотность энергетических уровней в зоне — по смыслу – это число уровней, приходящихся на единичный интервал энергий. |
|
|
Приближенная формула для зависимости плотности уровней от энергии; С = const для данного объема V тела, m— масса электрона |
Проводники, полупроводники и диэлектрики.
Теоретически количество разрешенных зон бесконечно, а число электронов в данном теле хотя и очень велико, но имеет конечное значение. Поэтому не все зоны заполняются электронами. При температуре Т = 0 К заполнены полностью все зоны с наименьшей энергией, все остальные – пустые. Разрешенные зоны принято изображать прямоугольниками. Т. к. уровней в зоне огромное количество, целесообразно заполненную зону полностью или частично заштриховывать, а незаполненную — оставить пустой. Заполненная зона, граничащая с незаполненной, называется валентной, зона выше валентной называется зоной проводимости
Электрические свойства различных веществ — проводников (металлов), собственных полупроводников, диэлектриков и примесных полупроводников — с позиций зонной теории можно объяснить различной заполненностью зон электронами и шириной запрещенной зоны DЕ. И у металлов и у диэлектриков имеется множество свободных электронов, но у них разные энергетические возможности. Основное, что следует понять, что электрон только тогда «принимает», сообщаемую ему энергию, когда он при этом имеет возможность перейти на более высокий свободный энергетический уровень.
Модель свободных
электронов в металлах предполагает,
что при образовании кристаллической
решетки от атомов отщепляются некоторые
слабее всего связанные с ними (валентные)
электроны. Отщепленные электроны
становятся общими для всех атомов и
могут свободно перемещаться в кристалле.
Именно эти электроны, в отличие от
электронов, заполняющих внутренние
электронные оболочки атомов, обеспечивают
электропроводность металлов. Поэтому
их называют электронами проводимости.
При 0 К энергия
всех электронов меньше энергии Ферми.
Ни один из электронов покинуть кристалл
не может и никакой термоэлектронной
эмиссии не наблюдается. С увеличением
температуры возрастает число термически
возбужденных электронов , способных
выйти из металла, что обусловливает
явление термоэлектронной эмиссии.
Уровень Ферми –
уровень энергии, ниже которого все
состояния при T = 0K заняты электронами.
30. Функция Ферми – Дирака. Энергия Ферми. Понятие вырожденного и невырожденного электронного газа. Условие вырождения.
Функция Ферми-Дирака
описывает равновесное состояние
электронов. Если при какой-то температуре
электронов нет, то будет происходить
термогенерация электронов и дырок, и
постепенно они распределятся по функции
Ферми-Дирака.

Ферми (EF) системы невзаимодействующих
фермионов — это увеличение энергии
основного состояния системы при
добавлении одной частицы. Это эквивалентно
химическому потенциалу системы в ее
основном состоянии при абсолютном нуле
температур.
Вырожденный газ
— газ, на свойства которого существенно
влияют квантовомеханические эффекты,
возникающие вследствие тождественности
его частиц.В
собственных полупроводниках электронный
или дырочный газ в, соответственно, зоне
проводимости или валентной зоне,
невырожденный.
Условия вырождения
выполняются при достаточно низкой
температуре T
(для идеального газа v≈√T
) и высокой концентрации частиц.
31. Плотность электронных состояний. Заполнение электронами энергетических зон. Энергия и уровень Ферми.
Плотность состояний
— величина определяющая количество
энергетических уровней в интервале
энергий на единицу площади.Термин
может применяться к фотонам, электронам,
квазичастицам в твёрдом теле и т. п.
В каждой
энергетической зоне могут располагаться
в соответствии принципом Паули не более
2(2l + 1) электронов – по два с противоположными
спинами на каждом уровне. Число электронов
в кристалле конечно и зависит как от
числа атомов N, так и от количества
электронов в атоме. Электроны стремятся
занять энергетические уровни с наинизшей
энергией.
В физике, энергия
Ферми (EF) системы невзаимодействующих
фермионов — это увеличение энергии
основного состояния системы при
добавлении одной частицы. Это эквивалентно
химическому потенциалу системы в ее
основном состоянии при абсолютном нуле
температур.
Уровень Ферми –
уровень энергии, ниже которого все
состояния при T = 0K заняты электронами.
Медь, серебро и золото составляют IB группу периодической системы. На внешнем энергетическом уровне атомов этих элементов находится по одному s-электрону, что характеризует их как металлы. В то же время их предпоследний энергетический уровень, содержаш,ий 18 электронов, недостаточно устойчив. При возбуждении атомов во время реакции, вследствие недостаточной стабильности группировки d предпоследнего энергетического уровня, один из -электронов переходит в подуровень р внешнего энергетического уровня и число непарных (валентных) электронов достигает трех. В результате этого максимальное окислительное число элементов этой группы может достигнуть +3. [c.258]
Анализ потенциальных кривых для реакции (А) показывает, что равновесный энергетический уровень начального состояния (окисленной формы О и п электронов в металле) оказывается тем ниже, чем больше сумма go hnF Е—%), а равновесный энергетический уровень конечного состояния (восстановленной формы R) тем ниже, чем больше gR. Таким образом, изменение разницы этих уровней [c.187]
У ионов и Са” 4у-орбиталь чуть более устойчива, чем З -орбита-ли, и поэтому присоединяемые к ним электроны поступают на 4х-орби-таль. В отличие от этого у иона 8с энергетический уровень З -орбитали располагается ниже уровня 4. -орбитали, и у ионов переходных металлов с более высокими порядковыми номерами дело обстоит таким же образом. Единственный внешний электрон у иона 8с” находится на З -орби-тали, а не на 4, -орбитали. Таким свойством обладают и все остальные переходные металлы. Перепутывание энергетических уровней 5- и -орби-талей происходит в начале каждого ряда переходных металлов. Хотя у элементов групп 1А и ПА сначала заполняется электронами внешняя орбиталь, у ионов переходных металлов электроны занимают -орбитали. Например, ион Т1″ имеет валентную конфигурацию 3 “, а не 4 “. [c.438]
Количество поглощенного водорода зависит от плотности упаковки атомов в решетке металла, характеризующей энергетический уровень и интенсивность силовых полей решетки 0 3- Чем вьш1е плотность упаковки атомов в решетке /чем выше ее энергетический уровень/, тем больше может быть связано водорода в решетке и выше растворимость водорода в металле, однако тем значительнее затрудняется диффузия водорода в металле. Растворимость и поглощение водорода мелкозернистой сталью выше, чем крупнозернистой, тогда как скорость диффузии водорода, наоборот, уменьшается с увеличением дисперсности структуры. [c.18]
Зонная теория твердого тела позволяет объяснить основные физико-химические свойства кристаллов высокую электрическую проводимость и теплопроводность металлов, особенности проводимости в полупроводниках, изолирующие свойства диэлектриков и т. п. Электрическая проводимость кристаллов определяется наличием квазисвободных электронов, способных к направленному перемещению под действием внешнего электрического поля. Если на электрон действует сила, определяемая напряженностью электрического поля, то он начинает двигаться с ускорением и его кинетическая энергия при этом возрастает. В зонной модели, которая является результатом применения представлений квантовой механики к твердому телу, возрастание энергии электрона равносильно его переходу на более высокий энергетический уровень. При наличии в зоне разрешенных энергий вакантных уровней, ко- [c.309]
Когда энергетический уровень ионов на поверхности металла и в растворе становится одинаковым, т. е. и[ = И ч (что наступает обычно довольно быстро), устанавливается динамическое равновесие, при котором Qя = = Qo скорости анодного и катодного процессов равны [c.153]
Окраска металлов обусловлена тем, что они поглощают лучи волн различной длины не одинаково. Неметаллические элементарные вещества также кажутся окрашенными, если они способны поглощать видимый свет, хотя бы в определенной области частоты колебаний. Поглощение видимого света происходит в том случае, если в веществе есть электроны, которые посредством поглощения энергии могут быть подняты на более высокие уровни, с тем чтобы разность энергий оказалась равной энергии квантов видимого света. Если для того, чтобы поднять электроны на более высокий энергетический уровень, требуется большая энергия, то вещество бесцветно. [c.45]
Атомно-эмиссионный анализ. ]. Фотометрия пламени. Анализируемый раствор распыляют в пламени газовой горелки. Под влиянием высокой температуры пламени атомы переходят в возбужденное состояние. Внешние валентные электроны переходят на более высокие, чаще всего соседние с основным, энергетические уровни обратный переход электронов на основной энергетический уровень сопровождается излучением, длина волны которого зависит от того, атомы какого элемента находились в пламени. Интенсивность излучения при определенных условиях пропорциональна количеству атомов элемента в пламени, а длина волны излучения характеризует качественный состав пробы. Метод фотометрии пламени чаще всего применяют для качественного обнаружения и количественного определения легко возбуждающихся щелочных и щелочноземельных металлов. [c.30]
Когда два металла, погруженные в раствор своих ионов, приводятся в соприкосновение через проводник первого рода (как, например, в элементе Якоби — Даниэля), то электроны переходят с более высокого уровня энергии в металлическом цинке на более низкий уровень в меди. При этом энергетический уровень электронов в цинке будет понижаться, а в меди повышаться. Но понижение уровня электронов в цинке означает повышение уровня положительного иона в этом металле. Это нарушает условие равновесия, указанное на рис. 37, б, и создает положение, изображенное на рис. 37, а, только при этом разность в условиях потенциальной энергии становится значительной. В меди наблюдается обратная картина уровни электронов повышаются, уровни ионов понижаются и на поверхности металлов создается положение, изображенное на рис. 37, в. [c.150]
Каждому виду находящихся в растворе ионов соответствует определенный уровень полной потенциальной энергии электронов. Положение этого уровня определяется местом данного элемента в ряду напряжений. Чем правее находится элемент в ряду напряжений металлов (или полупроводников), тем ниже расположен соответствующий энергетический уровень электронов. Для металлоидов это правило меняется на обратное. [c.203]
Промежуточное положение между металлами и непроводниками электрического тока ( изоляторами) занимают полупроводники (рис. 111-65). Электронами у них заполнены все подуровни валентной зоны, но запрещенная зона ( ) настолько узка, что перевод части электронов в зону проводимости требует сравнительно небольшой затраты энергии (например, для кремния—1,10 эв, а для германия — 0,75 эв). Следовательно, само по себе вещество является непроводником, но более или менее легко превращается в проводник под влиянием некоторых внешних воздействий (усиления электрического поля, нагревания, освещения). По устранении таких воздействий электроны возвращаются на низший энергетический уровень и вещество вновь становится непроводником. [c.112]
Щелочные металлы образуют главную подгруппу I группы и обладают наиболее выраженными металлическими свойствами. Это обусловлено строением атомов щелочных металлов, наружный энергетический уровень которых имеет конфигурацию ns. [c.245]
Рассмотрим, что произойдет, если два металла с различными ионизационными потенциалами приведены в контакт между собой (рис. 36). Так как верхний заполненный энергетический уровень металла / на этом рисунке расположен выше, чем соответствующий уровень энергии металла 2, электроны с металла 1 будут перетекать на металл 2. Этот переход будет продолжаться до тех пор, пока верхние заполненные уровни энергии электронов в обоих металлах не выровняются. Тогда вероятность перехода электронов от металла 1 к металлу 2 и обратно станет одинаковой. Но при этом металл / с меньшим потенциалом ионизации получит положительный заряд, а металл 2 приобретает равный по величине отрицательный заряд. На границе между металлами возникнет разность потенциалов, т. е. гальвани-потенциал. Он не совпадет по величине с разностью ионизационных потенциалов металлов и вообще не может быть определен или же рассчитан какими бы то ни было доступными средствами. Причина этого состоит в том, что при переходе электронов от одного металла к другому помимо электрической производится работа, обусловленная разностью химического потенциала электрона в обеих фазах. [c.50]
Современные представления квантовомеханической теории исходят из того, что электрон может перескакивать с поверхности металла к протону лишь в тот момент, когда энергетические уровни электрона и протона будут одинаковыми. Вероятность возникновения такого состояния весьма мала, вследствие чего процесс присоединения отрицательного заряда (электрона) к положительному (протону) протекает с неожиданно большими затруднениями. Частота выравнивания энергетического уровня протона до уровня энергии электрона определяется флуктуациями молекул полярного растворителя, вследствие чего изменяется энергетический уровень протона. В результате перенос заряда через фазовую границу существенно зависит от свойств полярного растворителя. [c.346]
В соответствии с классической кинетической теорией при абсолютном нуле все электроны в металле должны занять самый низкий энергетический уровень, т. е. иметь энергию, равную нулю. Согласно представлениям о молекулярных орбиталях, в применении к металлу даже при абсолютном нуле только два электрона смогут занять самую низкую по энергии орбиталь. Остальные электроны должны располагаться на орбиталях с большей энергией. И следовательно, энергия таких электронов будет всегда выше нуля. При возрастании температуры электроны, расположенные на верхних орбиталях, приобретая энергию, смогут перейти на следующие по энергии орбитали. Электроны, расположенные на более [c.133]
А. И. Красильщиков с сотрудниками считает защитная способность покрытия связана с тем, что в результате его взаимодействия с металлом изменяется энергетический уровень атомов, расположенных на поверхности, и таким образом повышается его термодинамическая стабильность. Образующийся на границе раздела металл — покрытие двойной электрический слой вызывает торможение электрохимических процессов на металле под пленкой, снижает ток пассивации и увеличивает адгезию полимера к металлу. На основании установленной зависимости между адгезией покрытия к стали и током поляризации, характеризующим защитную способность покрытия, авторами предложен неразрушающий метод определения прочности связи покрытия сЬ сталью по величине плотности тока анодной пассивации [19, 30]. [c.27]
К внутренним факторам относят химический состав и его неоднородность, строение металла, состояние и протяженность границ зерен, наличие неметаллических включений, градиент остаточных напряжений, состояние поверхности и др. Следует отметить, что упруго-пластическая деформация металла меняет его энергетический уровень и, как правило, увеличивает коррозионную активность. Механические напряжения могут усиливать работу гальванических пар. Это особенно важно при циклическом нагружении, обусловливающем значительную локальную деформацию металла, что приводит к увеличению его электрохимической гетерогенности. [c.9]
Описанный процесс туннельного проникновения электрона сквозь барьер может происходить только между двумя равновесными энергетическими состояниями в металле или полупроводнике с одной стороны и в растворе — с другой. При этом, естественно, энергетический уровень, с которого происходит анодный или катодный переход электрона, должен быть занят, а уровень, на который он совершается, — свободен. [c.149]
Анодная поляризация металла, т. е. сдвиг потенциала металла в положительную сторону, когда > (Ул1е)обр и А1/ > О, повышает энергетический уровень катионов на поверхности металла и понижает его у катионов, находящихся в растворе на расстоянии бо от поверхности металла, как это представлено кривой 3 на рис. 138. Устанавливающийся при этом скачок потенциала, поляризуемого внешним током металла относительно растЕюра Уа, дает в плотной части двойного слоя скачок г]) 4= обр- совершаемая работа А при переходе 1 г-иона катионов металла в раствор будет равна [c.199]
Переход электрона из оболочки атома благородного газа иа более высокий энергетический уровень требует такой затраты энергии, которая не может быть компеиспрована образованием связи, поэтому щелочные металлы не проявляют других степеней. окпсления, кроме 4-1- [c.300]
Из рассмотренной схемы взаимодействия между металлом и электролитом (см. рис. 8), вытекает, что причиной возникновения электродных потенциалов является перенос иоггав из металла в раствор и обратно. Электродные потенциалы являются энергетической характеристикой двойных слоев, представляя собой меру энергии, нужную для перехода ионов в раствор или в обратном направлении. Когда двойной электрический слой достигает разности потенциалов, при которой энергетический уровень ионов в металле и растворе сравняется, процесс перехода ионов прекращается (устанавливается равновесие). [c.19]
Окрашивание пламени и изучение спектров. При действии высоких температур электроны в атоме возбуждаются и переходят на более высокий энергетический уровень. Дри переходе электронов на ярежний энергетический уровень излучается свет определенной длины волны. Для каждого элемента существует характеристическая длина волны. Под, действием сравнительно низкой тем,пературы газового пламени излучают свет лишь немногие элементы. К ним относятся щелочные, щелочноземельные, а также некоторые тяжелые металлы. Температура возбуждения зависит и от присутствующих анионов. Сульфаты щелочноземельных металлов в пламени практически не излучают света. Для1 испытаний на окрашивание пламени лучше всего. применять <хлориды.. Поскольку следовые количества натрия практически невозможно устранить, окрашивание пламени соединениями натрия часто маскирует окрашивание других элементов. Дерекрывание окрасок наблюдается также. при одновременном присутствии нескольких элементов. В этих случаях лучше применять простейший спектроскоп. [c.38]
Различие между а и а обусловлено тем, что в действительности имеется не один электронный терм начального состояния, как это показано на рис. 157, а множество термов, каждому из которых соответствует свой энергетический уровень электрона в металле. С каждого из этих уровней в принципе возможен переход электрона на реагирующую частицу. Вероятность такого перехода определяется как энергией активации и а (е), являющейся функцией от энергии электронного уровня е, так и функцией распределения электронов по уровням п (е) 1см. уравнение (55.4)]. В самом деле, чем ниже уровень е, тем с большей вероятностью там можно найти электрон, но одновременно тем больше энергия активации и а, затрудняют,ая достижение точки пересечения термов. С другой стороны, чем выше уровень е, тем меньше и А, но тем меньше вероятность нахождения на этом уровне электрона. Таким образом, в зависимости от е произведение п(е) ехр [—и а (е)/ /кТ, определяющее общую вероятность перехода электрона с уровня е в металле на реагирующую частицу, проходит через максимум при некотором значении е=е. Именно с уровня е и будет совершаться электронный переход, составляющий элементарный акт процесса разряда — ионизации. Так как максимуму произведения п(е) ехр [— /д/ /кТ] отвечает также максимум его логарифма, т. е. величины 1п л(е)— [c.287]
Если кристалл поместить в небольшое постоянное электрическое поле, то для того чтобы в нем возник электрический ток, необходимо движение некоторых электронов ускорить, т. е. изменить их энергию. Небольшое изменение энергии, соответствующее слабому полю, может произойти только B том случае, если в кристаллах есть свободный энергетический уровень, близкий к тому, на котором находился электрон до действия поля (кристаллы первого и второго типов). Такие кристаллы обладают свойством проводников. Это, например, щелочные металлы, у которых на каждый атом приходится по одному валентному электрону. Так как энергетических уровней в кристаллах щелочных металлов вдвое больше, чем элементарных ячеек, то половина уровней в зоне свободна (кристаллы первого типа). У щелочноземельных элементов близколежащие s- и р-уровни атомов в кристаллах размываются так, что образуют перекрывающиеся зоны, (кристаллы второго типа). [c.170]
В ионных соединениях атомы более электроотрицательных элементов (неметаллов) дополняют свой внешний энергетический уровень до октета за счет электронов атомов менее электротрицатель-чых элементов (металлов), у которых [c.64]
В ионных соединениях атомы более электроотрицательных элементов (неметаллов) дополняют свой внешний энергетический уровень до октета за счет электронов атомов менее электроотрицательных элементов (металлов), у которых пред-внешний уровень становится внешним уровнем. Электронные уровни образовавшихся ионов могут иметь одинаковое строение. Например, в хлориде калия (ДЭО = 2,2) ионы К+ и С1 имеют одинаковзто электронную структуру (Ке)3 3р — такую же, как у атомов Аг. В этом случае говорят, что эти частицы (К+, СГ, Аг) имеют изоэлектронную структуру. [c.80]
Химические свойства. Атом серы, имея незавершенный внешний энергетический уровень, может присоединять два электрона и проявлять степень окисления —2. Такую степень окисления сера проявляет в соединениях с металлами и водородом (например, Na2S и НзЗ). При отдаче или оттягивании электронов к атому более электроотрицательного элемента степень окисления серы может быть +2, +4 и +6. [c.177]
Степень поляризации аниона под воздействием катиона определяется не только ионным потенциалом катиона, но и тем, каков его самый внешний занятый электронами энергетический уровень. Для одного и того же энергетического уровня распределение -электронов оказывается более диффузным, чем распределения 5- и р-электронов. Другими словами, -электроны проводят в среднем больше времени в удалении от ядра, чем. 9- или р-электроны. По этой причине катионы с -электронами на внешнем энергетическом уровне оказываются более мягкими и сильнее взаимодействуют с анионами. К числу таких ионов с -электронами на внешнем энергетическом уровне относятся катионы большинства переходных металлов и непосредственно следующих за ними (постпереходных) элементов соответствующих периодов. Принято говорить, что они обладают большой поляризующей способностью. [c.131]
Переходы молекулы из одного состояния в друтое сопровождаются перераспределением электронной плотности. Имеется несколько способов разделять наблюдаемые переходы по типам изменений, происходящих в молекуле под действием электромагнитного излучения. Электронные спектры поглощения молекул, наблюдаемые в УФ- и видимой областях спектра, связаны, главным образом, с возбуждением электронов валентной оболочки. Принято считать, что при возбуждении меняется состояние (энергия и волновая функция) только одного электрона. Одноэлектронные волновые функции молекулы (молекулярные орбитали) принято обозначать в соответствии с типом связи между атомами. Орбитали, симметричные относительно оси связи, обозначаются а. Если орбитали не меняют знака вдоль связи, они являются связывающими. Им соответствуют наиболее глубоко расположенные энергетические уровни. Электроны, находящиеся на этих орбиталях, обеспечивают а-связь между атомами. Если а-орбиталь меняет знак между связываемыми атомами, она является разрыхляющей и обозначается а. Соответствующий ей энергетический уровень расположен много выше уровней орбиталей несвязанных атомов. Орбитали, меняющие знак на оси связи, обозначаются как тг-орбитали, которые тоже могут быть как связывающими (тс), так и разрыхляющими (тг). Уровни этих молекулярных орбиталей расположены соответственно ближе к уровням несвязывающих атомных орбиталей. При возбуждении могут меняться и состояния электронов, не участвующих в связи, орбитали которых локализованы на отдельных атомах ( -электроны). В спектрах комплексов ионов переходных металлов участвуют электроны, расположенные на с1-орбиталях. Электронные переходы обычно обозначают символами, соответствующими исходному и конечному одноэлектронным состояниям (например, а->а, тг->тг, п- а, и—). Однако по мере увеличения числа атомов в молекуле классификация электронньгх переходов усложняется. [c.221]
Элементы группы 1А (Ы, N3, К,—) имеют свободные р-орбиты, но их катионы не обладают значительной поляризующей способностью, а сами они не располагают тем количеством электронов, которое удовлетворяет первому из сформулированных выше условий, поэтому окислы металлов группы 1А не должны проявлять значительного структурирующего действия при использовании их в качестве промоторов. Этот вывод подтверждается результатами испытания ЫагО и КгО в качестве промоторов (см. рис. 1). При переходе от К к Ыа и далее к Ы увеличивается отношение г/Гк, характеризующее поляризующую способность катиона, и одновременно понижается энергетический уровень свободных р-орбит элемента, что должно облегчать переход на них электронов с 2р-орбнты [c.51]
В то же время, если энергия валентных состояний адатома находится за пределами валентной зоны металла, виртуальные связывающие состояния образоваться не могут. Если атомный энергетический уровень расположен значительно ниже уровня Ферми, то в принципе возможен такой переход электрона с уровня Ферми и образование адиона, при котором кулоновское отталкизаике электронов в ионе не повышает энергию ионного состояния (после учета взаимодействия между ионом и его изображением в металле) настолько, чтобы связывание стало невозможным. Однако атомный энергетический уровень, по-видимому, редко располагается настолько низко, чтобы имела место чисто ионная адсорбция. Более вероятным представляется промежуточный вариант электроны не локализуются на адатоме, а распределяются между ним и одним или несколькихми поверхностными атомами металла с образованием квазинор-мальной ковалентной связи. Вполне допустимо участие в этом связывании металлических валентных состояний у верхней границы валентной зоны, где их плотность (для переходных металлов максимальна. [c.18]
Два л-электрона ненасыщенной С=С-связи, занимающей наиболее высокий энергетический уровень в молекулах с сопряженной системой связей, подобны, в некоторой степени, неподеленной паре электронов уи омянутых выше атомов. Вопрос о том, способна ли такая пара электронов в какой-то мере взаимодействовать с вакантной орбитой галогенида металла аналогично тому, как это рассмотрено выше, решается в первую очередь энергетикой этих систем. [c.109]
Величина представляет собой внутренний, а —внешний потенциал металла цри условии, что величина фвак принята за нуль. В расчете на 1 г-мокМе энергетический уровень иона в металле можно выразить так [c.162]





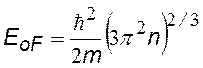



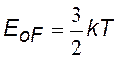
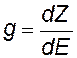 (1/эВ)
(1/эВ)
