Решая совместно уравнения
(2),
(5), (9), получим выражение для полной
энергии электрона в атоме водорода:
| (10) |
Уравнение (10) определяет разрешенные
значения энергии электрона в атоме
водорода. Число n
принимает целые значения n =
1,2,3, …¥ .
Таким образом, энергия электрона в атоме
водорода может иметь не любые значения,
а только дискретный набор значений,
определяемых числом n,
или, как говорят, энергия электрона квантуется.
Подставляя значения
массы и
заряда электрона, постоянных 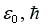
уравнение (10) и выражая энергию в электронвольтах
(эВ) (1эВ = 1,6.10-19
Дж), получим
формулу
| (11) |
Энергия основного состояния
(при n
= 1), равна E1=
– 13,6 эВ. На рис. 1
приведена диаграмма энергетических
уровней электрона в атоме водорода, на
которой горизонтальными прямыми
отмечены разрешенные значения энергии.
Все состояния с величиной n= 1 … ¥ являются
связанными. При увеличении числа n
энергетические уровни сближаются все
больше и больше. При n ® ¥ E ®
0.
Энергетические состояния с энергией E ³
0
соответствуют тому, что электрон
становится свободным (не связанным с
ядром).
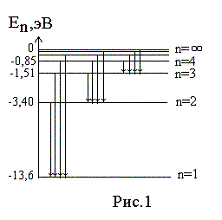
энергетических уровней (рис.1) позволяет
дать несколько важных определений.
Энергия возбуждения Евоз
– это энергия, которую необходимо
сообщить электрону, чтобы он из
основного состояния (n = 1)
перешел в возбужденное. Например, Евоз
= 10,2 эВ – энергия, необходимая для
перехода электрона в состояние,
соответствующее n =
2 (первое возбужденное состояние).
Энергия ионизации Еион
– энергия, необходимая для отрыва
электрона, находящегося в основном
состоянии (n
= 1), от ядра, т.е. для перевода электрона
на уровень с n = ¥ .
Для атома водорода энергия ионизации
равна 13,6 эВ.
Согласно постулату Бора, при
переходе электрона из одного состояния (с
большей энергией) в другое (с меньшей
энергией) испускается фотон, частота
которого определяется формулой (8).
Учитывая выражение (10) для энергии
электрона в атоме, получим выражение для
частот испускаемых фотонов:
| (12) |
или, соответственно, для длин
волн испускаемых фотонов:
| (13) |
где Ry =
1,0974.107
м–1
– так называемая постоянная Ридберга.
Таким образом, модель атома Н.Бора
объясняет дискретный (линейчатый)
характер спектра испускания атома
водорода.
Спектральные
серии атома водорода
На диаграмме энергетических уровней (рис.1)
показаны возможные переходы электрона с
верхних уровней на нижние. При каждом
таком переходе излучается фотон с
частотой, определяемой формулой (12), или
длиной волны, определяемой формулой (13).
Переходы электрона с различных верхних
уровней на определенный нижний образуют
так называемые спектральные серии
атома водорода. Так, все переходы из
состояний с n
= 2, 3, 4, … в
состояние с n
= 1 образуют так называемую серию
Лаймана (ультрафиолетовое излучение).
Все длины волн этой серии лежат в
ультрафиолетовой области шкалы
электромагнитных волн. Переходы из
состояний с n
= 3, 4, 5, … в состояние с n
= 2 образуют серию Бальмера (видимый
свет). Переходы из состояний с n
= 4, 5, 6, … в состояние с n
= 3 образуют серию Пашена (инфракрасное
излучение). Длины волн всех остальных
серий (переходы на уровни с n
= 4, 5, и т.д.) лежат в инфракрасной области
спектра электромагнитного излучения.
Приветствую вас, уважаемые читатели, на своем канале!
В данной статье разберем основное и возбужденное состояния атомов и электронные формулы ионов.
Предыдущие статьи по вопросу 1 можно посмотреть здесь:
Основное и возбужденное состояния атомов
Валентность – это способность атома химического элемента образовывать с другими атомами химические связи за счет отдачи или принятия электронов. Валентность определяется числом неспаренных электронов в обычном и возбужденном состоянии атома.
Когда мы строим электронные конфигурации атомов по ПС, то это основное состояние (т.е. состояние с минимальной энергией).
Иногда, некоторые атомы, когда получают энергию извне, могут переходить в возбужденное состояние.
Возбужденное состояние атома – это состояние, при котором электрон из электронной пары с предыдущего подуровня с меньшей энергией “расспаривается” и переходит на следующий подуровень с большей энергией.
Например, рассмотрим электронные оболочки атомов углерода и серы в основном и возбужденном состояниях.
Возбужденное состояние характерно для таких атомов, которые имеют свободную орбиталь. Например, мы знаем, что третий уровень характеризуются тремя подуровнями, независимо от их заполнения (например, как у серы).
Атомы азота (N), кислорода (O), фтора (F) и неона не могут переходить в возбужденное состояние, так как нет свободных орбиталей и второй уровень характеризуется только двумя подуровнями.
Атом азота (N):
– количество неспаренных электронов 3;
-валентность: 3.
Атом кислорода (O):
– количество неспаренных электронов: 2;
-валентность: 2.
Атом фтора (F):
– количество неспаренных электронов: 1;
-валентность 1.
Атом неона (Ne):
– количество неспаренных электронов: 0;
– валентность: 0.
Электронные формулы ионов
Если атом отдает или принимает электрон, он превращается в ион.
Например, переход железа в состояние Fe(3+) связано с отдачей трех электронов:
Fe(0) → Fe(3+) (атом отдал 3е) =>
26Fe …3d(6)4s(2) Fe(3+) …3d(5) (катион).
В первую очередь атом отдает электроны с более высокого энергетического уровня и подуровня.
S(0) → S(2-) (атом принял 2е) =>
16S …3s(2)3p(4) S(2-) …3s(2)3p(6) (анион).
Электронная конфигурация иона S(2-) аналогична электронной конфигурации атома аргона.
Связь электронного строения атома с положением элемента в ПС
1. Число энергетических уровней в атоме, на которых расположены электроны, равно номеру периода.
2. У элементов главных подгрупп число электронов на внешнем энергетическом уровне равно номеру группы ПС. У элементов главных подгрупп электроны внешнего энергетического уровня являются валентными.
3. У элементов побочных подгруппы III – VIII групп общее число электронов на s-подуровне внешнего энергетического уровня атома и d-подуровне предпоследнего уровня равно номеру группы.
Например:
25Mn 1s(2)2s(2)2p(6)3s(2)3p(6)3d(5)4s(2)
26Fe 1s(2)2s(2)2p(6)3s(2)3p(6)3d(6)4s(2)
У элементов побочных подгрупп валентными могут быть электроны внешнего энергетического уровня и d-подуровня предпоследнего уровня.
4. У элементов побочных подгрупп I и II групп d-подуровень предпоследнего энергетического уровня завершен (d(10)), а на внешнем энергетическом уровне число электронов равно номеру группы.
Например:
29Cu 1s(2)2s(2)2p(6)3s(2)3p(6)3d(10)4s(1)
30Zn 1s(2)2s(2)2p(6)3s(2)3p(6)3d(10)4s(2)
Если есть вопросы по данной статье, то пишите в комментариях!
Разборы заданий второй части реальных вариантов ЕГЭ 2021 смотрим ниже.
Решение заданий 30 и 31 разных вариантов можно посмотреть здесь:
Решение заданий 32 разных вариантов можно посмотреть здесь:
Решение заданий 33 разных вариантов можно посмотреть здесь:
Решение заданий 34 разных вариантов можно посмотреть здесь:
Решение заданий 35 разных вариантов можно посмотреть здесь:
Не забываем поставить лайк этой статье и подписаться на канал!
Всем успехов в изучении химии!
Возбужденное состояние электрона отвечает за многие проявляемые им свойства. Это основа атомной химии и образования молекул. Эта статья иллюстрирует интересные факты, связанные с фазой возбуждения электронов.
Возбужденное состояние электрона можно определить как временное перемещение электрона из основного состояния в возбужденное при наличии дополнительной энергии. Это возбужденное состояние электрона может быть достигнуто передачей энергии в виде столкновения между молекулами, поглощения фотона, пакета или света.
Для понимания возбужденного состояния электрона необходимо обратить внимание на энергетический каркас атома. Атом состоит из трех элементов, а именно нейтронов, протонов и электронов. Ядро состоит из протонов и нейтронов, которые окружены электронами в четко определенных оболочках, известных как энергетические уровни, которые имеют различные энергии. Это описание основного состояния атома, в котором электроны находятся в состоянии с наименьшей энергией.

Каждая орбиталь имеет определенные энергетические параметры. Чтобы электрон возбудился, ему необходимо перейти с самого низкого стабильного энергетического уровня на более высокий нестабильный энергетический уровень. Это возможно только в том случае, если электрон преодолеет разницу энергий между обеими орбиталями. Это возможно только в том случае, если фотон с такой большой энергоемкостью поглощается электроном. Выполнение этой потребности в энергии приводит к идеальному состоянию возбужденного состояния электрона. Но это возбужденное состояние электрона является временным, и в течение нескольких миллисекунд электроны возвращаются в свое основное состояние из возбужденного состояния с испусканием фотона.

Помимо возбужденного состояния электрона, существует также возможность достижения электроном максимальной энергии, когда ядерное притяжение или ядерная энергия не играют роли. Электрон в возбужденном состоянии является ионизированным электроном. Есть много фактов, связанных с возбужденным состоянием электрона, которые обсуждаются далее:

- Электронная конфигурация возбужденного состояния электрона
- Когда находится возбужденное состояние электрона?
- Как формируется возбужденное состояние электрона?
- Роль электронной конфигурации в определении возбужденного состояния электрона
- Формула электронной конфигурации при возбужденном состоянии электрона
- Время возбужденного состояния электрона
- Изменения в электроне во время возбужденного состояния электрона
- Первое возбужденное состояние электрона
- Расчет первого возбужденного состояния электрона
- Уровень электрона в первом возбужденном состоянии
- Достоверность возбужденного состояния электрона
Электронная конфигурация электрона в возбужденном состоянии
Электронная конфигурация – это расположение электронов на энергетических уровнях в соответствии со стабильностью. Обычно электронная конфигурация каждого элемента, изображенного в периодической таблице, находится в основном состоянии. Во время соединения элементов с образованием различных соединений происходит совместное использование, приобретение и потеря электронов, что приводит к возбужденному состоянию образования электронов.
Электроны в возбужденном состоянии образуются за счет подвода энергии и всегда находятся в более высоком расположении. Это демонстрируется с помощью примера. Например, давайте рассмотрим кислород, имеющий атомный номер = 8. Его электронная конфигурация в основном состоянии или самой низкой наиболее стабильной энергетической форме равна 1s.22s22p4. Если кислород нужно возбудить, то он может занимать бесконечное количество орбиталей, но обычно они занимают следующую орбиталь. Таким образом, в возбужденном состоянии электронная конфигурация кислорода будет равна 1s.22s22p33s1
Когда находится возбужденное состояние электрона?
Возбужденное состояние электрона возникает из-за того, что валентные электроны или самые внешние электроны не всегда остаются в своих соответствующих оболочках. Из-за поглощения тепла, света или квантов они переходят на более высокий энергетический уровень, находящийся далеко от ядра. Но это явление не является постоянным. Возбужденный электрон возвращается в исходное положение, теряя энергию, что называется процессом испускания.
Как формируется возбужденное состояние электрона?
Процесс формирования возбужденного состояния электрона аналогичен объясненному выше. Он включает в себя поглощение и испускание энергии, что приводит к возбуждению, а затем возврату электронов обратно в их основное состояние. Минимальная энергия, необходимая для движения электрона, является пороговой энергией. Это разница между основным состоянием и возбужденным состоянием. Эта полная процедура происходит на ограниченной длине волны, которая, в свою очередь, испускает цветное излучение, формируя тем самым спектры.
Например, медный металл при нагревании в горячем пламени имеет ярко-зеленый цвет. Это подтверждается возбужденным состоянием электрона с последующей эмиссией.
Роль электронной конфигурации в определении возбужденного состояния электрона
На электронную конфигурацию влияет возбужденное состояние электрона. Электронная конфигурация атома, где есть возбуждение, показывает движение валентных электронов на следующую более высокую орбиталь.
Например, металлический натрий — это металл с атомным номером 11. Его электронная конфигурация в основном состоянии равна 1s.22s22p63s1. Во время возбуждения электрон, находящийся на подуровне 3s, переместится на подуровень 3p. Таким образом, электронная конфигурация в возбужденном состоянии будет равна 1 с.22s22p63p1. Но это очень нестабильное состояние, и возбужденное состояние электрона не будет долгоживущим, прежде чем он вернется к своей исходной электронной конфигурации.
Вся эта процедура возбуждения и возвращения в исходное состояние приводит к высвобождению характерного желтого пламени в случае металлического натрия.
Формула электронной конфигурации при возбужденном состоянии электрона
Не существует формул или жестких правил для определения электронной конфигурации возбужденного состояния электрона. Единственная важная вещь, о которой нужно знать, это как записать электронную конфигурацию элементов с правильным распределением энергии. Затем возбужденное состояние электрона может быть достигнуто путем перескока электрона на соседний более высокий энергетический уровень, который является короткоживущим.
Время возбужденного состояния электрона
Возбужденное состояние электронов является очень короткоживущим периодом из-за нестабильности в распределении энергии. У большинства атомов среднее время до процесса испускания составляет 10-9 в 10-8 секунды. Единственное возбужденное состояние, которое может сохраняться длительное время, — это метастабильное состояние. Хотя это время меньше, чем в основном состоянии, оно намного больше, чем в другом возбужденном состоянии электрона. Значительное время в метастабильном состоянии составляет 10-6 в 10-3.
Изменения в электроне во время возбужденного состояния электрона
Представление о том, что происходит с электронами при возбуждении, очень сложное и имеет разные теории и представления. Многие ученые и исследователи считают, что сами электроны не переходят с одной оболочки на другую, но многие с этим не согласны
Они работают над этим представлением о том, что атом не является объектом, как это объяснялось классической теорией, но имеет форму волны, как объяснялось позже развитой квантовой теорией. Предполагается, что существует движение электронов во многих молекулярных возбуждениях, таких как n до pi*, где начальное и конечное состояния имеют разные волновые функции. Эта тема касается волнообразного аспекта орбитали, где энергия находится в форме кванты.
Первое возбужденное состояние электрона
Первое возбужденное состояние электрона в атоме можно объяснить тем, что электроны в основном состоянии получают достаточную энергию для перехода на следующую орбиталь. Например
В атоме H электроны занимают оболочки, обозначенные как n. Тогда основное состояние равно n=1, а выше него находится первое возбужденное состояние электрона n=2.
Разность энергий определяется выражением
En = -13.6 эВ/n^2, где n = 1, 2, 3, 4….
Таким образом, разность энергий первого возбужденного состояния электрона может составлять E2-E1 = 10.2 эВ.
Расчет первого возбужденного состояния электрона
Энергетический расчет возбужденного состояния электрона обычно делается для водородоподобных атомов, которые имеют только один электрон. Энергия n-го уровня может быть рассчитана как
Эн = -Z2 х 13.6 эВ/н2 где Z — порядковый номер атома.
Наличие 1 электрона означает, что электронная конфигурация будет 1s1
Итак, Е1 = -Z2 х 13.6 эВ/12
Следовательно, первое возбужденное состояние энергетического уровня электрона будет 1s02s1.
Уровень первого возбужденного состояния электрона
Об уровне первого возбужденного состояния электрона можно судить с помощью энергетических уровней, предложенных Нилом Бором в его модели атома водорода. Уровни энергии обозначаются буквой n, где n=1 считается основным состоянием, а n=2 — первым возбужденным состоянием электрона. Он также подчеркнул тот факт, что каждый электрон в атоме может достичь своей максимальной энергии и все еще может быть частью атома.
Достоверность возбужденного состояния электрона
Проверка возбужденного состояния электрона осуществляется с помощью теория функционала плотности (DFT) используя либо реальную пространственную сетку, либо базисный набор плоских волн. Это понятие довольно сложное и рассматривается в рамках исследовательской категории.
Заключение
Подводя итог, возбужденное состояние электрона – это состояние, когда электрон перескакивает из своего основного состояния в более высокое возбужденное состояние, когда ему предоставляется энергия, превышающая пороговую энергию, в виде пакетов света или тепла. Это переходное состояние недолговечно, и такое же количество энергии излучается при реверсировании, когда атом переходит из возбужденного состояния в основное. Этот процесс генерирует различные спектры в зависимости от задействованного элемента.
Закономерности
атомных спектров
Изучение
излучения атомов различных элементов
показало, что они состоят из отдельных
спектральных линий, расположенных в
определенном порядке. В спектре
простейшего атома – водорода было
обнаружено, что длина волны, частота и
циклическая частота спектральных линий
определяются обобщенными формулами
Бальмера:
,
,
,
где
м–1,
с–1,
с–1;
– постоянные Ридберга,
– длина волны, частота и циклическая
частота спектральных линий в спектре
атома водорода, соответственно.
Спектральные
линии с одинаковым числом
(
)
и различными m
(
)
образуют спектральную серию, носящую
имя исследователя, который обнаружил
ее в спектре атома водорода (таблица
1).
Таблица 1.
Спектральные серии атома водорода.
|
Значение |
Наименование |
Значение |
|
1 |
Серия Лаймана в |
2,3,4,… |
|
2 |
Серия Бальмера |
3,4,5,… |
|
3 |
Серия Пашена в |
4,5,6,… |
|
4 |
Серия Брэккета |
5,6,7,… |
При
увеличении
длина волны уменьшается, а частота линий
увеличивается и достигает предельного
значения
при
.
является границей серии. Головная линия
серии – линия, соответствующая наименьшей
частоте (наибольшей длине волны) в серии
при переходе с уровня n
+ 1 на уровень n.
Спектр
поглощения атома водорода при нормальных
условиях содержит только одну серию –
серию Лаймана. Аналогичный вид имеют и
спектры водородоподобных ионов (атомов
других элементов таблицы Менделеева с
зарядом ядра
,
у которых удалены все электроны, кроме
одного). Это ионы
и др.
Z
=
1 соответствует
атому водорода
Ядерная модель
атома.
Экспериментально
установив, что в атоме (размером ~10–10м)
имеется ядро (размером ~10–15м),
в котором сосредоточена вся масса атома
(99,4%), Резерфорд предложил планетарную
модель строения атома. Вокруг ядра с
зарядом
(
–порядковый
номер элемента в системе Д.И. Менделеева,
е–заряд
электрона) под действием сил
электростатического притяжения по
круговым (или эллиптическим) орбитам
движутся электроны (подобно тому, как
планеты обращаются вокруг Солнца под
действием сил гравитационного притяжения),
образуя электронную оболочку атома.
Однако, такая модель оказалась
несостоятельной. Движение электрона
по круговой орбите происходит с нормальным
ускорением, поэтому он постоянно излучает
электромагнитные волны и теряет свою
энергию. В результате через короткое
время электрон упадет на ядро и атом
перестанет существовать.
Выход из сложившейся
ситуации предложил Нильс Бор, который
дополнил модель атома Резерфорда двумя
постулатами.
Постулаты Бора
Первый постулат
Бора (постулат стационарных состояний):
В атоме существуют
стационарные (не изменяющиеся со
временем) орбиты (состояния), находясь
на которых электрон не излучает
электромагнитные волны.
Из
всех возможных орбит электрона
разрешенными являются только те, для
которых момент импульса электрона
кратен величине
,
т.е. для которых выполняется условие
(правило
квантования):
(
),
где
–момент
импульса электрона на
–
ой орбите,
–
главное квантовое число,
–масса
электрона,
–скорость
электрона на
–ой
орбите радиусом
,
=
1,0510–34 Джс
– постоянная Планка. Для круговых орбит,
которые рассматриваются в дальнейшем,
Второй
постулат Бора (правило частот).
Любое
изменение энергии атома связано со
скачкообразным переходом из одного
стационарного состояния в другое, при
этом атом испускает или поглощает фотон,
энергия которого определяется выражением
(правило частот).
Таким
образом, энергия фотона равна модулю
разности энергий стационарных состояний
электрона до (
)
и после (
)
перехода. Переход из состояния с большей
энергией в состояние с меньшей энергией
сопровождается излучением
фотона. Обратный процесс возможен
только при поглощении
фотона.
Набор
возможных дискретных частот
квантовых переходов и определяет
линейчатый спектр излучения атома
водорода, состоящего из отдельных
спектральных линий, расположенных в
определенном порядке
Второй
закон Ньютона для электрона в
водородноподобном ионе
имеет вид:
.
Добавив
к этому уравнению первый постулат Бора
для круговых орбит
,
получим
систему из двух уравнений, решая которую,
найдем радиусы орбит электронов и их
линейные и угловые скорости на орбите
с номером n.
Радиусы
разрешенных круговых орбит
в модели Бора для водородоподобного
иона:
,
где
–
номер орбиты,
– электрическая постоянная,
– масса электрона,
– заряд электрона,
– постоянная Планка. Состояние атома с
называется основным. Радиус первой
орбиты электрона при Z=1
(атом водорода) называется боровским
радиусом и обозначается
:
= 53пм = 5,310–11м.
Он является единицей длины в атомной
физике. Тогда
,
т.е. радиусы орбит для стационарных
состояний атома водорода равны
соответственно
Скорость
электрона на орбите с номером
в водородоподобном
ионе:
м/с,
где
м/с – скорость электрона на первой
орбите. Приведем выражение для угловой
скорости вращения электрона на орбите
с номером
:
,
где
– угловая скорость на первой орбите.
Полная
энергия электрона на орбите с номером
n
в водородоподобном ионе складывается
из его кинетической энергии и потенциальной
энергии в электростатическом поле ядра:

Z
= 1 соответствует атому водорода. Полная
энергия электрона равна

Состояние
с номером
и энергией
эВ
– называется основным,
остальные значения соответствуют
возбужденным состояниям. Для целочисленных
,
получаем энергетические уровни атома
водорода, схематически представленные
на Рис.10.

Рис.10
Диаграмма
энергетических уровней атома водорода.
Показаны переходы, соответствующие
различным спектральным сериям.
Полная
энергия электрона, являющаяся отрицательной
величиной, соответствует ограниченному
движению электрона в пространстве по
стационарной орбите. Минимальная энергия
атома водорода
эВ при n
= 1.
Переходы
электрона с одной орбиты (энергетического
уровня) на другую приводят к образованию
спектральных серий Лаймана, Бальмера,
Пашена, изображенных на Рис.10б. При
увеличении номера орбиты n
энергия электрона возрастает и при
становится равной нулю. Если энергия
электрона
,
то его движение является неограниченным,
т.е. он оторвался от ядра атома водорода
и произошла ионизация атома. Минимальная
энергия, необходимая для удаления
электрона из атома (водородоподобного
иона) называется энергией
ионизации
:
Дж=
13,6 эВ.
Энергия
возбуждения
– минимальная энергия, которую необходимо
сообщить атому водорода (водородоподобному
иону), чтобы электрон из основного
состояния перешел в возбужденное.
Энергия
связи
данного состояния – энергия, необходимая
для удаления электрона из атома
(водородоподобного иона), находящегося
в данном возбужденном состоянии.
Потенциалом
ионизации
называется ускоряющая разность
потенциалов, которую должен пройти
бомбардирующий электрон, чтобы приобрести
энергию, достаточную для ионизации
атома (водородоподобного иона):
В.
Энергия ионизации, выраженная в
электронвольтах, численно равна
потенциалу ионизации.
Первый
потенциал возбуждения U1
есть наименьшая разность потенциалов,
которую должен пройти в ускоряющем поле
электрон, чтобы при столкновении с
невозбужденным атомом водорода
(водородоподобным ионом) перевести его
в первое возбужденное состояние:
,
так как
=1
и
=2.
=10,2Z2
В. Для атома водорода (Z=1)
U1=10,2В
Вывод формулы
Бальмера в теории Бора
Рассматривая
первый постулат Бора для перехода
водородоподобного иона с орбиты под
номером m
на орбиту с номером n
для энергии излучаемого фотона
,
получим:
,
откуда
,
где
– постоянная
Ридберга.
Примеры решения
задач
Задача
1. Найдите
спектральный интервал, в пределах
которого расположены линии серии
Бальмера атомарного водорода (в длинах
волн).
Решение.
Формула
Бальмера для серии Бальмера имеет вид:
,
где
– длина волны,
= 1,1107
м-1
– постоянная Ридберга.
Интервал
серии Бальмера ограничен головной
линией серии, соответствующей
=
656 нм и границей серии при
365
нм.
Задача
2. Атом
водорода находится в возбужденном
состоянии с главным квантовым числом
.
Определите длины волн возможных
спектральных линий в спектре атома
водорода, наблюдающихся при переходе
атома из возбужденных состояний в
основное.
Решение.
Если атом
находится в возбужденном состоянии,
характеризующемся главным квантовым
числом
,
то возможны переходы на уровни, указанные
на Рис.11 стрелками:
ч
етыре
линии серии Лаймана (соответствуют
переходам 1 – 4), три линии серии Бальмера
(соответствует переходам 5 – 7) и две
линии серии Пашена (соответствуют
переходам 8 -9).
Рис.11
Схема возможных переходов с уровня n
= 5
В
соответствии с обобщенной формулой
Бальмера
,
для каждой из этих линий получим:
=
121 нм,
=
102 нм.
=
97 нм,
=
95 нм,
.
=
654 нм,
=
485 нм,
.
=
433 нм,
=
1870 нм
=
1280 нм.
Задача
3. Покоившийся
атом водорода испустил фотон,
соответствующий головной линии серии
Лаймана. Найдите скорость отдачи, которую
получил атом.
Решение.
В соответствии
с законом сохранения импульса атом
приобрел импульс
,
равный импульсу вылетевшего из него
фотона:
,
где
– масса атома. Частота испущенного
фотона равна
,
откуда скорость отдачи атома
м/с.
Задача
4. Определите
потенциал ионизации атома водорода.
Решение.
Потенциал
ионизации
– наименьшая разность потенциалов,
которую должен пройти электрон в
ускоряющем электрическом поле, чтобы
его энергии
при столкновении с невозбужденным
атомом было достаточно, чтобы провести
его ионизацию.
.
В теории Бора ионизации соответствует
переход электрона в атоме из основного
состояния в состояние с минимальной
кинетической энергией E=0.
Энергия электрона при таком переходе
увеличивается на величину
E=0
.
Тогда, энергия ионизации
,
откуда
=
13,6 В.
Задача
5. Определите
первый потенциал возбуждения атома
водорода.
Решение.
Первый
потенциал
возбуждения – наименьшая разность
потен-
циалов,
которую должен пройти электрон в
ускоряющем электрическом поле, чтобы
при столкновении с невозбужденном
атомом перевести его в первое возбужденное
состояние. Для атома водорода – это
переход с первой боровской орбиты на
вторую c
увеличением энергии на
за счет энергии бомбардирующего
электрона, равной
.
Записывая закон сохранения энергии
,
получим:
=
10,2 В
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #




























