Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 28 сентября 2020 года; проверки требуют 23 правки.
Свобо́дная эне́ргия Ги́ббса (или просто эне́ргия Ги́ббса, или потенциа́л Ги́ббса, или изобарно-изотермический потенциал, или термодинами́ческий потенциа́л в узком смысле) — это величина, изменение которой в ходе химической реакции равно изменению внутренней энергии системы. Энергия Гиббса показывает, какая часть от полной внутренней энергии системы может быть использована для химических превращений или получена в их результате в заданных условиях и позволяет установить принципиальную возможность протекания химической реакции в заданных условиях. Математически это термодинамический потенциал следующего вида:
Энергию Гиббса можно понимать как полную потенциальную химическую энергию системы (кристалла, жидкости и т. д.)
Понятие энергии Гиббса широко используется в термодинамике и химии.
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (


Определение[править | править код]
Классическим определением энергии Гиббса является выражение
где 




Дифференциал энергии Гиббса для системы с постоянным числом частиц, выраженный в собственных переменных — через давление 

Для системы с переменным числом частиц этот дифференциал записывается так:
Здесь 
Связь с термодинамической устойчивостью системы[править | править код]
Покажем, что минимум потенциала Гиббса соответствует устойчивому равновесию термодинамической системы с фиксированными температурой, давлением и числом частиц.
Запишем обобщённое уравнение первого и второго начал термодинамики:
При 
Таким образом в системе при постоянных температуре и давлении энергия Гиббса достигает минимального значения.
Применение в химии[править | править код]
Связь с химическим потенциалом[править | править код]
Используя свойства экстенсивности термодинамических потенциалов, математическим следствием которых является соотношение Гиббса-Дюгема, можно показать, что химический потенциал для системы с одним типом частиц есть отношение энергии Гиббса к числу молей вещества n в системе:
Если система состоит из частиц нескольких сортов 

Химический потенциал применяется при анализе систем с переменным числом частиц, а также при изучении фазовых переходов. Так, исходя из соотношений Гиббса — Дюгема и из условий равенства химических потенциалов 

Энергия Гиббса и направление протекания реакции[править | править код]
a) эндотермическая реакция
б)экзотермическая реакция
Энергетический профиль реакции[2]
В химических процессах одновременно действуют два противоположных фактора — энтропийный (


уравнению Гиббса — Гельмгольца :
Из этого выражения следует, что 


Характер изменения энергии Гиббса позволяет судить о принципиальной возможности осуществления процесса.

|
процесс может протекать — самопроизвольный процесс, |

|
система находится в состоянии химического равновесия. |

|
процесс протекать не может — несамопроизвольный процесс |
Иными словами, если энергия Гиббса в исходном состоянии системы больше, чем в конечном, то процесс принципиально может протекать, если наоборот — то не может. Речь идёт исключительно о принципиальной возможности протекания реакции. В реальных же условиях реакция может не начинаться и при соблюдении неравенства 
Изотерма Вант-Гоффа[править | править код]
Изотерма Вант-Гоффа — соотношение, связывающее изменение свободной энергии Гиббса 

где 

Solid — твердое
Liquid — жидкое
Gas — газообразное
Вообще говоря, любая реакция может быть рассмотрена как обратимая (даже если на практике она таковой не является). При этом константа равновесия определяется как
где 

Историческая справка[править | править код]
Энергия Гиббса названа в честь одного из основателей термодинамики, Джозайи Уилларда Гиббса.
Примечания[править | править код]
- ↑ Стромберг А. Г., Семченко Д. П. Физическая химия: учебник для хим. спец. вузов. — 6-е изд. — М.: Высшая школа, 2006. — 527 с.
- ↑ Desmos.
Литература[править | править код]
- Ахметов Н. С. Актуальные вопросы курса неорганической химии. — М.: Просвещение, 1991. — 495 с. — ISBN 5-09-002630-0.
- Базаров И. П. Термодинамика. — М.: Высшая школа, 1991. — 376 с. — ISBN 5-06-000626-3.
- Ландау Л. Д., Лифшиц Е. М. Статистическая физика. Часть 1. — Издание 3-е, доп. — М.: Наука, 1976. — 584 с. — («Теоретическая физика», том V).
См. также[править | править код]
- Термодинамический потенциал
- Свободная энергия Гельмгольца
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Понятие энтропии
Абсолютная энтропия веществ и изменение энтропии в процессах
Стандартная энтропия
Стандартная энтропия образования
Энергия Гиббса
Стандартная энергия Гиббса образования
Энтальпийный, энтропийный фактор и направление процесса
Примеры решения задач
Задачи для самостоятельного решения
Понятие энтропии
Энтропия S – функция состояния системы. Энтропия характеризует меру неупорядоченности (хаотичности) состояния системы. Единицами измерения энтропии являются Дж/(моль·К).
Абсолютная энтропия веществ и изменение энтропии в процессах
При абсолютном нуле температур (Т = 0 К) энтропия идеального кристалла любого чистого простого вещества или соединения равна нулю. Равенство нулю S при 0 К позволяет вычислить абсолютные величины энтропий веществ на основе экспериментальных данных о температурной зависимости теплоемкости.
Изменение энтропии в процессе выражается уравнением:
ΔS = S(прод.) – S(исх.)
где S(прод.) и S(исх.) – соответственно абсолютные энтропии продуктов реакции и исходных веществ.
На качественном уровне знак S реакции можно оценить по изменению объема системы ΔV в результате процесса. Знак ΔV определяется по изменению количества вещества газообразных реагентов Δnг. Так, для реакции
CaCO3(к) = CaO(к) + CO2(г)
(Δnг = 1) ΔV > 0, значит, ΔS > 0.
Для реакции:
С(графит) + 2Н2(г) = СН4(г)
(Δnг = -1) ΔV < 0, следовательно и ΔS < 0.
Стандартная энтропия
Величины энтропии принято относить к стандартному состоянию. Чаще всего значения S рассматриваются при Р = 101,325 кПа (1 атм) и температуре Т = 298,15 К (25оС). Энтропия в этом случае обозначается Sо298 и называется стандартной энтропией при Т = 298,15 К. Следует подчеркнуть, что энтропия вещества S (Sо) увеличивается при повышении температуры.
Стандартная энтропия образования
Стандартная энтропия образования ΔSоf,298 (или ΔSообр,298) – это изменение энтропии в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии.
Энергия Гиббса
Энергия Гиббса G – функция состояния системы. Энергия Гиббса равна:
G = Н – ТS.
Абсолютное значение энергии Гиббса определить невозможно, однако можно вычислить изменение δG в результате протекания процесса.
Критерий самопроизвольного протекания процесса: в системах, находящихся при Р, Т = const, самопроизвольно могут протекать только процессы, сопровождающиеся уменьшением энергии Гиббса (ΔG < 0). При достижении равновесия в системе ΔG = 0.
Стандартная энергия Гиббса образования
Стандартная энергия Гиббса образования δGоf,298 (или δGообр,298) – это изменение энергии Гиббса в процессе образования данного вещества (обычно 1 моль), находящегося в стандартном состоянии, из простых веществ, также находящихся в стандартном состоянии, причем простые вещества пристутствуют в наиболее термодинамически устойчивых состояниях при данной температуре.
Для простых веществ, находящихся в термодинамически наиболее устойчивой форме, δGоf,298 = 0.
Энтальпийный, энтропийный фактор и направление процесса
Проанализируем уравнение ΔGоТ = ΔНоТ — ΔТSоТ. При низких температурах ТΔSоТ мало. Поэтому знак ΔGоТ определяется в основном значением ΔНоТ (энтальпийный фактор). При высоких температурах ТΔSоТ – большая величина, знак Δ GоТ определяется и энтропийным фактором. В зависимости от соотношения энтальпийного (ΔНоТ) и энтропийного (ТΔSоТ) факторов существует четыре варианта процессов.
-
-
- Если ΔНоТ < 0, ΔSоТ > 0, то ΔGоТ < 0 всегда (процесс может протекать самопроизвольно при любой температуре).
- Если ΔНоТ > 0, ΔSоТ < 0, то ΔGоТ > 0 всегда (процесс не протекает ни при какой температуре).
- Если ΔНоТ < 0, ΔSоТ < 0, то ΔGоТ < 0 при Т < ΔНо/ΔSо (процесс идет при низкой температуре за счет энтальпийного фактора).
- Если ΔНоТ > 0, ΔSоТ > 0, то ΔGоТ < 0 при Т > ΔНо/ ΔSо (процесс идет при высокой температуре за счет энтропийного фактора).
-
Примеры решения задач
Задача 1. Используя термодинамические справочные данные, вычислить при 298,15 К изменение энтропии в реакции:
4NH3(г) + 5O2(г) = 4NО(г) + 6H2O(ж)
Объяснить знак и величину ΔSо.
Решение. Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | NH3(г) | O2(г) | NО(г) | H2O(ж) |
| Sо298,
Дж/(моль·К) |
192,66 | 205,04 | 210,64 | 69,95 |
ΔSох.р.,298 = 4Sо298(NО(г) ) + 6Sо298(H2O(ж)) — 4Sо298(NH3(г)) — 5Sо298(O2(г)) = 4× 210,64 + 6× 69,95 — 4× 192,66 — 5× 205,04 = — 533,58 Дж/К
В данной реакции ΔV < 0 (Δnг = — 5), следовательно и ΔSoх.р.,298 < 0, что и подтверждено расчетом.
Задача 2. Используя справочные термодинамические данные, рассчитать стандартную энтропию образования NH4NO3(к). Отличается ли стандартная энтропия образования NH4NO3(к) от стандартной энтропии этого соединения?
Решение. Стандартной энтропии образования NH4NO3 отвечает изменение энтропии в процессе:
N(г) + 2H2(г) + 3/2O2(г) = NH4NO3(к); δSоf,298(NH4NO3(к)) = ?
Значения стандартных энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2(г) | H2(г) | O2(г) | NH4NO3(к) |
| Sо298,
Дж/(моль·К) |
191,50 | 130,52 | 205,04 | 151,04 |
ΔSох.р.,298 = ΔSоf,298(NH4NO3(к)) = Sо298(NH4NO3(к)) — Sо298(N2(г)) — 2Sо298(H2(г)) – 3/2Sо298(O2(г)) = 151,04–191,50 —— 2× 130,52–3/2× 205,04 = — 609,06 Дж/(моль·К).
Стандартная энтропия образования NH4NO3(к), равная — 609,06 Дж/(моль·К), отличается от стандартной энтропии нитрата аммония Sо298(NH4NO3(к)) = +151,04 Дж/(моль·К) и по величине, и по знаку. Следует помнить, что стандартные энтропии веществ Sо298 всегда больше нуля, в то время как величины ΔS0f,298, как правило, знакопеременны.
Задача 3. Изменение энергии Гиббса реакции:
2Н2(г) + О2(г) = 2 Н2О(ж)
равно δGо298= –474,46 кДж. Не проводя термодинамические расчеты, определить, за счет какого фактора (энтальпийного или энтропийного) протекает эта реакция при 298 К и как будет влиять повышение температуры на протекание этой реакции.
Решение. Поскольку протекание рассматриваемой реакции сопровождается существенным уменьшением объема (из 67,2 л (н.у.) исходных веществ образуется 36 мл жидкой воды), изменение энтропии реакции ΔSо<0. Поскольку ΔGо298 реакции меньше нуля, то она может протекать при температуре 298 К только за счет энтальпийного фактора. Повышение температуры уменьшает равновесный выход воды, поскольку ТΔSо<0.
Задача 4. Используя справочные термодинамические данные, определить может ли при 298,15 К самопроизвольно протекать реакция:
С4Н10(г) = 2С2Н4(г) + Н2(г)
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | С4Н10(г) | С2Н4(г) | Н2(г) |
| ΔGоf,298× , кДж/моль | — 17,19 | 68,14 | 0 |
| Sо298, Дж/(моль·К) | 310,12 | 219,45 | 130,52 |
ΔGох.р.,298 = 2ΔGоf,298(С2Н4(г)) + ΔGоf,298(Н2(г)) — ΔGоf,298(С4Н10(г)) = 2× 68,14 + 17,19 = 153,47 кДж.
ΔGох.р.,298 > 0, следовательно, при Т = 298,15 К реакция самопроизвольно протекать не будет.
ΔSох.р.,298 = 2Sо298(С2Н4(г)) + Sо298(Н2(г)) — Sо298(С4Н10(г)) = 2× 219,45 + 130,52 – 310,12 = +259,30 Дж/К.
Поскольку ΔSох.р.,298 > 0, то при температуре Т>ΔНо/ΔSо величина ΔGох.р.,298 станет величиной отрицательной и процесс сможет протекать самопроизвольно.
Задача 5. Пользуясь справочными данными по ΔGоf,298 и Sо298, определите ΔHо298 реакции:
N2O(г) + 3H2(г) = N2H4(г) + H2O(ж)
Решение. Значения стандартных энергий Гиббса и энтропий исходных веществ и продуктов реакции приведены ниже:
| Вещество | N2O(г) | H2(г) | N2H4(г) | H2O(ж) |
| ΔGоf,298, кДж/моль | 104,12 | 0 | 159,10 | -237,23 |
| Sо298, Дж/(моль·К) | 219,83 | 130,52 | 238,50 | 69,95 |
ΔGох.р.,298 = ΔGоf,298(N2H4(г)) + ΔGоf,298(H2O(ж)) – ΔGоf,298(N2O(г)) – 3ΔGоf,298(H2(г)) = 159,10 + (–237,23) – 104,12 – 0 = –182,25 кДж.
ΔSох.р.,298 = Sо298(N2H4(г)) + Sо298(H2O(ж)) – Sо298(N2O(г)) — 3Sо298(H2(г)) = 238,50 + 69,95 – 219,83 –3× 130,52 = –302,94 Дж/К.
ΔGо298 = ΔНо298 – ТΔSо298. Подставляя в это уравнение величины ΔНо298 и ТΔSо298, получаем:
ΔНо298 = –182,25× 103 + 298·(–302,94) = –272526,12 Дж = – 272,53 кДж.
Следует подчеркнуть, что поскольку ΔSо298 выражена в Дж/(моль× К), то при проведении расчетов ΔG0298 необходимо также выразить в Дж или величину ΔS0298 представить в кДж/(мольK).
Задачи для самостоятельного решения
1. Используя справочные данные, определите стандартную энтропию образования ΔSоf,298 NaHCO3(к).
2. Выберите процесс, изменение энергии Гиббса которого соответствует стандартной энергии Гиббса образования NO2(г):
а) NO(г) + 1/2O2(г) = NO2(г);
б) N2(г) + 2O2(г) = 2NO2(г);
в) 1/2N2(г) + O2(г) = NO2(г);
г) N(г) + O2(г) = NO2(г).
3. Используя справочные данные, вычислите при 298,15 К изменение энтропии в реакции:
2NH4NO3(к) = 2N2(г) + 4H2O(г) + О2(г).
Объясните знак и величину ΔSº реакции.
-
- .
|
δSох.р.,298 =1040,84 Дж/К. В данной реакции δV > 0 (D nг = 7), |
4. Используя справочные данные, определите принципиальную возможность протекания реакции при 298,15 К:
NiO(к) + C(графит) = Ni(к) + CO(г)
Если реакция не будет самопроизвольно протекать при 298,15 К, оценить возможность ее протекания при более высоких температурах.
|
ΔGох.р.,298 = 74,45 кДж > 0, следовательно, при Т = 298,15 К |
5. Рассчитайте стандартную энергию Гиббса образования ΔGоf,298 C2H5OH(ж), используя справочные данные о величинах ΔНоf,298 и Sо298.
6. Используя справочные данные, определите стандартную энтропию образования ΔSоf,298 K2Cr2O7(к).
7. На основе расчетов термодинамических величин покажите, чем эффективнее восстанавливать при 298 К Cr2O3(к) до металла — алюминием или магнием:
1) Cr2O3(к) + 3Mg(к) = 3MgO(к) + 2Cr(к); ΔGо1;
2) Cr2O3(к) + 2Al(к) = Al2O3(к) + 2Cr(к); ΔGо2.
|
ΔGо1=-648,9 кДж; ΔGо2=-523,3 кДж. |
8. Используя справочными данными по величинам Sо298, определите возможность самопроизвольного протекания в изолированной системе при 298 К процесса:
KClO3(к) = KCl(к) + 3/2O2(к)
|
ΔSо298=247,1 Дж/К. |
9. Используя справочные данные, вычислите при 298 К изменение энтропии в процессе:
Н2(г) + 1/2О2(г) = Н2О(г)
10. На основе справочных данных оценить температуру восстановления WO3(к) водородом:
WO3(к) + 3H2(г) = W(к) + 3H2O(г).
Биохимические
реакции обычно происходят при изобарно-
изотермических условиях. В этих условиях
энергетическое состояние системы
характеризуется энтальпией, а мерой
неупорядоченности системы будет
произведение температуры и энтропии.
Функцией, учитывающей обе эти характеристики
и противоположность в тенденции их
изменения при самопроизвольных процессах,
является свободная
энергия Гиббса.
Энергия
Гиббса (или изобарно – изотермический
потенциал) является обобщенной функцией
состояния системы, учитывающей энергетику
и неупорядоченность системы при изобарно
– изотермических условиях.
Названа она в честь одного из основателей
химической термодинамики, американского
ученого Джозайи Уилларда Гиббса (1839 –
1903).
Изменение
энергии Гиббса для биохимических
процессов в условиях, отличных от
стандартных, можно рассчитать на основе
экспериментальных значений ∆Н и ∆S
для этих процессов по уравнению:
∆G
=∆Н – Т∆S,
где
∆Н – характеризует полное изменение
энергии системы при p,T
= const и отражает стремление
системы к минимуму энергии (энтальпийный
фактор);
Т∆S
– характеризует ту часть энергии,
которую нельзя превратить в работу, и
отражает стремление системы к максимуму
неупорядоченности (энтропийный фактор);
∆G – характеризует ту часть энергии,
которую можно перевести в работу, и
является термодинамическим критерием
самопроизвольного протекания любых
процессов при p,T=const.
Если в уравнение для расчета свободной
энергии Гиббса ввести значение ∆Н°р.и ∆S°р., найденные
с использованием следствия из закона
Гесса, то мы получаем формулу для расчета
∆G реакции, протекающей в стандартных
условиях:
∆G°p.f=∑νj∆G°j
– ∑νi∆G°i
где ∆G°j, ∆G°i– значения энергии Гиббса продуктов
реакции и исходных веществ, νj,νi
– соответствующие стехиометрические
коэффициенты в уравнении химической
реакции.
В термодинамических расчетах используют
значения энергии Гиббса, измеренные
при стандартных условиях (∆G°, кДж/моль).
Данные величины приведены в справочниках
термодинамических величин. Для простых
веществ в термодинамически устойчивой
форме стандартная энергия Гиббса их
образования принята равной нулю.
Таблица 12.
Значение ∆G°f
298некоторых соединений.
|
Молекулярная формула |
∆G°f 298, |
Молекулярная формула |
∆G°f 298, |
|
О2 |
0 |
HF(г) |
-275.41 |
|
НCl(г) |
-95.3 |
HI(г) |
1.58 |
|
H2O(ж) |
-228.61 |
CH4 |
-50.85 |
|
CO2(г) |
-394.37 |
C6H6(ж) |
124.38 |
|
CO(г) |
-137.15 |
NO2 |
52.29 |
|
NO(г) |
87.58 |
NH3 |
-16.48 |
|
HCN(г) |
121.58 |
NaСl(кр.) |
-384.13 |
Рассчитав ∆G химической реакции, можно
не производя экспериментов, дать ответ
о принципиальной (термодинамической)
возможности (или невозможности) ее
протекания:
∆G<0 – реакция протекает самопроизвольно;
∆G=0 – реакция находится в состоянии
равновесия;
∆G>0 – несамопроизвольная реакция
(самопроизвольна обратная реакция).
Знак ∆G, а значит, и самопроизвольность
реакции зависит от величины соотношения
∆Н и Т∆S. Самопроизвольное осуществление
реакции (∆G<0) возможно в следующих
случаях:
-
∆Н<0 (экзотермический процесс) и в то
же время |∆Н |>| Т∆S |, т.е. при
экзотермических процессах знаки ∆Н
и ∆G совпадают, что означает возможность
протекания процесса независимо от
знака ∆S; -
∆Н>0 (эндотермический процесс) и |∆Н
|<| Т∆S |, тогда возрастание энтальпии
компенсируется значительно большим
ростом энтропийного фактора, что
осуществимо при высоких температурах
или при реакциях с участием газовой
фазы, когда наблюдается значительное
увеличение энтропии. Этим и объясняется
возможность протекания эндотермических
реакций, что не согласуется с принципом
Бертло о самопроизвольности только
экзотермических реакций. Судить о
направлении процесса по знаку изменения
энтальпии в соответствии с этим признаком
можно лишь: а) при низких температурах
(при Т→0, Т∆S→0, и Т∆S<< ∆Н), когда
знаки изменения свободной энергии и
энтальпии совпадают; б) в конденсированных
системах, в которых в процессе
взаимодействия энтропия меняется
незначительно, (беспорядок не может
существенно возрасти, если, например,
одно кристаллическое вещество
превращается в другое кристаллическое
вещество). Поэтому при низких температурах
и в конденсированных системах возможно
лишь протекание экзотермических реакций
(∆G<0, когда ∆Н<0).
Возможность протекания реакции в
зависимости от знака ∆Н и ∆S и температуры
суммарно можно выразить в таблице:
Таблица 13.
|
Знак ∆Н |
Знак ∆S |
Знак ∆G |
Самопроизвольность реакции |
Пример |
|
– |
+ |
Всегда «-» |
Самопроизвольна |
2О3 |
|
+ |
– |
Всегда |
Несамопроизвольна при любых температурах |
3О2 |
|
– |
– |
«-» «+» |
Самопроизвольна при низких температурах, |
2Н2 →2Н2О(г) |
|
+ |
+ |
«+» при низких температурах, «-» при высоких температурах |
Несамопроизвольна при низких |
2Н2О(г)→ →2Н2 |
Второй
закон термодинамики для любых систем
формулируется следующим образом:
В
системе при постоянной температуре и
давлении самопроизвольно могут
совершаться только такие процессы, в
результате которых энергия Гиббса
уменьшается, т.е. ΔGкон
>
ΔGнач,
или ΔG
< 0.
Для закрытых термодинамических систем
наряду со свободной энергией Гиббса ∆G(изобарно-изотермический потенциал) в
изохорных условиях (V=const) применяют функцию
состояния системыэнергию Гельмгольца
(F) (изохорно
– изотермический потенциал).
В химии энергия Гиббса имеет более
широкое применение, чем энергия
Гельмгольца, так как химические процессы
чаще протекают при постоянном давлении,
а не при постоянном объеме.
Энергия Гельмгольца находится по
формуле:
F=U–T∙S,
гдеU- внутренняя энергия
системы
Энергия Гельмгольца характеризует
работоспособность системы, т.е. определяет
ту часть энергии, которая в
изохорно-изотермическом процессе
превращается в работу.
Энергию Гиббса можно выразить через
энергию Гельмгольца следующим образом:
G=U+pV–TS=F+pV
Оба рассмотренных термодинамических
потенциала являются функциями состояния,
зависят от природы веществ – участников
реакции, их массы и температуры. Кроме
того, энергия Гиббса зависит от давления,
а энергия Гельмгольца – от объема
системы. Абсолютные значения
термодинамических потенциалов неизвестны,
а для расчетов пользуются обычно
изменениями потенциалов (∆Gи ∆F).
Соседние файлы в предмете Химия
- #
- #
…
Здесь вы найдете примеры задач на вычисление таких термодинамических параметров как энтальпия, энтропия, энергия Гиббса. Определение возможности самопроизвольного протекания процесса, а также составление термохимических уравнений.
Задачи к разделу Основы термодинамики с решениями
Задача 1. Рассчитайте стандартную энтальпию и стандартную энтропию химической реакции. Определите в каком направлении при 298 °К (прямом или обратном) будет протекать реакция. Рассчитайте температуру, при которой равновероятны оба направления реакции.
Fe2O3 (к) + 3H2 = 2Fe(к) + 3H2O(г)
Показать решение »
Решение.
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
Используя справочные данные стандартных энтальпий веществ, находим:
ΔHр-ции = 2·ΔH0Fe+3·ΔH0H2O— ΔH0Fe2O3 — 3·ΔH0H2= 2·0 + 3·(- 241,82) – (-822,16) — 3·0 = 96,7 кДж/моль
ΔSр-ции=ΣS0кон – ΣS0исх Дж/(моль·K)
Используя справочные данные стандартных энтропий веществ, находим:
ΔSр-ции = 2·ΔS0Fe + 3·ΔS0H2O — ΔS0Fe2O3 — 3·ΔS0H2= 2·27,15 + 3·188,7 – 89,96 — 3·131 = 137,44 Дж/(моль·K)
ΔG = ΔH – TΔS= 96,7 – 298 ·137,44 /1000 = 55,75 кДж/моль
При Т=298°К, ΔG > 0 – реакция не идет самопроизвольно, т.е. реакция будет протекать в обратном направлении.
Чтобы рассчитать температуру, при которой равновероятны оба направления реакции, надо ΔG приравнять к нулю:
ΔG = ΔH – TΔS = 0, тогда
T= — (ΔG – ΔH) / ΔS= — (0-96,7)/0,137 = 705,83 K
При Т = 705,83 К реакция будет идти равновероятно как в прямом так и в обратном направлении.
Задача 2. Вычислите энергию Гиббса и определите возможность протекания реакции при температурах 1000 и 3000 К.
| Cr2O3 (т) + 3C (т) = 2Cr (т) + 3CO (г) | |||||
| ΔH298, кДж/моль | — 1141 | 0 | 0 | — 110,6 | |
| ΔS298, Дж/(моль×К) | 81,2 | 5,7 | 23,6 | 197,7 |
Показать решение »
Решение.
Вычисления энергии Гиббса проводим согласно выражению:
ΔGр-ции = ΔHр-ции – TΔSр-ции
Необходимо рассчитать энтальпию и энтропию химической реакции.
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
Используя справочные данные стандартных энтальпий веществ, находим:
ΔHр-ции= 2·ΔH0Cr + 3·ΔH0CO — ΔH0Cr2O3 — 3·ΔH0C= 2·0 + 3·(- 110,6) – (-1141) — 3·0 = 809,2 кДж/моль
ΔSр-ции=ΣS0кон – ΣS0исх Дж/моль·K
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
ΔSр-ции= 2·ΔS0Cr + 3·ΔS0CO — ΔS0Cr2O3 — 3·ΔS0C= 2·23,6 + 3·197,7 – 81,2 — 3·5,7 = 542 Дж/(моль·K)
Найдем энергию Гиббса при 1000 К
ΔG1000 = ΔH – TΔS= 809,2 – 1000 ·542 /1000 = 267,2 кДж/моль
ΔG1000 > 0, следовательно, реакция самопроизвольно не идет.
Найдем энергию Гиббса при 3000 К
ΔG3000= ΔH – TΔS = 809,2 – 3000 ·542 /1000 = — 816,8 кДж/моль
ΔG3000 ˂ 0, следовательно, реакция протекает самопроизвольно.
Задача 3. Определите тепловой эффект сгорания жидкого CS2(ж) до образования газообразных СО2 и SO2. Сколько молей CS2 вступят в реакцию, если выделится 700 кДж тепла?
Показать решение »
Решение.
Уравнение реакции сгорания жидкого сероуглерода следующее:
CS2(ж) + 3O2 = СО2 + 2SO2
Тепловой эффект реакции вычислим подставляя справочные данные стандартных энтальпий веществ в выражение:
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
ΔHр-ции= 2·ΔH0SO2 + ΔH0CO2 — ΔH0CS2 — 3·ΔH0O2 = 2·(-296,9) + 3·(- 393,5) – 87 — 3·0 = -1075,1 кДж/моль
Т.е. при сгорании 1 моля сероуглерода выделяется 1075,1 кДж тепла
а при сгорании x молей сероуглерода выделяется 700 кДж тепла
Найдем х:
x = 700·1/1075,1 = 0,65 моль
Итак, если в результате реакции выделится 700 кДж тепла, то в реакцию вступят 0,65 моль CS2
Задача 4. Вычислите тепловой эффект реакции восстановления оксида железа (II) водородом, исходя из следующих термохимических уравнений:
1. FeO (к) + CO (г) = Fe (к) + CО2 (г); ΔH1 = -18,20 кДж;
2. СO (г) + 1/2O2 (г) = СO2 (г) ΔН2 = -283,0 кДж;
3. H2 (г) + ½ O2 (г) = H2O (г) ΔН3 = -241,83 кДж.
Показать решение »
Решение.
Реакция восстановления оксида железа (II) водородом имеет следующий вид:
4. FeO (к) + H2 (г) = Fe (к) + H2O (г)
Чтобы вычислить тепловой эффект реакции необходимо применить закон Гесса, т.е. реакцию 4. можно получить, если сложить реакции 1. и 2. и вычесть реакцию 1.:
ΔHр-ции = ΔH1 + ΔH3 – ΔH2 = -18,2 – 241,3 + 283 = 23 кДж
Таким образом, тепловой эффект реакции восстановления оксида железа (II) водородом равен
ΔHр-ции = 23 кДж
Задача 5. Реакция горения бензола выражается термохимическим уравнением:
С6Н6(ж) + 7½ О2(г) = 6СО2(г) + 3Н2О(г) – 3135,6 кДж.
Вычислите теплоту образования жидкого бензола. Определите теплотворную способность жидкого бензола при условии, что стандартные условия совпадают с нормальными.
Показать решение »
Решение.
Тепловой эффект реакции равен:
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
В нашем случае ΔHр-ции = – 3135,6 кДж, найдем теплоту образования жидкого бензола:
ΔHр-ции= 6·ΔH0СO2 + 3·ΔH0H2O — ΔH0C6H6 – 7,5·ΔH0O2
-ΔH0C6H6 = ΔHр-ции — 3·(-241,84) + 6·(- 393,51) – 7,5·0 = — 3135,6 — 3·(-241,84) + 6·(- 393,51) – 7,5·0 = — 49,02 кДж/моль
ΔH0C6H6 = 49,02 кДж/моль
Теплотворная способность жидкого бензола вычисляется по формуле:
QТ = ΔHр-ции · 1000 / М
М(бензола) = 78 г/моль
QТ = – 3135,6· 1000 / 78 = — 4,02·104 кДж/кг
Теплотворная способность жидкого бензола QТ = — 4,02·104 кДж/кг
Задача 6. Реакция окисления этилового спирта выражается уравнением:
С2Н5ОН(ж) + 3,0 О2(г) = 2СО2(г) + 3Н2О(ж).
Определить теплоту образования С2Н5ОН(ж), зная ΔН х.р. = — 1366,87 кДж. Напишите термохимическое уравнение. Определите мольную теплоту парообразования С2Н5ОН(ж) → С2Н5ОН(г), если известна теплота образования С2Н5ОН(г), равная –235,31 кДж·моль-1.
Показать решение »
Решение.
Исходя из приведенных данных, запишем термохимическое уравнение:
С2Н5ОН(ж) + 3О2(г) = 2СО2(г) + 3Н2О(ж) + 1366,87 кДж
Тепловой эффект реакции равен:
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
В нашем случае ΔHр-ции = – 1366,87 кДж.
Используя справочные данные теплот образования веществ, найдем теплоту образования С2Н5ОН(ж):
ΔHр-ции= 2·ΔH0СO2 + 3·ΔH0H2O — ΔH0C2H5OH(ж) – 3·ΔH0O2
– 1366,87 =2·(-393,51)+ 3·(-285,84) — ΔH0C2H5OH – 3·0
ΔH0C2H5OH(ж) = -277,36 кДж/моль
ΔH0C2H5OH(г) = ΔH0C2H5OH(ж) + ΔH0парообразования
ΔH0парообразования = ΔH0C2H5OH(г) — ΔH0C2H5OH(ж)
ΔH0парообразования = — 235,31 + 277,36 = 42,36 кДж/моль
Мы определили, что теплота образования С2Н5ОН(ж) равна
ΔH0C2H5OH(ж) = -277,36 кДж/моль
и мольная теплота парообразования С2Н5ОН(ж) → С2Н5ОН(г) равна
ΔH0парообразования = 42,36 кДж/моль
Задача 7. Чем можно объяснить, что при стандартных условиях, невозможна экзотермическая реакция:
СО2 (г)+Н2 (г) ↔ СО (г)+Н2О (ж)?
Рассчитайте ΔG данной реакции. При каких температурах данная реакция становится самопроизвольной?
Показать решение »
Решение.
Рассчитаем ΔG данной реакции:
ΔG = ΔH – TΔS
Для этого сначала определим ΔH и ΔS реакции:
ΔHр-ции = ΣH0кон – ΣH0исх кДж/моль
Используя справочные данные стандартных энтальпий веществ, находим:
ΔHр-ции= ΔH0H2O(ж) + ΔH0CO — ΔH0CО2 — ΔH0Н2 = -110,5 + (-285,8) – (393,5) — 0 = -2,8 кДж/моль
ΔSр-ции=ΣS0кон – ΣS0исх Дж/(моль·K)
Аналогично, используя справочные данные стандартных энтропий веществ, находим:
ΔSр-ции= ΔS0H2O(ж) + ΔS0CO — ΔS0CО2 — ΔS0Н2 = 197,5 + 70,1 — 213,7 — 130,52 = -76,6 Дж/(моль·K)
Найдем энергию Гиббса при стандартных условиях
ΔGр-ции= ΔH – TΔS= -2,8 + 298 · 76,6 /1000 = 20 кДж/моль> 0,
следовательно, реакция самопроизвольно не идет.
Найдем при каких температурах данная реакция становится самопроизвольной.
В состоянии равновесия ΔGр-ции= 0, тогда
T = ΔH/ΔS = -2,8/(-76,6·1000) = 36,6 К
Задача 8. Рассчитав на основании табличных данных ΔG и ΔS, определите тепловой эффект реакции:
2 NO (г) + Cl2 (г) ↔ 2 NOCl(г).
Показать решение »
Решение.
При постоянных температуре и давлении, изменение энергии Гиббса связано с энтальпией и энтропией выражением:
ΔG = ΔH – TΔS
На основании табличных данных рассчитаем ΔG и ΔS
ΔG0р-ции = Σ ΔG0прод — Σ ΔG0исх
ΔGр-ции = 2·ΔG0NOCl(г) — 2·ΔG0NO(г) — ΔG0Cl2(г)
ΔGр-ции = 2· 66,37 — 2· 89,69 – 0 = — 40,64 кДж/моль
ΔGр-ции < 0, значит реакция самопроизвольна.
ΔSр-ции=ΣS0кон – ΣS0исх Дж/(моль·K)
ΔSр-ции = 2·ΔS0NOCl(г) — 2·ΔS0NO(г) — ΔS0Cl2(г)
ΔSр-ции = 2· 261,6 — 2· 210,62 – 223,0 = -121,04 Дж/(моль·K)
Найдем ΔH:
ΔH = ΔG + TΔS
ΔH = — 40,64 + 298 · (-121,04/1000) = — 76,7 кДж/моль
Тепловой эффект реакции ΔH = — 76,7 кДж/моль
Задача 9. С чем будет более интенсивно взаимодействовать газообразный хлористый водород (в расчете на 1 моль): с алюминием или с оловом? Ответ дайте, рассчитав ΔG0 обеих реакций. Продуктами реакций являются твердая соль и газообразный водород.
Показать решение »
Решение.
Рассчитаем ΔG0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с алюминием
2Al(т) + 6HCl (г) = 2AlCl3 (т) + 3H2
ΔG0р-ции = Σ ΔG0прод — Σ ΔG0исх кДж/моль
ΔG0р-ции1 = 2·ΔG0AlCl3 (т) + 3·ΔG0H2 — 2·ΔG0Al (т) — 6·ΔG0HCl(г)
ΔG0р-ции1 = 2· (-636,8) + 3·0— 2·0— 6·(-95,27) = -701,98 кДж/моль
В реакции принимает участие 2 моль Al(т), тогда ΔGр-ции1 1 моля Al(т) равно
ΔG0р-ции 1 = -701,98 / 2 = -350,99 кДж/моль
Рассчитаем ΔG0 для реакции взаимодействия газообразного хлористого водорода (в расчете на 1 моль) с оловом:
Sn(т) + 2HCl (г) = SnCl2(т) + H2
ΔG0р-ции2 =ΔG0SnCl2 (т) + ΔG0H2 — ΔG0Sn (т) — 2·ΔG0HCl(г)
ΔG0р-ции 2 = -288,4 + 0- 0- 2·(-95,27) = -97,86 кДж/моль
Обе реакции имеют ΔG0<0, поэтому они протекают самопроизвольно в прямом направлении, но более интенсивно взаимодействовать газообразный хлористый водород будет с алюминием, т.к
ΔG0р-ции 1 ˂ ΔG0р-ции 2
Задача 10. Не прибегая к вычислениям, определите, какие знаки (>0, <0, ≅0) имеют ΔG, ΔH и ΔS для протекающей в прямом направлении реакции:
4 НBr (г) + O2(г) ↔ 2 H2O(г) + 2 Br2(г)
Как повлияет повышение температуры на направленность химической реакции?
Показать решение »
Решение.
При постоянных температуре и давлении изменение энергии Гиббса связано с энтальпией и энтропией выражением:
ΔG = ΔH – TΔS
Энтропия – мера беспорядочности системы. Значение энтропии тем больше, чем больше беспорядок в системе (больше газообразных веществ). В данной реакции количество молей газов в правой части равно – 5, а в левой – 4, значит энтропия системы уменьшается ΔS˂0.
По условию задачи реакция протекает в прямом направлении, следовательно ΔG˂0.
В обычных условиях TΔS ˂˂ ΔH, поэтому в данном случае ΔH˂0 – реакция экзотермическая.
При повышении температуры может настать момент, когда значения TΔS и ΔH станут одинаковыми, тогда система придет в равновесие ΔG=0. Если температуру повысить значительно, то будет преобладать энтропийный фактор TΔS, тогда реакция самопроизвольно протекать уже не будет ΔG>0.
Расчет энергии Гиббса и энтропии химической реакции
Вычисление энергии Гиббса
Задание 101.
Вычислите 
а) 2NaF (к) + Cl2 (г) = 2NaCl (к) + F2
б) PbO2 (к) + 2Zn (к) = Pb (к) + 2ZnO (к)
Можно ли получить фтор по реакции (а) и восстановить РbO2 цинком по реакции (б). Ответ: +313,94 кДж; -4 17,4 кДж.
Решение:
Реакция имеет вид:
2NaF (к) + Cl2 (г) = 2NaCl (к) + F2
Для вычисления энергии Гиббса прямой реакции используются значения 






То, что 
б) Реакция имеет вид:
PbO2 (к) + 2Zn (к) = Pb (к) + 2ZnO (к)
Находим 



То, что 
Ответ: +313,94 кДж; -4 17,4 кДж.
Равновесие системы
Задание 102.
При какой температуре наступит равновесие системы
4НСI (г) + 02 (г) = 2Н2О (г) + 2С12 (г); 
Хлор или кислород в этой системе является более сильным окислителем и при какой температуре? Ответ: 891 К.
Решение:
Уравнение реакции имеет вид:
4НСI (г) + O2 (г) = 2Н2О (г) + 2С12 (г); 

Находим 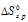
Для данной реакции:






Зная 




При 

Тогда
Т = 

Находим энергии Гиббса реакции:



Так как 
Ответ: 891 К.
Задание 103.
Восстановление Fe3O4 оксидом углерода идет по уравнению
Fe3O4 (к) + СО (г) = 3ЕеО (к) + СO2 (г)
Вычислите 

Решение:
Реакция имеет вид:
Fe3O4 (к) + СО (г) = 3ЕеО (к) + СO2 (г)
Для вычисления энергии Гиббса прямой реакции используются значения соответствующих веществ, приведённых в специальных таблицах. Зная, что есть функция состояния и, что для простых веществ, находящихся в устойчивом при стандартных условиях агрегатных состояниях, равны нулю, находим , получим:






То, что 
Находим 
Для данной реакции:






Ответ. +24,19 кДж; + 31,34 Дж/(моль . К).
Энтропия системы
Задание 104.
Реакция горения ацетилена идет по уравнению
С2Н2 (г) + 5/2О2 (г) = 2СО2 (г) + Н2О (ж)
Вычислите 
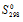
Решение:
Реакция имеет вид:
С2Н2 (г) + 5/2О2 (г) = 2СО2 (г) + Н2О (ж)
Для вычисления энергии Гиббса прямой реакции используются значения 









Энтропия (
Значения 
Для данной реакции:


Уменьшение энтропии объясняется тем, что система в результате реакции переходит в более устойчивое состояние, так как из 3,5 объёмов газообразных веществ происходит образование 2 объёмов газообразных веществ и образуется 1 моль жидкого вещества, т. е. объём системы уменьшается, и агрегатное состояние вещества упорядочивается, 
Ответ: -1235,15 кДж; -216,15 Дж/(моль . К).
Задание 105.
Уменьшается или увеличивается энтропии при переходах: а) воды в пар; б) графита в алмаз? Почему? Вычислите 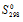
Решение:
Энтропия является свойством вещества, пропорциональным его количеству. Она обладает аддитивными свойствами, т. е. при соприкосновении систем суммируется. Энтропия отражает движение частиц вещества и является мерой неупорядоченности системы. Она возрастает с увеличением движения частиц (при нагревании, испарении, плавлении, расширении газа, при ослаблении или разрыве связей между атомами и т.п.), 

а) Изменение значений энтропии при переходе воды в пар.
При переходе воды в пар энтропия будет возрастать, потому что при испарении воды происходит увеличение движения молекул, т. е. система переходит в менее устойчивое состояние, из жидкого в газообразное, 
Уравнение реакции имеет вид:
Н2О (ж) → Н2О (г);


б) Изменение значений энтропии при переходе. При переходе графита в алмаз образуются более прочные связи между атомами углерода в алмазе, чем в графите, т. е. происходит процесс с упорядоченностью системы, упрочнение связей, что ведёт к уменьшению энтропии, 
Уравнение реакции имеет вид:
С (графит) → С (алмаз);


Значения 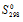
Ответ: а) 118,78 Дж(моль . К); 6) -3,25 Дж/(моль . К).
Определение энергии Гиббса реакции
Задание 106.
Чем можно объяснить, что при стандартных условиях невозможна экзотермическая реакция
Н2 (г) + СО2 (г) = СО (г) + Н2О (ж); 
Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите 
Решение:
Уравнение реакции имеет вид:
Н2 (г) + СО2 (г) = СО (г) + Н2О (ж); 
Значения 
Для данной реакции:

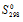
Теперь вычислим 




То, что 
Ответ: +19,91 кДж.
Задание 107.
Прямая или обратная реакция будет протекать при стандартных условиях в системе
2NO (г) + O2 (г) = 2NO2 (г)
Ответ мотивируйте, вычислив 
Решение:
Уравнение процесса:
2NO (г) + O2 (г) = 2NO2 (г)
Для вычисления энергии Гиббса прямой реакции используются значения 






То, что 
Ответ: -69,70 кДж.