28
Цель
работы – определение параметров влажного
пара
![]() которые вычисляются на основе
которые вычисляются на основе
экспериментальных данных и таблиц
термодинамических особенностей сухого
насыщенного пар и кипящей жидкости на
линии насыщения.
Процесс
преобразования воды в перегретый пар
при постоянном давлении (с подведенным
теплом) складывается из трёх последовательных
стадий: подогрев жидкости, парообразования
и перегрев пара. В процессе парообразования
осуществляется переход из кипящей воды
в сухой пар. В обратном процессе (с
отведением теплоты) имеют место такие
стадии: охлаждение перегретого пара,
конденсация, охлаждение жидкости. В
этой работе должен обратить внимание
на характерные особенности стадий и
чётко знать расчётные формулы как
отдельных из них, так и всего процесса
в целом. Первая стадия получения пара
– нагрев жидкости до кипения, процесс
1-2 при постоянном давлении (рис.12). На
начало отсчёта энтальпии для воды и
водяного пар принимают значения io=O
при
температуре О
оС
и давлении
О,101325 МПа.
Без особых
потерь для точности расчётов можно
считать, что при температуре О
оС
энтальпия не зависит от давления и
равняется нулю. Энтальпия кипящей
жидкости
![]() численно
численно
равна теплотеq
рд,
которая необходима для нагрева 1кг
жидкости в изобарном процессе от О
оС
до температуры кипения
![]() .
.
q
рд
=
![]() –
–
io=
![]()
Вычисляют энтальпию
кипящей воды по формуле:
![]() (1.1)
(1.1)
где
![]() –средняя
–средняя
теплоёмкость воды. Дж/(кг
К);
![]() –
–
температура кипения, которая зависит
от давления.
Чем
выше давление пара, тем больше температура
насыщения
![]() и энтальпияi
и энтальпияi
кипящей
жидкости, которая измеряется в джоулях
на килограмм (Дж/кг).
Энтропия кипящей жидкости:
![]()
![]() (1.2)
(1.2)
(изменение
энтропии отсчитывают от О
°С, когда
энтропия условно равна 0).
Вторая стадия –
переход кипящей жидкости в парообразное
состояние – процесс 2-4 (кипение жидкости),
существенно отличается от первой.
Процесс характеризуется не только
постоянным давлением, но и постоянной
температурой, то есть он есть
изобарно-изотермическим, при котором
давление и температура кипения
взаимозависимы.
Парообразование
начинается с момента закипания жидкости
при подведении теплоты и заканчивается
её полным испарением – состояние сухого
пара точка 4 (рис.12). Количество теплоты,
необходимое для преобразования одного
килограмма кипящей жидкости в сухой
пар при постоянном давлении называется
теплотой парообразования
![]() (Дж/кг).
(Дж/кг).
С
повышением давления теплота парообразования
уменьшается, приближаясь к нулю в
критической точке при критическом
давлении
![]()
22,13
МПа и
критической температуре
![]() 374‚15С.
374‚15С.
В
процессе кипения масса жидкости масса
жидкости уменьшается, а количество пара
увеличивается. Состояние, при котором
одновременно существуют кипящая жидкость
и сухой пар называется влажным паром,
точка 3 (рис.12). Массовое соотношение
пара с жидкостью оценивается степенью
сухости
![]() ,
,
которая составляет массовую часть пара
в пароводяной смеси, то есть отношение
массы сухого пара![]() к массе влажного пара
к массе влажного пара![]() .
.
Масса влажного пара равна сумме масс
кипящей жидкости и сухого пара![]() .
.
Очевидно, что на момент начала выпаривания
доля кипящей жидкости
![]() 0,
0,
а на при полном выпаривании для сухого
пара
![]() 1.
1.
Пар в последнем случае получил название
сухого насыщенного пара. Если выпаривание
воды не доведено до конца то есть 0![]() 1,
1,
то пар становится влажным насыщенным,
и на его образование тратится в процессе
выпаривания меньше теплоты, чем для
сухого пара.
|
|
Рис. 12
Для
влажного пара энтальпия ix
и энтропия
s
x
находятся
по формулам:
![]() ;
;
![]() ;
;
(1.3)
Изменение энтальпии
и энтропии в процессе выпаривания
![]() (1.4)
(1.4)
Энтальпия
и энтропия сухого насыщенного пара при
x=1
составляют
![]() ;
;![]()
![]() (1.5)
(1.5)
Третья
стадия – перегрева пара – осуществляется
при дополнительной подачи теплоты до
сухого насыщенного пара, процесс 4-5
(рис.12). В этом случае между давлением
пар и его температурой существует
полнейшая независимость: мы можем
нагреть пар выше температуры насыщения
![]() ,
,
до любой заданной температурыtпп
=![]() .
.
Перегретый пар приобретает особенности
близкие к идеальному газу. Теплоту
перегрева рассчитывают по формуле
![]() , (1.6)
, (1.6)
где
![]() — средняя удельная теплоёмкость удельного
— средняя удельная теплоёмкость удельного
пара в интервале температурыts
… tпп,
и зависит не только от температуры, но
и от давления (определяют по таблицам
воды и перегретого пара).
Энтальпия перегретого
пара численно равна сумме теплот трёх
последовательных стадий парообразования,
т.е.
![]() (1.7)
(1.7)
Энтропия перегретого
пара также определяет её аддитивную
сторону
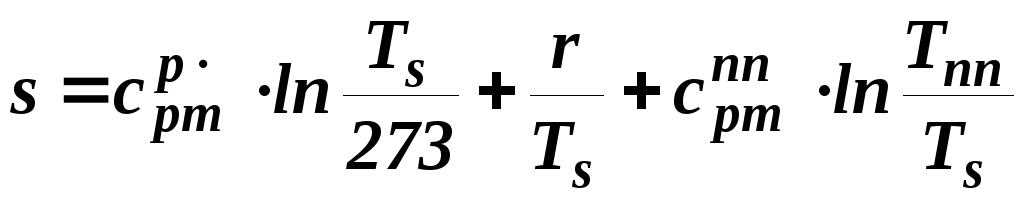 .
.
(1.9)
Таким
образом, энтальпия перегретого пара
численно равна количеству теплоты в
джоулях на килограмм массы, нужной для
нагревания 1кг воды от О
°С до
температуры кипения, дальнейшее
выпаривания и для перегрева до заданной
температуры при постоянном давлении.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Д/З ХИМИЯ
Ученик
(82),
закрыт
8 лет назад
Geselle
Гений
(63461)
8 лет назад
[Это не химия, а химическая термодинамика – раздел физхимии]
Сопоставив данное эмпирическое уравнение с уравнением Клаузиуса-Клапейрона в интегральной форме (для процесса испарения) :
lnp = -ΔHисп/RT + C
видим, что ΔHисп/R = 2501,8, откуда энтальпия испарения:
ΔHисп = 2501,8*8,31 = 20790 Дж/моль = 20,8 Дж/моль (округленно)
Нормальная точка кипения будет при нормальном давлении 760 Торр
Ln760 = 6,6333 (берем с точностью до пяти значащих цифр, как и те числа, которые есть в уравнении)
6,6333 = 16,255 – 2501.8 / T
Т = 260 К, что соответствует крайней точке указанного в условии интервала температур для данного уравнения.
Здравствуйте! Водяной пар может быть трех видов: влажным насыщенным, сухим насыщенным, перегретым. Рассмотрим все три вида.
Влажный насыщенный пар. Удельный объем влажного насыщенного пара находится из выражения
υ = υ”x+υ'(1— х),
где υ” — удельный объем сухого насыщенного пара; υ’ — удельный объем воды при температуре парообразования и том же давлении, что и объем υ”.
Двумя штрихами в технической термодинамике принято обозначать параметры и функции состояния сухого насыщенного пара, а одним штрихом — величины, характеризующие состояние воды при температуре парообразования.
При небольших давлениях (p < 3 МПа) удельный объем υ’ воды очень мал по сравнению с удельным объемом υ” сухого насыщенного пара. Поэтому при х>0,8 объем жидкости υ'(1—х) можно не учитывать и приближенно определять удельный объем влажного насыщенного пара из соотношения υ ≈ υ”x. В процессе парообразования при постоянном давлении для получения 1 кг влажного насыщенного пара к 1 кг кипящей жидкости необходимо подвести количество теплоты
q=rx (1)
Так как в процессе при р = const количество теплоты равно изменению энтальпии, то величину энтальпии i влажного насыщенного пара можно определить из выражения
q = rx = i—i’ или i=i’+rx. (2)
Энтальпия i’ кипящей воды при температуре парообразования и теплота парообразования г соответствуют тому же давлению, что и энтальпия i. Так как величина энтальпии при 273 К принимается за нуль, то энтальпию i’ кипящей воды можно найти из выражения
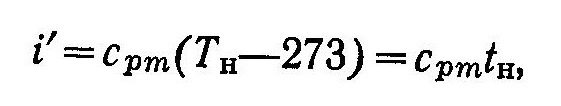 (3)
(3)
где сm — средняя массовая теплоемкость воды в интервале температур от 273 К до Тн.
Энтальпия i’ кипящей воды, как следует из выражения (3), численно равна количеству теплоты, которая затрачивается для нагревания 1 кг воды от 0° С до температуры кипения tн при р = const.
В соответствии с уравнением первого закона термодинамики q = ∆u+l имеем
r = u” — u’ + p*(u” — υ’).
Анализ этого выражения показывает, что теплота парообразования r складывается из внутренней теплоты парообразования u”- u’, затрачиваемой на изменение внутренней энергии (преодоление сил притяжения между молекулами), и внешней теплоты парообразования p (u”- u’), равной работе против внешних сил. Для давлений меньше 20 МПа внешняя теплота парообразования незначительна и не превышает 13% от величины r.
Энтропию влажного насыщенного пара найдем из выражения
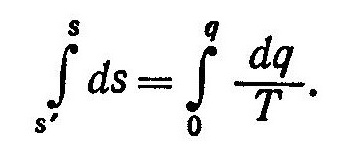
Так как в процессе парообразования при p=const T=const, то с учетом уравнения (1) получим
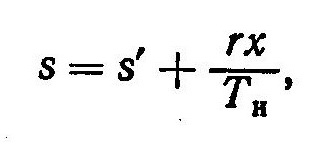
где s’— энтропия воды при температуре парообразования и том же давлении, что и величины s, г и Tн.
Величину s’ можно определить из соотношения
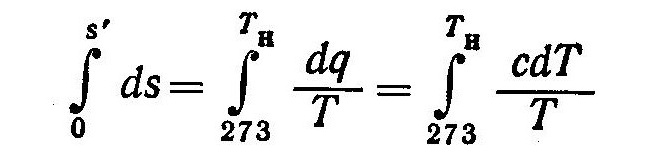 (4)
(4)
или
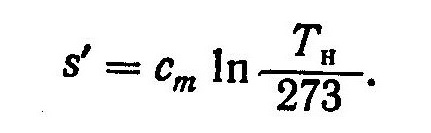
Пределы интегрирования в выражении (4) приняты в соответствии с условием, что при 273 К энтропия равна нулю.
Сухой насыщенный пар.
Состояние сухого насыщенного пара определяется значением одного параметра, например давления или температуры парообразования, так как другой параметр состояния — степень сухости — имеет определенное значение х=1. Параметры и функции состояния сухого насыщенного пара можно определить по выведенным выше формулам (1), (2) для влажного пара при условия х = 1.
Перегретый пар.
Для получения перегретого пара в котельном агрегате устанавливают специальный теплообменник (пароперегреватель), в котором происходит перегрев влажного насыщенного пара. Для характеристики состояния перегретого пара должны быть известны два любых параметра состояния пара, например давление и температура. Вместо параметров могут быть заданы функции состояния (энтальпия или энтропия).
Энтальпия перегретого пара находится из выражения
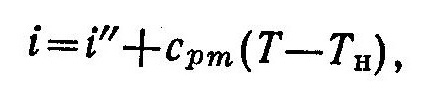 (5)
(5)
где сpm—массовая средняя изобарная теплоемкость пара в интервале температур от Tн до Т.
Энтропия перегретого пара определяется следующим образом
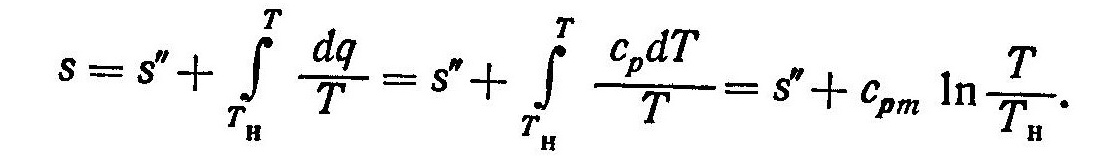 (6)
(6)
В уравнения (5) и (6) необходимо подставлять значения величин i”, s” и cpm при том же давлении, для которого определяются энтальпия i и энтропия s. Исп.литература: 1) Теплотехника и теплотехническое оборудование предприятий промышленности строительных материалов и изделий, Н.М. Никифорова, Москва, «Высшая школа», 1981. 2) Теплотехника, Бондарев В.А., Процкий А.Е., Гринкевич Р.Н. Минск, изд. 2-е,”Вышейшая школа”, 1976.
Как читать таблицы водяного пара
Если вы едете по неизвестной местности, вам понадобится карта или навигатор, если вы летите на самолете, вам не обойтись без расписания полётов. Так и таблицы водяного пара необходимы всем пользователям в индустрии пара. В этой статье мы познакомимся с таблицами пара, рассмотрим их виды и немного поговорим о присутствующих в них элементах.
Таблицы насыщенного водяного пара
Таблицы насыщенного водяного пара — необходимый инструмент для любого инженера, работающего с паром. Обычно их используют для определения зависимости температуры насыщенного пара от парового давления или, наоборот, давления от температуры насыщенного пара. Кроме этих параметров, таблицы обычно включают и другие показатели, такие как удельная энтальпия (h) и удельный объём (v).
Данные таблиц насыщенного водяного пара всегда отображают информацию о конкретной точке насыщения известной как точка кипения. Это точка, в которой вода (жидкость) и пар (газ) могут сосуществовать при одинаковых температуре и давлении. Так как H2O может быть и в жидком, и в газообразном состоянии, нам будут необходимы две подборки данных: данные о насыщенной воде (жидкости), которые обычно обозначаются подстрочной буквой f, и данные о насыщенном паре (газе), которые обозначают подстрочной буквой g.
Пример таблицы насыщенного пара

Обозначения:
- P = Давление пара/воды
- T = Точка насыщения пара/воды (точка кипения)
- vf = Удельный объём насыщенной воды (жидкости)
- vg = Удельный объём насыщенного пара (газа)
- hf = Удельная энтальпия насыщенной воды (энергия, необходимая для подогрева воды от 0 °C до точки кипения)
- hfg = Скрытое тепло испарения (энергия, необходимая для трансформации насыщенной воды в насыщенный пар)
- hg = Удельная энтальпия насыщенного пара (энергия, необходимая для получения пара из воды с температурой 0 °C)
* Источник: 1999 таблицы пара Японского общества инженеров-механиков
При нагреве обычно используется скрытое тепло испарения (Hfg). Как видно из таблицы, это скрытое тепло испарения будет выше при более низком давлении. По мере увеличения парового давления скрытое тепло постепенно снижается и достигает 0 при суперкритическом давлении, например, 22.06 МПа.
Полезно знать
Два формата: на основе давления и температуры
Так как давление и температура насыщенного пара напрямую связаны друг с другом, таблицы пара обычно доступны в двух форматах: на основе давления и температуры. В обоих содержится одинаковая информация, но классифицирована она по-разному.
Таблица насыщенного водяного пара, основанная на давлении
| Давл. (изб.) | Темп. | Удельный объём | Удельная энтальпия | |||
|---|---|---|---|---|---|---|
| кПа изб. | °C | м3/кг | кДж/кг | |||
| P | T | Vf | Vg | Hf | Hfg | Hg |
| 0 | 99.97 | 0.0010434 | 1.673 | 419.0 | 2257 | 2676 |
| 20 | 105.10 | 0.0010475 | 1.414 | 440.6 | 2243 | 2684 |
| 50 | 111.61 | 0.0010529 | 1.150 | 468.2 | 2225 | 2694 |
| 100 | 120.42 | 0.0010607 | 0.8803 | 505.6 | 2201 | 2707 |
Таблица насыщенного водяного пара, основанная на температуре
| Темп. | Давл. (изб.) | Удельный объём | Удельная энтальпия | |||
|---|---|---|---|---|---|---|
| °C | кПа изб. | м3/кг | кДж/кг | |||
| T | P | Vf | Vg | Hf | Hfg | Hg |
| 100 | 0.093 | 0.0010435 | 1.672 | 419.1 | 2256 | 2676 |
| 110 | 42.051 | 0.0010516 | 1.209 | 461.4 | 2230 | 2691 |
| 120 | 97.340 | 0.0010603 | 0.8913 | 503.8 | 2202 | 2706 |
| 130 | 168.93 | 0.0010697 | 0.6681 | 546.4 | 2174 | 2720 |
| 140 | 260.18 | 0.0010798 | 0.5085 | 589.2 | 2144 | 2733 |
| 150 | 374.78 | 0.0010905 | 0.39250 | 632.3 | 2114 | 2746 |
Разные единицы измерения: избыточное и абсолютное давление
Таблицы насыщенного пара также используют два различных вида давления: абсолютное и манометрическое (избыточное).
- Абсолютное давление — это нулевая точка по отношению к абсолютному вакууму.
- Манометрическое давление — это нулевая точка по отношению к атмосферному давлению (101.3 кПа).
Таблица насыщенного пара с абсолютным давлением
| Давл. (абс.) | Темп. | Удельный объём | Удельная энтальпия | |||
|---|---|---|---|---|---|---|
| кПа | °C | м3/кг | кДж/кг | |||
| P | T | Vf | Vg | Hf | Hfg | Hg |
| 0 | — | — | — | — | — | — |
| 20 | 60.06 | 0.0010103 | 7.648 | 251.4 | 2358 | 2609 |
| 50 | 81.32 | 0.0010299 | 3.240 | 340.5 | 2305 | 2645 |
| 100 | 99.61 | 0.0010432 | 1.694 | 417.4 | 2258 | 2675 |
Таблица насыщенного пара с избыточным давлением
| Давл. (изб.) | Темп. | Удельный объём | Удельная энтальпия | |||
|---|---|---|---|---|---|---|
| кПа изб. | °C | м3/кг | кДж/кг | |||
| P | T | Vf | Vg | Hf | Hfg | Hg |
| 0 | 99.97 | 0.0010434 | 1.673 | 419.0 | 2257 | 2676 |
| 20 | 105.10 | 0.0010475 | 1.414 | 440.6 | 2243 | 2684 |
| 50 | 111.61 | 0.0010529 | 1.150 | 468.2 | 2225 | 2694 |
| 100 | 120.42 | 0.0010607 | 0.8803 | 505.6 | 2201 | 2707 |
Избыточное давление было придумано для простоты измерения давления по отношению к тому, которое мы обычно испытываем.
В таблицах пара, составленных на основе манометрического давления, атмосферное давление определяется как 0, а в таблицах с абсолютным давлением — 101.3 кПа. А для того чтобы отличать избыточное давление от абсолютного в конце добавляют “изб.”, например, кПа изб. или фт/кв. дюйм изб..
Перевести показатели избыточного давления в показатели абсолютного
Для единиц СИ
Давление пара [кПа изб.] = Давление пара [кПа изб.] + 101.3 кПа
Важное замечание: Проблемы могут возникнуть в том случае, если перепутать абсолютное и манометрическое давление, именно поэтому надо быть особенно внимательными с единицами давления, указанными в таблице.
Сводная таблица
Избыточное давление
- Нулевая точка отсчёта при атмосферном давлении*
- Нулевое давление = Атмосферное давление
Абсолютное давление:
- Нулевая точка отсчёта при атмосферном давлении
- Нулевое давление = Абсолютный вакуум
*Атмосферное давление — 101.3 кПа
Таблицы перенасыщенного пара
Информацию о перенасыщенном паре нельзя получить из обычных таблиц насыщенного пара, для этого существуют специальные таблицы перенасыщенного пара. Происходит это потому, что температура перенасыщенного пара в отличии от температуры насыщенного может существенно меняться при одном и том же давлении.
В действительности, количество возможных комбинаций температуры и давления настолько велико, что даже теоретически не представляется возможным собрать их в одной таблице. В результате для перегретого пара используется общая сводная таблица данных о температуре и давлении.
Пример таблицы перенасыщенного пара

В приведенной выше таблице есть данные об удельном объёме (Vg), удельной энтальпии (Hg) и удельном тепле (Sg) при типичных значениях давления и температуры.

