Найди верный ответ на вопрос ✅ «Вычислить стандартную энтальпию реакции образования аммиака по стандартным энтальпиям реакций: Н2 (г) + ½ О2 (г) = Н2 О (ж), ΔH0 = – 285,83 …» по предмету 📙 Химия, а если ответа нет или никто не дал верного ответа, то воспользуйся поиском и попробуй найти ответ среди похожих вопросов.
Искать другие ответы
Главная » Химия » Вычислить стандартную энтальпию реакции образования аммиака по стандартным энтальпиям реакций: Н2 (г) + ½ О2 (г) = Н2 О (ж), ΔH0 = – 285,83 кДж/моль NH3 (г) + ¾ О2 (г) = ½ N2 (г) + 1,5 Н2 О (ж), ΔH0 = – 316,72 кДж/моль
 Готовое решение: Заказ №8477
Готовое решение: Заказ №8477
 Тип работы: Задача
Тип работы: Задача
 Статус: Выполнен (Зачтена преподавателем ВУЗа)
Статус: Выполнен (Зачтена преподавателем ВУЗа)
 Предмет: Химия
Предмет: Химия
 Дата выполнения: 10.09.2020
Дата выполнения: 10.09.2020
 Цена: 228 руб.
Цена: 228 руб.
Чтобы получить решение, напишите мне в WhatsApp, оплатите, и я Вам вышлю файлы.
Кстати, если эта работа не по вашей теме или не по вашим данным, не расстраивайтесь, напишите мне в WhatsApp и закажите у меня новую работу, я смогу выполнить её в срок 1-3 дня!
Описание и исходные данные задания, 50% решения + фотография:
Вычислить стандартную энтальпию образования аммиака, если известно:
1) 4NH3 + 3O2 = 2N2 + 6H2O + 1226кДж
2) 2H2 + O2 = 2H2O + 484кДж
Решение:
Энтальпия образования аммиака равна энтальпии реакции образования аммиака из простых веществ. Запишем уравнение реакции, тепловой эффект которой нужно получить:
3) ½ N2 + 3/2H2 = NH3
Реакцию (3)можно получить, если реакцию (2)умножить на 3 и поделить

- Мужчина, соблюдающий фигуру, на вечеринке не удержался и выпил 50 мл водки (40%-й раствор этанола в воде плотностью 0,94 г/мл). Рассчитать количество энергии, которое выделиться в организме мужчины
- 9,6г (NH4)2CO3 растворили в мерной колбе на 100 мл. плотность полученного раствора оказалась равна 1,03 г/мл. Рассчитать: 1) массовую долю; 2) молярную концентрацию
- Напишите молекулярные и ионные уравнения реакций. Для окислительно-восстановительных реакций составьте электронно-ионный баланс MnCl2 + H2O ↔ MnOHCl + HCl Mn2+ + 2Cl- + H2O ↔ MnOH+ + Cl- + H+ + Cl- Mn
- Вычислить стандартную энтальпию реакции гидролиза тристеарата, протекающей по уравнению: С54H110O6 + 3H2O = 3C17H35COOH + C3H8O3 Если известно: ΔНсгор(С54H110O6) = -37760 кДж/моль
химия! помогите пож!!
Иринка
Ученик
(162),
закрыт
8 лет назад
Екатерина Ганженко
Высший разум
(132674)
9 лет назад
1) N2 + 3H2 = 2NH3 +Q
^Hо 298 = – Q . n (NH3) = m/Mr = 1.7/17 = 0.1 моль, Q = 4.62/0.1 = 46.2 кДж/моль
^H = – 46.2 кДж/моль
6) С3Н8 +5 О2 = 3СО2 + 4Н2О + Q
n(C3H8) = 2.24/22.4 = 0.1 моль, Q = 216/0.1 = 2160 кДж/моль
^H o298 = -Q = – 2160 кДж/моль
А. Уравнение химической реакции и его
анализ.
N2 + 3H2
↔ 2NH3; ∆Н = – 92 кДж
При температуре 500 ºС и давлении 30 МПа
∆H = – 112 кДж.
Стандартная энтальпия образования
аммиака равна
∆Hºобр.
= – 46 кДж.
Реакция – обратимая, протекает с
уменьшением объёма газообразных
веществ, идёт с выделением тепла
(экзотермическая).
Б. Выражение для константы равновесия
через равновесные парциальные
давления (kр)
и равновесные концентрации (kC)


В. Выбор оптимальных условий синтеза
аммиака.
Поскольку реакция обратима, необходимо
определить условия, способствующие
выходу аммиака.
Смещение равновесия в сторону образования
аммиака по принципу Ле-Шателье происходит
при следующих условиях:
– увеличение концентрации исходных
веществ;
– увеличение давления;
– уменьшение температуры;
– уменьшение концентрации продуктов
реакции.
Следовательно, процесс необходимо
проводить при высоких концентрациях
азота и водорода в газовой смеси,
поступающей на синтез, при повышенном
давлении и при постоянном понижении
температуры. Равновесие сместится
вправо также при отводе продуктов
реакции.
В соответствии с ПРАВИЛОМ, касающегося
любого обратимого экзотермического
процесса, синтез аммиака начинают при
оптимальной температуре, обеспечивающей
необходимую скорость, а затем ведут
процесс по линии оптимальных температур
(ЛОТ), постоянно отводя тепло из системы.
Для того чтобы выбрать оптимальные
условия протекания процесса синтеза
аммиака, исследуется различные
характеристики процесса, например,
зависимость выхода аммиака от давления
в системе и от температуры.
Зависимость выхода аммиака от давления
представлена на рисунке (Рис.1).
Зависимость равновесного выхода аммиака
от температуры
при различных давлениях представлена
на рисунке (Рис.2).
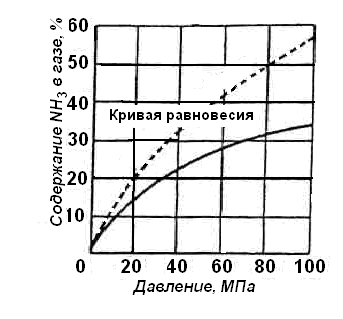
Рис. 1. Зависимость выхода аммиака от
давления (объёмная скорость 30 000 ч-1;
t = 500°C;
катализатор железный).
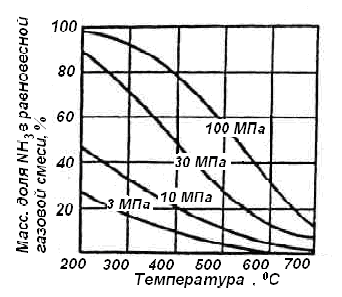
Рис.2. Зависимость равновесного выхода
аммиака от температуры для различных
давлений.
Выводы.
Исследование зависимости равновесного
выхода аммиака от давления и
температуры показывает, что:
– с увеличением давления содержание
аммиака в газе повышается и происходит
это по затухающей кривой (Рис.1.);
– с увеличением температуры равновесный
выход аммиака уменьшается (Рис. 2);
– при одной и той же температуре с
увеличением давления выход аммиака
увеличивается (Рис.2).
Все промышленные установки работают
при повышенном давлении. Различают
установки:
– низкого давления – (10 – 15) МПа;
– среднего давления – (25 – 60) МПа;
– высокого давления – (60 – 100) МПа.
Но применять слишком высокие давления
экономически невыгодно.
Наиболее эффективным является агрегат
синтеза аммиака под средним давлением
(Р = 32МПа) мощностью 450000т/год (или
1360т/сутки).
-
Обоснование использования катализатора.
Как следует из принципа Ле-Шателье и
подтверждается Рис.1 и 2, выход готового
продукта увеличивается с понижением
температуры. Но при низких температурах
скорость реакции настолько мала, что
реакция практически не протекает. В
таком случае есть один выход –
использование катализатора.
Реакция синтеза аммиака имеет ещё одну
особенность, которую необходимо
отметить. В молекуле азота, из которого
получают аммиак, связь тройная,
энергия связи очень большая, она равна
912 кДж/моль. Даже при сравнительно
высоких температурах активационный
энергетический барьер (или энергия
активации) слишком велик и образование
молекул аммиака протекает крайне
медленно. Поэтому для снижения энергии
активации процесс ведут на твёрдых
катализаторах.
-
Катализаторы синтеза аммиака.
Какие же катализаторы для синтеза
аммиака являются эффективными?
На реакцию синтеза аммиака каталитически
действуют многие металлы. Это элементы,
имеющие не полностью застроенные d-
и f-орбитали: марганец
(Mn), железо (Fe),
родий (Ro), вольфрам (W),
рений (Re), осмий (Os),
платина (Pt), уран (U)
и др.
Наиболее высокую активность проявляют
железо, рений, осмий и уран. Однако осмий
рений и уран дороги и опасны в работе.
Остаётся только одно – использовать
железо.
В промышленном синтезе аммиака используют
разработанный ГИАП железный катализатор,
промотированный оксидами алюминия,
калия, кальция и кремния. Такой катализатор
достаточно активен и стоек к местным
перегревам.
Необходимо отметить также, что катализатор
подвержен отравлению. Соединения
серы отравляют катализатор необратимо,
а кислород и некоторые его соединения
– обратимо, но очень быстро. Даже в
ничтожно малых количествах присутствие
соединений кислорода быстро выводят
катализатор из строя, после чего
требуется его восстановление. (Поэтому,
как известно, перед синтезом аммиака
проводят тонкую очистку от кислородсодержащих
соединений – стадию метанирования).
Механизм действия катализатора.
По теории механизма с неподвижным ядром
процесс каталитического синтеза аммиака
можно представить как ряд элементарных
актов:
– диффузия молекул азота и водорода
из газового объёма к поверхности зерна
катализатора и в его поры;
– активированная адсорбция азота
поверхностью катализатора;
– адсорбция водорода на адсорбированном
азоте, обусловливающая химическое
взаимодействие азота и водорода
через промежуточное соединение их с
катализатором;
– десорбция аммиака с поверхности
катализатора;
– диффузия газообразного аммиака в
общий газовый объём.
Известно, что скорость процесса зависит
от самой медленной стадии. Многочисленные
исследования показали, что лимитирующей
стадией собственно катализа является
активирующая адсорбция азота. Эта
стадия и лежит в основе изучения
кинетики процесса.
-
Определение оптимальной температуры
процесса.
Итак, синтез аммиак проводят при
повышенных давлениях на твёрдом
катализаторе. Температура процесса
400 – 500 ºС. Как установили оптимальную
температуру?
Рассмотрим зависимость выхода аммиака
от температуры при различных объёмных
скоростях, которая представлена ниже
на Рис.3.
Объёмная скорость газа (W)
– это количество газа в м3,
проходящего через 1м3 катализатора
за 1час (измеряется в м3/ м3.ч
или в ч-1).
Из рисунка видно следующее:
– с увеличением объёмной скорости (то
же самое, что «с уменьшением времени
соприкосновения газа с катализатором»)
выход аммиака уменьшается;
– для каждой объёмной скорости имеется
оптимальная температура, которой
соответствует МАКСИМАЛЬНЫЙ выход
аммиака.
Почему при увеличении температуры
возникает этот максимум объяснить
можно следующим образом. Сначала, когда
концентрации исходных веществ велики,
скорость прямой реакции большая по
сравнению с обратной, содержание аммиака
в газовой смеси растёт, кроме того,
увеличение температуры также способствует
этому.
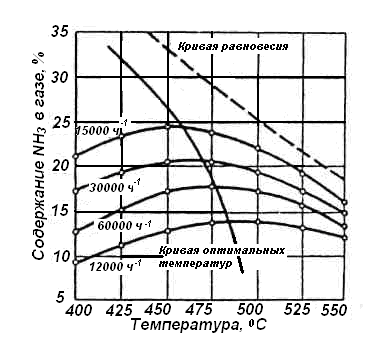
Рис. 3. Зависимость выхода аммиака от
температуры при различных объёмных
скоростях азотоводородной смеси (Р =
30 МПа)
При некоторой температуре (точка излома
или максимум на кривой), в соответствии
с принципом Ле-Шателье, сильнее ускоряется
обратная реакция, соответственно
содержание аммиака уменьшается.
Для разных объёмных скоростей на рисунке
(Рис.3) можно определить интервал
оптимальных температур. Он составляет
450 – 500 ºС.
Как определить, с какой объёмной
скоростью наиболее эффективно вести
процесс?
Дл этого рассмотрим влияние объёмной
скорости на концентрацию аммиака в
газовой смеси, представленной в следующей
таблице.
|
Объёмная скорость м3/м3 |
Содержание NH3, температурах, |
||
|
450 |
475 |
500 |
|
|
15000 |
19,6 |
21,6 |
23,0 |
|
30000 |
14,6 |
17,7 |
18,2 |
|
45000 |
12,7 |
15,2 |
16,5 |
Из таблицы следует:
– при увеличении объёмной скорости
происходит снижение концентрации
аммиака в газе;
– в интервале температур 450 – 500 ºС при
определённой объёмной скорости
содержание аммиака в газе увеличивается
(далее с увеличением температуры выход
аммиака уменьшается).
Несмотря на то, что с увеличением
объёмной скорости (то же самое, что «при
уменьшении времени соприкосновения
молекул газа с катализатором») уменьшается
содержание аммиака в газе, процесс
предпочитают вести с большими объёмными
скоростями. Почему?
Потому, что это уменьшение не
пропорционально увеличению объёмной
скорости.
Действительно, например, при увеличении
объёмной скорости от 15000 ч-1 до
45000 ч-1 , то есть в 3 раза, концентрация
аммиака при 450 ºС снижается от 19,6% до
12,7%, то есть не в
3 раза, а всего в 1,54
раза (19,6/12,7 = 1,54).
Более того, при увеличении объёмной
скорости количество аммиака на единицу
объёма катализатора должно возрастать.
Действительно, объём аммиака, получаемого
с 1м3 катализатора в час, составляет:
при W = 15000 ч-1
15000.0,196 = 2850 м3;
при W = 45000 ч-1
45000.0,127 = 5715 м3.
(45000/15000 = 3 … 5715/2850 = 2)
Таким образом, увеличение объёмной
скорости в три раза от
15000 ч-1
до 45000 ч-1 привело к удвоению
активности катализатора. Отсюда ВЫВОД
о целесообразности работы контактных
аппаратов при высоких объёмных
скоростях.
В современных установках синтеза
аммиака объёмные скорости достигают
значений 30000 – 40000 м3/ м3·ч.
Можно ли ещё больше увеличивать объёмную
скорость? Или есть ограничения?
Есть ограничения, которые вызваны
следующим:
– при более высоких объёмных скоростях,
когда через катализатор проходит
большое количество газа, может не
хватить тепла, выделяющегося по реакции,
для поддержания необходимой температуры,
то есть нарушается автотермичность
процесса;
– с ростом объёмной скорости увеличивается
расход энергии на подачу газа;
– в связи с увеличением размеров
аппаратуры увеличивается расход
металла.
На Рис.4 представлена зависимость
производительности контактной массы
от объёмной скорости при различных
давлениях.
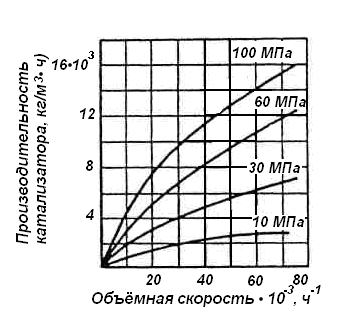
Рис.4. Зависимость производительности
катализатора от объёмной скорости при
различных давлениях (t =
500°C)
Производительность катализатора
– это съём аммиака (кг) с 1м3
контактной массы в течение одного часа.
m = 0,77 .·W
. ω(NH3)
, где
0,77 – масса 1м3 аммиака при н.у.;
ω(NH3)
– молярная доля аммиака в газе после
катализа;
W – объёмная скорость
газа.
Из Рис.4 следует:
– увеличение объёмной скорости газа
приводит к росту производительности
всей установки в целом;
– увеличение давления также увеличивает
производительность агрегата.
Однако даже при указанных условиях
синтеза:
– высокая температура;
– высокое давление;
– высокая объёмная скорость
– наличие катализатора;
не весь азот и водород вступают в
реакцию. В газовой смеси, выходящей
из контактного аппарата, содержится
всего
(18 – 20) % (об.) аммиака, остальное
– не прореагировавшая АВС.
Как отмечалось в первой части курса,
процессы с неблагоприятным состоянием
химического равновесия, то есть с низкой
степенью превращения, целесообразно
проводить по циклической схеме.
Схема цикла синтеза аммиака представляется
следующим образом:

Газовую смесь, выходящую из контактного
аппарата, охлаждают до температуры
сжижения аммиака. Аммиак выводят из
цикла, а смесь водорода и азота, не
вступившую в реакцию, возвращают в
контактный аппарат.
Способы выделения аммиака из газовой
смеси зависит от применяемого
давления.
В системах с высоким давлением
аммиак выделяется из газовой смеси при
охлаждении только в водяных
холодильниках (первичная конденсации
газа). Причём всю продукцию получают
в виде жидкого аммиака.
В системах, работающих при средних
давлениях, применяют водяное и
аммиачное охлаждение. В этом случае
часть продукции (30 – 40) % отводится
в виде жидкого аммиака, а остальная
часть (60 – 70) % в газообразном состоянии.
В установках, работающих при более
низких давлениях, весь
аммиак получают в газообразном
состоянии.
Продувочные газы.
Инерты или инертные газы синтеза
аммиака – газы, которые не участвуют
в реакции образования аммиака, но
присутствуют в АВС, это аргон и метан
и небольшие количества СО и СО2.
Так как реакция синтеза аммиака идёт
с уменьшением объёма и процесс организован
по циклической схеме, то со временем
содержание инертов в газе, поступающем
в колонну синтеза, увеличивается.
Поэтому необходимо периодически
выводить их из системы в виде продувочных
газов.
Для поддержания в агрегате содержания
инертов на определённом уровне
производится продувка после сепаратора
жидкого аммиака. Из продувочных газов
выделяют аммиак в отделителе. А
продувочные газы под давлением 32 МПа
направляются в межтрубное пространство
теплообменника конденсационной колонны
продувочных газов.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Загрузка…
