Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
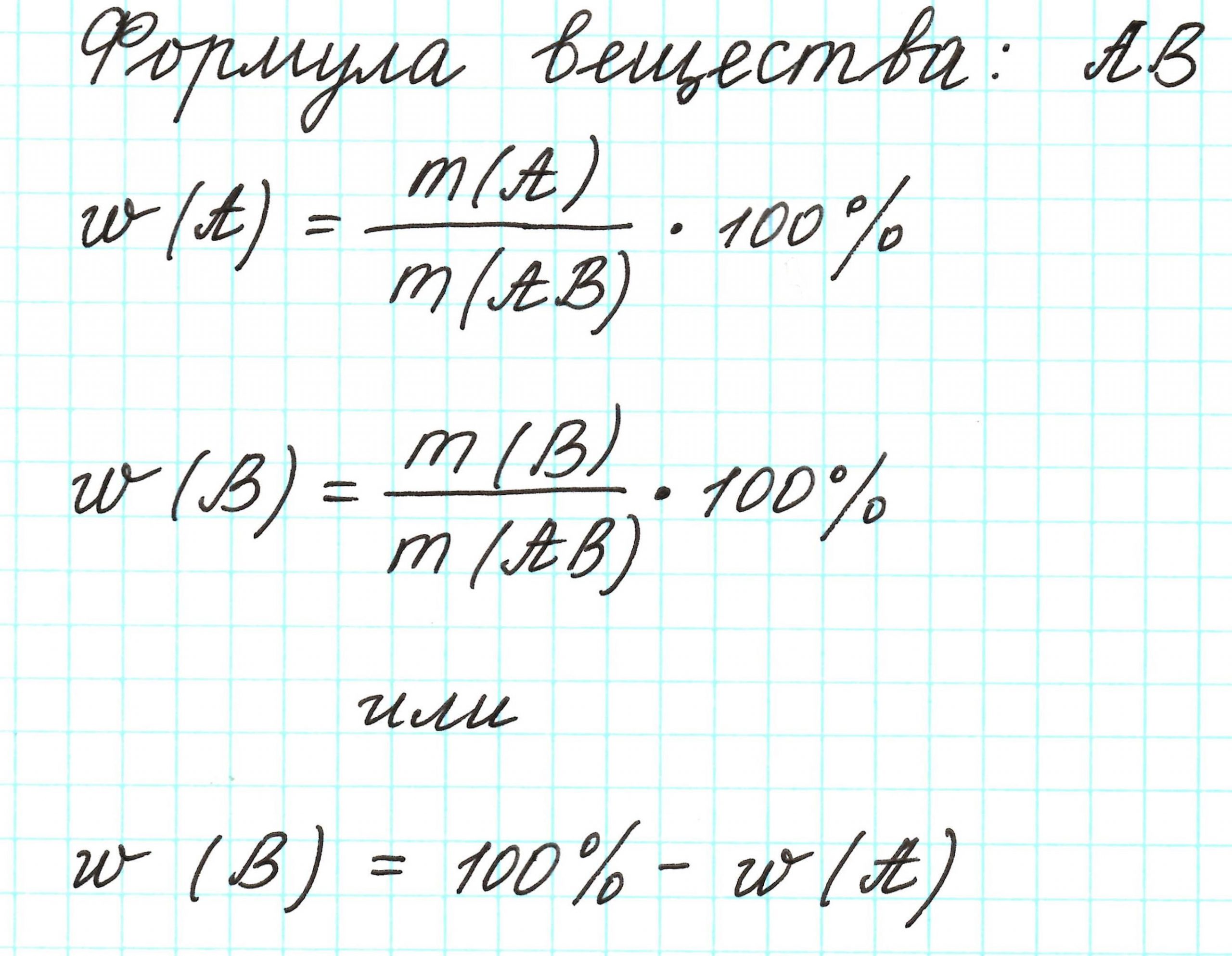
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
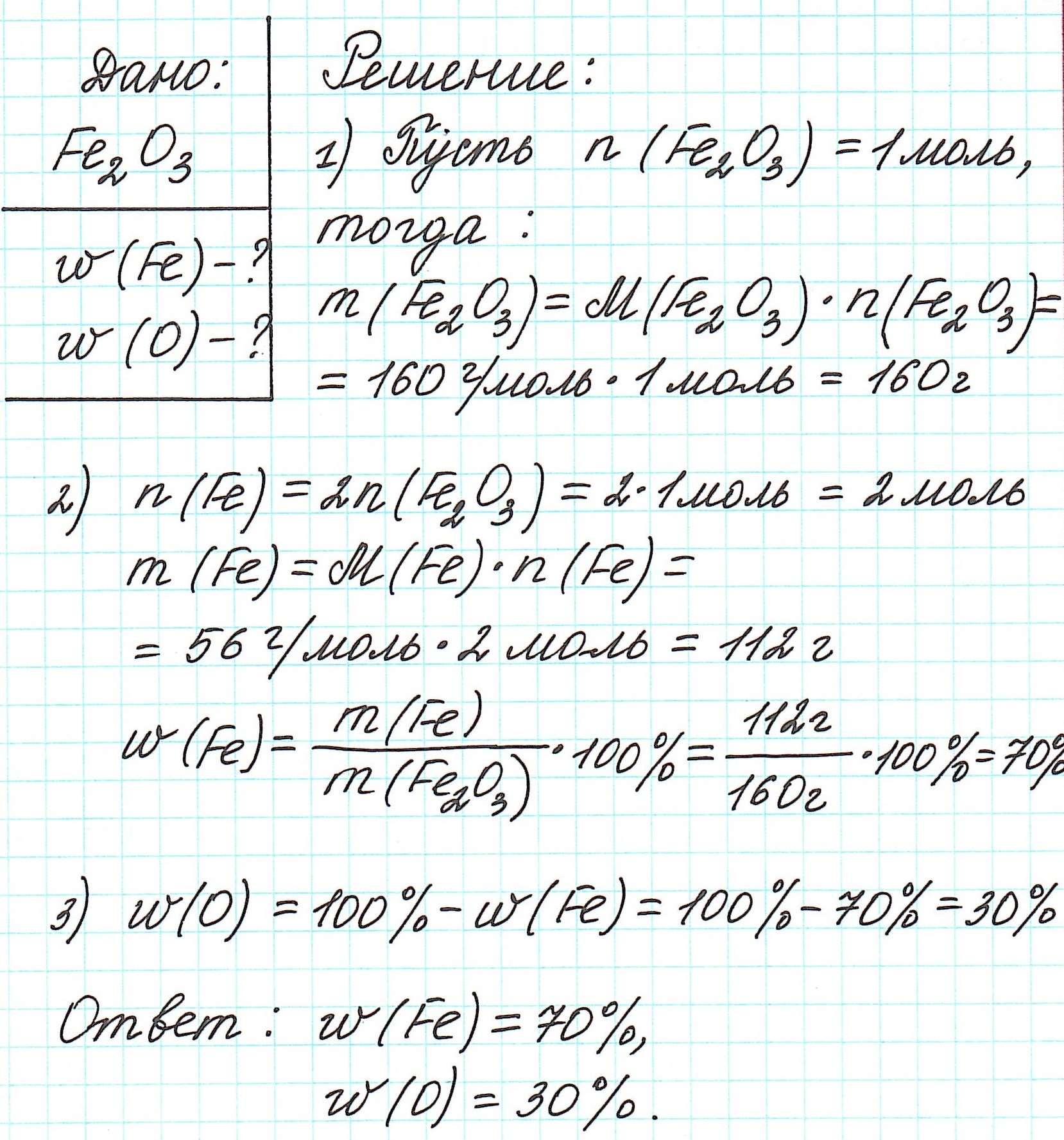
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
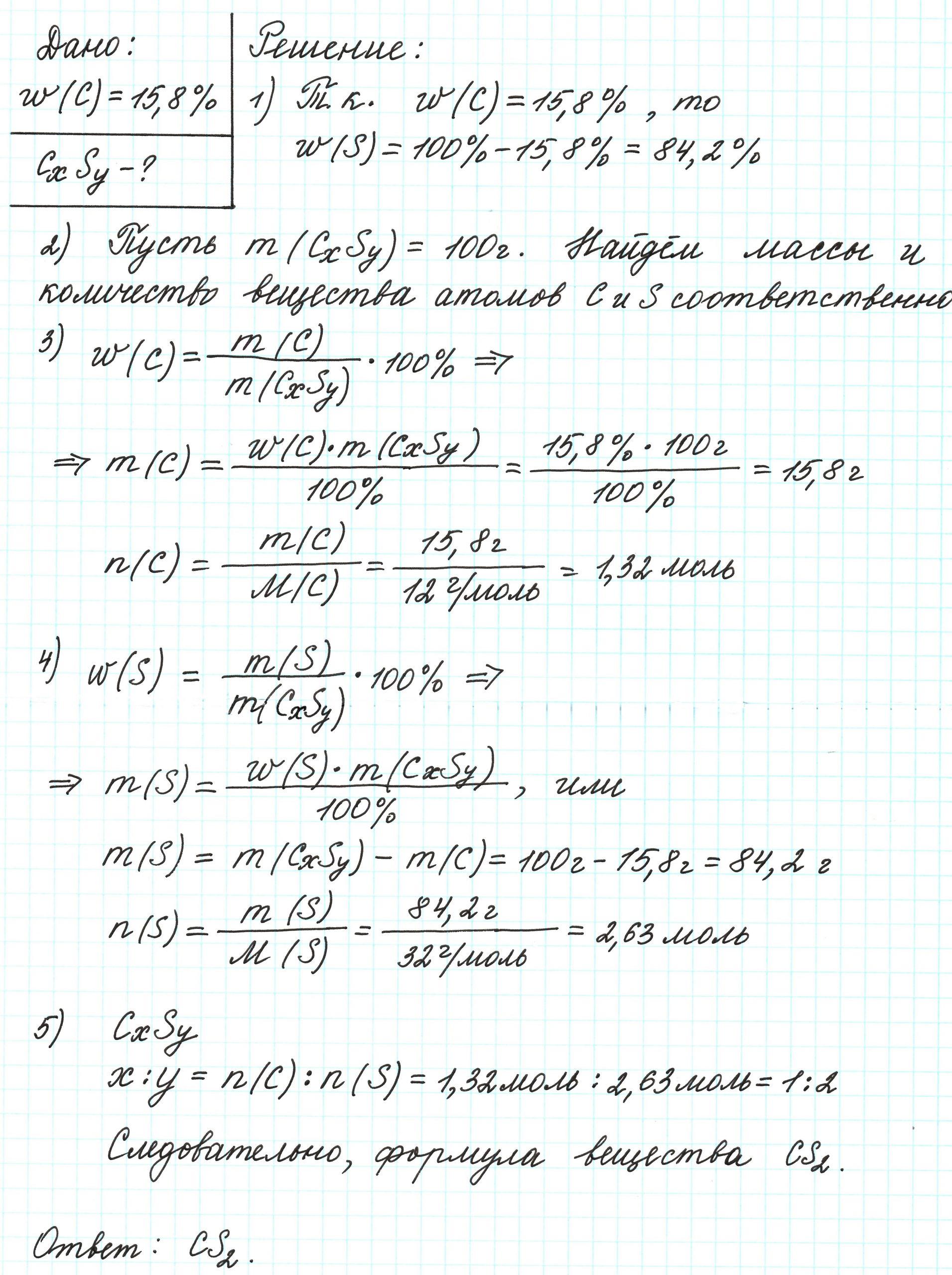
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.

Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
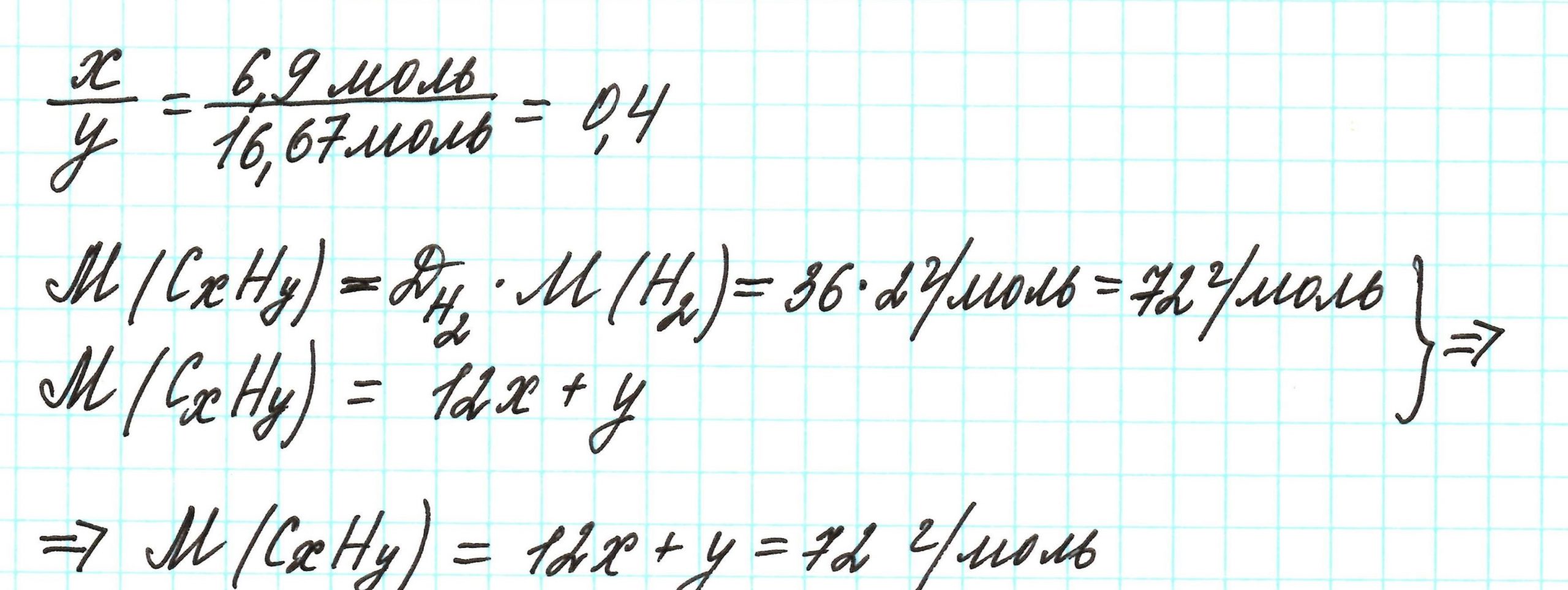

Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
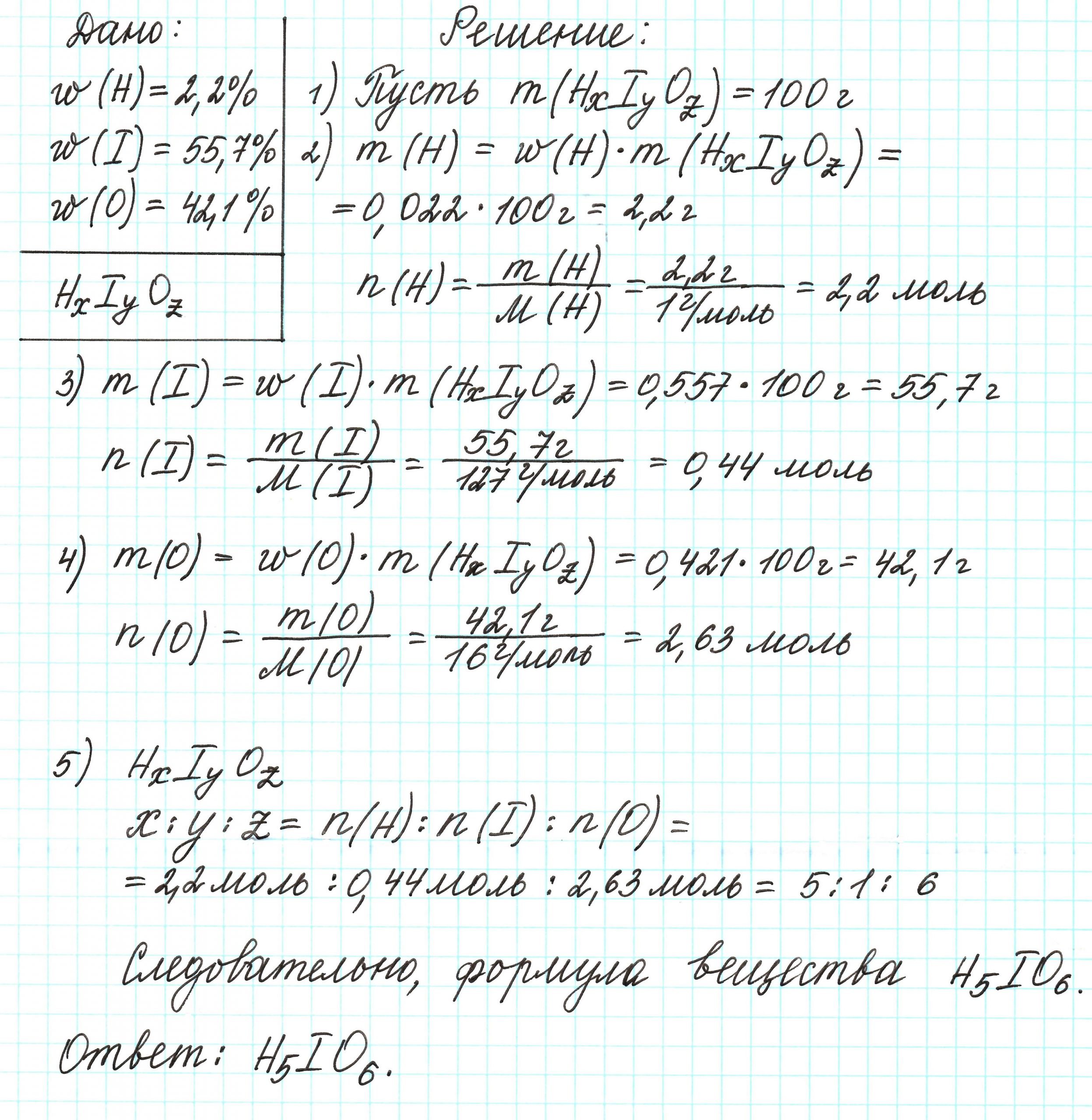
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
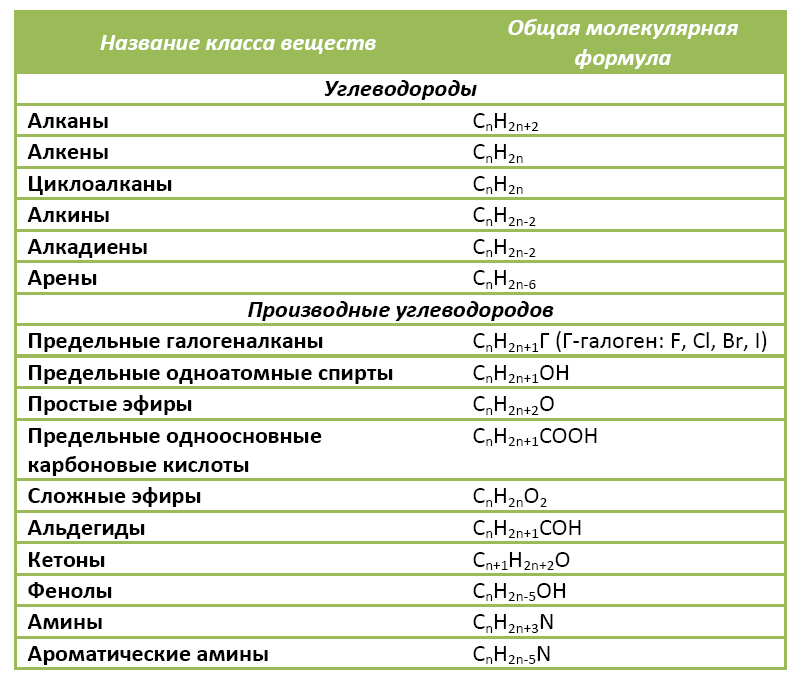
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
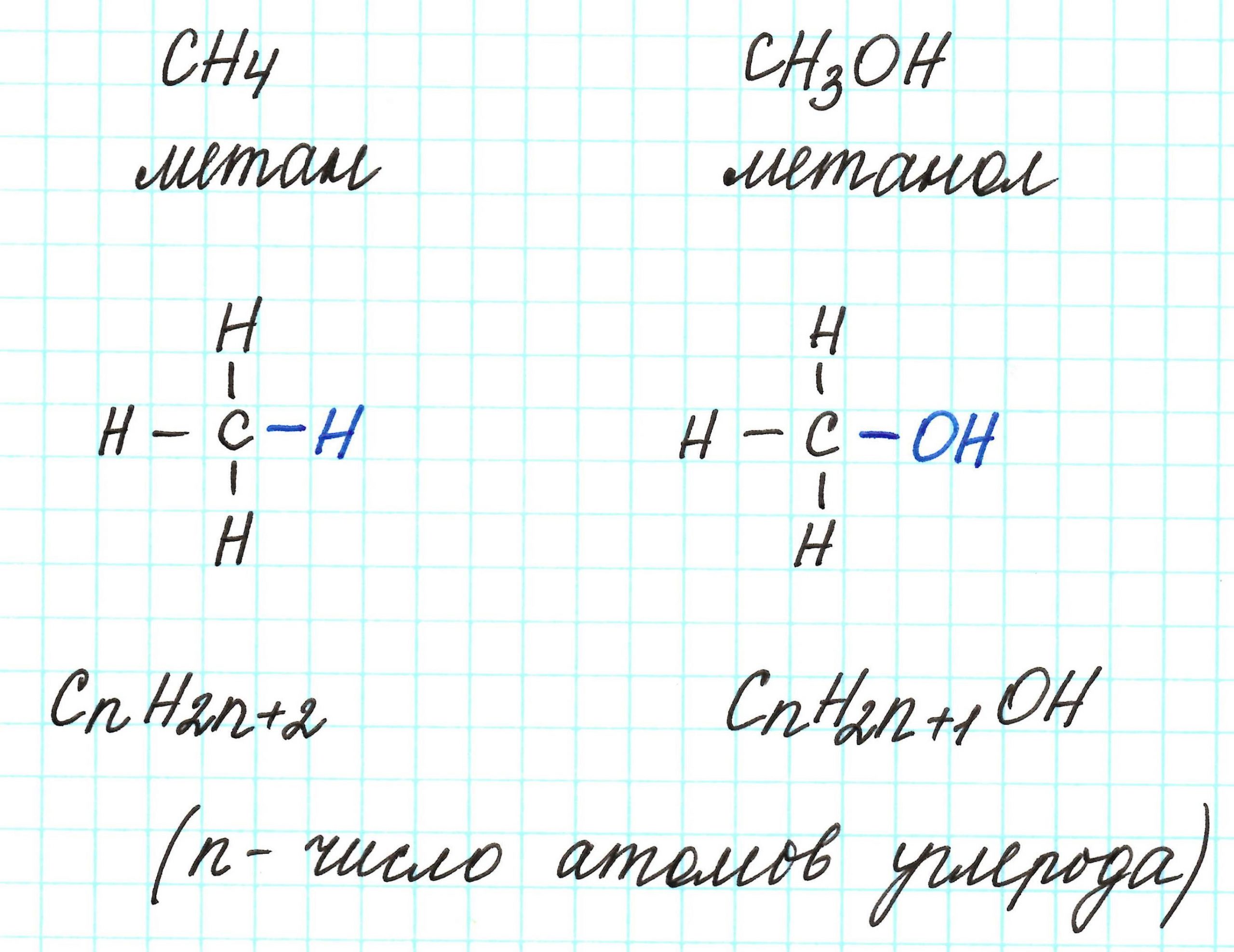
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
 Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Разберем примеры решения задач с использованием общей молекулярной формулы вещества.
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?

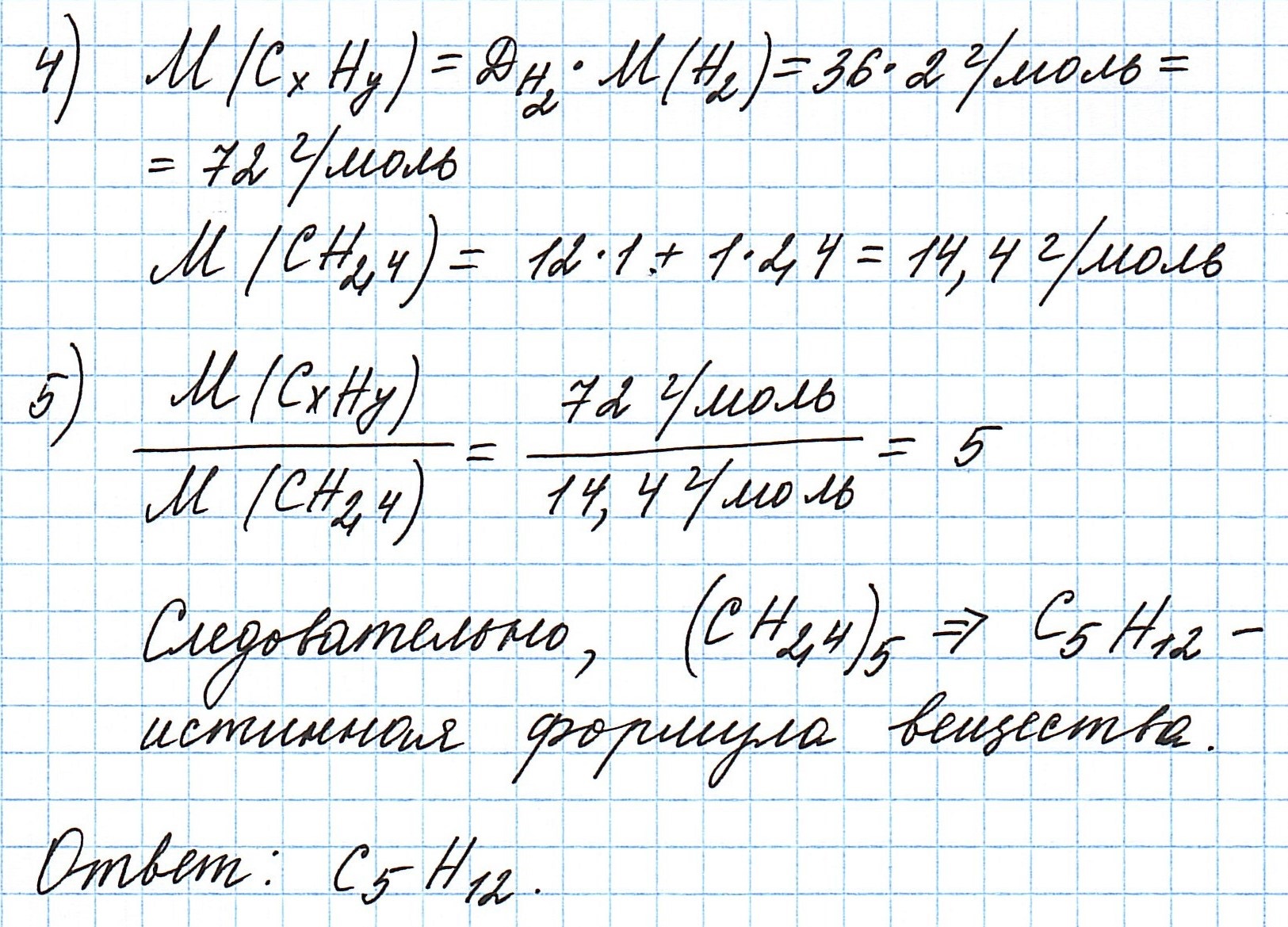
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.


Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.


5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.

Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.

Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.

Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.

Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Как определить формулу в химии
Химическая формула – это условное обозначение, написанное с помощью определенных символов и характеризующее состав любого вещества. С помощью химической формулы вы можете увидеть, атомы каких элементов и в каких количествах входят в состав той или иной молекулы. Очень важно правильно составлять и записывать химические формулы. Без этого не может быть и речи об изучении химии, поскольку именно с их помощью составляется номенклатура веществ, а также уравнения химических реакций.

Инструкция
Допустим, вам надо определить, какова формула у оксида серы. Из самого названия вещества следует, что каждая его молекула состоит только из двух элементов: кислорода (О) и серы (S). Состав молекулы зависит от величины валентности каждого из этих элементов, то есть от того, какое количество химических связей атом элемента способен образовать с другими атомами.
Кислород в обычном состоянии – газ, сера – твердое вещество. Оба эти элемента имеют ярко выраженные неметаллические свойства. Следовательно, они оба подчиняются правилу: каждый неметалл имеет высшую валентность, соответствующую номеру группы таблицы Менделеева, в которой он расположен, и низшую, соответствующую остатку от вычитания номера этой группы из восьми. То есть поскольку и кислород, и сера расположены в 6-й группе таблицы Менделеева, их высшая валентность равна 6, а низшая – 2.
Теперь надо определить, какую из этих валентностей имеет кислород, а какую – сера. Ведь невозможно, чтобы оба эти элемента в соединении имели одновременно либо высшую, либо низшую валентность. Теперь в действие вступает еще одно правило: «При соединении двух неметаллов тот из них, который находится ближе к верхнему правому углу таблицы Менделеева, имеет низший показатель валентности». Еще раз посмотрите в таблицу. Вы видите, что кислород располагается выше серы, следовательно, он находится ближе к верхнему правому углу. Таким образом, в соединении с серой он будет иметь низшую валентность, равную 2. А сера, соответственно, имеет высшую валентность, равную 6.
Остается последний шаг. Какие индексы будут у каждого из этих элементов? Известно, что произведения величин валентностей элементов, умноженные на их индексы, должны численно совпадать. Валентность серы в три раза больше валентности кислорода, следовательно, индекс кислорода должен быть в три раза больше индекса серы. Отсюда следует: формула соединения SO3.
Полезный совет
Правило высшей и низшей валентности не распространяется на фтор (F).
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Содержание:
Составление химических формул по валентности:
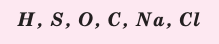
Пользуясь знаками представленных химических элементов, запишите химические формулы воды, поваренной соли, углекислого газа, серной кислоты. На чём основывается запись химических формул веществ?
Химические формулы веществ можно вывести на основе различных химических опытов. Рассмотрим формулы водородных соединений некоторых элементов (таблица 1).
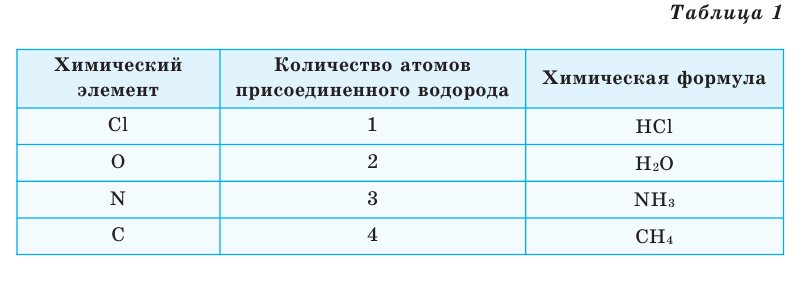
Из таблицы становится ясно, что атом хлора присоединяется с 1, атом кислорода – с 2, атом азота – с 3, а атом углерода – с 4 атомами водорода. Следовательно, химические элементы обладают разной способностью присоединять к себе атомы водорода. Для объяснения этого пользуются понятием «валентности». Свойство атомов химических элементов присоединять к себе определенное число атомов других химических элементов называют валентностью. Понятие валентности впервые было введено в 1852 году английским ученым Э.Франклендом.

Английский химик. В 1852 г. им было введено в науку понятие о соединительной силе атомов друг к другу. Данное свойство атомов впоследствии было названо валентностью.
Кислород в угарном газе в ионе гидроксония 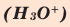 является I I I – валентным. А углерод бывает I I I – валентным только в угарном газе
является I I I – валентным. А углерод бывает I I I – валентным только в угарном газе 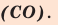
Валентность выражают римскими цифрами. Валентность водорода принята за единицу, и поэтому валентности других элементов берутся в сопоставлении с ним.
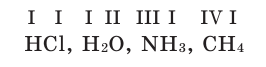
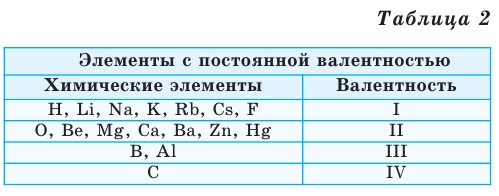
Валентность некоторых химических элементов остается неизменной во всех их химических соединениях, т.е. всегда обозначается одной и той же цифрой. Это элементы с постоянной валентностью (таблица 2).
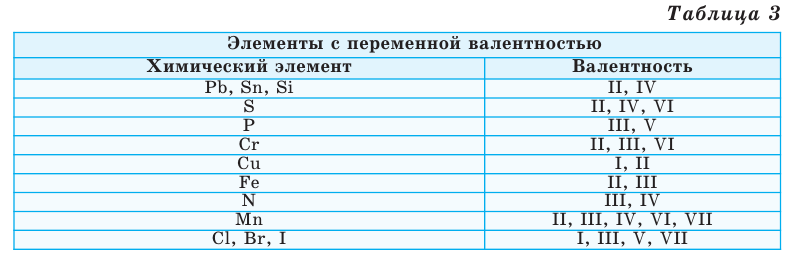
Однако другая группа элементов в различных химических соединениях имеет различную валентность. Их называют элементами с переменной валентностью (таблица 3).
Зная валентность химических элементов, можно легко составить формулу бинарного (двухэлементного) соединения, образованного ими. Для этого следует записать химические знаки элементов, проставив над ними их валентность. Далее, определив наименьшее общее кратное чисел, выражающих валентность этих элементов, его делят на валентность каждого из них и находят их индексы. Например:
1) Определим валентность атома алюминия по кислороду в химическом соединении 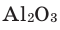 (оксид алюминия).
(оксид алюминия).
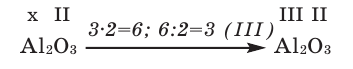
2) Составим химическую формулу соединения VII-валентного элемента марганца с кислородом:
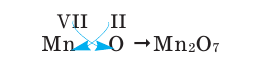
3) Если при составлении формулы по валентности полученные индексы сократить до минимальных целых чисел, в таком случае можно, проведя эту операцию, получить простую формулу вещества (поделив VI и II на самый большой делитель – 2, можно получить формулу).
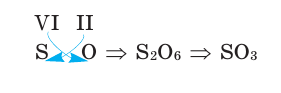
Химическая формула

Заполните таблицу. Как произносится химическая формула вещества?
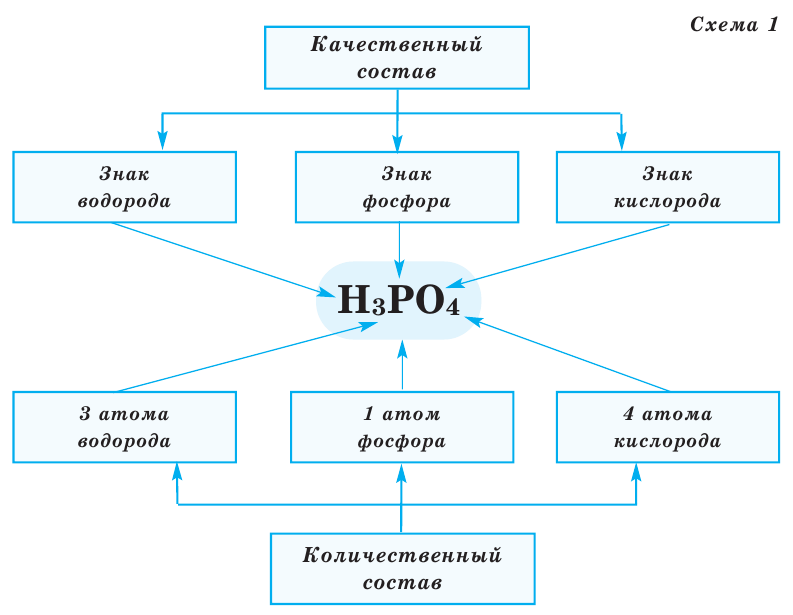
Все вещества имеют химическую формулу. Условное обозначение состава вещества при помощи химических знаков и индексов называют химической формулой. Химическая формула вещества выражает его количественный и качественный состав. Качественный состав вещества показывает, из атомов каких элементов оно состоит, а его количественный состав – число атомов элемента, содержащихся в его составе, т.е. в одной молекуле. Число, расположенное справа внизу у знака элемента и показывающее количество атомов, называется индексом (схема 1).
Число, стоящее перед химическими формулами и химическими знаками, называется коэффициентом.
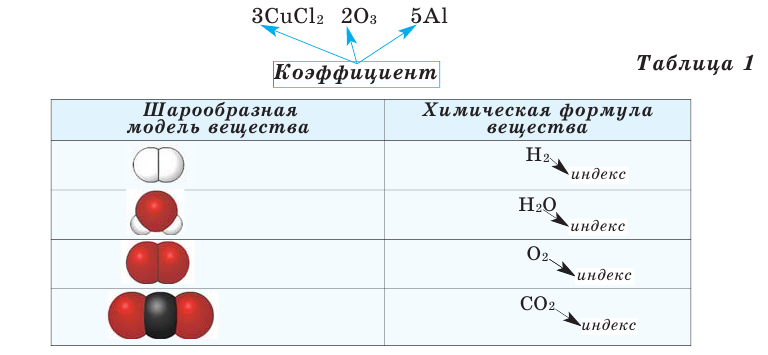
На основе представленных в таблице 1 моделей молекул и химических формул водорода, кислорода, воды и углекислого газа можно определить число атомов в их составе (таблица 2).

Пользуясь краткими названиями химических элементов, можно прочитать формулы:

Выясним, какие сведения о веществе можно получить по его химической формуле (таблица 3).

Состав веществ определяют разными физико-химическими способами, методом анализа результатов химических опытов. Так, например, в результате разложения воды под воздействием постоянного электрического тока наблюдается превышение в два раза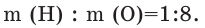 Т.е. при распаде 9 г воды будут получены 1 г водорода и 8 г кислорода. При сопоставлении данных чисел с относительными атомными массами элементов можно прийти к выводу, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Состав воды и других химических соединений, независимо от способа их получения и места нахождения, всегда остается постоянным. Основываясь на этом, в 1799 году французским химиком Ж.Л.Прустом был открыт «Закон постоянства состава веществ». В настоящее время закон постоянства состава веществ выражается следующим образом: Независимо от способа получения, состав и свойства химических соединений молекулярного строения всегда постоянны.
Т.е. при распаде 9 г воды будут получены 1 г водорода и 8 г кислорода. При сопоставлении данных чисел с относительными атомными массами элементов можно прийти к выводу, что молекула воды состоит из двух атомов водорода и одного атома кислорода. Состав воды и других химических соединений, независимо от способа их получения и места нахождения, всегда остается постоянным. Основываясь на этом, в 1799 году французским химиком Ж.Л.Прустом был открыт «Закон постоянства состава веществ». В настоящее время закон постоянства состава веществ выражается следующим образом: Независимо от способа получения, состав и свойства химических соединений молекулярного строения всегда постоянны.

Французский химик. В период с 1799 по 1806 гг. исследовал составы различных оксидов, сульфидов и других веществ. В итоге им был открыт закон постоянства состава химических соединений.
Данный закон о постоянстве и неизменности состава и свойств веществ с молекулярным строением является одним из основных законов химии. Для большинства химических соединений немолекулярного строения закон постоянства состава не подходит.
Как известно, не все вещества имеют молекулярное строение. Целая группа веществ имеет немолекулярное строение. Как же составляются химические формулы этих веществ? Химические формулы веществ с немолекулярным строением составляются на основе количественного соотношения частиц элементов (атомов или ионов) в соединениях. Для определения этого соотношения выясняется, сколько частиц другого элемента окружает (соединяется) частицу элемента в кристалле вещества немолекулярного строения. Исследования физическими методами строения кристаллов вещества позволяют получить такие сведения. В результате таких исследований стало известно, что в кварце количественное соотношение между атомами кремния (Si) и кислорода (О) составляет 1:2. Значит, его формулу можно представить в виде: 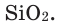 В хлориде алюминия же соотношение между ионами алюминия
В хлориде алюминия же соотношение между ионами алюминия 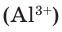 и хлора
и хлора  Следовательно, его формула –
Следовательно, его формула – 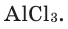
Начальные химические понятия и законы
Для овладения всесторонними знаниями о величинах атомов, а также их относительных и абсолютных массах требуется усвоить следующие важнейшие понятия.
Атом — это мельчайшая химически неделимая частица вещества.
Слово “атом” в переводе с древнегреческого языка означает ~ “неделимый”.
В настоящее время доказано, что атом состоит из ряда более мелких частиц.
Химический элемент — это вид определенных атомов. Например, атомы кислорода означают элемент кислород (табл. 1).
Каждый химический элемент обозначается символом — первой буквой своего латинского названия или при необходимости первой и следующей за ней буквами. Например, Н (аш) — химический символ водорода, от латинского слова Hydrogenium (“образующий воду”).
Будучи мельчайшими частицами, атомы обладают определенной массой. Так, абсолютная масса атома водорода составляет 0,00000000000000000000001674 г или 1,674•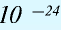 г. Абсолютная масса атома углерода — 19,993•
г. Абсолютная масса атома углерода — 19,993•  г.
г.
Относительная масса атома — это число, указывающее, во сколько раз масса атома химического элемента больше 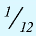 массы атома — изотопа
массы атома — изотопа 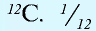 массы атома — изотопа
массы атома — изотопа 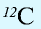 равна 1,66057•
равна 1,66057•  — 1 а.е.м.
— 1 а.е.м.
Относительная масса атома обозначается буквой Аг, где г — относительность (relative).
Количество вещества — величина, численно равная относительной атомной массе элемента, — выражается в г-молях (или молях).
В 1 моле любого вещества содержится 6,02• частиц (атомов, молекул, ионов). Число 6,02•
частиц (атомов, молекул, ионов). Число 6,02•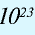 называется постоянной Авогадро.
называется постоянной Авогадро.
Таблица 1
Показатели некоторых химических элементов
| Химический элемент | Символ | Абсолютная масса атома, г | Абсолютная масса атома, 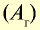 |
Число атомов в 1 моле |
| Водород | Н | 1,674•  |
1,008 | 6,02• |
| Кислород | О | 26,567• |
15,999 | 6,02• |
| Углерод | С |
19,993• |
12,011 | 6,02• |
Пример №1
Абсолютная масса атома кислорода равна 2,667• г. Определите его относительную атомную массу.
г. Определите его относительную атомную массу.
Решение. Единица массы 1 атома равна 1,66057• г.
г.
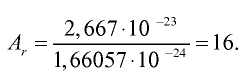
Ответ: 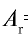 =16.
=16.
Пример №2
Какой будет масса (г) 0,301 •  атомов кислорода?
атомов кислорода?
Решение. 6,02 • атомов кислорода составляют 1 моль и равны 16 г.
атомов кислорода составляют 1 моль и равны 16 г.
Тогда, если 6,02 •  атомов кислорода —16 г, то 0,301•
атомов кислорода —16 г, то 0,301• атомов кислорода — х.
атомов кислорода — х.
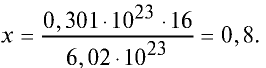
Ответ: 0,8 г.
Определение химической формулы
- Химическая формула — это выражение состава молекулы вещества посредством химических символов и (при необходимости) индексов.
- По химической формуле можно определить качественный и количественный состав вещества.
Например: 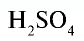 — серная кислота. Химическая формула
— серная кислота. Химическая формула 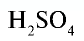 показывает, что это — одна молекула серной кислоты, в которой содержатся 2 атома водорода, 1 атом серы и 4 атома кислорода, или 1 моль вещества.
показывает, что это — одна молекула серной кислоты, в которой содержатся 2 атома водорода, 1 атом серы и 4 атома кислорода, или 1 моль вещества.
Точно так же можно найти абсолютную и относительную массы молекулы. Для нахождения абсолютной массы производится сложение абсолютных масс 2 атомов водорода, 1 атома серы и 4 атомов кислорода. Выполнение действий с такими малыми числами вызывает трудности, поэтому рассчитывают относительную массу молекулы (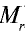 ) и количество молей вещества:
) и количество молей вещества:
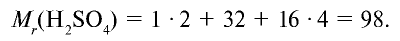
1 моль — значение, выраженное в граммах и численно равное относительной молекулярной массе вещества.
1 моль — количество вещества, содержащего столько структурных единиц (молекул, атомов, ионов, электронов), сколько атомов в 12 г изотопа углерода (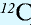 ).
).
В 12 г углерода содержится 6,02• атомов.
атомов.
Количество вещества обозначается буквой n и его значение выражается в молях.
Молярная масса вещества обозначается буквой М и выражается в г/молях (табл. 2).
Таблица 2
Показатели некоторых химических веществ
| Вещество | Химическая формула | Молярная масса, г/моль | Количество вещества, моль | Число молекул |
| Вода | 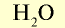 |
18 | 1 | 6,02• |
| Углекислый газ | 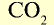 |
44 | 1 | 6,02• |
| Серная кислота | 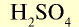 |
98 | 1 | 6,02• |
Валентность
1. Нахождение валентности элементов, входящих в состав вещества, по данным химическим формулам.
Свойство атомов элемента присоединять определенное число атомов другого элемента называется валентностью.
В качестве единицы измерения валентности принята валентность водорода.
Валентность атома водорода равна единице. Атом кислорода всегда двухвалентен.
Неизвестная валентность элемента определяется по водородным или кислородным соединениям, а также соединениям с каким-нибудь другим элементом, валентность которого известна.
Пример №3
Перепишите в тетрадь формулы следующих соединений и определите их валентность: 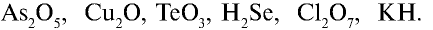
Решение.
1) 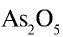 — валентность кислорода равна двум. Число атомов кислорода — пять, валентность каждого — два, общая валентность атомов кислорода (2•5=10) равна 10. Общая валентность мышьяка также должна быть равна десяти. Число атомов мышьяка в соединении — два: 10: 2 = 5. Следовательно, каждому атому мышьяка соответствуют 5 единиц. Валентность мышьяка в соединении — 5;
— валентность кислорода равна двум. Число атомов кислорода — пять, валентность каждого — два, общая валентность атомов кислорода (2•5=10) равна 10. Общая валентность мышьяка также должна быть равна десяти. Число атомов мышьяка в соединении — два: 10: 2 = 5. Следовательно, каждому атому мышьяка соответствуют 5 единиц. Валентность мышьяка в соединении — 5;
2) 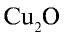 — 21•2, 2:2=1. Медь одновалентна;
— 21•2, 2:2=1. Медь одновалентна;
3) 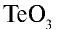 — 2•3 = 6, 6:1=6. Теллур шестивалентен;
— 2•3 = 6, 6:1=6. Теллур шестивалентен;
4) 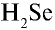 — 1•2 = 2, 2:1 = 2. Селен двухвалентен;
— 1•2 = 2, 2:1 = 2. Селен двухвалентен;
5) 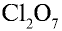 — 2 • 7 = 14, 14 : 2 = 7. Хлор семивалентен;
— 2 • 7 = 14, 14 : 2 = 7. Хлор семивалентен;
6) КН — 1•1 = 1, 1 : 1 =1. Калий одновалентен.
2. Составление формулы вещества, состоящего из двух элементов, валентности которых известны.
Пример №4
Составьте формулу оксида фосфора (V), зная, что фосфор пятивалентен, кислород двухвалентен.
Решение:
1) запишем символы фосфора и кислорода — РО;
2) запишем валентности элементов римскими цифрами над их символами — 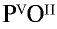 ;
;
3) определим самое малое общее делимое чисел, выражающих валентности, то есть пяти и двух. Оно равно десяти;
4) чтобы найти число атомов элементов в формуле, разделим общее делимое на валентности элементов: фосфор — 10 : 5 = 2; кислород — 10:2 = 5. Следовательно, в соединении фосфор представлен двумя, а кислород — пятью атомами.
5) запишем найденные числа атомов в индексе химических символов – 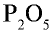 .
.
Пример №5
Определите валентность углерода в оксиде углерода (IV). Решение. Валентность кислорода в соединении равна двум, углерода — m. Если известны формула соединения и валентность (n) одного из элементов, валентность (m) второго можно определить по формуле
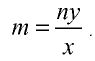
Например, валентность углерода в 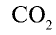 , равна
, равна 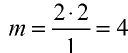 ; валентность кислорода —n = 2, число атомов кислорода — у = 2, число атомов углерода — х = 1.
; валентность кислорода —n = 2, число атомов кислорода — у = 2, число атомов углерода — х = 1.
Количество вещества
Определение количества вещества, если известна его масса, или нахождение его массы, если известно количество вещества.
Пример №6
Вычислите количество вещества в 49 г серной кислоты.
Решение.
1) 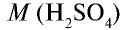 = 98 г/моль;
= 98 г/моль;
2) вычислим количество вещества n по формуле
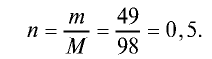
Ответ: 0,5 моля.
Пример №7
Сколько граммов составляют 5 молей оксида меди(||)?
Решение.
1) М (СuО) = 64+ 16- 80 г/моль;
2) найдем массу вещества по формуле
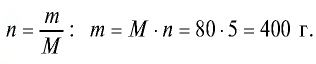
Ответ: 5 молей СuО равны 400 г.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях содержится одинаковое число молекул (закон Авогадро). 1 моль вещества в газообразном или парообразном состоянии при н.у. занимает объем 22,4 л, который называется молярным объемом (табл. 3).
Таблица 3
Молярные объемы некоторых газообразных веществ
| Вещество |  |
Молярная масса, г/моль | Молярный объем, л | Число молекул |
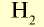 |
2 | 2 | 22,4 | 6,02• |
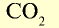 |
44 | 44 | 22,4 | 6,02• |
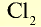 |
71 | 71 | 22,4 | 6,02• |
Плотность газа определятся по формуле 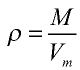 , а относительная плотность газа — по формуле
, а относительная плотность газа — по формуле 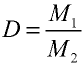 .
.
1. Определение объема газов.
Пример №8
Какой объем (л, ну) займут 22 г углекислого газа?
Решение:
1) 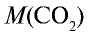 – 44 г/моль;
– 44 г/моль;
2) вычислим объем 22 г 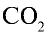 с помощью пропорции: 44 г
с помощью пропорции: 44 г 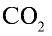 занимают объем 22,4 л, 22 г
занимают объем 22,4 л, 22 г 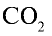 — займут х л объема,
— займут х л объема,
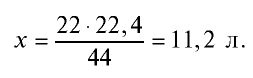
Ответ: 22 г 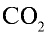 занимают объем 11,2 л.
занимают объем 11,2 л.
Определив количество вещества в 22 г углекислого газа, зная, что 1 моль любого газа занимает объем 22,4 л (н.у.), найдем
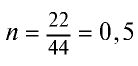 моля.
моля.
Если 1 моль газа занимает объем 22,4 л, то 0,5 моля — 11,2 л.
Пример №9
Каким будет объем 90 г воды, переведенной в газообразное (пар) состояние при 20°С ?
Решение. Жидкие и твердые вещества при переходе в газообразное состояние подчиняются тем же законам, что и газы. Поэтому:
1) М(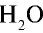 ) = 18 г/моль;
) = 18 г/моль;
2) рассчитаем объем 90 г воды в газообразном состоянии с помощью пропорции:
18 г 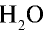 (пар) занимают объем 22,4 л,
(пар) занимают объем 22,4 л,
90г 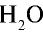 (пар) — х л объема,
(пар) — х л объема,
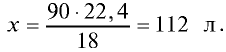
Ответ: объем 90 г водяного пара — 112 л.
Пример №10
Определите массу 7,84 м3 смеси, содержащей 71,45% метана и 28,55% оксида углерода (II).
Решение:
1) сколько метана и оксида углерода (II) содержится в 7,84 м3 смеси?
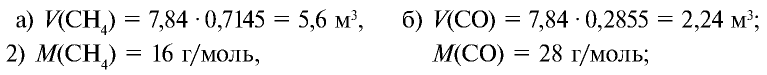
3)найдем массу 5,6 м3 СН4 с помощью пропорции: 22,4 м3 СН4 – 16 кг,
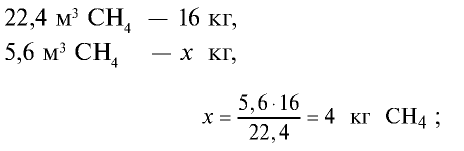
4) найдем массу 2,24 м3 СО с помощью пропорции: 22,4 м3 СО – 28 кг,
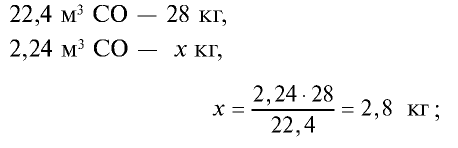
5) общая масса смеси газов: 4 кг + 2,8 кг = 6,8 кг.
Ответ: общая масса смеси газов — 6,8 кг.
Пример №11
Рассчитайте количество вещества и число молекул в 1 л воды при 20°С .
Решение:
1) найдем массу 1 л воды. Плотность воды — 1 г/см3. Отсюда т{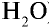 ) = 1000 см3 • 1 г/см3 = 1000 г;
) = 1000 см3 • 1 г/см3 = 1000 г;
2) вычислим количество вещества в 1000 г воды:
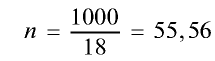 моль.
моль.
3) определим число молекул в 1 л (в 1000 г, или 55,56 моля) воды с помощью пропорции: в 1 моле воды — 6,02• молекул, в 55,56 молях воды — х молекул,
молекул, в 55,56 молях воды — х молекул,
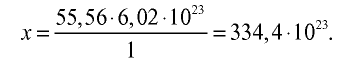
Ответ: в 1 л воды содержится 55,56 моля, 334,4 •  или 3,344 •
или 3,344 • 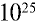 молекул.
молекул.
Пример №12
Какой объем (л,н.у.) займут 16 г оксида серы (IV)?
Решение:
1) найдем количество вещества в 16 г  :
:
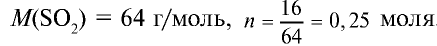 .
.
2) вычислим, какой объем займут 16 г (или 0,25 моля)  с помощью пропорции:
с помощью пропорции:
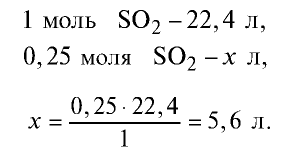
Ответ: 16 г  займут 5,6 л объема.
займут 5,6 л объема.
Вычисление плотности газов
Плотность газов определяется путем деления их молярной массы на молярный объем:
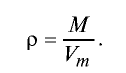
Пример №13
Рассчитайте плотность углекислого газа.
Решение:
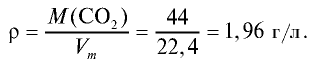
Ответ: плотность углекислого газа — 1,96 г/л.
Пример 2. Рассчитайте молярную массу газа с плотностью р = 2,86 г/л.
Решение.
Из формулы
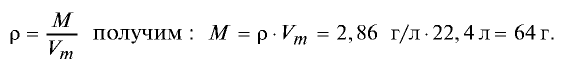
Ответ: молярная масса газа с плотностью 2,86 г/л —64 г.
Вычисление относительной плотности газов
Пример №14
Вычислите плотность метана относительно водорода.
Решение:
1) рассчитаем молекулярные массы метана и водорода:
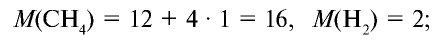
2) определим плотность метана относительно водорода:
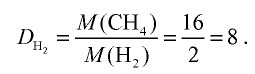
Ответ: плотность метана относительно водорода равна 8, или метан тяжелее водорода в 8 раз.
Пример №15
Определите относительную плотность газовой смеси, содержащей 40% угарного газа и 60 % углекислого газа.
Решение:
1) найдем среднюю молекулярную массу газовой смеси.
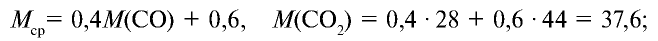
2) вычислим плотность газовой смеси относительно водорода:
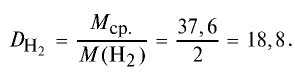
Ответ: плотность газовой смеси относительно водорода равна 18,8. Пример 3. В процессе производства азотного удобрения на Ферганском производственном объединении “Азот” в качестве промежуточного вещества образуется оксид азота (IV). Найдите плотность оксида азота (IV) относительно воздуха.
Решение:
1) молекулярная масса оксида азота (IV)
M(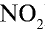 ) = 46 г/моль.
) = 46 г/моль.
Средняя молекулярная масса воздуха — 29 г/моль;
2) вычислим плотность оксида азота (IV) относительно воздуха:
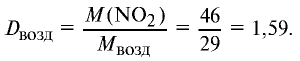
Ответ: плотность оксида азота (IV) относительно воздуха равна 1,59.
Пример №16
Плотность пара белого фосфора относительно гелия равна 31. Рассчитайте молекулярную массу белого фосфора.
Решение.
Из формулы
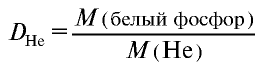
следует, что М(белый фосфор) = 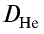 • М (Не) = 31•4 = 124 г/моль.
• М (Не) = 31•4 = 124 г/моль.
Ответ: молекулярная масса белого фосфора равна 124.
Закон эквивалентности
Химические элементы присоединяются друг к другу или замещаются в весовых количествах, пропорциональных своим эквивалентам (закон эквивалентности).
Эквивалентностью элемента называется количество этого элемента, присоединяющего или замещающего 1 моль или 1 г атомов водорода.
Отношение относительной атомной массы элемента к его валентноcти есть эквивалентность этого элемента: 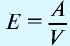
Эквивалентность оксида выражается формулой: 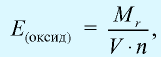 где
где  — молекулярная масса оксида; V — валентность элемента, образующего оксид; n — число атомов элемента, образующего данный оксид.
— молекулярная масса оксида; V — валентность элемента, образующего оксид; n — число атомов элемента, образующего данный оксид.
Эквивалентность оснований выражается формулой: 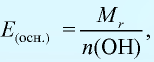
где  — молекулярная масса основания; n(ОН) — число гидроксильных групп в основании.
— молекулярная масса основания; n(ОН) — число гидроксильных групп в основании.
Эквивалентность кислот выражается формулой: 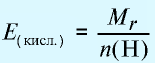 где
где  — молекулярная масса кислоты;
— молекулярная масса кислоты;
n(H) — число атомов водорода, замещаемых металлом, содержащимся в кислоте.
Эквивалентность солей выражается формулой: 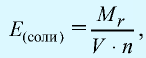 где
где  — молекулярная масса соли; V — валентность металла, образующего соль; n — число атомов металла, образующего соль.
— молекулярная масса соли; V — валентность металла, образующего соль; n — число атомов металла, образующего соль.
Пример №17
Определите эквивалентность железа в двух- и трехвалентных соединениях.
Решение:
1) найдем эквивалентность железа в двухвалентных соединениях:
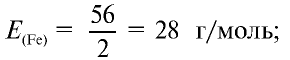
2) найдем эквивалентность железа в трехвалентных соединениях:
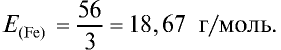
Ответ: эквивалентность железа в двухвалентных соединениях равна 28, в трехвалентных соединениях — 18,67 г/моль.
Пример №18
47,26 г меди, соединяясь с 52,74 г хлора, образуют соль хлорид меди (II). Рассчитайте эквивалентность меди, зная, что эквивалентность хлора равна 35,45 г/моль.
Решение:
1) уточним условия задачи:
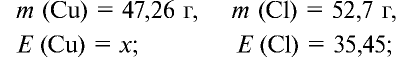
2) определим эквивалентность меди, пользуясь формулой 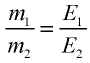
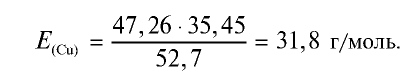
Ответ: эквивалентность меди равна 31,8 г/моль.
Энергетические явления в химических реакциях
Во всех химических реакциях происходит выделение или поглощение энергии.
Реакции, сопровождающиеся выделением теплоты, называются экзотермическими.
Реакции, сопровождающиеся поглощением теплоты, называются эндотермическими.
Количество теплоты, которое выделяется или поглощается при образовании из простых веществ 1 моля сложного вещества, называется теплотой образования вещества. Теплота разложения любого сложного вещества на простые вещества равна его теплоте образования и выражается противоположным знаком (закон Лавуазье и Лапласа).
Например: 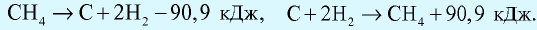 Тепловой эффект реакций обусловлен природой исходных веществ и образовавшихся продуктов и не имеет отношения к промежуточным этапам реакции (закон Гесса).
Тепловой эффект реакций обусловлен природой исходных веществ и образовавшихся продуктов и не имеет отношения к промежуточным этапам реакции (закон Гесса).
Пример №19
Для приготовления пищи в школьной столовой израсходовано 100 л метана (метан — основной компонент природного газа). Сколько тепла выделилось при сгорании 100 л метана? Тепловой эффект реакции горения метана равен + 880 кДж/моль.
Решение.
При полном сгорании 1 моля метана (22,4 л) выделяется 880 кДж тепла. Сколько тепла выделится при сгорании 100 л метана?
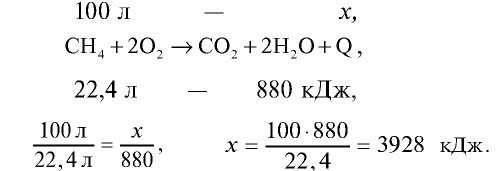
Ответ: при сгорании 100 л метана выделяется 3928 кДж.
Пример №20
Рассчитайте тепловой эффект реакции горения аммиака. Известно, что теплота испарения воды 241,88 кДж/моль, теплота образования  — 46,2 кДж/моль.
— 46,2 кДж/моль.
Решение.
Запишем реакцию горения аммиака:
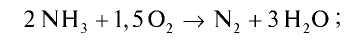
Найдем тепловой эффект реакции горения аммиака на основе закона Гесса. Для этого из суммы теплоты образования продуктов реакции вычтем сумму теплоты образования веществ, взятых в реакцию (примем, что теплота образования простых веществ равна нулю).
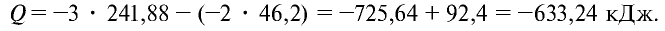
Ответ: 633,24 кДж.
- Относительная атомная и относительная молекулярная масса
- Молярная масса в химии
- Физические и химические явления
- Растворы в химии
- Вещества и их свойства в химии
- Чистые вещества и смеси в химии
- Состав и строение веществ в химии
- Простые и сложные вещества в химии
Вы знаете, чем простые вещества отличаются от сложных? Напомню, что молекулы простых веществ состоят из атомов одного вида (сера S, золото Au, кислород O2), а сложные – из атомов разных видов (вода Н2О, фосфорная кислота Н3РО4, этиловый спирт С2Н5ОН). Тут резонно задать вопросом, а почему атомы не соединятся один с одним, ведь так всё будет гораздо проще, мы получим вещества с формулами вида НО, HS, CaOH и так далее. Но это решительно невозможно потому, что в дело вступает валентность.
Напомню, что валентность – это способность атома образовывать химическую связь. Вот представьте, что атом водорода хочет соединиться с атомом кислорода (это будет вода). И тут проблема:
водород всегда имеет валентность I, а кислород всегда имеет валентность II.
Это означает, что один атом водорода может образовать только одну связь и не больше. А атому кислорода подавай две и не меньше! Как же быть? А давайте-ка одному предложим соединиться с двумя атомами водорода. Это будет выглядеть так: Н-О-Н. Здесь тире означает ту самую химическую связь. И, как видно из этой простой схемы, все счастливы: каждый атом водорода получил одну связь, а единственный атом кислорода радостно образовал две. Таким образом, формула воды Н2О.
Перед тем, как мы начнём тренироваться, нужно запомнить две принципиально важные вещи. Мы их рассмотрим на примере оксида алюминия:
1. Валентность пишется над знаком элемента и всегда римскими цифрами. Валентность никогда не может быть дробной, это всегда целое число. Просто потому, что атома связаны одной, двумя, тремя связями. Атомы не могут быть связаны полутора, двумя с половиной или тремя четвертями связей.
2. Рядом со знаком элемента внизу справа находится индекс. Это важно запомнить! Индекс (он пишется привычной арабской цифрой) показывает, сколько атомов данного вида входит в молекулу. В нашем примере мы видим, что в молекуле оксида алюминия имеется два атома алюминия (справа внизу от знака алюминия цифра 2) и три атома кислорода (справа внизу от знака кислорода цифра 3). Индекс всегда целое число! Потому что в молекулу не может входит половина атома или полтора атома. Представьте для наглядности, что молекула – это семья, где есть родственники. В семье же не может быть две с половиной бабушки или полтора брата. По крайней мере, я таких не видела.
А теперь тренировка
Учитель химии просит
составить формулу вещества, при этом валентность атомов известна.
Напомню, что некоторые атомы, склонные к постоянству, всегда имеют одинаковую валентность. Она определяется группой, в которой атом стоит в таблице Менделеева. Так, металлы основной подгруппы первой группы всегда имеют валентность I, второй – II, третьей – III. Элементы основной подгруппы седьмой группы имеют валентность I (пока просто запомните это). Итак, нам нужно составить формулу оксида натрия. Сразу понимаем, что молекула состоит из атомов натрия и кислорода. Записываем это: NaO. Теперь вспоминаем про валентность (без неё никак): натрий – элемент основной подгруппы первой группы, имеющий валентность I, кислород тоже постоянен в привычках и имеет валентность II. Записываем и это:
Обратите внимание, что пока индексы обозначены X и Y, ведь мы же их не знаем. Репетитор по химии расскажет, что нужно найти наименьшее кратное и будет говорить всякие другие страшные слова, но мы будем действовать проще. Поставьте валентность по диагонали, превратив их в арабские цифры:
Смотрите, что произошло. Валентность кислорода II. Мы превращаем её в арабскую 2 и переносим по диагонали к натрию. Валентность натрия I. Мы превращаем её в арабскую 1 и переносим к кислороду. Вы скажете, что справа внизу от кислорода нет никаких единиц, в чём дело? А дело в том, что если в молекуле уже есть атом, то понятно, что он есть и он один. Мы же в формуле указали, что кислород присутствует, значит, он и есть в единственном числе. Таким образом формула оксида натрия Na2О.
Другой случай. Нам нужна формула оксида цинка. Кислород с валентностью II встречается с цинком, который тоже всегда имеет валентность II. Это идеальная пара, смотрите:
Цинк образует две связи и кислород образует две связи, значит, им больше ничего не нужно, эти два атома свяжутся друг с другом с помощью двух связей. Не надо ничего переносить по диагонали, достаточно понять, что если валентности равны, то атомы соединяются один к одному, то есть формула оксида цинка ZnO.
Теперь разберём пример посложнее. В учебнике химии задание: составить формулу оксида железа (III). Обратите внимание, что тут указана валентность железа. Так пишут в случае, когда элемент может обладать разной валентность. Например, желез может быть двухвалентным или трёхвалентным. Чтобы было понятно, о каком именно идёт речь, валентность указывают в скобках. Итак, действуем привычным способом:
Что мы видим? Валентности, увы, разные, следовательно атомы не соединяются один к одному. Тогда без колебаний действуем как в первом примере: используем перенос по диагонали. Валентность железа III превращаем в арабскую 3 и приписываем справа внизу к кислороду. Валентность кислорода II превращаем в арабскую 2 и приписываем внизу справа к железу. Вуаля!
Вот так симпатично и выглядит оксид железа (III) Fe2О3!
Продолжаем. Хотите узнать формулу оксида серы (VI)? Это просто. Давайте сразу запишем:
Тут придётся слегка напрячься. По идее мы можем сделать перенос по диагонали и получить формулу S2О6. Но это неверно, будьте внимательны! Дело в том, что в такой куче получается слишком много атомов, а ведь их можно просто уменьшить в два раза, получив более простую (и правильную!) формулу SО3.
Ну и в заключение ещё один пример, который может встретиться в контрольной по химии. Как выглядит оксид азота (V)? Азот, кстати, тоже любит хулиганить и выступать с разной валентностью. Конкретно в этом случае у него валентность V. Думаю, теперь уже без заумных пояснений понятно, что формула будет такой:
Ура!
Но спешу вас немного огорчить: пока мы натренировались составлять формулы, если известна валентность. В следующий раз мы будет решать обратную задачу: зная формулу, будем определять валентность. Это уже гораздо проще, так что готовьте чай и печеньки.
Пожалуйста, пишите в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Загрузить PDF
Загрузить PDF
Если вам задали домашнее задание, в котором требуется найти эмпирическую формулу соединения, но вы не знаете, с чего начать, не бойтесь! wikiHow придет вам на помощь! Сначала прочтите базовые знания, которые необходимы вам для нахождения эмпирической формулы, а затем просмотрите пример во второй части статьи.
-

1
Узнайте, что такое эмпирическая формула. В химии ЭФ – это самый простой способ описания соединения – по сути это список элементов, образующих соединение с учетом их процентного содержания. Нужно обратить внимание, что эта простейшая формула не описывает порядок атомов в соединении, она просто указывает, из каких элементов оно состоит.[1]
For example:- Соединение, состоящее из 40,92% углерода; 4,58% водорода и 54,5% кислорода, будет иметь эмпирическую формулу C3H4O3 (пример того, как найти ЭФ этого соединения будет рассмотрен во второй части).
-

2
Усвойте термин ‘процентный состав’. ‘Процентным составом’ называется процентное содержание каждого отдельного атома во всем рассматриваемом соединении. Чтобы найти эмпирическую формулу соединения, необходимо знать процентный состав соединения. Если вы находите эмпирическую формулу в качестве домашнего задания, то проценты, скорее всего, будут даны.
- Чтобы найти процентный состав химического соединения в лаборатории, его подвергают некоторым физическим экспериментам, а затем – количественному анализу. Если вы не находитесь в лаборатории, вам не нужно делать эти эксперименты.
-

3
Имейте в виду, что вам придется иметь дело с грамм-атомами. Грамм-атом – это определенное количество вещества, масса которого равна его атомной массе. Чтобы найти грамм-атом, нужно воспользоваться следующим уравнением: Процентное содержание элемента в соединении делится на атомную массу элемента.[2]
- Допустим, к примеру, что у нас есть соединение, содержащее 40,92% углерода. Атомная масса углерода равна 12, поэтому наше уравнение будет иметь 40,92 / 12 = 3,41.
-

4
Знайте, как находить атомное соотношение. Работая с соединением, у вас будет получаться больше одного грамм-атома. После нахождения всех грамм-атомов вашего соединения, посмотрите на них. Для того, чтобы найти атомное соотношение, вам нужно будет выбрать наименьшее значение грамм-атома, которые вы вычислили. Затем нужно будет разделить все грамм-атомы на наименьший грамм-атом. Например:
- Допустим вы работаете с соединением, содержащим три грамм-атома: 1,5; 2 и 2,5. Наименьшее из этих чисел – 1,5. Поэтому, чтобы найти соотношение атомов, вы должны разделить все числа на 1,5 и поставить между ними знак отношения :.
- 1,5 / 1,5 = 1. 2 / 1,5 = 1,33. 2,5 / 1,5 = 1,66. Следовательно, соотношение атомов равно 1 : 1,33 : 1,66.
-

5
Разберитесь, как переводить значения отношений атомов в целые числа. Записывая эмпирическую формулу, вы должны использовать целые числа. Это значит, что вы не можете использовать числа вроде 1,33. После того, как вы найдете отношение атомов, вам нужно перевести дробные числа (вроде 1,33) в целые (например, 3). Для этого вам нужно найти целое число, умножив на которое каждое число атомного соотношения, вы получите целые числа. Например:
- Попробуйте 2. Умножьте числа атомного соотношения (1, 1,33 и 1,66) на 2. Вы получите 2, 2,66 и 3,32. Это не целые числа, поэтому 2 не подходит.
- Попробуйте 3. Если вы умножите 1, 1,33 и 1,66 на 3, у вас получится 3, 4 и 5 соответственно. Следовательно, атомное соотношение целых чисел имеет вид 3 : 4 : 5.
-

6
Разберитесь, что значат эти целые числа для эмпирической формулы. Соотношение целых чисел, которое мы только что нашли, подходит для эмпирической формулы. Эти три числа являются маленькими числами, которые записываются под каждой буквой, представляющей отдельный элемент химического соединения. Например, наша рассчитанная эмпирическая формула будет иметь вид:
- X3Y4Z5
Реклама
-

1
Определите процентный состав соединения. Если вы пытаетесь найти эмпирическую формулу для домашней работы, то вам, вероятнее всего, будет дан процентный состав, вам просто нужно знать, как он выглядит. Например:
- Допустим, в задании просят рассмотреть образец витамина C. В него входят 40,92% углерода, 4,58% водорода 54,5% кислорода — это и есть процентный состав.
- 40,92% витамина C состоит из углерода, а остальная часть состоит из 4,58% водорода и 54,5% кислорода.
-

2
Найдите значения грамм-атомов в соединении. Как было сказано в части 1, уравнение для нахождения количества грамм-атомов имеет вид: Процентное содержание элемента в соединении (%) деленное на атомную массу элемента. В нашем примере есть углерод, атомная масса которого 12, водород, с атомной массой 1, и кислород, с атомной массой 16.
- Количество грамм-атомов углерода = 40,92 / 12 = 3,41
- Количество грамм-атомов водорода = 04,58 / 01 = 4,58
- Количество грамм-атомов кислорода = 54,50 / 16 = 3,41
-

3
Выясните атомное соотношение. Найдите наименьший грамм-атом из всех вычисленных. В нашем примере – это 3,41 (углерод или кислород – у них одинаковое значение). Затем вы должны разделить все значения грамм-атомов на это число. Соотношение будет выглядеть следующим образом: значение для углерода : значение для водорода : значение для кислорода.
- Углерод: 3,41 / 3,41 = 1
- Водород: 4,58 / 3,41 = 1,34
- Кислород: 3,41 / 3,41 = 1
- Атомное соотношение – 1 : 1.34 : 1.
-

4
Переведите соотношение в целые числа. Если ваше атомное соотношение состоит из целых чисел, то вы можете пропустить этот шаг. В нашем примере, однако, нам нужно превратить 1,34 в целое число. Наименьшее число, которое можно умножить числа в атомном соотношении – это 3.
- 1 x 3 = 3 (подходит, так как 3 – целое число).
- 1,34 x 3 = 4 (4 – также целое число).
- 1 x 3 = 3 (и снова, 3 – это целое число).
- Следовательно, полученное соотношение целых чисел имеет вид углерод (C) : водород (H) : кислород (O) = 3 : 4 : 3
-

5
Запишите эмпирическую формулу. Для этого, все что вам нужно – это записать букву каждого компонента, в нашем случае – C для углерода, H для водорода и O для кислорода, с сопутствующими им числами в виде нижних индексов. В нашем примере эмпирическая формула имеет вид:
- C3H4O3
Реклама
Советы
- Молекулярная формула отражает общее количество присутствующих атомов, тогда как эмпирическая отражает наименьшее соотношение между отдельными атомами.
- Если вам нужно найти процентное соотношение в лаборатории, то вы должны будете провести над образцом соединения спектрометрические эксперименты.
Реклама
Об этой статье
Эту страницу просматривали 22 027 раз.
