Кислотные оксиды


4.5
Средняя оценка: 4.5
Всего получено оценок: 1555.
4.5
Средняя оценка: 4.5
Всего получено оценок: 1555.
Оксиды – сложные вещества, состоящие из двух элементов, один из которых кислород. В названиях оксидов сначала указывают слово оксид, затем название второго элемента, которым он образован. Какие особенности имеют кислотные оксиды, и чем они отличаются от других видов оксидов?
Классификация оксидов
Оксиды делятся на солеобразующие и несолеобразующие. Уже по названию ясно, что несолеобразующие не образуют солей. Таких оксидов немного : это вода H2 O, фторид кислорода OF2 (если условно его считать оксидом), угарный газ, или оксид углерода (II), монооксид углерода CO; оксиды азота (I) и (II): N2 O (оксид диазота, веселящий газ) и NO (монооксид азота).
Солеобразующие оксиды образуют соли при взаимодействии с кислотами или щелочами. В качестве гидроксидов им соответствуют основания, амфотерные основания и кислородосодержащие кислоты. Соответственно они называются основными оксидами (например, CaO), амфотерными оксидами (Al2 O3 ) и кислотными оксидами, или ангидридами кислот (CO2).
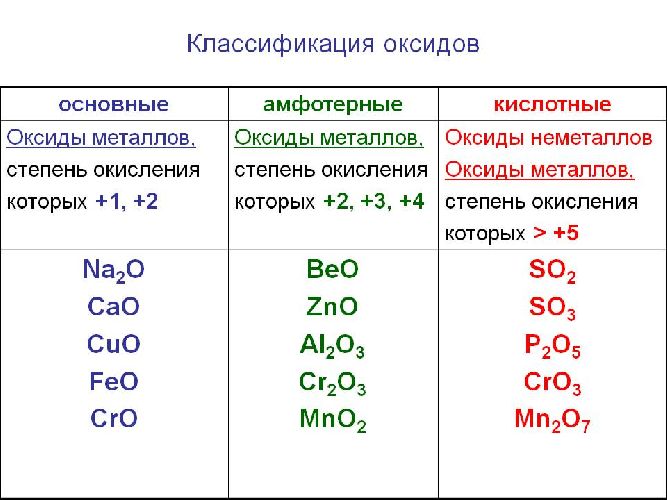
Часто перед учащимися встает вопрос, как отличить основной оксид от кислотного. Прежде всего необходимо обратить внимание на второй элемент рядом с кислородом. Кислотные оксиды – содержат неметалл или переходный металл (CO2 , SO3 , P2 O5 ) основные оксиды – содержат металл (Na2 O, FeO, CuO).
Основные свойства кислотных оксидов
Кислотные оксиды (ангидриды) – вещества, которые проявляют кислотные свойства и образуют кислородосодержащие кислоты. Следовательно, кислотным оксидам соответствуют кислоты. Например, кислотным оксидам SO2 ,SO3 соответствуют кислоты H2 SO3 и H2 SO4 .
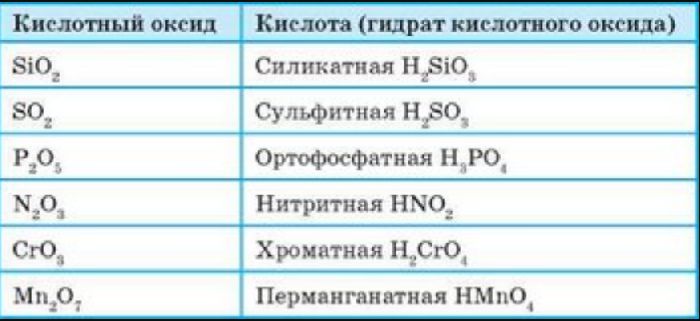
Кислотные оксиды, образуемые неметаллами и металлами с переменной валентностью в высшей степени окисления (например, SO3 , Мn2 O7 ), реагируют с основными оксидами и щелочами, образуя соли:
SO3 (кислотный оксид)+CaO (основной оксид)=СaSO4 (соль);
Типичными реакциями являются взаимодействие кислотных оксидов с основаниями в результате чего образуется соль и вода:
Mn2 O7 (кислотный оксид)+2KOH (щелочь)=2KMnO4 (соль)+H2O (вода)
Все кислотные оксиды, кроме диоксида кремния SiO2 (кремниевый ангидрид, кремнезем), реагируют с водой, образуя кислоты:
SO3 (кислотный оксид)+H2O (вода)=H2SO4 (кислота)
Кислотные оксиды образуются при взаимодействии с кислородом простых и сложных веществ (S+O2 =SO2 ), либо при разложении в результате нагревания сложных веществ, содержащих кислород, – кислот, нерастворимых оснований, солей (H2 SiO3 =SiO2 +H2 O).
Список кислотных оксидов:
| Название кислотного оксида | Формула кислотного оксида | Свойства кислотного оксида |
| Оксид серы (IV) | SO2 | бесцветный токсичный газ с резким запахом |
| Оксид серы (VI) | SO3 | легколетучая безцветная токсичная жидкость |
| Оксид углерода (IV) | CO2 | бесцветный газ без запаха |
| Оксид кремния (IV) | SiO2 | бесцветные кристаллы, обладающие прочностью |
| Оксид фосфора (V) | P2 O5 | белый легковозгораемый порошок с неприятным запахом |
| Оксид азота (V) | N2 O5 | вещество, состоящее из бесцветных летучих кристаллов |
| Оксид хлора (VII) | Cl2 O7 | бесцветная маслянистая токсичная жидкость |
| Оксид марганца (VII) | Mn2 O7 | жидкость с металлическим блеском, являющаяся сильным окислителем. |


Что мы узнали?
Кислотные оксиды относятся к солеобразующим оксидам и образуются с помощью кислот. Кислотные оксиды вступают в реакции с основаниями и водой, а их образование происходит при нагревании и разложении сложных веществ.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Владимир Мартынов
7/10
-

Polina Malchikova
9/10
-

Дима Кулагин
10/10
-

Сергей Ефремов
9/10
-

Артём Макушенко
10/10
-

Наталия Григорьева
10/10
-

Данила Волков
9/10
Оценка доклада
4.5
Средняя оценка: 4.5
Всего получено оценок: 1555.
А какая ваша оценка?
Методические
рекомендации для учащихся первого курса
по теме: «Основные классы неорганических
соединений»
1. ОКСИДЫ
– сложные вещества, состоящие из двух
элементов, одним из которых является
кислород в степени окисления -2.
Элементом
может быть как металл, так и неметалл.
2. КИСЛОТЫ
– сложные вещества, состоящие из атомов
водорода, способных
замещаться атомами металла,
и кислотных остатков. Водород в формулах
кислот всегда пишется на первом месте.
Кислоты – это
гидроксиды неметаллов.
3. ОСНОВАНИЯ
– сложные вещества, состоящие из атомов
металла и одной или нескольких
гидроксогрупп ОН.
Основания – это
гидроксиды металлов.
4. СОЛИ
– сложные вещества, состоящие из атомов
металла и кислотных остатков.
II Классификация оксидов
Все оксиды делят
на две группы: солеобразующие
и несолеобразующие.
Несолеобразующие
– это оксиды, которые не образуют солей
ни с кислотами, ни
с основаниями. К
ним относятся оксиды: CO,
NO,
N2O,
SiO.
Все эти оксиды –
оксиды неметаллов.
Солеобразующие
оксиды –
это оксиды, которые образуют соли
либо с кислота-
ми,
либо с основаниями.
Солеобразующие
оксиды делят
на три группы: кислотные,
основные и амфо-
терные.
КИСЛОТНЫЕ
ОКСИДЫ – это
оксиды, которым соответствуют кислоты.
К
ним относятся все
оксиды неметаллов
(за исключением несолеобразующих) и
оксиды металлов
с валентностью 4 и больше.
Например:
SO3
– H2SO4
SO2
– H2SO3
CO2
– H2CO3
SiO2
– H2SiO3
P2O5
– H3PO4
и
HPO3
N2O5
– HNO3
CrO3
– H2CrO4
SeO2
– H2SeO3
(Оксиды S,
C,
Si,
P,
N
– это оксиды неметаллов, а оксиды Cr
(VI)
и Se
(IV)
– это
оксиды металлов.
Однако и те и другие – это кислотные
оксиды).
Таким образом,
надо иметь в виду, что оксиды неметаллов
– это всегда кислотные
оксиды, а оксиды
металлов могут быть как основными, так
и кислотными.
ОБРАТИТЕ ВНИМАНИЕ!
Валентность (и степень окисления)
элемента в оксиде
и кислоте должны
быть ОДИНАКОВЫМИ.
Формулу кислоты
легко записать по формуле оксида Для
этого надо мысленно
(или на черновике)
прибавить
воду Н2О
к оксиду и
(если в этом есть необходи-
мость) сократить.
Например:
формула оксида N2O3.
Прибавляем к N2O3
воду Н2О.Получаем
–
Н2
N2O4;
сокращаем на 2 – получаем Н
NO2.
Второй пример:
формула оксида V2O5.
Прибавляем к V2O5
воду Н2О.
Получаем – Н2
V2O6;
сокращаем на 2 – получаем Н
VO3.
Третий пример:
формула оксида Cl2O7.
Прибавляем к Cl2O7
воду Н2О.
Получаем – Н2
Cl2O8;
сокращаем на 2 – получаем Н
ClO4.
Четвертый пример:
формула оксида МоO3.
Прибавляем к МоO3
воду Н2О.
Получаем – Н2
МоO4;
естественно, сокращать в этом случае
просто нечего.
ОСНОВНЫЕ
ОКСИДЫ – это
оксиды, которым соответствуют основания.
К
ним относятся
только оксиды
металлов
(за исключением тех, которые относятся
к кислотным, то-есть
с валентностью металла 4 и больше.
НАПРИМЕР: К2О
– КОН Na2O
– NaOH
BaO
– Ba(OH)2
FeO –
Fe(OH)2
Fe2O3
– Fe(OH)3
CrO – Cr(OH)2
Ag2O
– AgOH
ПОМНИТЕ!
Валентность гидроксогруппы
ОН равна 1.
Валентность металла
может быть не
только постоянной, но и переменной.
АМФОТЕРНЫЕ
ОКСИДЫ – это
оксиды, которые проявляют свойства как
основных, так и
кислотных оксидов. К ним относятся
только
некоторые оксиды
металлов –
Al2O3,
ZnO,
BeO,
Cr2O3
(эти оксиды надо запомнить) и ряд других.
Если амфотерный
оксид реагирует с кислотой, то он
реагирует как обычный
основный оксид.
Если же амфотерный оксид реагирует со
щелочью, то в этом
случае он реагирует
как кислотный оксид и ему соответствует
кислота, формулу
которой находим
так же, как и с любым кислотным оксидом,
то-есть прибавляя
Н2О.
НАПРИМЕР:
Al2O3
– Н2Al2O4;
сокращаем на 2, получаем НАlО2.
Если же Al2O3
реагирует с
кислотой, то, естественно, ему соответствует
гидроксид Аl(ОН)3.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Е.Н.ФРЕНКЕЛЬ
Самоучитель по химии
Пособие для тех, кто не знает, но хочет
узнать и понять химию
Продолжение. Начало см. в № 13/2007
Глава 2. Важнейшие классы
неорганических соединений
2.1. Оксиды
Оксиды – сложные вещества, которые состоят из
атомов двух химических элементов, один из
которых кислород.
Определим, какое из следующих соединений оксид:
PH3, H3PO4, P2O5.
К оксидам относят соединение P2O5.
Два других вещества – не оксиды: в состав РН3
не входит атом кислорода, а в состав H3PO4 входят
атомы трех химических элементов – H, Р, O.
Названия оксидов складываются из двух слов:
первое слово – «оксид», второе слово – название
химического элемента, образующего данный оксид,
в родительном падеже. Например: СаО – оксид
кальция.
Если оксид образован химическим элементом с
переменной валентностью, то после названия
элемента нужно указать его валентность.
Например: Fe2О3 – оксид железа(III), FеО –
оксид железа(II).
Задание 2.1. Среди следующих соединений
найдите оксиды и назовите их:
N2O3, NH3, MnO2, H2O,
HCl, NaOH, Na2O, P2O5, H2SO4.
Задание 2.2. Составьте формулы следующих
оксидов:
оксид хрома(III), оксид углерода(IV), оксид магния,
оксид серы(VI), оксид азота(V), оксид калия, оксид
марганца(VI).
Многие оксиды могут реагировать с кислотами
или основаниями. В таких реакциях получаются
соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов,
которые к таким реакциям не способны. Такие
оксиды называют несолеобразующими.
Задание 2.3. Назовите несолеобразующие оксиды:
H2O, CO, N2O, NO, F2O.
Некоторые оксиды имеют особые (тривиальные)
названия: Н2О – вода, СО – угарный газ, СО2
– углекислый газ и др.
Солеобразующие оксиды подразделяют на три
группы: основные, кислотные, амфотерные.
Точно установить характер оксида можно, только
изучая его химические свойства. Например,
кислотные оксиды реагируют с основаниями и не
реагируют с кислотами. Основные оксиды реагируют
с кислотами и не реагируют с основаниями.
Амфотерные оксиды могут реагировать и с
кислотами, и с основаниями.
По формуле оксида можно определить, какими
свойствами он обладает. Правда, иногда эта оценка
будет приблизительной.
• Неметаллы образуют только кислотные и
безразличные оксиды.
• Металлы в зависимости от валентности могут
образовывать разные оксиды – основные, амфотерные
и кислотные.
Предсказать свойства оксида металла может
помочь эта схема:

Основные оксиды металлов от кислотных оксидов
металлов отличить легко: малая валентность
металла – основный оксид, большая – кислотный.
Как быть с амфотерными оксидами? «Любимая»
валентность металлов в этих оксидах III, но есть и
исключения. Поэтому желательно запомнить
формулы наиболее часто встречающихся амфотерных
оксидов: ZnO, Al2O3, SnO, PbO, Cr2O3.
Задание 2.4. Назовите амфотерные оксиды:
ZnO, SnO, PbO, Al2O3, Cr2O3.
Задание 2.5. Классифицируйте приведенные
ниже оксиды:
V2O5, SO2, ZnO, Fe2O3,
SO3, CO2, Li2O, FeO, Al2O3, H2O,
BaO.
Задание рекомендуется выполнить по следующей
схеме.
1) Определить, какой это оксид – солеобразующий
или несолеобразующий.
2) Определить, какой элемент входит в состав
солеобразующего оксида – металл или неметалл.
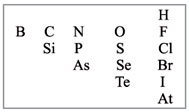
Для этого надо выписать из таблицы
Д.И.Менделеева символы элементов-неметаллов. Они
расположены в главных подгруппах на линии бор –
астат и выше этой линии (рис. 1).
|
|
Рис. 1. Элементы-неметаллы
|
3) Если в состав оксида входит атом
неметалла, то оксид кислотный.
4) Если в состав оксида входит атом металла, то
следует определить его валентность и по ней
выяснить характер оксида – основный, амфотерный
или кислотный.
Например: Cr2O3 – амфотерный, т.к. хром
– металл с валентностью III;
N2O3 – кислотный оксид, т.к. азот –
неметалл;
CrO3 – кислотный оксид, т.к. хром – металл с
высокой валентностью VI.
Зная характер оксида, можно описать его
свойства.
Свойства кислотных оксидов
• Кислотные оксиды реагируют c водой, образуя
кислоты. Например:
CO2 + H2O = H2CO3.
Чтобы составить формулу кислоты, нужно сложить
все атомы исходных веществ, записывая на первом
месте атом водорода, на втором – элемент,
образующий оксид, и на последнем – кислород. Если
индексы получились четными, то их можно
сократить:
N2O3 + H2O = H2N2O4
(2HNO2).
Эти же реакции можно записать в виде
арифметического примера:
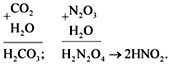
Задание 2.6. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с водой.
• Кислотные оксиды реагируют с осно?вными
оксидами, образуя соли соответствующей кислоты,
т.е. соль той кислоты, которая образуется при
взаимодействии этого оксида с водой. Например:
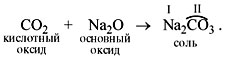
Чтобы составить такое уравнение, нужно
действовать по следующей схеме.
1) Составить формулу кислоты (прибавив к
молекуле оксида молекулу воды):
CO2 + H2O = H2CO3.
2) Определить валентность кислотного остатка
(это часть молекулы кислоты без атомов водорода).
В данном случае кислотный остаток имеет
состав СО3, его валентность равна числу
атомов водорода в кислоте, т.е. II.
3) Cоставить формулу соли, записав вместо атомов
водорода атом металла из основного оксида с его
валентностью (в данном случае натрий).
4) Составить формулу соли по валентности
металла и кислотного остатка: Na2CO3.
Задание 2.7. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с оксидом
кальция.
• Кислотные оксиды реагируют с основаниями,
образуя соль соответствующей кислоты и воду.
Например:
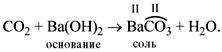
Принципы составления уравнений реакций с
основаниями те же, что и для реакций с
осно?вными оксидами (см. выше).
Задание 2.8. Составьте уравнения реакций
кислотных оксидов из задания 2.5 с гидроксидом
натрия NаОН.
З а п о м н и т е! Кислотные оксиды ни с кислотами,
ни c кислотными оксидами не реагируют.
Свойства основных оксидов
• Основные оксиды реагируют с водой,
образуя основания. Реакция протекает, если
получающееся основание растворимо в воде.
Общая формула оснований – М(ОН)х, где х
– число ОН-групп, равное валентности металла М.
Например:
СаО + Н2О = Са(ОН)2,
Fe2O3 + Н2О ![]() нет реакции.
нет реакции.
Последняя реакция не идет, т.к. основание Fe(ОН)3
нерастворимо в воде. Растворимость веществ в
воде можно определить по таблице растворимости
(рис. 2).
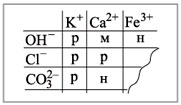 |
Рис. 2.
|
Условные обозначения: р – растворимо в воде, м
– малорастворимо в воде,
н – нерастворимо в воде.
При определении возможности протекания данной
реакции можно использовать и другое правило.
Основный оксид реагирует с водой, если он
образован активным металлом. Эти металлы стоят в
ряду напряжений до магния: Li, K, Ba, Ca, Na, Mg…
Задание 2.9. Составьте уравнения реакций основных
оксидов из задания 2.5 с водой.
• Основные оксиды реагируют с
кислотами, образуя соль и воду:
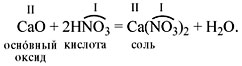
Обратите внимание: при составлении формулы
соли нужно вместо атомов водорода в формуле
кислоты написать символ металла, а затем
расставить индексы согласно валентности.
Задание 2.10. Составьте уравнения реакций
осно?вных оксидов из задания 2.5 с Н2SО4.
• Основные оксиды реагируют с
кислотными оксидами, образуя соли.
• Некоторые основные оксиды
реагируют при нагревании с водородом, при этом
образуются металл и вода:
CuO + H2 = Cu + H2O.
З а п о м н и т е! Основные оксиды с
основаниями и основными оксидами не
реагируют!
В ы в о д. В реакцию легче всего вступают
вещества с противоположными свойствами и не
вступают в реакцию вещества со сходными
свойствами.
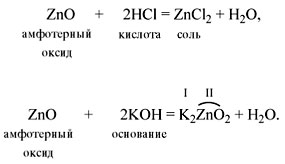
Свойства амфотерных оксидов
Амфотерные оксиды (от греч. amphi – двойной)
проявляют двойственные свойства: они могут
реагировать и с кислотами, и с основаниями
(точнее, со щелочами). При этом образуются соль и
вода. Например:
Задание 2.11. Составьте уравнения реакций
амфотерных оксидов из задания 2.5 с КОН и НNО3.
Задание 2.12. С какими из веществ – Н2О,
NаОН, НСl – могут реагировать следующие оксиды:
Cr2O3, CrO, SO3, V2O5?
Составьте уравнения возможных реакций.
Способы получения оксидов
Оксиды могут быть получены при разложении
некоторых кислот, оснований, солей:
H2SO3 = SO2 + H2O,
Cu(OH)2 = CuO + H2O,
Са(НСО3)2 = Н2О + СО2
+ СаСО3.
Оксиды обычно получают сжиганием в кислороде
простых и сложных веществ:
2Mg + O2 = 2MgO,
C + O2 = CO2,
2H2 + O2 = 2H2O,
CH4 + 2O2 = CO2 + 2H2O.
Обратите внимание: при сгорании сложного
вещества образуются оксиды элементов, которые
входят в его состав. Исключение составляют
только азот и галогены, которые выделяются в виде
простых веществ.
В ы в о д ы по главе 2.1
Молекулы оксидов состоят из атомов двух
элементов. Один из этих элементов – кислород.
Оксиды, образующие соли, бывают кислотными,
амфотерными и основными.
Оксиды реагируют с веществами, которые
проявляют противоположные свойства.
Основные оксиды реагируют с
кислотными оксидами или кислотами, кислотные
оксиды – с основными оксидами или
основаниями, амфотерные оксиды – и с кислотами, и
с основаниями (щелочами).
2.2. Кислоты
Кислоты – это сложные вещества, в состав
молекул которых входят активные атомы водорода и
кислотные остатки. Активный атом водорода в
химических реакциях способен замещаться на атом
металла, в результате чего всегда получается
соль.
В формулах неорганических кислот атом водорода
записывается на первом месте*.
Например:
![]()
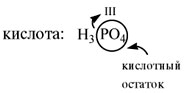
В состав молекулы любой кислоты кроме атомов
водорода входит кислотный остаток. Кислотный
остаток – это часть молекулы кислоты без атомов
водорода (которые могут быть замещены на атом
металла). Валентность кислотного остатка равна
числу таких атомов водорода:
При определении валентности кислотного
остатка учитываются те атомы водорода, которые
участвовали в реакции или могут участвовать в
ней. Так, фосфорной кислоте Н3РО4 в
зависимости от условий могут соответствовать
кислотные остатки разного состава:
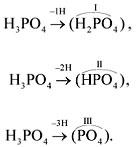
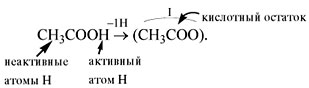
У органических кислот не все атомы водорода в
молекуле способны замещаться на атом металла:
Задание 2.13. Определите состав и валентность
кислотных остатков для кислот, учитывая, что все
атомы водорода кислот активные:
HNO3, H2S, NaHCO3, H2SO3,
KOH, HMnO4.
По числу атомов водорода в молекулах кислоты
делят на одноосновные и многоосновные.
Например:
HCl – одноосновная кислота, т. к. в ее молекуле
один атом водорода;
Н2СО3 – двухосновная кислота, т. к. в
ее молекуле два атома водорода.
По составу кислоты делят на бескислородные
(НСl, Н2S) и кислородсодержащие (НСlO, Н2SO4).
Бескислородные кислоты представляют собой
растворы некоторых газов в воде, при этом и
растворенному газу, и полученному раствору
приписывают одинаковые свойства, хотя это не так.
Например, из простых веществ водорода и хлора
получается газ хлороводород:
H2 + Cl2 = 2HCl.
Этот газ не проявляет кислотных свойств, если
он сухой: его можно перевозить в металлических
емкостях, и никакой реакции не происходит.
Но при растворении хлороводорода в воде
получается раствор, который проявляет свойства
сильной кислоты. Такую кислоту перевозить в
металлических емкостях нельзя.
Названия бескислородных кислот составляют по
схеме:
элемент + водород + «ная» кислота.
Например: H2S – сероводородная кислота
(раствор газа сероводорода в воде).
Некоторые бескислородные кислоты имеют особые
(тривиальные) названия: НСl – соляная кислота
(раствор газа хлороводорода в воде), НF –
плавиковая кислота (раствор газа фтороводорода в
воде).
Задание 2.14. Дайте химические названия
соляной и плавиковой кислотам.
Кислородсодержащие кислоты могут быть
получены при действии воды на кислотные оксиды
(см. выше). Исходные кислотные оксиды называют
«ангидриды кислот»:
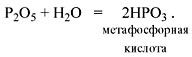
Метафосфорная кислота неустойчива и,
присоединяя воду, превращается в более
устойчивую ортофосфорную кислоту:
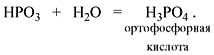
Или в суммарном виде:
Р2О5 + 3Н2О = 2Н3РО4
.
Таким образом, Р2O5 – ангидрид
фосфорной кислоты, а также некоторых других,
менее устойчивых кислот.
Обратите внимание: название
кислородсодержащей кислоты содержит в виде
корня название элемента, входящего в состав
ангидрида: фосфор Р ![]()
фосфорный ангидрид Р2О5 ![]() фосфорная кислота Н3РО4.
фосфорная кислота Н3РО4.
Если элементу соответствует несколько кислот,
то для кислоты с большей валентностью
элемента, входящего в состав ангидрида, в
названии употребляют суффиксы «н» или «в».
Для кислот с меньшей валентностью элемента в
название кислоты добавляют суффикс «ист».
Валентность элемента проще всего определять по
формуле ангидрида:
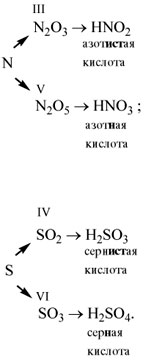
В названии сернистой кислоты основной суффикс
«ист», а суффикс «н» введен дополнительно для
благозвучия.
Сведения о названиях некоторых кислот обобщены
в табл. 3.
Таблица 3
Названия кислот
| Ангидрид | Кислота | Название |
| Нет | НС1 | Соляная, хлороводородная |
| CO2 | Н2СО3 | Угольная |
| SiO2 | …………… | Кремниевая |
| N2O3 | …………… | Азотистая |
| N2O5 | …………… | Азотная |
| SO2 | …………… | …………………….. |
| SO3 | …………… | …………………….. |
| P2O5 | …………… | …………………….. |
| CrO3 | …………… | Хромовая |
| Нет | H2S | Сероводородная |
Задание 2.15. Вместо пропусков в табл.
3 напишите формулы и названия соответствующих
кислот.
Задание 2.16. Напишите на память (никуда не
заглядывая) формулы кислот: кремниевой,
сернистой, серной, сероводородной, азотистой,
азотной, соляной, фосфорной, угольной. Укажите
ангидриды этих кислот (там, где они существуют).
Свойства кислот
Главным свойством всех кислот является их
способность образовывать соли. Соль образуется в
любой реакции, в которой участвует кислота, при
этом замещаются активные атомы водорода (один
или несколько).
• Кислоты реагируют с металлами. При этом атомы
водорода кислоты замещаются на атомы металла с
образованием растворимой соли и водорода.
Например:
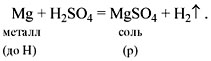
Не все металлы способны вытеснять водород из
растворов кислот. Этот процесс возможен только
для тех металлов, которые стоят в ряду напряжений
(ряд активности) до водорода (рис. 3, см. с. 20):
 |
Рис. 3. Ряд напряжений металлов |
Задание 2.17. Составьте уравнения
возможных реакций:
серная кислота + алюминий,
соляная кислота + серебро,
бромоводородная кислота + цинк.
При составлении уравнений пользуйтесь рядом
напряжений. Не забывайте, составляя формулы
солей, учитывать валентности металла и
кислотного остатка.
Некоторые кислоты могут растворять металлы,
которые стоят в ряду напряжения после водорода,
но водород при этом не выделяется:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO![]() + 4H2O.
+ 4H2O.
• Кислоты реагируют с основаниями, образуя
соль и воду**. Это реакция
обмена, и поэтому валентность составных частей в
результате реакции не меняется:
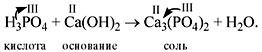
Расставим коэффициенты:
2Н3РО4 + 3Са(ОН)2 = Са3(РО4)2
+ 6Н2О.
Задание 2.18. Составьте уравнения реакций:
серной кислоты и Fe(ОН)3,
соляной кислоты и Ва(ОН)2,
сернистой кислоты и NаОН.
Не забудьте порядок действий: составить
формулу соли по валентности металла и кислотного
остатка; расставить коэффициенты.
• Кислоты могут реагировать с солями. При этом
сильная кислота вытесняет более слабую из ее
соли.
К сильным кислотам относятся серная, азотная,
соляная и др.
К слабым кислотам относятся угольная,
кремниевая, сероводородная, азотистая.
В реакции обмена кислоты с солью образуются
новая соль и новая кислота. Например:
2HNO3 + CaCO3 = Ca(NO3)2 + H2CO3.
Более подробно о подобных реакциях см. главу 6.
Задание 2.19. Составьте, не обращаясь к
учебнику и пособиям, формулы: а) сильных кислот;
б) слабых кислот.
Задание 2.20. Составьте уравнения реакций:
соляная кислота + FeS,
азотная кислота + Na2SiO3,
серная кислота + K2CO3.
• Как обнаружить кислоту в растворе? Например,
в одном стакане налита вода, а в другом – раствор
кислоты. Как определить, где кислота? Хотя все
кислоты кислые на вкус, пробовать их нельзя, это
опасно. Выручают особые вещества – индикаторы.
Это соединения, которые изменяют цвет в
присутствии кислот.
Синий лакмус в кислоте становится красным;
оранжевый метилоранж тоже становится красным в
присутствии кислот.
В ы в о д ы по главе 2.2
Кислоты классифицируют:
по числу атомов водорода – на одноосновные,
двухосновные и т.д.;по наличию атома кислорода в составе
молекулы – на бескислородные и
кислородсодержащие;по силе – на сильные и слабые;
по устойчивости – на устойчивые и
неустойчивые.
Кислоты реагируют:
с активными металлами (стоящими в ряду
активности до Н),с основаниями,
с основными и амфотерными оксидами,
с солями более слабых кислот.
Кислоты обнаруживаются индикаторами в кислой
(«красной») области.
* В химических формулах
органических кислот атом водорода стоит в конце,
например CH3COOH – уксусная кислота.
** Реакция между кислотой и
основанием называется реакцией нейтрализации.
Продолжение следует
Как составить химические формулы кислот соответствующих оксидам?
Ученик
(63),
закрыт
8 лет назад
Александр Титов
Гений
(50749)
9 лет назад
Просто добавить воду в формулу и записать формулу соответствующей кислоты.
На первом месте будет водород, на втором – неметалл, на третьем – кислород.
Например,
Кислотному оксиду SO3 соответствует кислота H2SO4
SO3 + H2O – всего водорода 2 атома, его на 1-е место ставим H2**, далее один атом серы – ставим его после водорода
H2S*, ещё остаётся кислород – три атома от SO3 и один от H2O – итого 4, ставим после серы и получаем H2SO4.
В случае, если атомы в молекуле можно сократить на одно и то же число – сокращаем.
Например, способом выше из N2O5 и H2O получится формально H2N2O6 – сокращаем на 2 и получаем HNO3.
Есть и особые случаи, например, оксиду P2O5 соответствует как метафосфорная (HPO3), так и ортофосфорная (H3PO4) кислота. В первом случае молекул воды условно добавили 2 штуки.
Ещё надо помнить, что не все оксиды являются солеобразующими – несолеобразующим оксидам не соответствуют никакие кислоты, таковы, например, оксиды N2O, NO, CO. Нельзя формально написать, например, H2NO2 – нет такой кислоты.

Классификация оксидов
Материал по химии
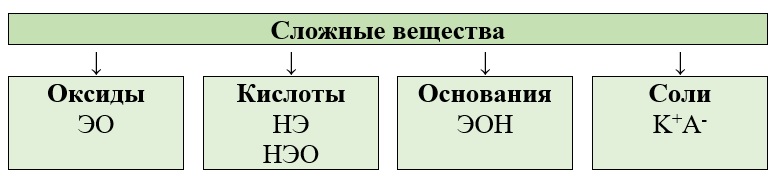
Все сложные неорганические вещества можно разделить на следующие группы:
Классификация оксидов
Классификация веществ
Рассмотрим эти классы по отдельности, начиная с оксидов.
Оксиды – это соединения кислорода в степени окисления «‒2» с другими элементами. Но не все соединения кислорода с элементами будут являться оксидами, степень окисления кислорода очень важна!
Таб. «Соединения кислорода»

* Так как фтор принимает только отрицательную степень окисления (так как может выступать только в качестве окислителя), кислород во фториде кислорода может быть только положительным. Положительные ионы записываются первыми в формуле, поэтому правильнее писать OF2.
** Hадпероксид калия состоит из ионов K+ и O2-1.
Зачем нужно знать классификацию оксидов?
Рассмотрим несколько уравнений:
- K2O + H2O = 2KOH
- CaO + H2O = Ca(OH)2
- FeO + H2O ≠
- CuO + H2O ≠
Почему какие-то оксиды реагируют с водой, а другие – нет? Нужно знать классификацию оксидов на растворимые и нерастворимые.
- CaO + N2O3 = Ca(NO3)2
- CaO + Cs2O ≠
Как определить, какие оксиды реагируют друг с другом, а какие нет? Для ответа на этот вопрос нужно знать, какие оксиды относятся к кислотным, а какие к основным, амфотерным или несолеобразующим.
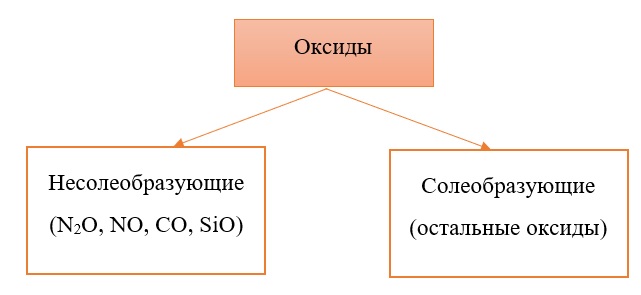
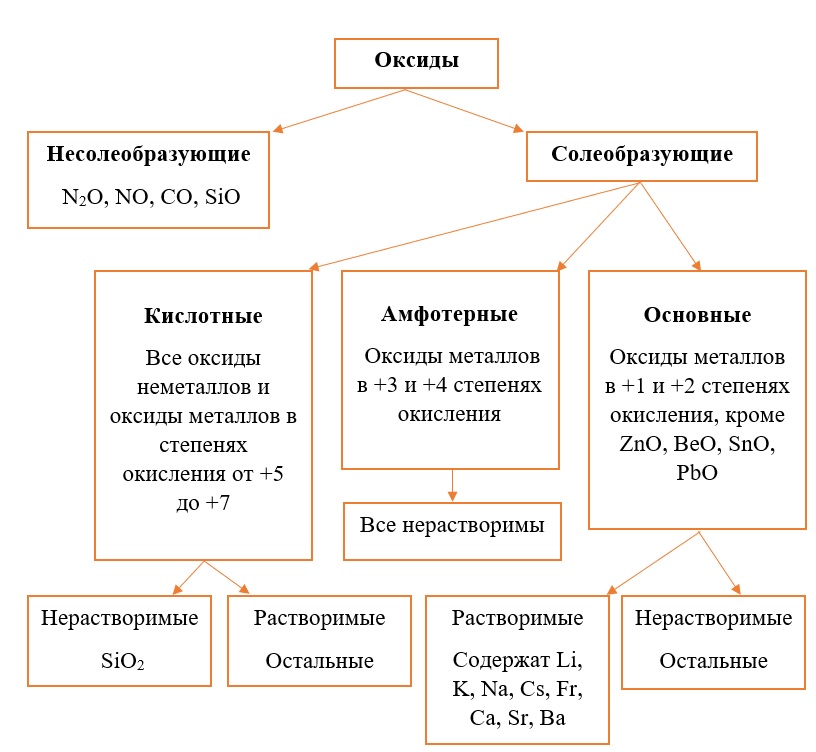
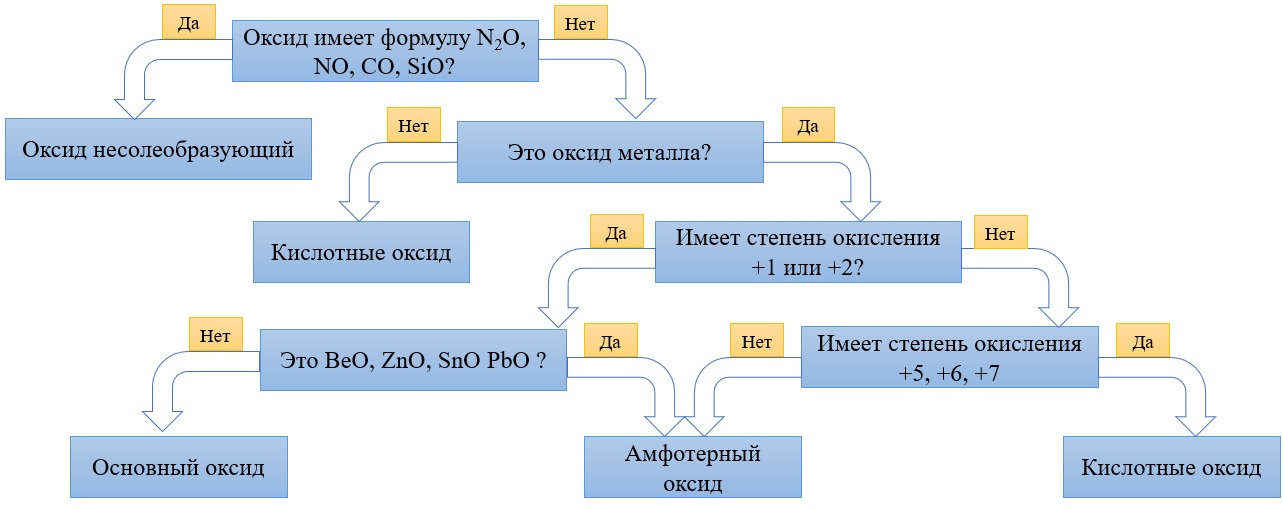
Классификация оксидов на солеобразующие и несолеобразующие
Существует две группы оксидов – те, что при взаимодействии с кислотами/основаниями или друг с другом образуют соли и те, что не вступают в типичные реакции оксидов и не способны образовывать соли (несолеобразующие), их свойства рассматриваются отдельно.
Самыми распространёнными несолеобразующими оксидами являются: N2O, NO, CO, SiO, остальные оксиды считаем солеобразующими (с типичными свойствами).
Классификация солеобразующих оксидов
Все солеобразующие оксиды делятся на основные, кислотные и амфотерные.
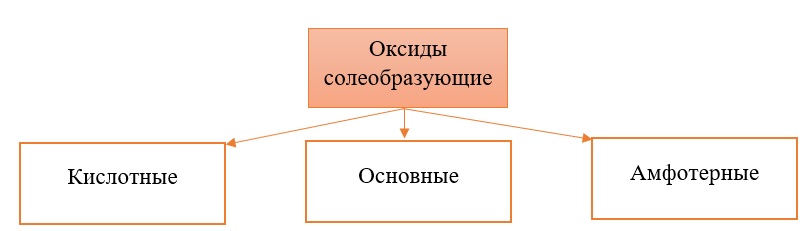
Кислотные оксиды соответствуют определенным кислотам, они легко взаимодействуют со своими противоположностями – основными веществами.
Основные оксиды соответствуют определенным основаниям, они легко взаимодействуют со своими противоположностями – кислотными веществами.
Амфотерные оксиды, соответствуют определённым гидроксидам, имеют двойственную природу: с кислотными веществами реагируют как основные соединения, а с основными – как кислотные соединения.
Таб. «Некоторые оксиды и соответствующие им гидроксиды»
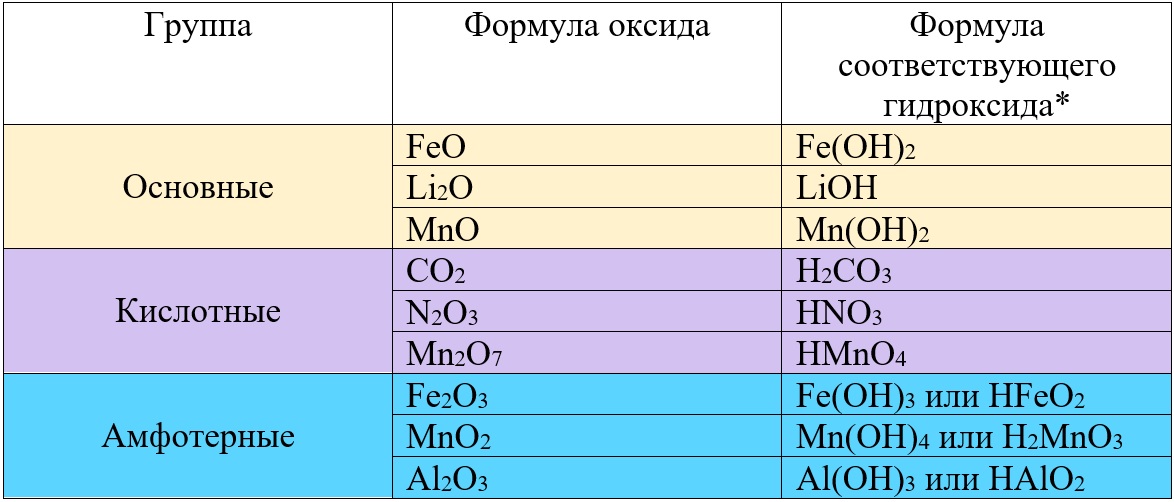
* Гидроксид – соединение элемента с гидроксо-группой (OH‒).
Проанализировав таблицу, Вы заметите, что разные оксиды железа могут быть основными или амфотерными, а разные оксиды марганца оказались во всех трех группах. Что бы лучше понимать, от чего зависит принадлежность к тому или иному виду оксидов, необходимо глубже разобраться в классификации этих веществ.
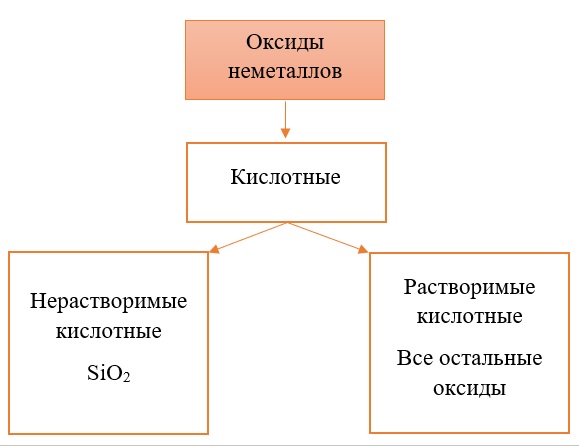
Классификация оксидов неметаллов.
Все солеобразующие оксиды неметаллов относятся к кислотным. Большая часть из них являются растворимыми:
Классификация оксидов металлов.
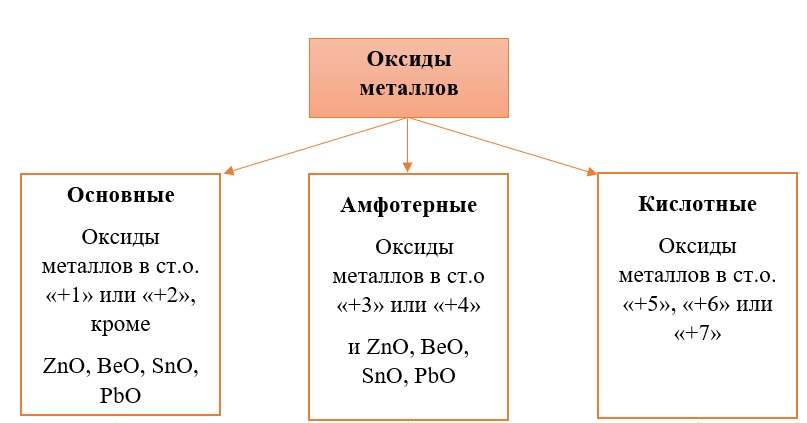
В отличие от предыдущей группы, в этой не так всё однозначно. Среди оксидов металлов встречаются как основные, так и амфотерные, и даже кислотные. А принадлежность к определённой группе зависит он степени окисления металла, который входит в состав оксида.
Основные оксиды – это оксиды, в которых металл имеет степень окисления «+1» или «+2» (для элементов с большим диапазоном возможных степеней окисления это будут низшие степени окисления). Есть исключения, например, BeO, ZnO хоть и имеют в своём составе металлы в степени окисления «+2», проявляют амфотерные свойства. Список таких оксидов гораздо шире (SnO, PbO, CuO), но в ЕГЭ остальные примеры исключений игнорируются.
Амфотерные оксиды содержат металлы в степени окисления «+3» и «+4» (промежуточные значения степеней окисления для веществ с большим диапазоном возможных степеней окисления), и два примера оксидов с металлами в ст. о. «+2», написанных выше (BeO, ZnO).
Кислотные оксиды содержат металлы в степени окисления «+5», «+6» и «+7» (для элементов с большим диапазоном возможных степеней окисления это будут высшие степени окисления).
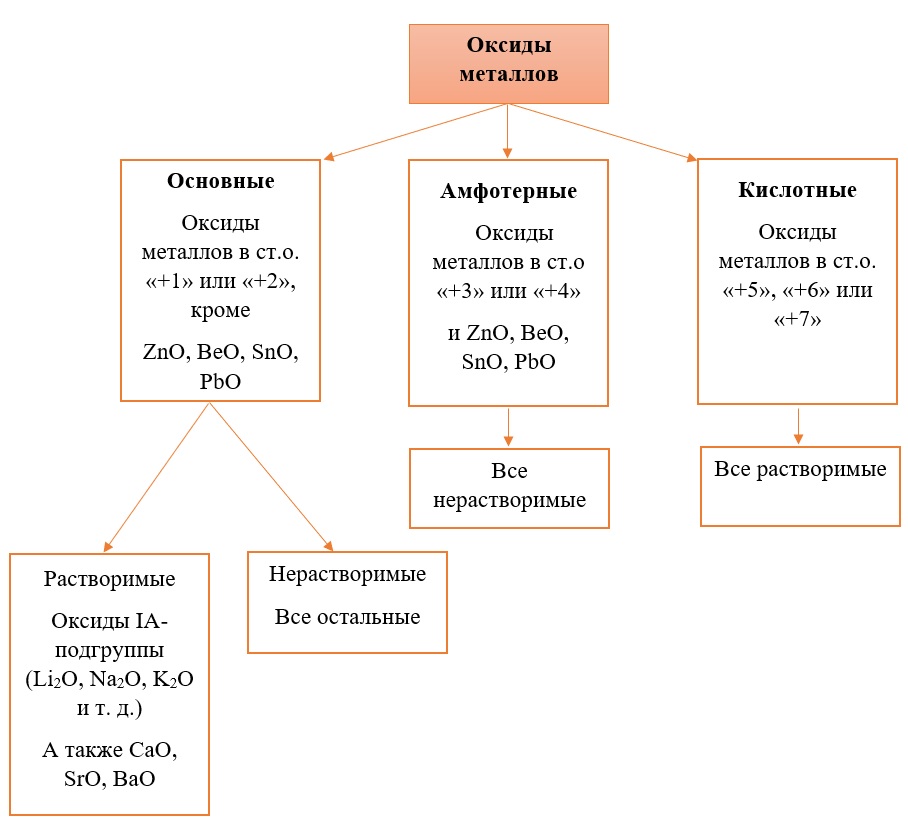
Все кислотные оксиды металлов растворяются в воде и реагируют с ней. Все амфотерные оксиды не растворяются в воде и не реагируют с ней. Среди основных оксидов большинство нерастворимы и только оксиды, образованные кальцием, стронцием, барием, а также всеми металлами IА-подгруппы являются растворимыми.
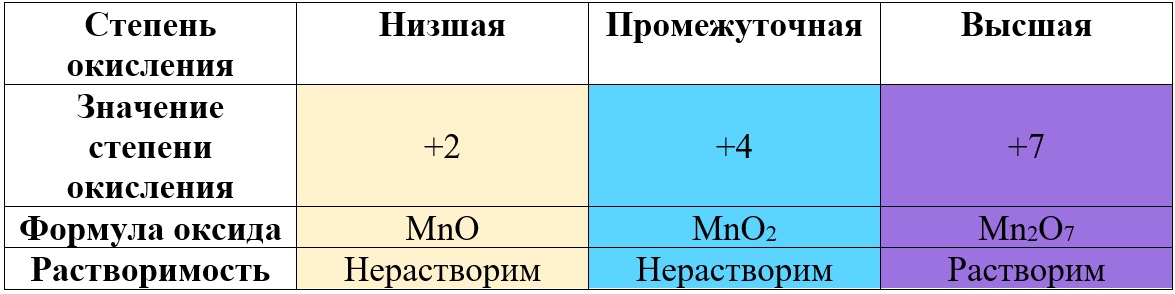
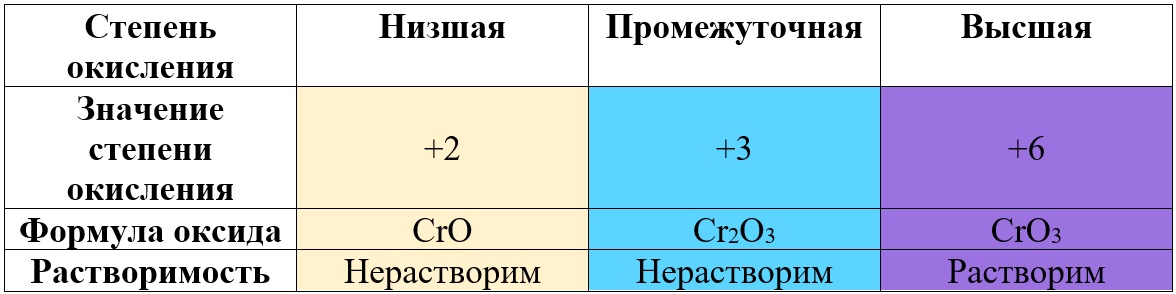
Таким образом металлы, имеющие большой диапазон возможных степеней окисления, могут образовывать совершенно разные по характеру оксиды, например оксиды марганца и хрома:
Таб. «Зависимость характера оксида от степени окисления марганца» (рассмотрены только наиболее распространённые степени)
Таб. «Зависимость характера оксида от степени окисления хрома» (рассмотрены только наиболее степени)
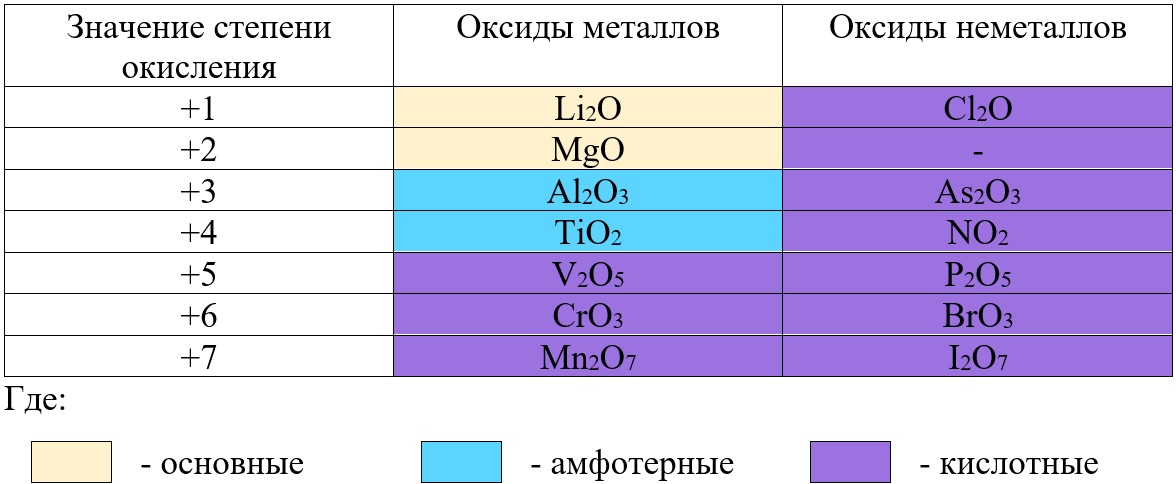
Не следует путать оксиды металлов и неметаллов: у оксидов металлов степень окисления определяет характер оксида, а у оксида неметалла – нет.
Таб. «Зависимость характера оксида от степени окисления элемента»
Обобщим всю классификацию оксидов одной схемой:
Алгоритм для определения характера оксида:
Простая таблица для определения принадлежности к группе оксидов: