Расчет формул минералов
В
минералогии важно суметь рассчитать
формулу минерала по результатам его
химических анализов. Результаты
химических анализов выражают в массовых
(весовых) процентах. В случае сульфидных
минералов расчет формулы по данным
таких анализов представляет собой
простую арифметическую задачу. В качестве
первого шага следует разделить содержание
каждого элемента в массовых процентах
на его атомное количество для получения
мольной доли этого элемента (табл.
1). Структурная
формула железосодержащего сфалерита
выглядит как (Fe,Zn)S,
и поэтому, чтобы результаты имели
правильные соотношения, необходимо
привести к единице либо сумму мольных
долей Zn
и Fe,
либо мольную долю S.
Рассчитанные обоими способами формулы
должны совпадать. Так, приводя S
к единице и округляя значения до второго
знака, получаем формулу (Zn0,86Fe0,14)1,00S.
Расчет формулы сфалерит
Таблица
1
|
Элемент |
Вес. |
Атомный |
Атомный |
Атомные соотношения |
|
Zn |
57,93 |
0,886 |
0,858 |
|
|
Fe |
8,21 |
55,85 |
0,1407 |
0,136 |
|
S |
33,09 |
32,07 |
1,032 |
1,000 |
|
Сумма |
99,23 |
Большинство
минералов имеет не постоянный, а
характерный состав, что и выражается
их формулой. Например, сфалерит в одних
случаях может представлять почти чистый
сульфид цинка, а в других содержать
значительные примеси железа и
незначительные кадмия и магния. Однако
для всех разновидностей сфалерита
атомные количества серы и катионов
(цинка, железа и др.) будут составлять
1:1, что соответствует формуле ZnS
или (Zn,Fe)S,
где атомные количества Zn+Fe
= 1 и атомные количества серы также равны
1.
Расчет формулы граната
Таблица
2
|
Оксид |
Вес. |
Молекулярное |
Атомные |
Число |
Число |
|
1 |
2 |
3 |
4 |
5 |
|
|
SiO2 |
40,34 |
0,6714 |
1,3426 |
5,937 |
Si |
|
Al2O3 |
18,25 |
0,1790 |
0,537 |
2,374 |
0,032 Al 1,550 |
|
FeO |
4,84 |
0,0674 |
0,0674 |
0,298 |
Fe |
|
MnO |
0,25 |
0,0035 |
0,0035 |
0,015 |
Mn |
|
TiO2 |
2,10 |
0,0263 |
0,05226 |
0,232 |
Ti |
|
Cr2O3 |
2,22 |
0,0146 |
0,0438 |
0,194 |
Cr |
|
CaO |
18,77 |
0,3347 |
0,3347 |
1,480 |
Ca |
|
MgO |
13,37 |
0,3317 |
0,3317 |
1,467 |
Mg1,467 |
|
Сумма |
100,14 |
2,7133 12/2,7133=4,422 |
Результаты
анализов породообразующих минералов
обычно выражают в массовых процентах
оксидов (табл.
2). Сначала
рассчитывают число молей каждого оксида
путем деления его массового процента
на молекулярную массу, что дает
относительное содержание оксидных
молекул (столбец 2). Далее рассчитывают
атомные количества кислорода. Для этого
каждое значение столбца 2 умножается
на число атомов кислорода в соответствующих
оксидах (столбец 3). В нижней части столбца
приведено общее число атомов кислорода
(2,7133). Если надо получить формулу граната
на основе 12 атомов кислорода, то необходимо
пересчитать соотношения кислородных
атомов таким образом, чтобы их общее
число равнялось 12. для этого цифры
столбца 3 для каждого оксида умножаются
на 12/Т, где Т – общее количество кислорода
из столбца 3. Результаты приведены в
столбце 4. Далее надо рассчитать
соотношения атомов для различных
катионов. С этой целью числа столбца 4
нужно умножить или разделить на значения
этих соотношений, определяемые
стехиометрией. Так, например, у SiO2
имеется один кремний на два кислорода.
Поэтому соответствующее число столбца
4 делится на 2. У Al2O3
на каждые три атома кислорода приходится
два атома алюминия, и в этом случае число
столбца 4 умножается на 2/3. Для двухвалентных
катионов числа в столбцах 4 и 5 совпадают.
Количества катионов в формуле,
соответствующие установленному числу
атомов кислорода (12) и приведенные в
столбце 5, могут быть сгруппированы, как
это показано в таблице, в соответствии
со структурной формулой граната
A3B2[(Si,Al)O4]3,
где А – двухвалентные катионы (Ca,
Mg,
Fe,
Mn),
а В – трехвалентные катионы (Al,
Cr),
а также Ti4+.
Дефицит Si
компенсируется за счет Al,
который берется в таком количестве,
чтобы целиком заполнить тетраэдрические
позиции. Оставшиеся атомы алюминия
относятся к позиции В.
Чтобы
быстро оценить правильность расчетов,
можно просуммировать положительные и
отрицательные заряды, проверив баланс
валентностей.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Собрание уникальных книг, учебных материалов и пособий, курсов лекций и отчетов по геодезии, литологии, картированию, строительству, бурению, вулканологии и т.д.
Библиотека собрана и рассчитана на инженеров, студентов высших учебных заведений по соответствующим специальностям. Все материалы собраны из открытых источников.
Расчет формул минералов по данным химических анализов.
В минералогии важно суметь рассчитать формулу минерала по результатам его химического анализа. В этом разделе приводится ряд примеров таких расчетов для разных минералов. Когда подсчеты произведены и получена структурная формула, становится ясным, совпадает ли она с кри-сталлохимическими данными по минералу. Следует отметить, что если даже общая сумма компонентов в анализе оказывается равной 100%, это не всегда означает, что состав минерала определен верно и точно.
5.7.1 Расчет анализа сульфидов
В случае сульфидных минералов результаты анализов обычно выражаются в массовых процен-
Таблица 5.1 Результаты химического анализа железосодержащего сфалерита из месторождения Ренстрём, Сев. Швеция (по R. С. Duckworth and D. Richard, Mineral. Mag. 57: 83-91, 1993)
|
Элемент |
Mac.% |
Атомные |
Атомные |
|
количества |
соотношения |
||
|
при S = 1 |
|||
|
Zn |
57,93 |
0,886 |
0,858 |
|
Fe |
8,21 |
0,1407 |
0,136 |
|
S |
33,09 |
1,032 |
1,000 |
|
Сумма |
99,23 |
тах (мас.%) элементов. Расчет формулы по данным таких анализов представляет собой простую арифметическую задачу. В приведенном ниже примере железосодержащего сфалерита (табл. 5.1) в качестве первого шага следует разделить содержание каждого элемента в массовых процентах на его атомную массу для получения мольной доли этого элемента. Структурная формула железосодержащего сфалерита выглядит как (Zn, Fe)S, и поэтому, чтобы результаты имели правильные соотношения, необходимо привести к единице либо сумму мольных долей Zn и Fe, либо мольную долю S. Используемая формула, допускающая как полностью катионную, так и полностью анионную решетку, справедлива для рассматриваемого случая, и если результаты анализа верны, то рассчитанные обоими способами формулы должны совпадать. Так, приводя S к единице и округляя получаемые значения до второго знака, получаем формулу (Zn086Fe014)100S. У некоторых сульфидных минералов (например, пирротина Fe1-xS) наблюдается нестехиометрическое содержание катионов. В таких случаях анализы следует рассчитывать, основываясь на количестве ионов серы.
5.7.2 Расчет силикатного анализа
Результаты анализов породообразующих минералов (см., например, анализ граната в табл. 5.2) обычно выражают в массовых процентах оксидов. Расчет анализа, представленного в таком виде, несколько более сложен и включает ряд дополнительных операций.
1. Рассчитать число молей каждого оксида путем деления значения его массового процента на
молекулярную массу, что дает относительное содержание оксидных молекул (столбец 2).
2. Рассчитать атомные количества кислорода. Для этого каждое значение столбца 2 умножается на число атомов кислорода в соответствующих оксидах, что дает относительное содержание кислородных атомов, вносимых в формулу каждым элементом (столбец 3).
В нижней части столбца 3 приведено общее число атомов кислорода (2,7133).
3. Если мы хотим получить формулу граната на основе 12 атомов кислорода, то необходимо пересчитать соотношения кислородных атомов таким образом, чтобы их общее число равнялось 12. Для этого цифры столбца 3 для каждого оксида умножаются на 12/Т, где Т —общее количество кислорода из столбца 3. Результаты приведены в столбце 4.
4. Рассчитать соотношения атомов для различных катионов. С этой целью числа столбца 4 нужно умножить или разделить на значения этих соотношений, определяемые стехиометрией. Так, например, у SiO2 имеется один кремний на два кислорода. Поэтому соответствующее число столбца 4 делится на 2. У А1203 на каждые три атома кислорода приходится два атома алюминия, и в этом случае число столбца 4 умножается на 2/3. Для двухвалентных катионов числа в столбцах 4 и 5 совпадают.
Таблица 5.2 Результаты химического анализа граната, рудник Уесселтон, Кимберли, ЮАР (по A.D. Edgar and Н.Е. Charbonneau, Am.Mineral. 78: 132-142, 1993)
|
Оксид |
ММас.% оксидов |
М) Молекулярные количества оксидов |
Атомные количества кислорода в молекуле |
Число анионов в расчете на 12 атомов О, т. е столбец (3) x 4,422 |
Число катионов в формуле |
|
Si02 |
40,34 |
0,6714 |
1,3426 |
5,937 |
Si 2,968 |
|
A1203 |
18,25 |
0,1790 |
0,537 |
2,374 |
Al 1,582 |
|
FeO |
4,84 |
0,0674 |
0,0674 |
0,298 |
Fe 0,298 |
|
MnO |
0,25 |
0,0035 |
0,0035 |
0,015 |
Mn 0,015 |
|
Ti02 |
2,10 |
0,0263 |
0,0526 |
0,232 |
Ti 0,116 |
|
Cr203 |
2,22 |
0,0146 |
0,0438 |
0,194 |
Cr 0,129 |
|
Ca0 |
18,77 |
0,3347 |
0,3347 |
1,480 |
Ca 1,480 |
|
Mg0 |
13,37 |
0,3317 |
0,3317 |
1,467 |
Mg 1,467 |
|
Сумма |
100,14 |
2,7133 |
|||
|
12/2,7133 = 4,422 |
Количества катионов в формуле, соответствующие установленному числу атомов кислорода (12) и приведенные в столбце 5, могут быть сгруппированы показанным в таблице образом в соответствии со структурной формулой граната A3B2[(Si, Al)04], где А — двухвалентные катионы (Ca, Mg, Fe, Mn), а В — трехвалентные катионы (Al,Cr), а также Ti4+. Дефицит Si компенсируется за счет Al, который берется в таком количестве, чтобы целиком заполнить тетраэдр ические позиции. Оставшиеся атомы алюминия относятся к позиции В,
Чтобы быстро оценить правильность выполненных арифметических действий, нужно проверить баланс валентностей, просуммировав положительные и отрицательные заряды.
5.7.3 Расчет анализа при наличии разных анионов
В последнем примере мы кратко рассмотрим расчет формулы по результатам анализа при наличии в составе минерала разных анионов (табл. 5.3). В нашем случае минерал представлен фтор-апатитом Са5(РО4)3^,0,ОН), который помимо
Таблица 5.3 Результаты химического анализа апатита
|
Оксиды |
(!) ~ |
(2.) |
(3) |
Ч4) Число ка |
|
Мас.% |
Молеку |
Молеку |
||
|
лярные |
лярные |
тионов в |
||
|
коли |
количест |
расчете на |
||
|
CaO FeA FeO MgO SrO Na2O K2O P2O5 F Cl H2O Сумма O=FjCl Сумма |
55,08 0,32 0,02 0,05 0,03 0,04 0,0! 42,40 1,63 0,20 1,06 100,84 -0,72 100,12 ! |
чества 0,9822 0,0020 0,0003 0,0012 0,0003 0,0006 0,0001 0,2987 0,0858 0,0056 0,0567 -0,0914 3/2, 5409 = |
ва кислорода 0,9822 0,0060 0,0003 0,0012 0,0003 0,0006 0,0001 1,4935 0,0858 0,0056 0,0567 -0,0914 2,5409 4, 9386 |
13 анионов (4,9386) 4,85 0,02 0,01 0,01 2,95 0,42 0,03 0,56 |
кислорода содержит F и Cl. Результаты анализа опять-таки выражены в массовых процентах оксидов, хотя на самом деле некоторые из них являются галоидами. В таких случаях необходимо скорректировать общую сумму кислорода посредством учета количества его молей, эквивалентного присутствующим галоидам.
Итак, расчет включает следующие этапы.
Рассчитать число молей каждого оксида и галоида. Для этого следует массовый процент каждого компонента разделить на его молекулярную массу (столбец 2).
Рассчитать число молей анионов (кислорода).
Для этого число молей, указанное в столбце 2, необходимо умножить на стехиометрическое
число аниона. Не забудьте вычесть кислород, эквивалентный (в данном случае 0,0914 молей) присутствующим в минерале F и Cl (столбец 3).
3. Просуммировать количество анионов, не забывая вычесть 0,0914 молей кислорода, связанных с присутствующими F и Cl (получится 2,5409).
4. Если мы хотим получить формулу апатита, основанную на 13 анионах, то нам необходимо пересчитать соотношения анионов таким образом, чтобы их общее число равнялось 13. Для этого каждый из них умножается на 13/2,5409, т.е. на 4,9386.
5. Рассчитать соотношения атомов различных катионов. Для этого нужно приведенные в столбце 2 молекулярные количества умножить на 4,9386, а затем умножить или разделить полученные величины на значения этих соотношений, определяемые стехиометрией оксидов. Например, у P2O5 на моль оксида приходится два атома фосфора. Окончательные результаты приведены в столбце 4.
Литература для дальнейшего изучения
1. Goldstein, J. L, Newbury, D. E., Echhn, P., Joy, D. С., FiOTi, C. and Lifshm, E. Scanning Electron Microscopy and X-ray Microanalysis. New York, Plenum, 1984.
2. Marfunin, A. S. (ed.]. Methods and Instrumentation: Results and Recent Developments, vol. 2 of Advanced Mineralogy Berlin, Springer-Verlag, 1985.
3. Willard, H. H., Merntt, L. L., Dean, J. A. and Settle, F. A. Instrumental Methods of Analysis, 7th edn. Belmont, CA, Wadsworth, 1988.
Дополнение редактора
1. Гаранин В. К., Кудрявцева Г. П. Применение элек-тронно-зондовых приборов для изучения минерального вещества. M , Недра, 1983, 216 с.
2. ЛапутинаИ.П. Микрозонд в минералогии. M., Наука, 1991, 139 с.
Физические свойства минералов определяются взаимодействием между структурой и химическим составом. В число этих свойств входят и такие, которые влияют на внешний вид минерала, например, его блеск и цвет. Другие свойства сказываются на физических характеристиках минералов — твердости, пьезоэлектричестве, магнетизме. Сначала мы рассмотрим плотность минералов, поскольку это свойство находится в прямой связи с их структурой и составом.
Закрепленные
Понравившиеся
Какой бывает химический состав минералов
 Каждый минерал характеризуется определенным химическим составом. Минералы могут состоять либо из одного химического элемента, либо из нескольких. Если минерал состоит из одного химического элемента, его называют самородным элементом.
Каждый минерал характеризуется определенным химическим составом. Минералы могут состоять либо из одного химического элемента, либо из нескольких. Если минерал состоит из одного химического элемента, его называют самородным элементом.
Например, самородное золото, самородное серебро, самородная медь и т. д. Однако большинство минералов состоит из нескольких, а иногда и многих химических элементов. Состав минералов принято выражать в виде химической формулы или в весовых процентах, определяемых с помощью химического анализа.
Например, химический состав минералов халькопирита и анальцима может быть выражен следующими весовыми процентами химических элементов (для первого) или окислов (для второго):
I. (Cu — 34,9)+(Fe — 30,47)+(S — 34,6)=Сумма 99,97
II. (SiO2 — 55,12)+(Al2O3 — 22,99)+(Na2O — 13,53)+(H2O — 8,27)= Сумма 99,81
Формулы данных минералов рассчитываются делением указанных весовых количеств на соответствующие атомные или молекулярные массы. При этом получают атомные или молекулярные количества. Атомные массы химических элементов берутся по таблице периодической системы элементов Д. И. Менделеева, молекулярная масса окисла выводится путем суммирования атомных масс, слагающих соответствующий окисел элементов. Атомные или молекулярные количества заменяют пропорциональными им коэффициентами в получаемой формуле. Примеры расчета формулы халькопирита и анальцима приводятся в табл. 7.
Как определяется формула минерала
Формулы, получаемые при расчете и дающие представление о химическом составе минерала, называются эмпирическими. Таковы полученные формулы халькопирита и анальцима — 4SiO2•Аl2O3 • NagO• 2Н2O. Эмпирическая формула анальцима, написанная в виде окислов, не отражает связей между химическими элементами и ничего не говорит о структуре минерала, такое написание формулы имеет одно преимущество — ее проще запомнить.
| Компоненты | Весовые проценты | Атомные(молекулярные)
количества |
Количество атомов | Название и формула |
| Cu | 34,9 | 34,9 : 63,5 = 0,550 | 1 | Халькопирит CuFeS2 |
| Fe | 30,47 | 30,47 : 55,8 = 0,546 | 1 | |
| S | 34,6 | 34,6 : 32 = 1,081 | 2 | |
| SiO2 | 55,12 | 55,12 : 60 = 0,919 | 4 | Анальцим 4SiO2 · Al2O3 · Na2O · 2H2O |
| Al2O3 | 22,99 | 22,99 : 102 = 0,225 | 1 | |
| Na2O | 13,53 | 13,53 : 62 = 0,218 | 1 | |
| H2O | 8,27 | 8,27 : 18 = 0,459 | 2 |
Для ряда минералов принято писать формулы, в которых отражается тип химического соединения и взаимные связи между слагающими химическими элементами. Такие формулы называются структурными или кристаллохимическими.
Пример формулы минерала
 Формула анальцима Na[AlSi2O6]•H2O; является структурной. Квадратными скобками выделен радикал, представляющий сложный анионный комплекс Вода, имеющаяся в минерале в количестве одной молекулы, пишется в конце формулы и отделяется от нее точкой. Другой пример. Эмпирическая формула мусковита H2KAl3Si3O12, структурная — KAl2[AlSi8O10](OH, F)2. В данной формуле выделен в виде радикала сложный анионный комплекс, а вода присутствует в минерале не в виде Н2O, а в виде гидроксила (ОН)—, который может замещаться.
Формула анальцима Na[AlSi2O6]•H2O; является структурной. Квадратными скобками выделен радикал, представляющий сложный анионный комплекс Вода, имеющаяся в минерале в количестве одной молекулы, пишется в конце формулы и отделяется от нее точкой. Другой пример. Эмпирическая формула мусковита H2KAl3Si3O12, структурная — KAl2[AlSi8O10](OH, F)2. В данной формуле выделен в виде радикала сложный анионный комплекс, а вода присутствует в минерале не в виде Н2O, а в виде гидроксила (ОН)—, который может замещаться.
Как уже отмечалось, изоморфные примеси в формуле минерала изображаются в круглых скобках и отделяются друг от друга запятой. Химический элемент, стоящий на первом месте в скобках, присутствует в большем количестве. Например, формула анкерита Са (Mg, Fe)2[CO3]2. Рентгеноструктурный анализ в настоящее время позволил установить структурные формулы многих минералов.
Статья на тему Химический состав минералов
В состав минерала халькопирита входят медь (массовая доля 34,78 %), железо (массовая доля 30,44 %) и сера (массовая доля 34,78 %). Определите формулу минерала.

reshalka.com
ГДЗ учебник по химии 9 класс класс Габриелян. §36. Примените свои знания. Номер №7
Решение
Дано:
ω (Cu) = 34,78%
ω (Fe) = 30,44%
ω (S) = 34,78%
Найти:
формула − ?
Решение:
n (Cu) = 0,3478 : 64 = 0,0054
n (Fe) = 0,3044 : 56 = 0,0054
n (S) = 0,3478 : 32 = 0,0109
x : y : z = n (Cu) : n (Fe) : n (S) = 0,0054 : 0,0054 : 0,0109 = 1 : 1 : 2
Таким образом, молекулярная формула − $CuFeS_{2}$.
Ответ: $CuFeS_{2}$.
ФОРМУЛЫ МИНЕРАЛОВ
- ФОРМУЛЫ МИНЕРАЛОВ —
- в настоящее время применяется много способов написания хим. формул м-лов. Так, при отражении качественного состава важнейших компонентов и их количественных соотношений используется, напр., для кислородных соединений, написание в виде окислов (K,Na)2O·Аl2О3·6SiO2 — ортоклаз или микроклин; внутри скобок с разделением запятой объединяются изоморфные элементы (см. Изоморфизм), причем ведущий элемент ставится первым. Для отражения, кроме этих характеристик, важнейших черт строения используются упрощенные кристаллохим. формулы. Способов написания таких формул существует много в зависимости от той информации, которая требуется в конкретных исследованиях. Так, общая формула мусковита может быть изображена: K{Al2·[АlSi3О8](ОН)2}, а более детальная, отражающая конкретный его образец по данным хим. анализа, — К0,95Rb0,08·{Al1,50Fe3+0,45Mg0,07[Al1,05Si2,95O8](OH)2}·0,03H2O.Круглыми, квадратными, фигурными, иногда и другими видами скобок отражаются структурные группировки элементов: комплексные ионы, сочетания в виде цепочек, лент, листов и вязей (каркасов), причем достаточного единства в способе выделения этих группировок нет (исключение составляют комплексные ионы (но не ОН), которые обычно выделяют квадратными скобками). Для силикатов иногда наряду со скобками употребляются, ставящиеся перед формулами символы:
 — для одномерной кремнекислородной или алюмокремнекислородной основы цепочек и лент,
— для одномерной кремнекислородной или алюмокремнекислородной основы цепочек и лент,  , — для двумерной, т. е. для листов и
, — для двумерной, т. е. для листов и 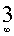 , — трехмерной, т. е. для каркасов. Особенности хим. связи элементов в соединении отражаются в зависимости от вкладываемых представлений о природе хим. связей. Так, при отражении гипотезы о существенно ионных связях формулу микроклина пишут: K+[Al3+Si4+O82-]–. Исходя из гипотезы отрицательно однозарядного и одновалентного состояния кислорода — О ” (В. И. Лебедев, 1957) формула микроклина будет иметь такой вид: К+[Al↓↓+Si↓↓++O8 -↓- ], а мусковита — К+Аl+++ ·[Al↓↓+Si↓↓++Si2↓↓↓+O10-↓ (OH)2–. Такое написание почти точно отражает состояние связей атомов кислорода, и в первом приближении атомов с ним связанных — катионов, установленное современными исследованиями по распределению эффективных зарядов. Иногда отражается координационное число элемента в виде индекса в квадратных скобках, напр., в формуле буры Nа2[Ва[4]В2[3]О5(ОН)4]·8H2O. В. И. Лебедев.
, — трехмерной, т. е. для каркасов. Особенности хим. связи элементов в соединении отражаются в зависимости от вкладываемых представлений о природе хим. связей. Так, при отражении гипотезы о существенно ионных связях формулу микроклина пишут: K+[Al3+Si4+O82-]–. Исходя из гипотезы отрицательно однозарядного и одновалентного состояния кислорода — О ” (В. И. Лебедев, 1957) формула микроклина будет иметь такой вид: К+[Al↓↓+Si↓↓++O8 -↓- ], а мусковита — К+Аl+++ ·[Al↓↓+Si↓↓++Si2↓↓↓+O10-↓ (OH)2–. Такое написание почти точно отражает состояние связей атомов кислорода, и в первом приближении атомов с ним связанных — катионов, установленное современными исследованиями по распределению эффективных зарядов. Иногда отражается координационное число элемента в виде индекса в квадратных скобках, напр., в формуле буры Nа2[Ва[4]В2[3]О5(ОН)4]·8H2O. В. И. Лебедев.
Геологический словарь: в 2-х томах. — М.: Недра.
.
1978.
Полезное
Смотреть что такое “ФОРМУЛЫ МИНЕРАЛОВ” в других словарях:
-
КРИСТАЛЛОХИМИЧЕСКИЕ ФОРМУЛЫ . — Собственно К. ф. соединений и м лов, отражающие не только основные мотивы строения соединений, как это принято в упрощенных кристаллохим. формулах (см. Формулы минералов), но и непосредственно важнейшие характеристики строения координационные чи … Геологическая энциклопедия
-
Минералы — Минерал (фр. minéral, от позднелат. minera руда) природное тело с определённым химическим составом и кристаллической структурой, образующееся в результате природных физико химических процессов и являющееся составной частью земной коры, горных… … Википедия
-
Минерал — термин, имеющий несколько определений. Вернадский (1923); “физ. или хим. индивидуализированный продукт земных хим. реакций, состоящий из хим. молекул”. Болдырев (1926): “хим. и физ. вполне или приблизительно однородная составная часть земной коры … Геологическая энциклопедия
-
Минерал — (франц. minéral, от позднелат. minera руда) природное тело, приблизительно однородное по химическому составу и физическим свойствам, образующееся в результате физико химических процессов на поверхности или в глубинах Земли (и других… … Большая советская энциклопедия
-
Минерал — (Mineral) Характеристика и классификация минерала Физические и химические свойства минералов, применение минералов Содержание Содержание Раздел 1. Определение. Раздел 2. Классификация минералов. Раздел 3. Структура и химический состав минералов.… … Энциклопедия инвестора
-
Геобаротермометрия — Возможно, эта статья содержит оригинальное исследование. Добавьте ссылки на источники, в противном случае она может быть выставлена на удаление. Дополнительные сведения могут быть на странице обсуждения. (11 мая 2011) … Википедия
-
Берцелиус Йёнс Якоб — (Berzelius) (1779 1848), шведский химик и минералог, иностранный почётный член Петербургской АН (1820). Открыл церий (1803), селен (1817), торий (1828). Создал (1812 1819) электрохимическую теорию химического сродства, на её основе построил… … Энциклопедический словарь
-
МИНЕРАЛОГИЯ — (от лат. minera кусок руды, горный штуф и греческого logos учение. слово), наука о минералах, об их хим. составе, физ. свойствах, условиях образования в природе, изменениях и превращениях в связи с изменением этих условий. Минералы твердые,… … Большая медицинская энциклопедия
-
Горные породы — твердая кора земного шара и весь твердый его остов сложены из минеральных агрегатов. Г. породами называются те из этих агрегатов, которые играют существенную роль в составе литосферы, обнаруживая в основных чертах постоянство состава и строения в … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
-
А=А — формула, выражающая принцип тождества в формальной логике; читается: А есть А , А тождественно А , А равно А , А есть то же самое, что А , А эквивалентно А . Различают онтологический и логич. аспекты принципа А = А. Онтологич. аспект означает… … Философская энциклопедия
