Оксиды хлора — неорганические химические соединения хлора и кислорода, общей формулой: ClхOу.
Хлор образует следующие оксиды: Cl2O, Cl2O2 (ClClO2), Cl2O3 (ClOClO2), ClO2 (радикал), Cl2O4 (ClOClO3), Cl2O6 (O2ClOClO3), Cl2O7. Кроме того известны неустойчивые соединения: пероксид хлора(I) ClOOCl, ClOClO, короткоживущий радикал ClO, радикал хлорпероксил ClOO и радикал триоксид хлора ClO3.
Ниже в таблице представлены свойства устойчивых оксидов хлора:
| Свойство | Cl2O | ClO2 | ClOClO3 | Cl2O6 | Cl2O7 |
|---|---|---|---|---|---|
| Оксид хлора(I) | Диоксид хлора | Перхлорат хлора (англ.) (рус. | Оксид хлора(VI) | Оксид хлора(VII) | |
| Цвет и состояние при комн. температуре | Жёлто-коричневый газ | Жёлто-зелёный газ | Светло-жёлтая или бледно-зелёная жидкость | Тёмно-красная жидкость | Бесцветная жидкость |
| Степень окисления хлора | (+1) | (+4) | (+1), (+7) | (+5), (+7) | (+7) |
| Тпл, °C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| Ткип, °C | 2,0 | 11 | 44,5 | 203 | 81 |
| Плотность (ж, 0°C), г·см−3 | — | 1,64 | 1,806 | — | 2,02 |
| ΔH°обр (газ, 298 К), кДж·моль−1 | 80,3 | 102,6 | ~180 | (155) | 272 |
| ΔG°обр (газ, 298 К), кДж·моль−1 | 97,9 | 120,6 | — | — | — |
| S°обр (газ, 298 К), Дж·K−1·моль−1 | 265,9 | 256,7 | 327,2 | — | — |
| Дипольный момент, Д | 0,78 ± 0,08 | 1,78 ± 0,01 | — | — | 0,72 ± 0,02 |
Литература[править | править код]
- Nils Wiberg, Egon Wiberg und Arnold Fr. Holleman: Lehrbuch der Anorganischen Chemie. Gruyter; 102. stark umgearb. u. verb. Auflage; ISBN 978-3-11-017770-1; S. 482–487
- Chlorine oxoacids and structure of dichlorine oxides. Chem. Educator, Vol. 16, 2011, vol. 16, pp. 275—278 Архивная копия от 20 января 2015 на Wayback Machine
…
Хлороводород, соляная кислота (HCl)
Способы
получения хлороводорода
Промышленный способ:
- Синтез из простых веществ:
Н2 + Cl2 = 2HCl
- Образуется как побочный продукт при хлорировании углеводородов:
R-H + Cl2 = R-Cl + HCl
Лабораторный способ:
В лаборатории HCl получают действием концентрированной H2SO4 на хлориды:
- при слабом нагревании
H2SО4(конц.) + NaCl = 2HCl↑ + NaHSО4
- при очень сильном нагревании
H2SО4(конц.) + 2NaCl = 2HCl↑ + Na2SО4
Физические свойства хлороводорода
HCl при обычной температуре — бесцветный газ с резким запахом, достаточно легко сжижается (Тпл = -114°С, Ткип = -85°С). Безводный НСl и в газообразном, и в жидком состояниях не проводит электрический ток.
HCl хорошо растворяется в воде: при обычной температуре в 1 л воды растворяется ~ 450 л газа (реакция экзотермическая). Насыщенный раствор содержит 36-37 % HCl по массе, имеет резкий, удушающий запах.
Химические свойства хлороводорода
Газообразный HCl
Безводный НСl химически инертен по отношению к металлам, оксидам и гидроксидам металлов, а также ко многим другим веществам. Что означает, что в отсутствие воды хлороводород не проявляет кислотных свойств.
И только при очень сильном нагревании газообразный HCl реагирует с металлами, даже такими малоактивными, как Сu и Аg.
Восстановительные свойства HCl проявляются также в малой степени:
- он может окисляться фтором при обычной температуре:
2HCl + F2 = Сl2 + 2HF
- при высокой температуре (600°С) в присутствии катализаторов обратимо реагирует с кислородом:
4HCl + O2 = 2Сl2 + 2Н2O
Раствор HCl
Водный раствор HCl является сильной кислотой, т.к. молекулы HCl практически полностью распадаются на ионы:
HCl → H+ + Cl—
Общие свойства кислот
Он проявляет
все свойства кислот:
- реагирует с металлами, стоящими в электрохимическом ряду напряжения металлов до водорода Н:
2HCl2 + Zn = ZnCl2 + H2
- взаимодействует с основными и амфотерными оксидами:
2HCl + CuO = CuCl2 + Н2O
6HCl + Аl2O3 = 2АlCl3 + ЗН2O
- реагирует с основаниями и амфотерными гидроксидами:
2HCl + Са(ОН)2 = CaCl2 + 2Н2О
3HCl + Аl(ОН)3 = АlСl3 + ЗН2O
- Вступает в реакцию с аммиаком:
HCl + NH3 = NH4Cl
- взаимодействует с солями более слабых кислот:
2HCl + СаСО3 = CaCl2 + СO2 + Н3O
HCl + C6H5ONa = С6Н5ОН + NaCl
- Реагирует с сильными окислителями F2, MnO2, KMnO4, KClO3, K2Cr2O7. При этом анион Cl— окисляется до свободного хлора:
2Cl—— 2e— = Cl20
4HCI + MnO2 = Cl2↑ + МпCl2 + 2Н2O
16НСl + 2КМпО4 = 5Cl2↑ + 2MnCl2 + 2KCl + 8Н2O
6HCl + КСlO3 = ЗCl2↑ + KCl + 3Н2O
14HCl + К2Сr2O7 = 3Cl2↑ + 2CrCl3 + 2KCl + 7Н2O
![]()
- Качественная реакция – взаимодействие с растворимыми солями серебра с образованием белого творожистого осадка хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
- С органическими соединениями
Вступает в реакции с органическими соединениями:
с аминами:
R-NH2 + HCl → [RNH3]+Cl—
с аминокислотами:
![]()
Кислородсодержащие кислоты галогенов
![]()
Хлорноватистая кислота (HClO) и ее соли
Хлорноватистая кислота
очень слабая кислота и существует только в разбавленных водных растворах.
Получение хлорноватистой кислоты:
- Диспропорционирование хлора в холодной воде:
Cl2 + H2O ↔ HCl + HClO
- Реакция гипохлоритов с диоксидом углерода и водой :
KClO
+ H2O + CO2 → KHCO3 + HClO
Ca(OCl)2 + CO2 + H2O → CaCl2 + CaCO3 + HClO
Химические свойства хлорноватистой кислоты:
- Несмотря на то, что хлорноватистая кислота HClO – слабая кислота, она является сильным окислителем, особенно в кислой среде. При этом хлор хлорноватистой кислоты восстанавливается до степени окисления -1.
HClO + 2HI → HCl + I2 + H2O
HClO + KI → KIO3 + HCl
2HBr
+ HClO → HCl + Br2 + H2O
HClO + H2O2 → HCl + O2 + H2O
4HClO + MnS → 4HCl + MnSO4
- на свету хлорноватистая
кислота разлагается:
2HClO → 2HCl + O2
- Как кислота реагирует с сильными основаниями:
HClO + KOH → KClO + H2O
- Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой
кислоты (гипохлоритов):
- Разложение гипохлоритов при нагревании:
Ca(ClO)2 → CaCl2 + O2
- Кислоты, более сильные, чем
хлорноватистая вытесняют гипохлориты из солей:
NaClO + 2HCl → NaCl + Cl2 + H2O
Ca(ClO)2 + H2SO4 → CaSO4 + 2HCl + O2
Ca(ClO)2 + CO2 + H2O → CaCO3 + 2HClO
- Взаимодействуют с другими солями, если продуктом является слабый электролит:
Ca(ClO)2 + Na2CO3 → CaCO3 + 2NaClO
Хлористая кислота (HClO2) и ее соли
Хлористая кислота HClO2– слабая кислота, существует только в водных растворах, очень
неустойчива
Способы получения хлористой кислоты:
- Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
2KClO3 + H2C2O4 + H2SO4 = K2SO4 + CO2 + 2ClO2 + 2H2O
2ClO2 + H2O2 → 2HClO2 + O2
- из хлоритов:
Ba(ClO2)2 + H2SO4 → BaSO4 + HClO2
Химические свойства хлористой кислоты:
- Вступает в реакции с щелочами с образованием хлоритов:
HClO2 + KOH → KClO2 + H2O
- При длительном хранении разлагается:
4HClO2 → HCl + HClO3 + 2ClO2 + H2O
- Проявляет окислительно-восстановительные свойства:
HClO2 + HClO → HClO3 + HCl
5HClO2 + 3H2SO4 + 2KMnO4 → 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
Соли хлористой кислоты – хлориты
- разлагаются при нагревании:
KClO2 → KClO3 +
KCl
KClO2 → KCl + O2
- реагируют с сильными кислотами:
NaClO2 + 4HCl(конц) = 2Cl2 + NaCl + 2H2O
- являются слабыми восстановителями и сильными окислителями в кислой среде:
NaClO2 + S = NaCl + SO2
5NaClO2 + 3H2SO4 + 2KMnO4 → 5NaClO3 + 2MnSO4 + K2SO4 + 3H2O
Хлорноватая кислота (HClO3) и ее соли
Хлорноватая кислота HClO3– существует только в водных растворах, в свободном виде не выделена. Является сильной кислотой
Получение хлорноватой кислоты:
Действием кислот на хлораты:
Ba(ClO3)2 + H2SO4 → 2HClO3 + BaSO4
Химические свойства хлорноватой кислоты:
- Взаимодействует с щелочами с образованием хлоратов:
HClO3 + KOH → KClO3 + H2O
- Окисляет некоторые вещества:
6P + 5HClO3 → 3P2O5 + 5HCl
НСlO3 + 6НВr → НСl + 3Вr2 + 3Н2О
HClO3 + 3SO2 + 3H2O → 3H2SO4 + HCl
- Разлагается при слабом нагревании:
6НСlO3(конц) → 4СlO2 + Cl2O7 + 3H2O (40-60ºC)
3НСlO3(конц) → HСlO4 + Cl2 + O2 + H2O (кипечение)
Соли хлорноватой кислоты – хлораты:
Получают хлораты при пропускании хлора
через подогретый раствор щелочи:
3Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
- Хлораты сильные окислители.
2KClO3 + 3S → 2KCl + 3SO2
5KClO3 + 6P → 5KCl + 3P2O5
КСlO3 + 6НСl = КСl + 3Сl2 + 3Н2О
- хлорат калия (бертолетова соль) при нагревании разлагается диспропорционируя на хлорид и перхлорат калия:
4KClO3 → 3KClO4 + KCl
- В присутствии оксида марганца (IV) в качестве катализатора хлорат калия разлагается с выделением кислорода:
2KClO3 → 2KCl + 3O2↑
Хлорная кислота (HClO4) и ее соли
Хлорная кислота HClO4– летучая, хорошо растворимая в воде жидкость, не имеющая цвета. Является сильной кислотой и сильным окислителем. Взрывоопасна. Кислотный оксид — Cl2O7, соли хлорной кислоты — перхлораты.
Получение хлорной кислоты
Перегонкой при пониженном давлении смеси перхлората калия с серной кислотой:
2NaClO4 + H2SO4 → 2HClO4 + Na2SO4
Химические свойства хлорной кислоты
- Как сильная кислота вступает в реакции с
щелочами с образованием перхлоратов:
HClO4 + KOH → KClO4 + H2O
- Как сильный окислитель окисляет многие вещества:
8HClO4 + 14C → 14CO2 + 4Cl2 + 4H2O
5HClO4 + 8As + 12H2O = 8H3AsO4 + 5HCl
3HClO4 + 2Ag = 2AgClO4 + HClO3 + H2O
- Хлорная кислота является неустойчивой и разлагается при умеренном нагревании:
4HClO4 → 4ClO2 + 3O2 + 2H2O
Химические свойства солей хлорной кислоты – перхлоратов:
- Перхлораты также являются сильными окислителями
3KClO4 + 8Al → 3KCl + 4Al2O3
- Взаимодействуют с сильными кислотами:
2KClO4 + 3H2SO4(конц) → 2HClO4↑ + K2SO4
- При нагревании более 550ºС разлагаются:
KClO4 → KCl + 2O2↑
Оксиды хлора
![]()
Оксид хлора (I), оксид дихлора ( Cl2O)
В газообразном состоянии имеет темно-желтый цвет, в жидком состоянии – красно-бурый. Неустойчив на свету при повышении температуры.
Получение оксид хлора (I)
2Cl2 + 3HgO =
Hg3O2Cl2↓ + Cl2O↑
2Cl2 + Bi2O3 = 2BiOCl↓ + Cl2O↑
Химические свойства оксида хлора (I)
- Имеет кислотные свойства. Реагирует с водой, щелочами:
Сl2O + H2O = 2HClO
Сl2O + NaOH = 2NaClO + H2O
- Является сильным окислителем:
3Сl2O + 3H2O +
6AgNO3 = 2AgClO + AgCl + 6HNO3
- При температуре выше 20ºС или на свету разлагается:
4Сl2O = 3Сl2 + 2ClO2
Оксид хлора (IV), диоксид хлора, двуокись хлора ( ClO2)
ClO2 – ядовитый газ желто-зеленого цвета с резким запахом. Взрывается при механическом воздействии, при нагревании до 100 ºС и при контакте с восстановителем
Получение двуокиси хлора
В промышленности ClO2 получают, пропуская оксид серы (IV) через подкисленный раствор хлората натрия NaClO3:
2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + 2ClO2↑
В лаборатории ClO2получают при взаимодействии хлората калия с щавелевой кислотой в присутствии концентрированной серной кислоты:
2KClO3 + H2C2O4 + H2SO4 = 2K2SO4 + 2ClO2↑ + 2CO2 + 2H2O
Химические свойства оксида хлора (IV)
- ClO2 сильный окислитель, проявляет кислотные свойства. Реагирует с водой (медленно), со щелочью (быстро):
2ClO2 + H2O = HClO2 + HClO3 (холодная
вода)
6ClO2 + 3H2O = HCl +
5HClO3 (горячая вода)
2ClO2 + 2NaOH = NaClO2 + NaClO3
- Разлагается в концентрированной хлороводородной кислоте:
2ClO2 + 8HСl(конц) = 5Cl2 + 4H2O
- Проявляет окислительно-восстановительные свойства:
2ClO2 + Na2СO3 = NaClO2 + NaClO3 + CO2
2ClO2 + 10HI(конц) = 2HCl + I2↓ + 4H2O
Оксид хлора (VI), триоксид хлора (ClO3 (Cl2O6))
ClO3 (Cl2O6)
– вязкая жидкость красного цвета. Соприкосновение с органическими веществами
приводит к взрыву.
Получение оксида хлора (VI)
Получают окислением озоном ClO2
2ClO2 + 2О3 = 2O2 + Cl2O6
Химические свойства оксида хлора (VI)
- В обычных условиях постепенно разлагается на ClO2 и О2:
4ClO3 = 2ClO2 + 4О2 + Сl2
- ClO2 – сильный окислитель. Вступает в реакции диспропорционирования с водой, со щелочью:
2ClO3 + H2O = HClO4 + HClO3
2ClO3 + 2NaOH = NaClO4 + NaClO3 + H2O
Оксид хлора (VII) (Cl2О7)
Cl2О7 – тяжелая, маслянистая
жидкость, не имеющая цвета. Наиболее устойчивый из всех оксидов хлора. Очень
взрывоопасен.
Получение оксида хлора (VII)
Получают при взаимодействии оксида фосфора (V) с концентрированной хлорной кислотой:
P2O5 + 2HClO4 = Cl2O7↑
+ 2HPO3
Химические свойства Cl2O7
Проявляет кислотные свойства.
- При взаимодействии Cl2О7 с водой образуется хлорная кислота HClO4:
Cl2O7 + H2O = HClO4
- При взаимодействии Cl2О7 с щелочами образуются перхлораты:
Cl2O7 + 2NaOH = 2NaClO4 + H2O
- При нагревании разлагается:
Cl2O7= 2Cl2 + 7О2
Как получить оксиды хлора
Хлор способен образовывать несколько различных оксидов. Все они применяются в промышленности в больших объемах, так как востребованы во многих областях промышленности.
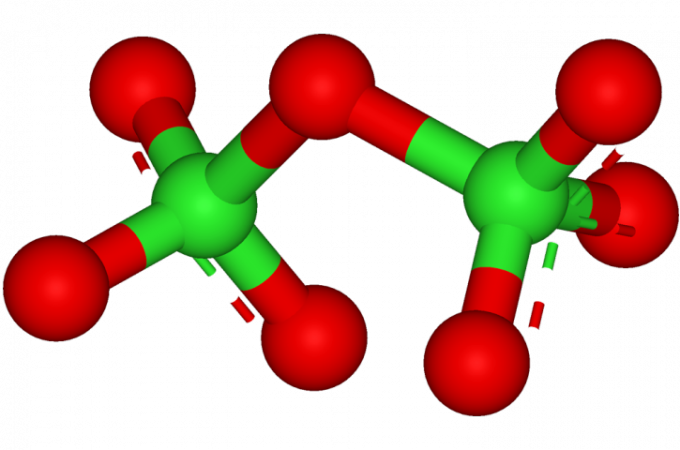
Хлор образует с кислородом целый ряд оксидов, общее число которых составляет целых пять видов. Все их можно описать общей формулой ClxOy. В них валентность хлора меняется от 1 до 7.
Валентность разных оксидов хлора различна: Cl2O – 1, Cl2O3 – 3, ClO2 – 4, Cl2O6 – 6, Cl2O7 – 7.
Оксид хлора(I) применяют для производства гипохлоритов, которые являются сильными отбеливающими и обеззараживающими агентами.
Оксид хлора(II) активно применяют для отбеливания муки, целлюлозы, бумаги и других вещей, а также для стерилизации и дезинфекции.
Оксид хлора(VI) и оксид хлора(VII) применяют для синтеза органических соединений.
Данный оксид на крупнотоннажных производствах получают двумя способами.
1. По методу Пелуза. Проводят реакцию между газообразным хлором и оксидом ртути. В зависимости от условий может образоваться иное соединение ртути, однако целевой продукт остается. После этого газообразный оксид хлора сжижают при температуре -60 градусов Цельсия.
Уравнения реакции, описывающие метод Пелуза:
2HgO + Cl2 = Hg2OCl2 + Cl2O
HgO + 2Cl2 = HgCl2 + Cl2O
2. Взаимодействие хлора с водным раствором карбоната натрия по реакции:
2Cl2 + 2Na2CO3 + H2O = 2NaHCO3 + Cl2O + 2NaCl
Карбонат натрия может быть заменен другими карбонатами щелочных или щелочноземельных металлов.
Единственный промышленный метод получения диоксида хлора основан на взаимодействии хлората натрия и диоксида серы в кислой среде. Результатом такого взаимодействия становится реакция:
2NaClO3 + SO2 + H2SO4 = 2NaHSO4 + ClO2
В промышленности Cl2O6 получают взаимодействием диоксида хлора с озоном:
2ClO2 + 2O3 = 2O2 + Cl2O6
1. Осторожное нагревание хлорной кислоты с фосфорным ангидридом приводит к отделению маслянистой жидкости, которая является оксидом хлора (VII). Весь процесс описывается реакцией:
2HClO4 + P4O10 = H2P4O11 + Cl2O7
2. Второй способ получения данного оксида связан с электричеством. Если проводить электролиз раствора хлорной кислоты, то в анодном пространстве можно обнаружить Cl2O7.
3. Нагревание в вакууме перхлоратов переходных металлов приводит к образованию оксида хлора (VII). Наиболее часто нагревают перхлорат ниобия либо молибдена.
Cl2O: при стандартных условиях буровато-желтый газ с запахом хлора, а при температуре ниже +2 градусов Цельсия золотисто-красная жидкость. Взрывоопасен в больших концентрациях.
ClO2: при стандартных условиях – газ с характерным запахом красно-желтого цвета, при температуре ниже +10 градусов Цельсия – красно-коричневая жидкость. Взрывается на свету, в присутствии восстановителей и при нагревании.
Cl2O6: неустойчивый газ, который начинает разлагаться при температуре от 0 до +10 градусов Цельсия с образованием диоксида хлора, при 20 градусах Цельсия образуется хлор. Ввиду образования диоксида хлора – взрывоопасен.
Cl2O7: бесцветная маслянистая жидкость, которая при нагревании выше 120 градусов Цельсия взрывается. Может детонировать от удара.
Поиск химических веществ по названиям или формулам.
Справочник содержит названия веществ и описания химических формул (в т.ч. структурные формулы и скелетные формулы).
Введите часть названия или формулу для поиска:
Общее число найденных записей: 356.
Показано записей: 20.
1. Оксид хлора(II)
Брутто-формула:
ClO
CAS# 12301-79-0
Названия
Русский:
- Оксид хлора(II)
- радикал ClO
;
;
English:
- Chlorine monoxide [Wiki]
- Chlorine monoxide monocation
- Chlorine oxide (ClO), ion(1+)
- Chlorine oxide ion (ClO+)
- Chlorine oxide ion (ClO1+)
- Chlorine(II) oxide
- Chlorinemonooxide ion(1+)
- Chlorooxidanyl
- Chlorosyl ion (9CI)
- Oxido-λ3-chloranyl(IUPAC)
- Oxochloronium
- chloranyl, oxido-
- oxidochlorine(.)
- oxidochlorine(•)
;
;
;
;
;
;
;
;
;
;
;
;
;
;
$dashes(|_)$dots(Ul)O_(x1)$dashes(-_|)Cl
2. Диоксид хлора
Брутто-формула:
ClO2
CAS# 10049-04-4
Названия
Русский:
- Диоксид хлора [Wiki]
- Оксид хлора(IV)
;
;
English:
- Alcide
- Anthium dioxcide
- Caswell No. 179A
- Chlorine dioxide [Wiki]
- Chlorine oxide (ClO2)
- Chlorine peroxide
- Chlorine(IV) oxide
- Chloroperoxyl
- Chlorosyloxidanyl
- Chloryl
- Chloryl radical
- ClO2(.)
- Doxcide 50
- EINECS:233-162-8
- chlorosyloxy
- dioxido-λ5-chloranyl(IUPAC)
- dioxidochlorine(.)
- dioxidochlorine(•)
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
;
3. Оксид хлора(VI)
Брутто-формула:
Cl2O6
CAS# 12442-63-6
Названия
Русский:
- Оксид хлора(VI) [Wiki]
;
English:
- Chlorine trioxide
- Chlorine(V,VII) oxide
- Chloryl perchlorate
- Dichlorine hexoxide [Wiki]
;
;
;
;
O_(A-60,N2)$dashes(/)Cl<_(A60,N2)O>/OCl<_qqO><_ppO>\O
4. Оксид хлора(I)
Брутто-формула:
Cl2O
CAS# 7791-21-1
Названия
Русский:
- Оксид хлора(I) [Wiki]
- ангидрид хлорноватистой кислоты
- гемоксид хлора
;
;
;
English:
- CHLORINE OXIDE (CL2O)
- Chlorine(I) oxide
- ClOCl
- Dichlorine monoxide [Wiki]
- Dichlorine oxide
- Hypochlorous anhydride
- Hypochlorous oxide
- Oxygen dichloride
- [OCl2]
- chloro hypochlorite(IUPAC)
- dichloridooxygen
- dichloroether
- dichlorooxidane
- oxychloride
;
;
;
;
;
;
;
;
;
;
;
;
;
;
5. Оксид хлора(I,V)
Брутто-формула:
Cl2O3
CAS# 17496-59-2
Названия
Русский:
- Оксид хлора(I,V)
;
English:
- (Chlorooxy)chlorane dioxide
- Dichlorine trioxide [Wiki]
- chlorine chlorate
- chlorine(I,V) oxide
;
;
;
;
O_(A-100,N2)$dashes(-)Cl`/O/O/Cl
6. Перхлорат хлора
Брутто-формула:
Cl2O4
CAS# 27218-16-2
Названия
Русский:
- Оксид хлора(I,VII)
- Перхлорат хлора
- дихлоротетраоксид
;
;
;
English:
- (chlorooxy)chlorane trioxide
- Chlorine (I,VII) oxide
- Chlorine chlorate oxide [Cl(ClO3)O]
- Chlorine perchlorate [Wiki]
- Chlorine perchlorate(Cl(ClO4))
- Chlorineoxide (Cl2O4) (8CI)
- Chloro perchlorate(IUPAC)
- Dichlorine tetroxide
;
;
;
;
;
;
;
;
O_(A-100,N2)Cl`/O/`|O|O/Cl
7. Оксид хлора(VII)
Брутто-формула:
Cl2O7
CAS# 10294-48-1
Названия
Русский:
- Оксид хлора(VII) [Wiki]
- дихлорогептаоксид
- хлорный ангидрид
;
;
;
English:
- (Perchloryloxy)chlorane trioxide
- Chlorine heptoxide (Cl2O7)
- Chlorine oxide (Cl2O7)
- Chlorine(VII) oxide
- Chlorineheptoxide
- Cl2O7
- Dichlorheptaoxid
- Dichlorine heptaoxide
- Dichlorine heptoxide [Wiki]
- Dichlorineheptoxide
- Perchloric anhydride
- oxybis(chlorane) hexaoxide
- perchloryl perchlorate(IUPAC)
;
;
;
;
;
;
;
;
;
;
;
;
;
O=Cl<`||O><||O>-O-Cl<`||O><||O>=O
O//Cl<_qq4O><_pp4O>/OCl<_qq4O><_pp4O>\O
8. Пероксид хлора(I)
Брутто-формула:
Cl2O2
CAS# 12292-23-8
Названия
Русский:
- Пероксид хлора(I)
;
English:
- Chlorine peroxide(Cl2(O2)) (9CI)(CAS)
- Cl2O2
- ClOOCl
- Dichlorine dioxide [Wiki]
- chlorine(I) peroxide
- chlorooxy hypochlorite(IUPAC)
;
;
;
;
;
;
9. метиловый спирт
Брутто-формула:
CH4O
CAS# 67-56-1
Названия
Русский:
- Метанол(IUPAC) [Wiki]
- гидроксид метила
- древесный спирт
- карбинол
- метилгидрат
- метиловый спирт
;
;
;
;
;
;
English:
- Colonial Spirit
- EINECS:212-378-6
- Hydroxymethane
- Methanol(IUPAC)(CAS) [Wiki]
- Methyl hydrate
- Methyl hydroxide
- Methylic alcohol
- Methylol
- Pyroxylic spirit
- Wood alcohol
- Wood naphtha
- Wood spirit
- carbinol
- methyl alcohol
;
;
;
;
;
;
;
;
;
;
;
;
;
;
$slope(55)H/C<_(A-160,w+)H><_(A-100,d+)H>-O/H
10. Хлораль
Брутто-формула:
C2HCl3O
CAS# 75-87-6
Названия
Русский:
- Хлораль [Wiki]
- трихлорацетальдегид
- трихлоруксусный альдегид(IUPAC)
;
;
;
English:
- 2,2,2-trichloroacetaldehyde(IUPAC)
- Acetaldehyde, trichloro-(CAS)
- Anhydrous chloral
- Chloral [Wiki]
- Grasex
- Trichloroethanal
;
;
;
;
;
;
Cl/`|O|H; Cl_(A-60,w-)#2_(A60,d+)Cl
11. Этиленоксид
Брутто-формула:
C2H4O
CAS# 75-21-8
Названия
Русский:
- 1,2-эпоксиэтан
- Окись этилена(IUPAC) [Wiki]
- Этиленоксид
- оксиран
;
;
;
;
English:
- Ethylene oxide(IUPAC) [Wiki]
- Oxirane(CAS)
- dimethylene oxide
- epoxyethane
- oxacyclopropane
;
;
;
;
;
C_(x1.4)C_q3O_q3; H_(A-15,d-)#1_(A110,w+)H; H_(A-165,d-)#2_(A70,w+)H;
$L(1.4)C_(A0)C_q3O_q3; H_(x1)#1_p3H;H_(x-1)#2_q3H
12. Триметиленоксид
Брутто-формула:
C3H6O
Названия
Русский:
- Оксетан(IUPAC)
- Триметиленоксид
;
;
English:
- 1,3-epoxypropane
- 1,3-propylene oxide
- Oxetane(IUPAC)
- oxacyclobutane
- trimethylene oxide
;
;
;
;
;
H|C|C|H; H|C|$atomColor1(blue)O; H-#2-#6-H; H-#3-#O
13. Гексаметиленоксид
Брутто-формула:
C6H12O
Названия
Русский:
- Гексаметиленоксид
- Оксепан(IUPAC)
;
;
English:
- Oxepane
;
14. Вода
Брутто-формула:
H2O
CAS# 7732-18-5
Названия
Русский:
- Вода [Wiki]
- Оксид водорода(IUPAC)
;
;
English:
- Dihydrogen oxide
- Water(CAS) [Wiki]
- oxidane(IUPAC)
;
;
;
15. Углекислый газ
Брутто-формула:
CO2
Названия
Русский:
- Оксид углерода(IV)(IUPAC)
- Углекислый газ
- двуокись углерода
- диоксид углерода
- угольный ангидрид
;
;
;
;
;
English:
- Carbon dioxide
- Carbon oxide
- Carbon(IV) oxide
- Carbonic acid gas
- Carbonic anhydride
- Carbonic oxide
- Dry ice
;
;
;
;
;
;
;
16. Оксид фосфора(V)
Брутто-формула:
O10P4
Названия
Русский:
- Оксид фосфора(V)
- Пентаоксид фосфора
- пятиокись фосфора
- фосфорный ангидрид
;
;
;
;
English:
- Diphosphorus pentoxide
- Phosphoric anhydride
- Phosphoric oxide
- Phosphoric pentoxide
- Phosphorus oxide
- Phosphorus pentaoxide
- Phosphorus pentoxide
;
;
;
;
;
;
;
$slope(15)$L(1.5)O||P`/O|P:l`/O/O/P:rO“|O`_(A120)O|P<`/O_#l><O_#r>_(A120,N2)O
17. Гидроксид калия
Брутто-формула:
HKO
CAS# 1310-58-3
Названия
Русский:
- Гидроксид калия(IUPAC) [Wiki]
- Кали едкое
- гидроокись калия
- калия гидроксид
- каустический поташ
;
;
;
;
;
English:
- Caustic potash
- E525
- Potash lye
- Potassia
- Potassium hydrate
- Potassium hydroxide(IUPAC) [Wiki]
;
;
;
;
;
;
18. Гидроксид натрия
Брутто-формула:
HNaO
CAS# 1310-73-2
Названия
Русский:
- Гидроксид натрия(IUPAC) [Wiki]
- гидроокись натрия
- едкая щелочь
- едкий натр
- каустик
- каустическая сода
- натрия гидроксид
;
;
;
;
;
;
;
English:
- Ascarite
- Caustic soda
- E524
- Lye
- Sodium hydrate
- Sodium hydroxide(IUPAC) [Wiki]
- Sodium oxidanide
- White caustic
;
;
;
;
;
;
;
;
19. Гидроксид кальция
Брутто-формула:
H2CaO2
CAS# 1305-62-0
Названия
Русский:
- Гидроксид кальция(IUPAC) [Wiki]
- гашёная известь
- гидроокись кальция
- кальция гидроксид
;
;
;
;
English:
- Calcium hydroxide(IUPAC) [Wiki]
- Calcium(II) hydroxide
- E526
- Hydrated lime
- Milk of lime
- Pickling lime
- Slaked lime
;
;
;
;
;
;
;
$L(1.5)HO^-Ca^2+/0`HO^-
20. Оксид кальция
Брутто-формула:
CaO
CAS# 1305-78-8
Названия
Русский:
- Оксид кальция(IUPAC) [Wiki]
- кальция оксид
- окись кальция, негашёная и́звесть
;
;
;
English:
- Calcia
- Calciogreen
- Calcium oxide(IUPAC) [Wiki]
- Calciumoxide (CaO)
- EINECS:215-138-9
- Oxocalcium(IUPAC)
- Quicklime
- burnt lime
- unslaked lime
;
;
;
;
;
;
;
;
;
- Учебники
- 8 класс
- Химия 👍
- Габриелян
- №4

авторы: Габриелян, Сладков, Остроумов.
издательство: “Просвещение”
Раздел:
- ГЛАВА 1. Первоначальные химические понятия
- ГЛАВА 2. Важнейшие представители неорганических веществ. Количественные отношения в химии
- §14. Оксиды
- Часть I
Составьте формулы оксидов:
а) хлора (I)
б) хлора (III)
в) хлора (V)
г) хлора (VII)
Не производя вычислений, расположите данные оксиды в порядке уменьшения в них массовой доли хлора.

reshalka.com
ГДЗ Химия 8 класс рабочая тетрадь Габриелян. §14. Часть I. Номер №4
Решение
а) хлора (I) − $Cl_{2}O$
б) хлора (III) − $Cl_{2}O_{3}$
в) хлора (V) − $Cl_{2}O_{5}$
г) хлора (VII) − $Cl_{2}O_{7}$
Оксиды в порядке уменьшения в них массовой доли хлора: $Cl_{2}O$; $Cl_{2}O_{3}$; $Cl_{2}O_{5}$; $Cl_{2}O_{7}$
- Предыдущее
- Следующее
![]()
Нашли ошибку?
Если Вы нашли ошибку, неточность или просто не согласны с ответом, пожалуйста сообщите нам об этом
