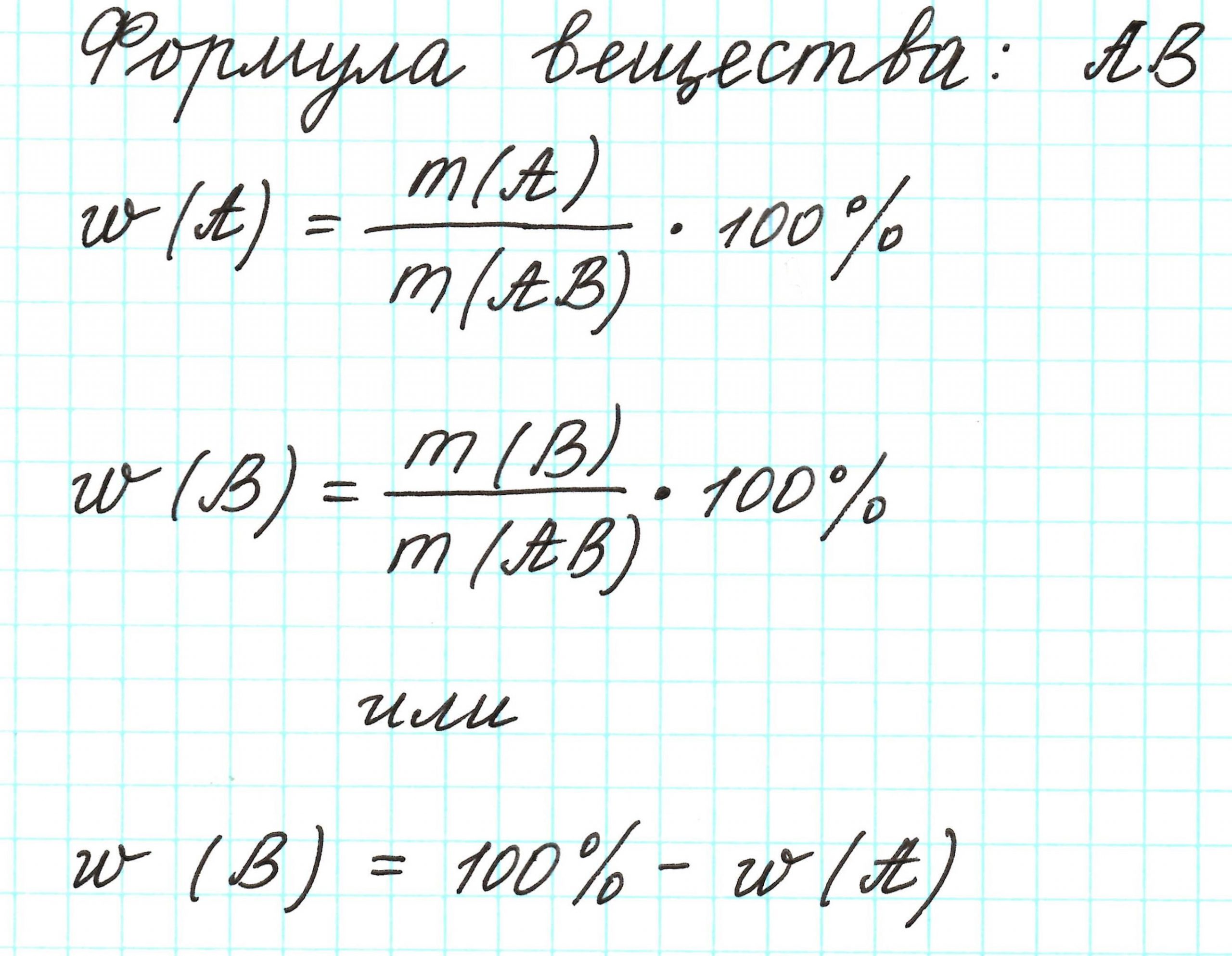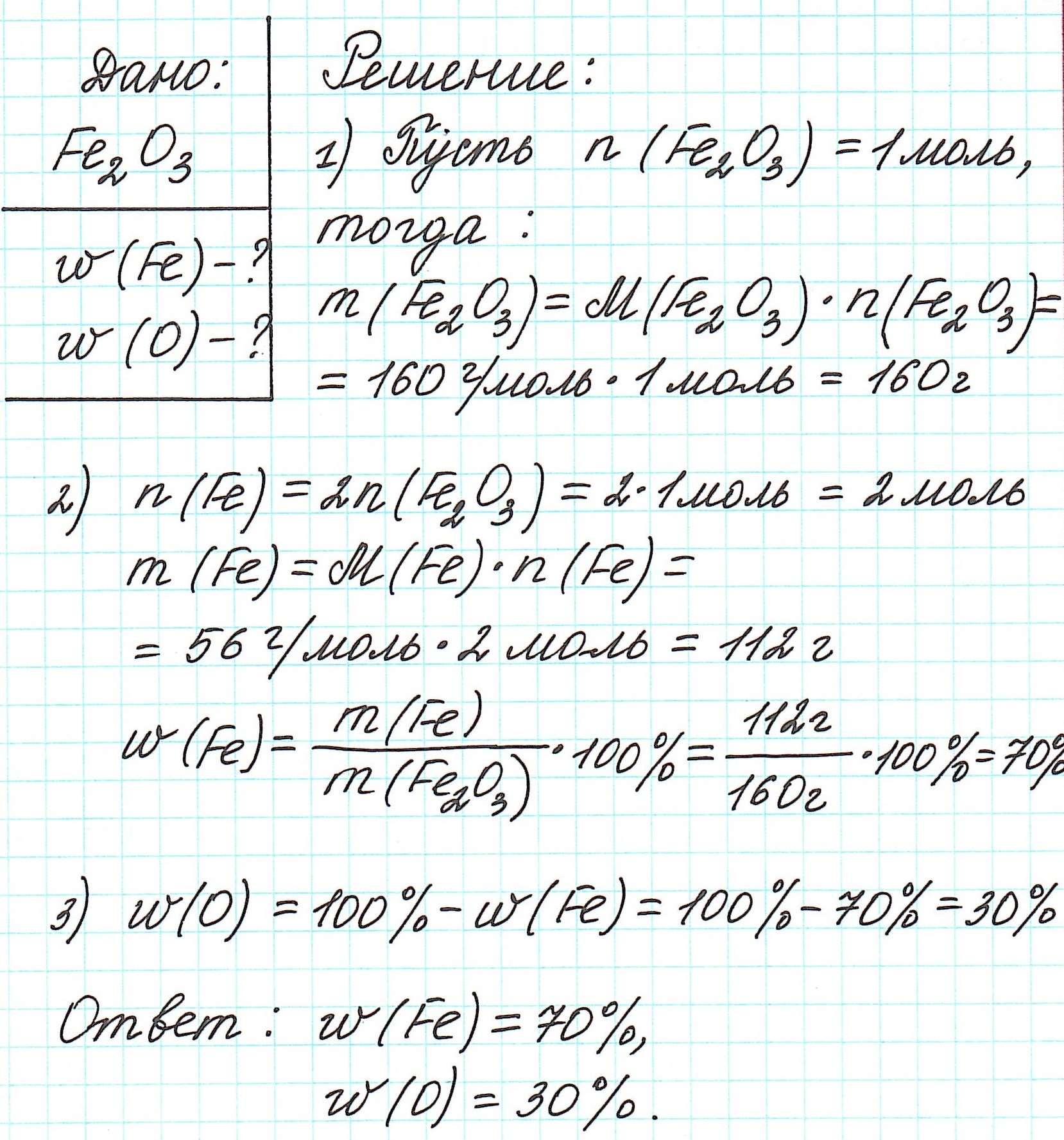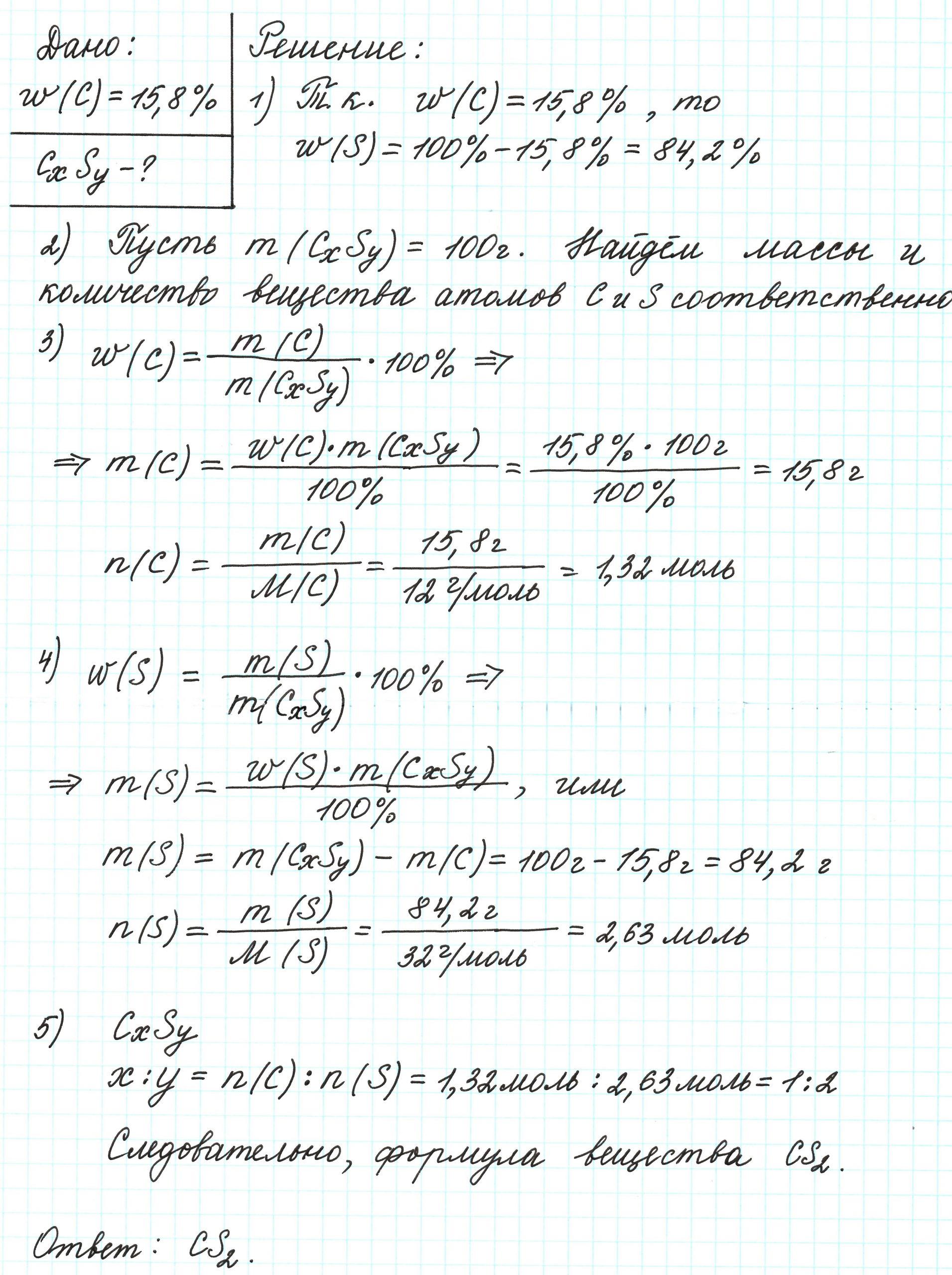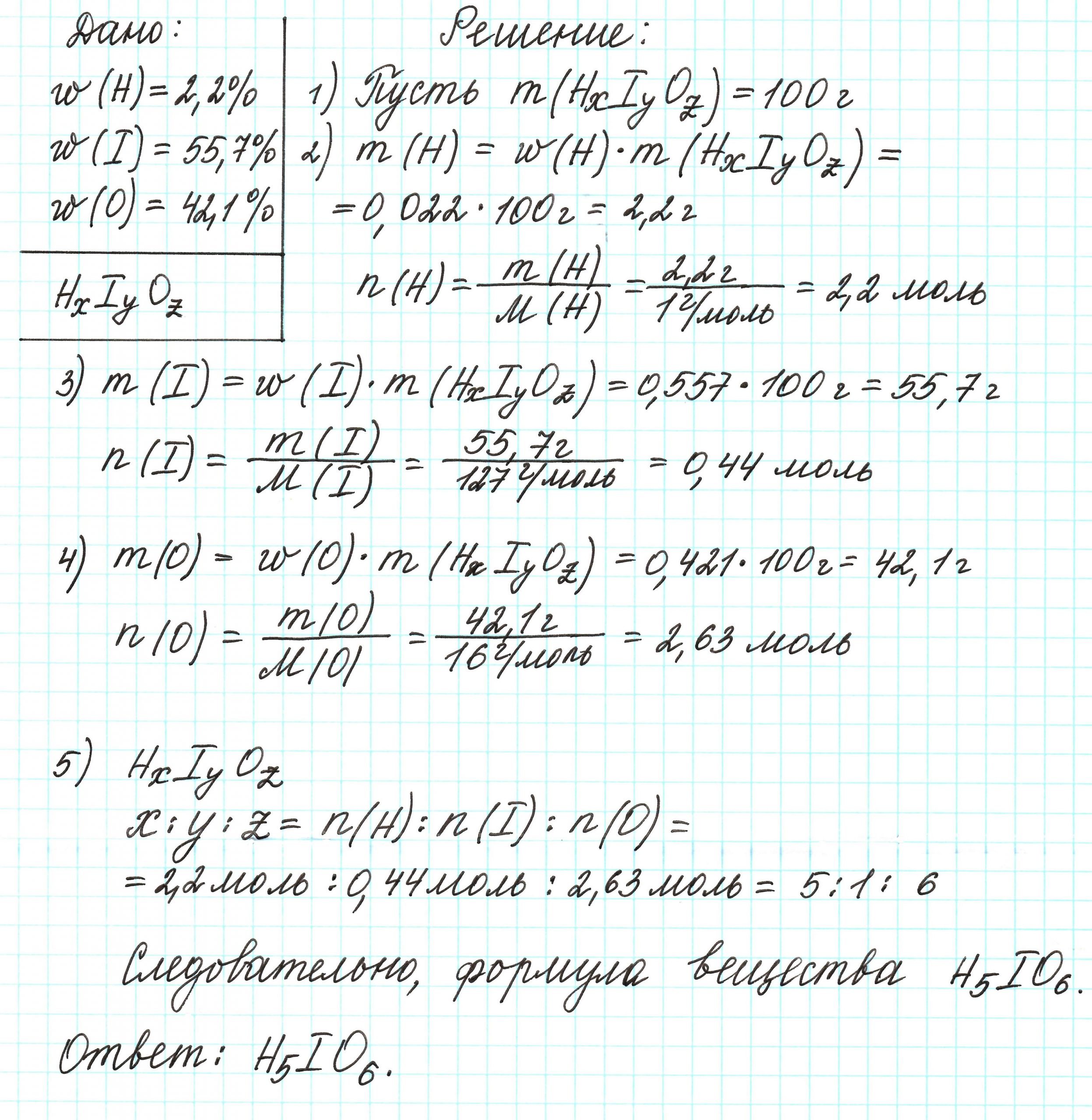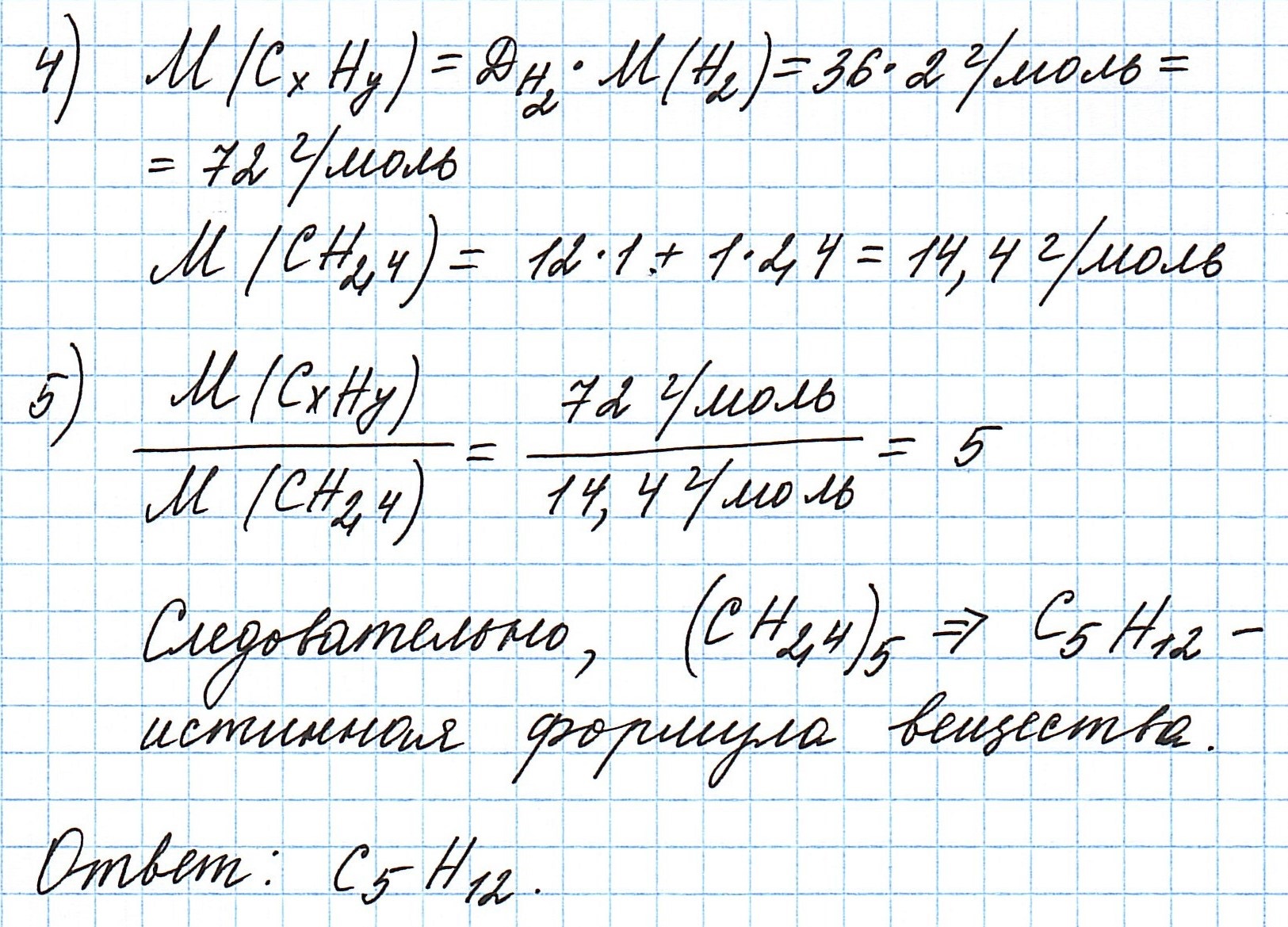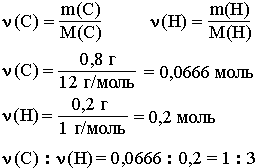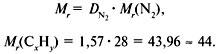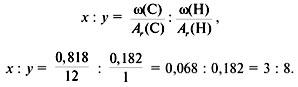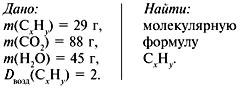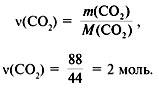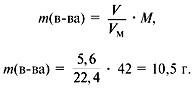Вы хотите изучать химию и профессионально, и с удовольствием? Тогда вам сюда! Автор методики системно-аналитического изучения химии Богунова В.Г. раскрывает тайны решения задач, делится секретами мастерства при подготовке к ОГЭ, ЕГЭ, ДВИ и олимпиадам
А вы знаете, что такое аффирмация?
Аффирмация – это короткая фраза, содержащая словесную формулу (лингвистический код), которая при многократном повторении закрепляет требуемую установку в подсознании.
Как работает аффирмация?
Если сосредоточить свое внимание на действиях (целях, установках), в головном мозге включаются интересные процессы. Между лимбической системой и корой больших полушарий формируются нейронные связи, определяющие конкретные чувства и действия человека. В результате, когда вы думаете о конкретных действиях (установках, целях), мозг начинает вырабатывать особые химические вещества – нейромедиаторы, которые активируют программу достижения ваших целей. Если вы натренируете свой мозг таким образом, чтобы он ассоциировал ваши действия по достижению результата с позитивными чувствами, вы каждый раз будете испытывать чувство радости и удовлетворения, вспоминая о целях, о действиях по достижению целей, о результатах работы. Таким образом, ваше подсознание будет ставить важные цели и действия на первое место среди остальных приоритетов.
Совет психолога
Возьмите ручку в руки и напишите три аффирмации, определяющие ваши цели и действия на ближайшие месяцы. Например:
1) Я хорошо себя чувствую и уверен в своих силах
2) Я буду изучать химию и решать задачи по химии каждый день
3) Я сдам ЕГЭ по химии на очень высокий балл
Прикрепите ваши аффирмации на видное место, например, над компьютером. Каждый день в течение пяти минут вы должны стать перед зеркалом и вслух произнести эти фразы. Произносите слова уверенно, так, словно вы уже достигли поставленных целей. Если вы чувствуете в своем теле дискомфорт, связанный с определенной аффирмацией, поместите свою руку на эту область тела и, в момент произношения фразы, мысленно направьте энергию руки в эту область.
Наверняка, у вас возник вопрос: “Откуда репетитор по химии Богунова В.Г. так хорошо знает психотерапевтические техники?” Отвечу. У меня есть советник. Мой психолог-консультант – Кристина. Это она знакомит меня с тайнами практик психотерапии. Чуть позже я расскажу о Кристине много интересного, а пока вернемся к основной теме статьи – Вывод формулы вещества по массовым долям. Итак, поехали!
Алгоритм решения лучше разобрать на конкретной задаче. Все задачи, конечно, решаются по Четырем Заповедям. Но если алгоритм решения – очень специфичный, лучше акцентировать внимание именно на нем.
Задача 1
Найти простейшую формулу соединения, содержащего 43,4% натрия, 11,3% углерода и 45,3% кислорода.
Выписываем данные в разделе Дано.
Выписываем формулу вещества в общем виде (по данным задачи) и определяем основную логическую структуру алгоритма
Выясняем происхождение каждой составляющей структуры (Как рассчитать количества вещества?). Это – логические рассуждения, как бы мои мысли вслух (т.е. на бумаге), поэтому я их обвела другим цветом.
Количества вещества можно рассчитать, например, из масс, а в задаче предлагаются только относительные данные (массовые доли), поэтому мы имеем право ввести свободный параметр – абсолютное значение массы. Зная массу элемента, легко рассчитать его количество вещества.
Поскольку максимальное значение массовой доли 100%, лучше ввести значение массы 100 г, тогда абсолютные значение массы элемента и его массовой доли в % – равны (по модулю).
Дальнейшее решение задачи лучше проводить в таблице, куда выписываем массы (бывшие массовые доли в %), молярные массы, рассчитанные количества вещества. Нужно как можно точнее рассчитать значение количество вещества (не менее трех знаков после запятой).
Теперь начинается Копперфильд, т.е. самое интересное и загадочное. Нам нужно привести к целым значениям соотношения количества вещества каждого элемента. Как это сделать? Внимательно слушаем и повторяем за мной на калькуляторе.
Как получить целые значения в дробных соотношениях?
Каждый показатель количества вещества делим на самое маленькое число из всех полученных значений
В нашем случае, самое маленькое число 0,9417. Делим каждый показатель на это число и получаем целые значения соотношений. После этого выводим простейшую формулу вещества. В представленных задачах простейшая формула является окончательной. Называем вещество.
Иногда (не часто) с первого раза не удается добиться целого результата. Тогда нужно умножить каждый показатель на наименьшее целое число, чтобы получить целые соотношения. Все вопросы – к математике.
Если делимое и делитель умножить (или разделить) на одно и тоже число, то частное не изменится
Попробуем решить еще одну задачу на закрепление мастерства.
Задача 2
Найти простейшую формулу соединения, содержащего 27,38% натрия, 1,19% водорода, 14,29% углерода и 57,14% кислорода.
Последовательность действий:
1) Выписать данные в разделе Дано
2) Составить логическую структуру алгоритма
3) Выяснить источник для расчета количества вещества атомов элемента
4) Ввести свободный параметр (Пусть было 100 г вещества)
5) Составить таблицу (масса, молярная масса, количество вещества)
6) Рассчитать целые значения соотношений количества вещества
7) Вывести простейшую формулу вещества
Надеюсь, вы поняли, как работать с алгоритмом Вывод формул вещества по массовым долям элементов? Если нет, пишите в комментариях или ВКонтакте в личку. Я обязательно отвечу на все ваши вопросы, замечания и пожелания.
Вернемся к моему другу, психотерапевту Кристине. Звонит мне как-то моя хорошая знакомая. С ее сыном случилась страшная беда – наркотики. Правда, не очень тяжелые, но все же… Из дома начали пропадать вещи, сын стал грубить, успеваемость съехала до нижнего предела. Что делать?! Не хочется выносить сор из избы (элитная школа, папа занимает солидную должность, мама – достаточно известная личность). Она не просила меня ни о чем, позвонила больше для того, чтобы выплакаться. Я, конечно, как могла, поддержала ее. Но одного моего сочувствия мало. И тут я вспомнила о Кристине. Я давно знаю эту уже взрослую девочку. Знаю ее непростую судьбу, ее серьезную психологическую практику. Я дала своей знакомой телефон Кристины. Они созвонились.
Пол-года я не получала никакой информации ни от одной, ни от другой. Сама боялась позвонить и услышать о самом страшном. Однажды утром раздался звонок и счастливый голос подруги радостно сообщил мне о том, что ее сын стал студентом престижного московского ВУЗа! Именно Кристина спасла “тонущего” мальчика и всю семью. “Я каждое воскресенье хожу в церковь и ставлю свечки за здравие всех родных, в том числе, за здравие нашей спасительницы Кристины!” – сказала мне знакомая. С тех пор я советую Кристину всем своим близким и знакомым.
Вы готовитесь к ЕГЭ и хотите поступить в медицинский? Обязательно посетите мой сайт Репетитор по химии и биологии. Здесь вы найдете огромное количество задач, заданий и теоретического материала, познакомитесь с моими учениками, многие из которых уже давно работают врачами. Звоните мне +7 (903) 186-74-55. Приходите ко мне на курс, на Мастер-классы “Решение задач по химии” – и вы сдадите ЕГЭ с высочайшими баллами, и станете студентом престижного ВУЗа!
PS! Если вы не можете со мной связаться из-за большого количества звонков от моих читателей, пишите мне в личку ВКонтакте или на Facebook. Я обязательно отвечу вам.
Репетитор по химии и биологии кбн В.Богунова
Способов, как определить формулу вещества, достаточно много. Все зависит от исходных данных. Наиболее разнообразны подобные вычисления в органической химии. И это не удивительно, так как органических соединений значительно больше, чем неорганических.
Содержание:
1.Понятие простейшей и истинной формулы вещества
2.Массовая доля химического элемента: что означает и как высчитывается
3.Как определить формулу вещества по массовым долям элементов
4.Как определить формулу органического соединения:
4.1. по общей формуле вещества
4.2. по продуктам сгорания вещества
5. Как определить формулу вещества: комбинированные задачи
1.Понятие простейшей и истинной формулы вещества
В одних задачах на определение формулы вещества необходимо найти его простейшую формулу, а в других – истинную. В чем разница?
Простейшая, или иными словами, эмпирическая формула, указывает на соотношение атомов в молекуле (или в формульной единице, если речь идет о не ковалентном соединении).
Так, например: СН2 – простейшая формула алкена – показывает, что на каждый 1 атом углерода приходится 2 водородных атома. То есть существует соотношение 1:2. Поэтому для нахождения простейшей (эмпирической) формулы вещества важно рассчитать количество вещества атомов, которые входят в его состав, то есть n(C) и n(H).
Истинная формула, или иначе молекулярная, отражает действительное количество атомов всех элементов в молекуле.
Например, для пропилена, относящегося к классу алкенов, истинная (молекулярная) формула будет C3H6. Она говорит о том, что молекула данного вещества включает 3 атома С и 6 атомов Н. Это вполне соответствует простейшей формуле, отвечающей соотношению атомов 1:2. Для нахождения истинной (молекулярной) формулы соединения требуется посчитать его относительную молекулярную (Mr) или молярную массу (M).
2.Массовая доля химического элемента: что означает и как высчитывается
Массовая доля – это отношение массы компонента системы к массе системы, выраженное в процентах или долях от единицы.
Ну, а теперь проще.
Молекула имеет массу. Все атомы в молекуле также имеют свои массы. Атомов одного химического элемента в молекуле может быть 1 или несколько. Важна масса всех атомов одного элемента. Если ее разделить на массу молекулы, то получится массовая доля этого элемента. Ее выражают либо в процентах, которые всегда меньше 100%, либо в долях от единицы, которые всегда меньше 1.
Массовая доля элемента обозначается греческой буквой «омега» — ω. И записывается, например, так: ω(Н), ω(Сl), ω(С) и т.д. и рассчитывается:
Пример 1. Каковы массовые доли элементов в оксиде железа (III) Fe2O3.
3.Как определить формулу вещества по массовым долям элементов
Нахождение формулы вещества по массовым долям элементов применимо как к органическим, так и к неорганическим соединениям.
Пример 2. Сероуглерод содержит 15,8% углерода по массе. Какова простейшая формула этого вещества?
Поскольку речь идет о массовых долях элементов, то необходимо знать массу вещества. В нашем случае – массу сероуглерода. В условии задачи о ней ничего не говорится. Поэтому допускаем, что масса вещества равна 100 г.
Почему 100 г? Это «круглое» число, и его использование облегчает все расчеты. Так как в итоге будем находить соотношения количеств веществ элементов, то какое-то особенное значение массы вещества не играет никакой роли.
Попробуйте ради эксперимента принять массу сероуглерода равной 23 г, 467 г и т.п. Результат будет один и тот же.
Допустим, что атомов углерода в молекуле х, а атомов серы – у. В таком случае формула вещества примет вид: СхSу.
Пример 3. Содержание углерода в углеводороде составляет 83,33%. Плотность паров соединения по водороду – 36. Какова молекулярная формула углеводорода?
Из данных задачи следует, что углеводород может находиться в газообразном состоянии, так как известна плотность его паров. Эта величина всегда требуется для нахождения молярной (относительной молекулярной) массы вещества. Как она находится и что это такое читайте подробнее здесь.
Чтобы не загромождать записи, массовую долю элементов будем считать не в процентах, а в долях от единицы.
Пусть вас не удивляет получившаяся простейшая формула. Ведь, исходя из определения простейшей формулы, на каждый 1 атом углерода приходится 2,4 атома водорода. Это всего лишь соотношение. Соединения с формулой СН2,4 в принципе не существует. Не всегда простейшая и истинная формулы совпадают друг с другом.
А если полученная формула СН2,4 вас все же смущает, вы можете решать задачу и вторым способом. Но это несколько более сложный способ, когда требуется составить и решить уравнение с двумя неизвестными.
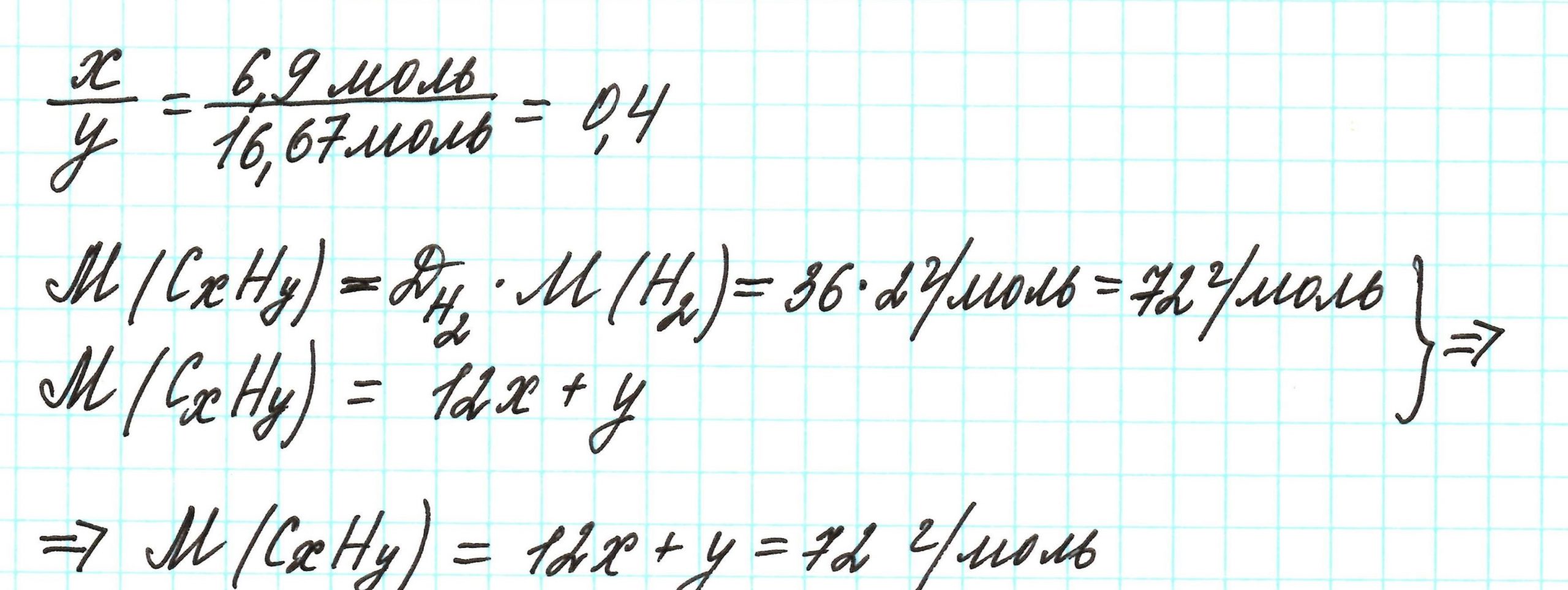
Не все химические вещества являются бинарными, то есть состоят из атомов двух химических элементов. Но в любом случае, алгоритм решения задачи тот же.
Пример 4. Некоторая кислота содержит водород (2,2%), иод (55,7%) и кислород (42,1%). Определите простейшую формулу этой кислоты.
4.Как определить формулу органического соединения
Определить формулу органического вещества можно не только зная массовые доли элементов в его составе.
4.1. Как определить формулу органического соединения
по общей молекулярной формуле вещества
Органические вещества сгруппированы по самостоятельным классам на основе общности строения и свойств. Каждый класс соединений характеризуется своей общей молекулярной формулой. Особенно это наглядно видно на примере углеводородов.
Если другие органические вещества рассматривать как их производные, в молекулы которых введена какая-либо функциональная группа, то и для них также можно составить общую молекулярную формулу.
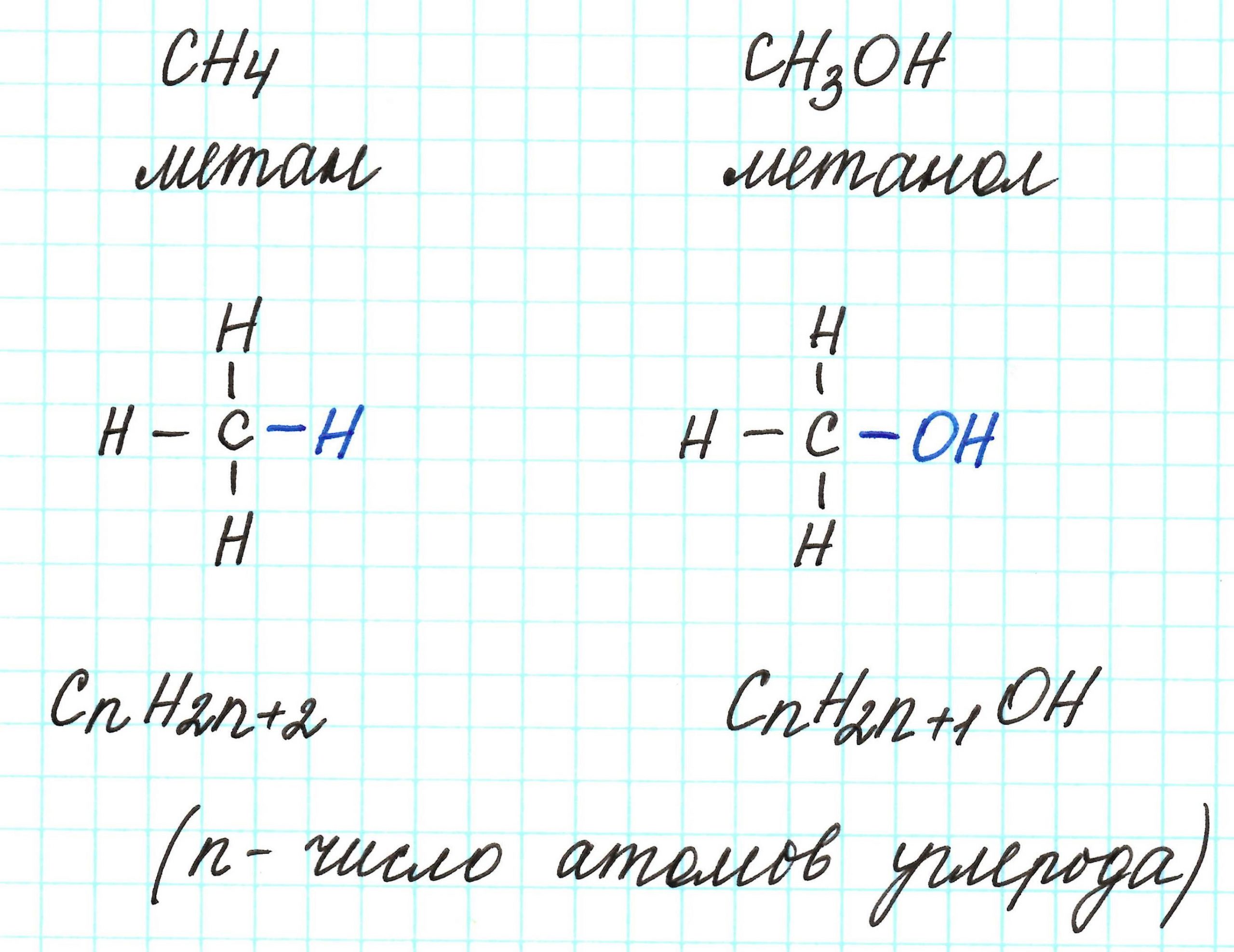
К слову, метан СН4 является представителем алканов, в молекулах которых на n атомов углерода и приходится 2n+2 атомов водорода. Алканы имеют общую молекулярную формулу, отражающую их состав: СnH2n+2.
Предельные одноатомные спирты можно рассматривать как производные алканов, в молекулах которых 1 атом водорода замещен на гидроксильную группа –ОН. Таким образом, их общая молекулярная формула такая: СnH2n+1ОН.
Ниже в таблице приведены общие молекулярные формулы основных классов органических соединений.
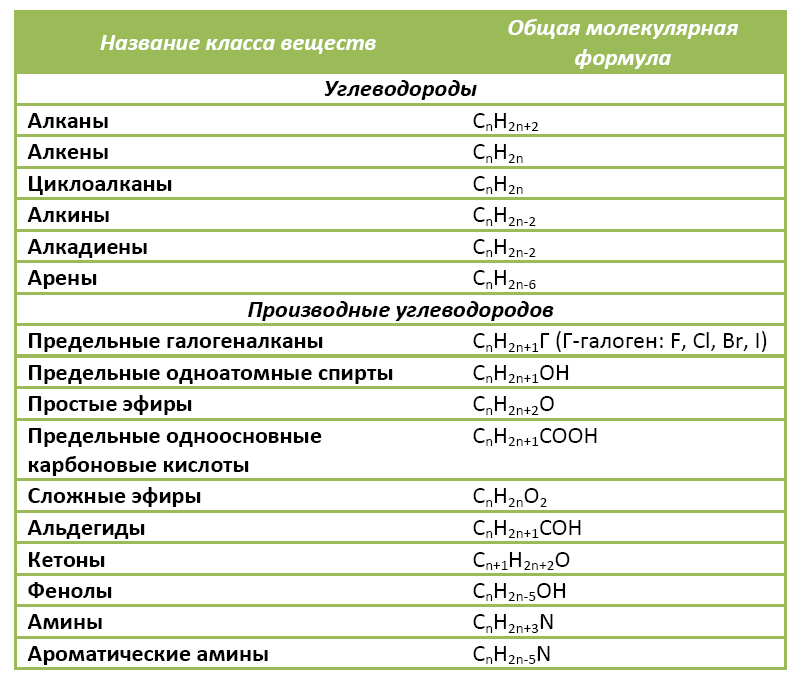
Пример 5. Плотность паров по воздуху некоторого алкана 4,414. Какова формула алкана?

4.2. Как определить формулу органического соединения
по продуктам его сгорания
Это еще один распространенный тип задач на определение формулы органического соединения.
Необходимо запомнить и понять основные моменты:
— так как все органические вещества содержат атомы С, Н, а также атомы О (кислородсодержащие соединения), то всегда при их сгорании выделяется углекислый газ СО2 и образуется вода Н2О;
— все углеродные атомы, входящие в состав органического соединения, окажутся в составе углекислого газа СО2; следовательно, n(С) как в соединении, так и в СО2 – это одна и та же величина;
— все атомы водорода Н, которые имеются в составе вещества, перейдут в состав воды Н2О; следовательно, n(Н) и в данном веществе, и в Н2О – это одна и та же величина;
— при сгорании веществ, включающих в себя азот (например, амины), кроме СО2 и Н2О, образуется еще и N2.
Разберем несколько примеров.
Пример 6. Сожгли 7,2 г углеводорода. Плотность его паров по водороду составляет 36. В результате реакции образовалось 22 г оксида углерода (IV) и 10,8 г воды. Какова молекулярная формула соединения?
Пример 7. В результате сгорания 4,8 г органического соединения выделилось 3,36 л (н.у.) оксида углерода (IV) и образовалось 5,4 г воды. Плотность паров искомого соединения по кислороду равна 1. Вычислите молекулярную формулу вещества.
Пример 8. Результатом сжигания 0,31 г газообразного органического соединения, имеющего плотность 1,384 г/л, стало выделение 0,224 л (с.у.) оксида углерода (IV), 0,112 л азота и образование 0,45 г воды. Вычислите молекулярную формулу этого вещества.

5. Как определить формулу вещества: комбинированные задачи
Наибольший интерес и некоторую трудность представляют комбинированные задачи, сочетающие в себе необходимость найти формулу соединения:
— используя приемы, применяемые в рассмотренных выше задачах;
— используя сведения не только о химических, но и физических свойствах вещества.
Вот несколько примеров.
Пример 9. Какова молекулярная формула предельного углеводорода, при полном сгорании 8,6 г которого выделилось 13, 44 л (н.у.) оксида углерода (IV).
В этой задаче:
1) известен класс вещества, поэтому возможно применить его общую молекулярную формулу;
2) речь идет о сгорании вещества, поэтому количество атомов в составе молекулы будем искать, используя данные о продукте сгорания – СО2.
Пример 10. Алкен нормального строения содержит двойную связь при первом углеродном атоме. Образец этого алкена массой 0,7 г присоединил бром массой 1,6 г. Вычислите формулу алкена и назовите его.
В предлагаемых условиях:
1) известен класс вещества, следовательно, применим его общую молекулярную формулу;
2) речь идет об одном из химических свойств: способности алкенов присоединять галогены по месту разрыва двойной связи.
Пример 11. После полного сжигания в кислороде арена, имевшего массу 0,92 г, выделился оксид углерода (IV). Пропуская газ через избыток раствора щелочи Ca(OH)2, получили 7 грамм осадка. Какова молекулярная формула арена?
В предлагаемой задаче:
1) известен класс вещества;
2) речь идет о сжигании соединения и образовании в качестве продукта горения углекислого газа, который при взаимодействии со щелочью Са(ОН)2 привел к выпадению осадка известной массы.
Следующий пример очень характерен для задач, встречающихся в заданиях второй части ЕГЭ по химии.
Пример 12. Некоторое соединение, образующее альдегид в реакции окисления, взаимодействует с избытком бромоводородной кислоты, образуя 9,84 г продукта (выход составляет 80% от теоретического), имеющего плотность паров по Н2 61,5. Определите строение этого соединения, а также его массу, вступившую в реакцию?
В этой задаче:
1) говорится о химических свойствах искомого соединения; анализируя их, приходим к выводу, что заданным веществом является предельный одноатомный спирт;
2) известна общая молекулярная формула предельных одноатомных спиртов;
3) более подробно говорится о взаимодействии заданного вещества с бромоводородной кислотой; спирт, реагируя с HBr, дает галогеналкан, для которого известны его масса, практический выход и относительная плотность по Н2; именно от этих данных и нужно отталкиваться при решении данной задачи.
Итак, способов, как определить формулу вещества, действительно, множество. Мы рассмотрели лишь основные из них. Важно правильно уяснить понятия «простейшая формула вещества» и «истинная формула вещества», чтобы не путать их.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.
определим молекулярную формулу углеводорода, в котором содержится (85,71)
%
углерода и (14,29)
%
водорода. Известно, что относительная плотность этого углеводорода по воздуху составляет (0,966).
Первый вариант решения
1. В веществе содержатся только атомы углерода и водорода, значит, его формулу можно записать так —
CxHy
. Индексы в формуле показывают отношение количеств атомов:
x:y=n(C):n(H).
По массовым долям определяем, что в (100) г углеводорода содержится (85,71) г углерода и (14,29) г водорода.
Найдём количества этих элементов:
x=m(C)Ar(C)=85,71 г12 г/моль=7,1425 моль;
y=m(H)Ar(H)=14,29г1г/моль=14,29моль;
x:y=7,1425:14,29=7,14257,1425:14,297,1425=1:2.
Значит, простейшая формула углеводорода —
CH2
.
2. Определим относительную молекулярную массу вещества и сравним её с массой
CH2
:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
Mr(CxHy)Mr(CH2)=2814=2.
Следовательно, молекулярная формула вещества
(CH2)2=C2H4.
Второй вариант решения
1. Определим относительную молекулярную массу углеводорода:
Mr(CxHy)=Dвозд.(CxHy)⋅Mr(возд.)=0,966⋅29=28,014≈28.
2. Найдём число атомов углерода и водорода в молекуле:
x=Mr(C)⋅w(C)Ar(C)⋅100%=28⋅85,71%12⋅100%=2;
y=Mr(CxHy)⋅w(H)Ar(H)⋅100%=28⋅14,29%1⋅100%=4.
Тема: «Решение задач на нахождение молекулярной формулы газообразного углеводорода по его плотности и массовой доле элементов»
1. Цели.
-
Образовательные:
-
закрепить знание понятий «органические вещества», «углеводороды», «массовая доля», «количество вещества», «относительная плотность»;
-
научить студентов решать задачи на нахождение молекулярной формулы органического вещества;
-
сформировать умения определять состав органических веществ исходя из знания массовых долей элементов, а также масс или объемов продуктов сгорания этих веществ;
-
Развивающие: развивать умения анализировать, сравнивать, применять теоретические знания на практике для решения задач;
-
Воспитательные: способствовать формированию научного мировоззрения.
2. Обеспечение занятия: таблица «Периодическая система», инструкции для студентов, тестовые задания для проверки знаний, карточки задания.
3. Порядок выполнения:
3.1. Разбор алгоритма решения задач.
3.2. Самостоятельное решение заданий.
3.3. Выполнение проверочной работы по вариантам.
4. Схема отчета:
4.1. Записать тему и цели практического занятия.
4.2. Привести решение задач.
4.3. Ответы к проверочной работе.
5. Анализ преподавателем выполнения работы.
6. Рекомендуемая литература:
-
Саенко О. Е. Химия. Учебник для колледжей. Ростов на Дону, 2008.
-
Габриелян О. С. Химия. Учебник для студентов среднего профессионального образования. –М.:Академия, 2008.
-
Кузьменко Н.Е., Еремин В.В., Попков В.А. Химия. Для школьников старших классов и поступающих в вузы. – М.: ОНИКС 21 век: Мир и образование, 2002. – С. 177–236.
Вывод формул соединений.
Этот вид расчетов чрезвычайно важен для химической практики, т.к. позволяет на основании экспериментальных данных определить формулу вещества (простейшую и молекулярную). На основании данных качественного и количественного анализов химик находит сначала соотношение атомов в молекуле (или другой структурной единице вещества), т.е. его простейшую формулу.
Например, анализ показал, что вещество является углеводородом CxHy, в котором массовые доли углерода и водорода соответственно равны 0,8 и 0,2 (80% и 20%). Чтобы определить соотношение атомов элементов, достаточно определить их количества вещества (число молей):
Таким образом, CH3 является простейшей формулой данного вещества. Соотношению атомов C и H, равному 1 : 3, соответствует бесчисленное количество формул: C2H6, C3H9, C4H12 и т.д., но из этого ряда только одна формула является молекулярной для данного вещества, т.е. отражающей истинное количество атомов в его молекуле. Чтобы вычислить молекулярную формулу, кроме количественного состава вещества, необходимо знать его молекулярную массу. Для определения этой величины часто используется значение относительной плотности газа D. Так, для вышеприведенного случая DH2 = 15.
Тогда M(CxHy) = 15 M(H2) = 15•2 г/моль = 30 г/моль.
Поскольку M(CH3) = 15, то для соответствия с истинной молекулярной массой необходимо удвоить индексы в формуле. Следовательно, молекулярная формула вещества: C2H6.
Алгоритм 1. Решение расчетных задач на вывод
молекулярной формулы вещества по массовым долям элементов
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Решение
1. Записать условие задачи.
2. Вычислить относительную молекулярную массу Mr(CхHy) по относительной плотности:
3. Найти индексы х и y по отношению :
4. Записать простейшую формулу: С3Н8.
Проверка: Мr(C3H8) = 44, следовательно, C3H8 – истинная формула.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Решение
1. Записать условие задачи.
2. Найти массовую долю водорода:
(Н) = 100% – 83,3% = 16,7%.
3. Найти индексы и простейшую формулу для углеводорода CхHy:
следовательно, простейшая формула – C2H5.
4. Найти истинную формулу. Поскольку общая формула алканов СnH2n+2, то истинная формула – С4Н10.
Алгоритм 2. Решение расчетных задач на вывод
молекулярной формулы вещества по массе (объему) продуктов сгорания
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Решение
1. Записать условие задачи.
2. Найти относительную молекулярную массу вещества:
Mr = Dвозд•Мr(возд.),
Mr(CхHy)= 2•29 = 58.
3. Найти количество вещества образовавшегося оксида углерода(IV):
4. Найти количество вещества углерода в сожженном веществе:
(C) =
(CO2) = 2 моль.
5. Найти количество вещества воды:
(H2O) = 45/18 = 2,5 моль.
6. Найти количество вещества водорода в сожженном веществе:
(H) = 2
(H2O),
(H) = 2,5•2 = 5 моль.
7. Найти простейшую формулу углеводорода:
(C) :
(Н) = 2 : 5,
следовательно, простейшая формула – С2Н5.
8. Найти истинную формулу углеводорода:
Мr(C2H5) = 29,
Mr (CхHy) = 58,
следовательно, истинная формула – C4H10.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества при н.у. равна 1,875 г. Найти его молекулярную формулу.
Решение
1. Записать условие задачи.
2. Найти молекулярную массу вещества из пропорции:
1 л газа – 1,875 г,
22,4 л – m г.
Отсюда m = 42 г, M = 42 г/моль.
3. Найти количество вещества углекислого газа и углерода:
(CO2) = 16,8/22,4 = 0,75 моль,
(C) = 0,75 моль.
4. Найти количества веществ воды и водорода:
(H2O) = 13,5/18 = 0,75 моль,
(H) = 0,75•2 = 1,5 моль.
5. Найти сумму масс углерода и водорода:
m(C) + m(H) = 0,75•12 +1,5•1 = 10,5 г.
6. Найти массу сожженного вещества:
Следовательно, вещество содержит только углерод и водород.
7. Найти простейшую формулу углеводорода CхHy:
(C) :
(H) = 0,75 : 1,5 = 1 : 2,
следовательно, простейшая формула – СН2.
8. Найти истинную формулу углеводорода:
Mr(CH2) = 14,
Mr(в-ва) : Mr(CH2) = 42 : 14 = 3,
следовательно, истинная формула – С3Н6.
Задачи для самостоятельного решения:
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле.
Решение:
-
Общая формула алканов CnH2n+2, общая формула монохлоралканов CnH2n+1Cl
-
Cоставим выражение для расчета массовой доли хлора:
М(Cl) 35,5
ω( Сl) =——————-=————-=0,3838 , откуда n=4
М(CnH2n+1Cl) 14n+36,5
Формула монохлоралкана С4Н9Сl
3. Графические формулы изомеров:
СН3 – СН2 – СН2 – СН2Сl 1-хлорбутан
СН3 – СН2 – СНCl– СН3 2- хлорбутан
СН3 – СН – СН2Сl 2-метил-1-хлорпропан
|
СН3
СН3 – СCl – СН3 2-метил-2-хлорпропан
|
СН3
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера.
Решение:
-
Общая формула монобромлканов CnH2n+1Br. Молярная масса монобромлкана М= 12n+2n+1+80=14n+81
-
Зная относительную плотность вещества по воздуху, находим молярную массу: М=29∙4,24=123г/моль
Из выражения 14n+81=123 n=3
-
Формула бромалкана С3Н7Br, исходного алкана С3Н6 – пропен. Изомер – циклопропан.
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного.
Решение:
-
Уравнения реакций:
CnH2n + Н Сl = CnH2n+1Cl
CnH2n + Н Br = CnH2n+1Br
-
Так как количество вещества алкена одно и то же в обеих реакциях, то количества веществ галогеналканов равны:
n(CnH2n+1Cl) = n(CnH2n+1Br)
3. Из выражения 5,23/14n+36,5=8,2/14n+81 n=3
Формула алкена С3Н6
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного.
Решение:
-
Находим количество вещества алкена:
n(CnH2n) = 1,012/22,4 = 0,045 моль
-
По уравнению реакции
CnH2n +Сl2 = CnH2nCl2
n(CnH2nCl2)= n(CnH2n) =0,045 моль
-
М(CnH2nCl2)=m/n=5,09/0,045=113г/моль
12n +2n+71=113 n=3
Формула алкена С3Н6
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу.
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров.
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода.
|
Задача 7. При полном сгорании неизвестной массы углеводорода образовалось 4,48 л углекислого газа и 3,6г воды. Относительная плотность вещества по водороду равна 14. Выведите молекулярную формулу углеводорода. |
Задача 6. При взаимодействии 1,74 г алкана с бромом образовалось 4,11 г монобромпроизводного. Определите молекулярную формулу алкана. Запишите структурные формулы названия возможных изомеров. |
|
Задача 5. При полном сгорании 3,9 г углеводорода образовалось 13,2 г углекислого газа и 2,7 г воды. Плотность паров вещества 3,482г/л. Выведите молекулярную формулу. |
Задача 1. Установите молекулярную формулу монохлоралкана, содержащего 38,38% хлора. Приведите графические формулы и названия всех соединений, отвечающих данной формуле. |
|
Задача 3. Установите молекулярную формулу алкена, если одно и то же количество его, взаимодействуя с различными галогеноводородами, образует, соответственно, 5,23 г хлорпроизводного или 8,2 г бромпроизводного. |
Задача 2. Установите молекулярную формулу алкена и продукта взаимодействия его с 1 моль бромоводорода, если это монобромпроизводное имеет относительную плотность по воздуху 4,24. Укажите название исходного алкена и одного его изомера. |
|
Задача 4. Установите молекулярную формулу алкена, если известно, что 1,012 л (н.у.) его при взаимодействии с хлором образует 5,09 г дихлорпроизводного. |
Задача 8. При сжигании 3.2г углеводорода образуется 8,8г СО2. Относительная плотность по водороду этого вещества равна 8. Найдите формулу углеводорода. |
|
Задача 9. При сжигании углеводорода массой 2,1 г получили 6,6г оксида углерода (IV). Относительная плотность органического соединения по водороду равна 42. Выведите молекулярную формулу углеводорода |
Задача 10. При сжигании 4,4г алкана выделилось 13,4г углекислого газа. Относительная плотность вещества по воздуху равна 1,52. Определите молекулярную формулу алкана. |
Задачи для самостоятельного решения:
Задача 1. Найти молекулярную формулу вещества, содержащего 81,8% углерода и 18,2% водорода. Относительная плотность вещества по азоту равна 1,57.
Задача 2. Найти молекулярную формулу предельного углеводорода, массовая доля углерода в котором 83,3%.
Задача 3. При сжигании 29г углеводорода образовалось 88г углекислого газа и 45 г воды, относительная плотность вещества по воздуху равна 2. Найти молекулярную формулу углеводорода.
Задача 4. При сжигании 5,6 л (н.у.) газообразного органического вещества было получено 16,8 л (н.у.) углекислого газа и 13,5 г воды. Масса 1 л исходного вещества ( при н.у.) равна 1,875 г. Найти его молекулярную формулу.
Задача 5. При сгорании 11,2 г Углеводорода получили оксид углерода массой 35,2 г и воду массой 14,4 г. Относительная плотность этого углеводорода по воздуху равна 1,93. Выведите молекулярную формулу.
Задача 6. При сжигании 2.2 г вещества получили 4,4 г оксида углерода и 1,8 г воды. Относительная плотность вещества по водороду равна 44. Определите молекулярную формулу вещества.
Задача 7. Выведите формулу вещества, содержащего 81,8% углерода и 18,2 % водорода, если относительная плотность по водороду равна 22.
Задача 8. Определите молекулярную формулу углеводорода, если массовая доля углерода равна 85,75, а водорода –14,3%. Относительная плотность этого вещества по азоту примерно равна 2.
Задача 9. Найти формулу вещества, содержащего 85,71% углерода и 14,29% водорода, если относительная плотность паров этого вещества по воздуху равна 1,448.
Задача10. При сгорании 4,3 г Углеводорода получили оксид углерода массой 13,2 г и воду массой 6,3 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 11. При сгорании 2,1 г вещества получили оксид углерода массой 6,6 г и воду массой 2,7 г. Относительная плотность этого углеводорода по воздуху равна 2,96. Выведите молекулярную формулу.
Задача 12. При сгорании 8,6 г Углеводорода получили оксид углерода массой 26,4 г и воду массой 12,6 г. Относительная плотность этого углеводорода по воздуху равна 2,966. Выведите молекулярную формулу.
Задача 13. При сжигании 3,9 г органического вещества плотность паров по водороду- 39, образовалось 13,2 г углекислого газа и 2,7 г воды. Определить формулу вещества .
Задача 14. При сжигании алкена массой 11,2 г получили 35,2 г оксида углерода (IV) и 14,4 г воды. Относительная плотность алкена по воздуху равна 1,93. Найти молекулярную формулу алкена.
Задача 15. Определить молекулярную формулу углеводорода, если при сжигании 2,2 г его было получено 3,36л углекислого газа и 3,6 г воды. Плотность вещества по воздуху равна 1,5172.
Задача 16. Определить молекулярную формулу углеводорода, если при сжигании 1,3 г его было получено 2,24л углекислого газа и 0,9 г воды. Плотность вещества по водороду равна 12,992.
Задача 17. При сжигании 5,25 г газообразного углеводорода с плотностью по водороду =21 получили 8,4 л углекислого газа и 6,75 г воды. Определить формулу вещества.
Задача 18. Найти молекулярную формулу углеводорода, имеющего плотность по водороду =22. если при сгорании 4,4 г его образуется 6,72л CO2 и 7,2 г Н2О.
Задача 19. Относительная плотность по водороду некоторого алкана 15. Определите его формулу.
Задача 20. Массовая доля углерода в алкане составляет 84%. Определите его формулу.
Задача 21. При сгорании 2,2 г органического вещества, имеющего плотность по воздуху 1,517, образовалось 3,36 л углекислого газа (н.у.) и 3,6 г воды. Определите формулу органического вещества.
Задача 22. Органическое вещество содержит углерод (массовая доля 84,21%) и водород (15,79%). Плотность паров вещества по воздуху составляет 3,93. Определите формулу органического вещества.
Задача 23. Массовая доля углерода в углеводороде составляет 83,33%. плотность паров по водороду =36. Определите формулу углеводорода. Сколько он имеет изомеров? Напишите структурные формулы этих изомеров и назовите их.
Задача 24. Определите формулу предельного одноатомного спирта, если при дегидратации образца его объемом 37 мл и плотностью 1,4 г/мл получили алкен 39,2 г.
Задача 25. Определите молекулярную формулу предельного трехатомного спирта, массовая доля углерода в котором равна массовой доле кислорода.
Обучение
решения задач по химии по нахождению формулы вещества (методические
рекомендации)
Автор:
учитель химии МБОУ Школа № 2 г. Ленска Республики Саха (Якутия)
Суянко
Татьяна Алексеевна
Задачи
по данной теме решаются в 8-11 классах, как в программном материале, так и
встречаются в заданиях ЕГЭ, но ещё более усложненные.
Задачи на
определение формулы органического вещества бывают нескольких видов. Обычно
решение этих задач не представляет особых сложностей, однако часто обучающиеся затрудняются
в решении задач по нахождению формулы вещества. Причин бывает несколько:
1.
Некорректное оформление;
2.
Решение не математическим
путем, а методом перебора;
3.
Неверно составленная общая
формула вещества;
4.
Ошибки в уравнении реакции с
участием вещества, записанного в общем виде.
Типы задач на
нахождение формулы вещества.
1.
Определение формулы вещества по
массовым долям химических элементов или по общей формуле вещества;
2.
Определение формулы вещества по
продуктам сгорания;
3.
Определение формулы вещества по
химическим свойствам.
Для решения задач необходимы теоретические
сведения.
- Для решения задач необходимо знать что такое:
- Массовая доля элемента в веществе.
Массовая доля элемента — это его
содержание в веществе в процентах по массе. Например, в веществе состава С2Н4 чтобы найти массовую долю углерода в этом
веществе, надо его массу разделить на массу всего вещества: ω(C) = 12 • 2 / 28 = 0,857 (от
единицы) или 85,7%. Если
записать эту формулу в общем виде, то получится следующее выражение:
|
Массовая доля |
Атомная масса атома Э |
• |
число атомов Э в |
молекуле |
|
Аr (Э) • n |
||||
|
—————— |
||||
|
Mr(вещ.) |
||||
|
Молекулярная масса вещества |
- Молекулярная и простейшая формула вещества.
Молекулярная (истинная) формула —
формула, в которой отражается реальное число атомов каждого вида, входящих в
молекулу вещества. Например, С6Н6 — истинная формула бензола. Простейшая
(эмпирическая) формула — показывает соотношение атомов в
веществе. Например, для бензола соотношение С:Н = 1:1, т.е. простейшая
формула бензола — СН.
- Относительная плотность газа Х по газу У — DпоУ(Х).
Относительная плотность обозначается D — это
величина, которая показывает, во сколько раз газ Х тяжелее газа У. Её
рассчитывают как отношение молярных масс газов Х и У: DпоУ(Х) = М(Х) / М(У) Часто для расчетов используют относительные
плотности газов по водороду и по воздуху.
4.
Абсолютная плотность газа
это масса 1 л газа при нормальных условиях. Обычно для
газов её измеряют в г/л. ρ = m(газа) / V(газа) Если взять 1 моль газа, то тогда: ρ = М / Vm, а молярную массу газа можно найти, умножая плотность
на молярный объём.
- Общие формулы веществ разных классов.
Часто для решения задач с химическими реакциями удобно
пользоваться не обычной общей формулой, а формулой, в которой выделена отдельно
кратная связь или функциональная группа.
|
Класс органических веществ |
Общая молекулярная формула |
Формула с выделенной кратной связью и функциональной |
|||||||||||||||||
|
Алканы |
CnH2n+2 |
||||||||||||||||||
|
Алкены |
CnH2n |
CnH2n+1–CH=CH2 |
|||||||||||||||||
|
Алкины |
CnH2n−2 |
CnH2n+1–C≡CH |
|||||||||||||||||
|
Диены |
CnH2n−2 |
— |
|||||||||||||||||
|
Гомологи бензола |
CnH2n−6 |
С6Н5–СnH2n+1 |
|||||||||||||||||
|
Предельные одноатомные спирты |
CnH2n+2O |
CnH2n+1–OH |
|||||||||||||||||
|
Многоатомные спирты |
CnH2n+2Ox |
CnH2n+2−x(OH)x |
|||||||||||||||||
|
Предельные альдегиды |
CnH2nO |
||||||||||||||||||
|
Кетоны |
CnH2nO |
|
|||||||||||||||||
|
Фенолы |
CnH2n−6O |
С6Н5(СnH2n)–OH |
|||||||||||||||||
|
Предельные карбоновые кислоты |
CnH2nO2 |
||||||||||||||||||
|
Сложные эфиры |
CnH2nO2 |
|
|||||||||||||||||
|
Амины |
CnH2n+3N |
СnH2n+1NH2 |
|||||||||||||||||
|
Аминокислоты (предельные одноосновные) |
CnH2n+1NO2 |
|
6. Определение формул веществ по
массовым долям атомов, входящих в его состав.
Решение таких задач состоит из двух частей:
·
сначала находят мольное
соотношение атомов в веществе — оно соответствует его простейшей формуле.
Например, для вещества состава АхВу соотношение количеств веществ А и В соответствует
соотношению числа их атомов в молекуле: х : у = n(A) : n(B);
·
затем, используя молярную массу
вещества, определяют его истинную формулу.
Пример 1. Определить формулу вещества, если оно содержит
84,21% С и 15,79% Н и имеет относительную плотность по воздуху, равную 3,93.
Решение:
1.
По относительной плотности
рассчитаем молярную массу: М = D(возд.) • 29 = 114 г/моль. Молярная масса, соответствующая простейшей
формуле С4Н9— 57 г/моль, это в
2 раза меньше истинно молярной массы. Значит, истинная формула — С8Н18.
2.
По формуле нахождения массовой
доли элемента найдём количество атомов элемента
n=
Mr(вещ.)*w/ Аr (э); n(С) : n(Н) = 144*0,8421/12 : 144*0,1579/1 = 8:18
формула вещества С8Н18
Пример 2. Определить
формулу алкина с плотностью 2,41 г/л при нормальных условиях.
Решение:
Найдем молярную массу алкина
по формуле
M = (плотность ρ) • (молярный объём Vm) = 2,41
г/л • 22,4 л/моль = 54 г/моль
Зная общую формулу алкина, составим уравнение:
14 • n − 2 = 54, n = 4. Значит, алкин имеет формулу С4Н6.
Пример 3. Определить формулу предельного альдегида, если
известно, что 3•1022 молекул этого альдегида весят 4,3 г.
Решение:
Находим количество вещества альдегида:
ν = N / Na = 3•1022 / 6,02•1023 = 0,05 моль, и молярную массу:
М = m / n = 4,3 г / 0,05 моль = 86 г/моль.
Далее, как в предыдущем примере, составляем уравнение и
находим n.
Общая формула предельного альдегида СnH2nO, то есть М = 14n + 16 = 86, n = 5.
Формула альдегида С5Н10О
Пример 4. Определить
формулу дихлоралкана, содержащего 31,86 % углерода.
Решение:
Зная общую формулу алкана СnH 2n+2 Cl2 и формулу
нахождения массовой доли элемента w(С) = (число
атомов C в молекуле) • (атомная масса C) / (молекулярная масса дихлоралкана) 0,3186 = n • 12 / (14n + 71) n = 3, вещество — дихлорпропан.
Пример 5
- Определить
формулу аминокислоты, если известно, что она содержит 15,73% азота.
Решение:
Написать общую
формулу и выразить относительную молекулярную массу вещества через n
а)
общая формула аминокислот СnH2n(NH2)COOH
б)
выразим через n относительную молекулярную массу :
Mr(СnH2n(NH2)COOH)
= 12n + 2n + 16 + 45 = 14n + 61
в) подставим данные в формулу:
0,1573=(14*1) / 14n + 61
г) решим уравнение: 2,2022n + 9,5953 = 14; n = 2. Ответ: С2Н4(NH2)COOH
7. Определение формул веществ по
продуктам сгорания.
В решении задач
с применением понятия моль учащиеся используют умения, сформированные в 10
классе; расчет количества вещества и элемента по их массам (объемам) и
определении их отношения в составе соединения.
Эти действия
четко прослеживаются в обобщенной схеме решения задач на нахождение
молекулярной формул.
Пример 1: При сжигании 0,29 г газообразного вещества получили 448 мл
углекислого газа (н.у.) и 0,45 г воды. Относительная плотность неизвестного
вещества по водороду равна 29. Определите молекулярную формулу вещества.
Решение:
Найдём
количество вещества углекислого газа и воды и перейдем к нахождению их масс:
1. ν =mM
m= ν *M
ν (CO2)
ν (C)
m (C)
2ν (H2O) ν (H) m(H)
m(в-ва) = m(C) + m(H) < m(в-ва)
углеводород вещество содержит
кислород (или другие элементы)
Составляем
отношение количества вещества элементов:
2. ν (в-ва) : ν (C) : ν (C) : ν (H) : ν (O) расчет количественного
состава вещества.
Решение:
Мr = 29*D(н2); Мr
= 29*2 = 58; М = 58гмоль.
ν (в-ва) = mM; ν (в-ва) = 0,2958 = 0,005(моль);
ν (CO2) = ν ν m; ν (CO2)
= 0,44822,4 = 0,02(моль); ν (C) = ν (CO2)=
0,02(моль)
m(C) = 0,02*12 = 0,24(г)
ν (H2O) = 0,4518 = 0,025(моль); ν (H) = 2 ν (H2O) = 0,05 моль;
m(H) = 0,05*1 = 0,05(г)
m(в-ва) = 0,24г +
0,05г = 0,29г, следовательно, вещество состоит из водорода и
углерода(углеводород)
ν (в-ва) : ν (C) : ν (H) = 0,005 : 0,02 : 0,05 = 1 : 4 : 10.
Итак, в 1 моль
вещества содержит 4 моль углерода и 10 моль водорода.
Ответ: С4 Н10 (бутан)
8. Определение формул веществ по
химическим свойствам.
Пример 9. Определить
формулу алкадиена, если 3,4 г его могут обесцветить 80 г 2%-го раствора брома.
Решение
1.
Общая формула алкадиенов
— СnH2n−2. Запишем уравнение реакции присоединения брома к
алкадиену: СnH2n−2 + 2Br2 → СnH2n−2Br4
2.
рассчитаем количества вещества
прореагировавшего брома:
m(Br2) = mраствора • ω = 80 • 0,02 = 1,6 г ν(Br2) = m / M = 1,6 / 160 = 0,01 моль.
3.
Найдём количество вещества
диена, и (так как известна его масса) его молярную массу:
|
0,005 |
0,01 |
|
|
СnH2n−2 |
+ 2Br2 → |
СnH2n−2Br4 |
4.
Мдиена = m / ν = 3,4 / 0,05 = 68 г/моль.
5.
Находим формулу алкадиена по
его общей формул, выражая молярную массу через n:
14n − 2 = 68 n =
5.
Это
пентадиен С5Н8.
Пример 10. При взаимодействии 0,74 г предельного одноатомного
спирта с металлическим натрием выделился водород в количестве, достаточном для
гидрирования 112 мл пропена (н. у.). Что это за спирт?
Решение
1.
Формула предельного
одноатомного спирта — CnH2n+1OH.
2.
Составим уравнения реакций:
2CnH2n+1OH +
2Na → 2CnH2n+1ONa + H2
C3H6 + H2 → C3H8
3.
Найдём количество пропена, а
по нему — количество водорода и количество вещества спирта:
ν(C3H6) = V / Vm =
0,112 / 22,4 = 0,005 моль => ν(H2) = 0,005 моль, νспирта =
0,005 • 2 = 0,01 моль
4.
Находим молярную массу спирта и
n:
- Задачи для самостоятельного решения:
1. Массовая доля водорода в алкане составляет
0,1579. Определить формулу алкана.
- Массовая доля углерода в алкине 87,8%.
Определить формулу алкина. - Массовая доля кислорода в аминокислоте равна
35,95%. Найти молекулярную формулу аминокислоты. - Массовая доля хлора в хлоралкане 55,04%.
Найти молекулярную формулу хлоралкана. - Найдите
молекулярную формулу углеводорода, массовая доля углерода в котором 83,3%.
Относительная плотность паров этого вещества по водороду равна 36. - Найдите
молекулярную формулу углеводорода, массовая доля углерода в котором 81,8%.
Относительная плотность вещества по азоту 1,57. - При сжигании
углеводорода массой 29 г. Образовалось 88 г оксида углерода и 45 г воды.
Относительная плотность вещества по воздуху равна 2. Найдите молекулярную
формулу углеводорода. - При сгорании 31,2
г углеводорода образовалось 105,6 г оксида углерода и вода. Относительная
плотность паров этого углеводорода по аргону равна 1,95. Найдите
молекулярную формулу углеводорода. - При сжигании 8,8
г органического соединения образовалось 14,4 г воды и 13,44 л оксида
углерода. Относительная плотность паров этого углеводорода по аммиаку
равна 2,588. Найдите молекулярную формулу углеводорода. - Массовая доля
углерода в предельном одноатомном спирте равна 0,6818. Найдите
молекулярную формулу спирта. - Предельный
альдегид содержит 18,60% кислорода. Найдите молекулярную формулу
альдегида.
Литература:
- ЕГЭ. Химия. Самостоятельная подготовка к
ЕГЭ/Р.А.Лидин- М.: Издательство «Экзамен», 2015. – 351, (1) с. (Серия
«ЕГЭ. Полный курс») - ЕГЭ. 1000заданий с ответами и решениями по
химии. Все задания части 1 и 2 / М.А.Рябов. – М. : Издательство
«Экзамен», 2017. – 399, (1) с. (Серия «ЕГЭ. Банк заданий») - Химия 11 класс. Задачник для учащихся
общеобразовательных организаций. 2-е издание, переработанное. Москва
Издательский центр «Вентана-Граф» 2014. ФГОС. А.Н.Лёвкин, Н.Е.Кузнецова - М.А.Рябов Сборник задач и упражнений и
тестов по химии. К учебнику Г.Е. Рудзитиса, Ф.Г.Фельдмана «Химия.10
класс» Издательство «Экзамен». - Химия Практикум по общей химии 10-11 классы.
Составитель Тулина Н.И., 2006, Издательство «Учитель»