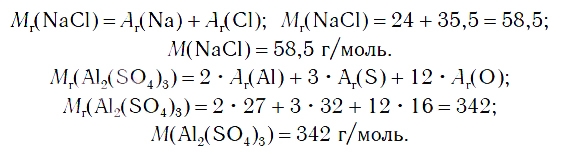В уроке 25 «Соли» из курса «Химия для чайников» узнаем, как правильно называть соли, их состав и научимся составлять химические формулы солей.
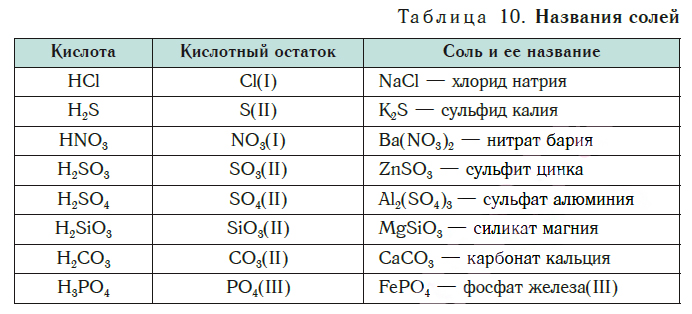
Как отмечалось в предыдущем уроке, в реакциях кислот с металлами выделяется простое вещество водород Н2. Кроме водорода, образуются и сложные вещества: ZnCl2, MgSO4 и др. Это представители класса широко распространенных в химии соединений — солей (рис. 102).
Здесь же мы рассмотрим состав солей, научимся составлять их формулы, узнаем, как называть соли.
Cостав солей
Сравним формулы кислот HCl и H2SO4 c формулами солей ZnCl2 и FeSO4. Мы видим, что в этих формулах одинаковые кислотные остатки Cl(I) и SO4(II). Но в молекулах кислот они соединены с атомами водорода Н, а в формульных единицах солей — с атомами цинка Zn и железа Fe. Значит, эти и другие соли можно рассматривать как продукты замещения атомов водорода в молекулах кислот на атомы металлов. Вещества, подобные ZnCl2 и FeSO4, относят к классу солей.
Соли — это сложные вещества, состоящие из атомов металлов и кислотных остатков.
В солях кислотные остатки соединяются с атомами металлов в соответствии с их валентностью. Для составления химической формулы соли необходимо знать валентность атома металла и валентность кислотного остатка. При этом пользуются тем же правилом, что и при составлении формул бинарных соединений. Для солей это правило следующее: сумма единиц валентности всех атомов металла должна быть равна сумме единиц валентности всех кислотных остатков.
Для примера составим формулу соли, в которую входят атомы кальция и кислотный остаток фосфорной кислоты PO4(III). Кальций проявляет постоянную валентность II, а валентность кислотного остатка PO4 равна III.
Названия солей
Соли образованы атомами разных металлов и различными кислотными остатками. Поэтому состав солей самый разнообразный. Давайте научимся давать им правильные названия.
Название соли состоит из названия кислотного остатка и названия металла в родительном падеже. Например, соль состава NaCl называют «хлорид натрия».
Если входящий в формульную единицу соли атом металла имеет переменную валентность, то она указывается римской цифрой в круглых скобках после его названия. Так, соль FeCl3 называют «хлорид железа(III)», а cоль FeCl2 — «хлорид железа(II)».
В таблице 10 приведены названия некоторых солей.
Соли — это вещества немолекулярного строения. Поэтому их состав выражают с помощью формульных единиц. В них отражено соотношение атомов металлов и кислотных остатков. Например, в формульной единице NaCl на один атом Na приходится один кислотный остаток Cl.
По химической формуле соли можно вычислить ее относительную формульную массу Mr, а также молярную массу M, например:
К солям относится не только поваренная соль (NaCl), но и мел, мрамор (СаСО3), сода (Na2CO3), марганцовка (KMnO4) и др.
Краткие выводы урока:
- Соли — сложные вещества, которые состоят из атомов металлов и кислотных остатков.
- Соли образуются при замещении атомов водорода в молекулах кислот на атомы металлов.
- Соли — вещества немолекулярного строения.
Надеюсь урок 25 «Соли» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Как составить формулы солей по химии
Знаток
(299),
закрыт
15 лет назад
Настя Ушанова
Профи
(712)
15 лет назад
Берешь любую кислоту заменяешь водород на нужный металл и все. Главное надо учитывать степень окисления металла. Например: КF(окисление у фтора +1);BaFдва (окисление у бария +2)
Inno4k@
Гуру
(2870)
15 лет назад
Вообще всё зависит от химического уравнения…. К примеру можешь взять основание NaOH и кислоту H3PO4 и получишь соль Na3PO4 и ещё вода будет (Н2О). Химическая формула солей состоит из мееталла и кислотного остатка.
Mozes Pombl4Мастер (1299)
15 лет назад
Скорее будет образовываться Na2HPO4, т.к. третья константа кислотности азотной кислоты крайне мала, тогда как очень велика константа гидролиза фосфата натрия по первой ступени.
Mozes Pombl4
Мастер
(1299)
15 лет назад
Разбирая химическую формулу соли, мы неприменно должны обнаружить по меньшей мери две части. Это катион и анион. Катион – составляющая частица соли, ион, имеющий положительный заряд. Анион – отрицательный. В качестве катиона могут выступать ионы металлов, ион аммония (NH4+) и ион водорода (в кислых солях, например NaHCO3). Анионом могут быть известные нам кислотные остатки, ОН группа (в основных солях, например Са (ОН) Cl ), а также составные комплексные ионы (часто это применимо для амфотерных металлов, к примеру соль Na2[Zn(OH)4] ).
Для составления формул необходимо знать заряды соответствующих ионов (это плюсик или минусик, с цифрой или без, который рисуется сверху справа у значка иона) . Далее руководствуемся правилом, что молекула соли всегда заряжена нейтрально, тоесть домножаем зарады катиона и аниона на соответствующие коэффициенты, чтобы в сумме они давали нуль. К примеру, имеем ионы Са2+ и РО4 3-, т. е. нужно домножить Са2+ на 3, а РО4 3- на 2. 3*2 + 2*(-3) = 0. Формула Са3(РО4)2.
Источник: моцке
дарья верхола
Ученик
(156)
6 лет назад
Формулы солей содержат металл и кислотный остаток, т. е. на первом месте обяъательно должен стоять металл, а на втором кислотный остаток!!!!
Формулы соли составить просто, например хлорид меди (II) – эта II – двойка, показывает, что медь двухвалентна, т. е. заряд у меди будет +2, а так как у хлора он всегда с металлами -1, то все дальше просто:
CuCl2
Нитрат натрия – натрий одновалентный металл, т. е. его степень окисления всегда +1, у нитрат – аниона всегда -1, значит формула:
NaNO3
P.S. Если не понятно, пиши в ЛС объясню по – другому)))
P.S. Если хочешь по практиковаться – пиши в ЛС, скину названия солей, а ты мне в ответ их составишь))))))
Методическая
разработка:
«Алгоритм
составления названий и формул солей».
При изучении химии в 8
классе учащиеся сталкиваются с затруднениями в названии химических веществ и
составления формул химических соединений. Для лучшего усвоения данного
материала им помогут «Алгоритмы» – краткая запись последовательности действий.
При составлении
названий и формул солей необходимо знать состав и название кислот, и
соответственно название кислотных остатков, входящих в эти кислоты. Для
удобства, они указаны в данной разработке.
Названия
кислот и кислотных остатков этих кислот, образующих соли.
–
HCl соляная
кислота Cl хлорид
–
HF фтороводородная
кислота F фторид
–
HBr бромоводородная
кислота Br бромид
–
HI иодоводородная
кислота I иодид
2-
H2S
сероводородная кислота S сульфид
2-
H2SO3
сернистая кислота SO3
сульфит
2-
H2SO4
серная
кислота SO4
сульфат
–
HNO3
азотная кислота NO3 нитрат
–
HNO2
азотистая кислота NO2
нитрит
2-
H2CO3
угольная
кислота CO3
карбонат
2-
H2SiO3
кремниевая
кислота SiO3 силикат
3-
H3PO4
фосфорная кислота PO4
фосфат
АЛГОРИТМ
СОСТАВЛЕНИЯ НАЗВАНИЙ СОЛЕЙ.
Соли – сложные
химические соединения, состоящие из ионов металла, связанного с ионами
кислотного остатка.
При составлении
названия соли, совершаются поочередно следующие шаги:
1. Называется
кислотный остаток, который стоит в формуле соли в конце.
2. Называется
металл ( в родительном падеже). Он записан перед кислотным остатком.
3. Если
заряд металла переменный, в скобках указывается валентность металла.
ПРИМЕР:
CuSO4
сульфат меди (II) NaCl хлорид
натрия
АЛГОРИТМ
СОСТАВЛЕНИЯ ФОРМУЛ СОЛЕЙ.
1. Записываем
химические символы металла и кислотного остатка, образующих соль. Металл
записываем перед кислотным остатком.
2. Над
хим. элементами указываем заряды ионов металла и кислотного остатка.
3. Находим
Наименьшее Общее Кратное между зарядами ионов.
4. НОК
делим поочередно: на заряд металла и заряд кислотного остатка.
5. Ставим
полученные при расчете индексы справа, внизу возле химических элементов. Если
кислотных остатков несколько, заключаем его в скобки. Индекс ставиться за
скобками.
ПРИМЕР:
Нитрат железа (III)
1. Fe
NO3
2.
3+
_
Fe NO3
3.
3
3+
–
Fe NO3
4. 3
: 3 = 1 , 3 :1 = 3
5. Fe(NO3)3
Сульфат
алюминия
1. Al
SO4
2. 3+
2-
Al
SO4
3.
6
3+
2-
Al SO4
4. 6
:3 = 2 , 6 :2 = 3
5. Al2(SO4)3
Соли можно рассматривать как продукты, полученные путём замещения атомов водорода в кислотах на металлы или ионы аммония, или гидроксогрупп в основаниях на кислотные остатки. В зависимости от этого выделяют средние, кислые и основные соли. Рассмотрим, как составить формулы этих солей.
Средние соли
Средними или нормальными называют те соли, в которых присутствуют только атомы металлов и кислотные остатки. Их рассматривают как продукты полного замещения атомов H в кислотах или ОН− групп в основаниях.
Составим формулу средней соли, образованной фосфорной кислотой H3PO4 и основанием Ca(OH)2. Для этого на первом месте запишем формулу металла, а на втором — кислотного остатка. Металл в данном случае — Ca, остаток — PO4.
Далее определим валентности этих частиц. Кальций, будучи металлом второй группы, двухвалентен. Валентность остатка трёхосновной фосфорной кислоты равна трём. Запишем эти значения римскими цифрами над формулами частиц: для элемента Ca – а II, а для PO4 –III.
Если полученные значения сокращаются на одно и то же число, то предварительно производим сокращение, если нет — сразу записываем их арабскими цифрами накрест. То есть индекс 2 пишем у фосфата, а 3 — у кальция. Получаем: Ca3(PO4)2
Ещё проще воспользоваться значениями зарядов этих частиц. Они записаны в таблице растворимости. У Ca – 2+, а у PO4 – 3-. Остальные действия будут теми же, что и при составлении формул по валентности.
Кислые и основные соли
Теперь составим формулу кислой соли, образованной этими же веществами. Кислыми называют соли, в которых не все атомы H из соответствующей кислоты замещены металлами.
Предположим, что из трех атомов H в фосфорной кислоте только два замещены катионами металлов. Составление формулы вновь начинаем с записи металла и кислотного остатка.
Валентность остатка HPO4 равна двум, так как в кислоте H3PO4 заместили два атома H. Записываем значения валентностей. В этом случае II и II сокращаются на 2. Индекс 1, как уже было сказано выше, в формулах не указывают. Получаем в итоге формулу CаHPO4
Можно воспользоваться и значениями зарядов. Величину заряда частицы HPO4 определяем следующим образом: заряд H равен 1+, заряд PO4 — 3-. Итого в сумме +1 + (-3) = -2. Запишем полученные значения над символами частиц: 2 и 2 сокращаются на 2, индекс 1 в формулы солей не записывают. В итоге получается формула CaHPO4 — гидрофосфат кальция.
Если при образовании соли не все группы ОН- в основании замещены на кислотные остатки, соль называют основной.
Запишем формулу основной соли, образованной серной кислотой (H2SO4) и гидроксидом магния(Mg(OH)2).
Из определения следует, что в состав основной соли входит кислотный остаток. В данном случае это SO4. Валентность его равна II, заряд 2-. Вторая частица — это продукт неполного замещения групп ОН в основании, то есть MgOH. Его валентность равна I (убрали одну одновалентную группу ОН), заряд +1 ( сумма зарядов Mg 2+ и ОН −.
Обратите внимание на названия кислых и основных солей. Их называют так же, как и нормальные, только с добавлением приставки «гидро» к названию кислой соли и «гидроксо» к основной.
Двойные и комплексные соли
Двойными называют соли, в которых один кислотный остаток соединен с двумя металлами. Например, в составе алюмокалиевых квасцов на один сульфат-ион приходится ион калия и ион алюминия. Составим формулу:
- Запишем формулы всех металлов и кислотного остатка: KAl SO4.
- Проставим заряды: K (+), Al (3+) и SO4 (2-). В сумме заряд катионов 4+, а анионов — 2-. Сокращаем 4 и 2 на 2.
- Записываем итог: KAl(SO4)2 — сульфат алюминия-калия.
Комплексные соли содержат комплексный анион или катион: Na[Al(OH)4] — тетрагидроксоалюминат натрия, [Cu(NH3)2]Cl — хлорид диамминмеди (II). Подробнее комплексные соединения будут рассмотрены в отдельной главе.
Подведем итог. Формулы солей, так же, как и формулы кислот, содержат в своем составе кислотный остаток. Обязательно в составе соли должны присутствовать катионы металлов или аммония. В формулах кислых или средних солей содержатся катионы Н+ или анионы ОН- соответственно. В комплексных солях катион либо анион представляют собой комплекс из металла и лигандов. Здесь можно прочитать также про химические свойства солей и химические свойства кислот.
Соли встречаются в химии очень часто. Состоят они из металла и кислотного остатка, образуются чаще всего в реакции нейтрализации, то есть реакции между основанием и кислотой, хотя получить соли можно и другими способами. Изучение химии в школе предполагает знакомство со средними солями, но иногда в школьной химии встречаются кислые и основные соли. О них и пойдёт речь.
Классификация солей
Средние соли
Итак, средние соли образуются, когда в кислоте все атомы водорода замещены металлом. Примеры средних солей: КCl, Li2SO4, Na3PO4.
Из примеров как раз видно, что в кислотах, использованных для получения солей, все атомы водорода заместились на металл. Посмотрите, например, на фосфат натрия Na3PO4. Эта соль фосфорной кислоты H3PO4. Видно, что все три атома водорода заместились на атомы натрия.
Средние соли. Номенклатура
Здесь нет никакой сложности:
в названии используется название кислотного остатка и металл.
Примеры:
Ca(NO3)2 – нитрат кальция (нитрат – соль азотной кислоты),
MgSO4 – сульфат магния (сульфат – соль серной кислоты),
К3PO4 – фосфат калия (фосфат – соль фосфорной кислоты).
Кислые соли
Кислые соли – продукт неполного замещения атомов водорода в кислоте атомами металла. Примеры кислых солей: NaHCO3, KHSO3.
При составлении формул кислых солей важно понимать, как они образуются, иначе будет путаница с индексами. Давайте разберём это на примере гидрокарбоната натрия NaHCO3. Для начала вспомним о карбонате натрия Na2CO3. Это соль угольной кислоты Н2СО3. При образовании карбоната натрия заместились оба атома водорода на два атома натрия, то есть вместо двух атомов водорода в кислоте H2CO3 встали два атома натрия, образовав карбонат натрия Na2CO3:
в H2CO3 заместились 2 атома водорода на 2 атома натрия с образованием Na2CO3
А вот если атомов натрия не хватило, то атом натрия заместит лишь один атом водорода, второй при этом останется, то есть:
в H2CO3 заместился 1 атом водорода на 1 атом натрия с образованием NaHCO3
Обратите внимание, что все валентности учтены! Это важно! Вы знаете, что валентность кислотного остатка угольной кислоты СО3 равна II (потому что угольная кислота двухосновная, в ней два атома водорода). Валентность атома натрия I, валентность атома водорода I, поэтому и формула гидрокарбоната выглядят так: NaHCO3.
Кислые соли. Номенклатура
Чтобы назвать кислую соль правильно,
нужно к кислотному остатку добавить часть «гидро» (если в соли два атома водорода, то нужно добавить «дигидро»).
Примеры:
NaHSO3 – гидросульфит натрия (сульфит – соль сернистой кислоты H2SO3, но у нас соль кислая, поэтому добавляем «гидро»),
Na2HPO4 – гидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, поэтому добавляем «гидро»),
NaH2PO4 – дигидрофосфат натрия (фосфат – соль фосфорной кислоты H3PO4, но у нас соль кислая, причём в ней два атома водорода, поэтому добавляем «дигидро»).
Запомните, что одноосновные кислоты не образуют кислых солей. Это довольно очевидно, ведь в одноосновных кислотах всего один атом водорода, и если он не заместится, то кислота так и останется кислотой, не превратившись в соль. Например, в соляной кислоте (одноосновной) HCl атом водорода в любом случае должен заместиться на атом металла, иначе соли не получится.
Основные соли
Основные соли получаются, когда не все гидроксильные группы в основании заместились кислотным остатком. Примеры основных солей: Zn(OH)Cl, Al(OH)SO4, Fe(OH)(NO3)2.
Здесь ситуация обратна той, что имеется при образовании кислых солей. Но если в кислых солях частично замещаются атомы водорода, то в основных – частично замещаются гидроксогруппы. Давайте рассмотрим это на примере гидроксохлорида цинка Zn(OH)Cl.
В гидроксиде цинка Zn(OH)2 заместились две группы ОН на два кислотных остатка соляной кислоты Cl с получением хлорида цинка ZnCl2 (средней соли).
Но бывает, что в гидроксиде цинка Zn(OH)2 заместилась одна группа ОН на один кислотный остаток соляной кислоты Cl с получением гидроксохлорида цинка Zn(ОН)Cl (средней соли).
Составление формул основных солей тоже требует внимательности. Здесь нужно учитывать число гидроксильных групп ОН и валентность кислотного остатка. Например, в Zn(OH)Cl валентность цинка II, валентность гидроксогруппы I, валентность кислотного остатка Cl – I.
Основные соли. Номенклатура
Чтобы правильно назвать основную соль,
нужно к кислотному остатку прибавить «гидроксо» (если в соли две гидроксильные группы, то добавляют «дигидроксо»).
Al(OH)SO4 – гидроксосульфат алюминия (сульфат – соль серной кислоты H2SO4, но у нас соль основная, поэтому добавляем «гидроксо»),
Fe(OH)2(NO3) – дигидроксонитрат железа (III) (нитрат – соль азотной кислоты HNO3, но у нас соль основная, причём в ней две гидроксильные группы ОН, поэтому добавляем «дигидроксо»),
Mg(ОН)Cl – гидроксохлорид магния (хлорид – соль соляной кислоты HCl, но у нас основная соль, поэтому добавляем «гидроксо»).
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.