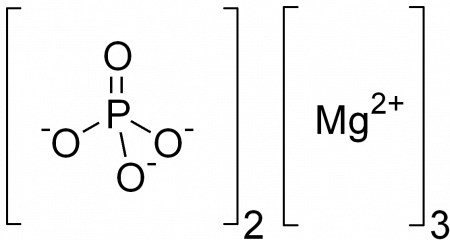
| Ортофосфат магния | |
|---|---|
 |
|
| Систематическое наименование |
Фосфат магния |
| Традиционные названия | Фосфорнокислый магний |
| Хим. формула | Mg3(PO4)2 |
| Молярная масса | 262,855 г/моль |
| Температура | |
| • плавления | 1357 °C |
| Растворимость | |
| • в воде | 3,9·10–26 г/100 мл |
| Рег. номер CAS | 7757-87-1 |
| PubChem | 24439 |
| Рег. номер EINECS | 231-824-0 |
| SMILES |
[O-]P(=O)([O-])[O-].[O-]P(=O)([O-])[O-].[Mg+2].[Mg+2].[Mg+2] |
| InChI |
1S/3Mg.2H3O4P/c;;;2*1-5(2,3)4/h;;;2*(H3,1,2,3,4)/q3*+2;;/p-6 GVALZJMUIHGIMD-UHFFFAOYSA-H |
| Кодекс Алиментариус | E343 |
| ChemSpider | 22847 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Фосфат магния — неорганическое соединение, соль магния и ортофосфорной кислоты с формулой Mg3(PO4)2. Бесцветные кристаллы почти не растворимые в воде. Образует несколько кристаллогидратов.
Содержание
- 1 Получение
- 2 Применение
Получение
- Смешиванием растворов разбавленного сульфата магния смесью гидрофосфата натрия и гидрокарбоната натрия:
-
- 3 MgSO4 + 2 Na2HPO4 + 2 NaHCO3 → Mg3(PO4)2 + 3 Na2SO4 + 2 CO2 + 2 H2O
- Из водных растворов кристаллизуется в виде кристаллогидратов вида Mg3(PO4)2•4H2O, Mg3(PO4)2•6H2O и Mg3(PO4)2•8H2O.
- Спеканием оксида магния и пирофосфата натрия получается безводная соль:
-
- 3 MgO + Na4P2O7 →900oC Mg3(PO4)2 + 2 Na2O
Применение
- В продуктах питания в качестве пищевой добавки E343 как регулятор кислотности, добавки, препятствующей слёживанию и комкованию сыпучих веществ, а также разрыхлителя.
- В аналитической химии.
| Ортофосфат магния | |
|---|---|
  |
|
| Общие | |
| Систематическое наименование |
Фосфат магния |
| Традиционные названия | Фосфорнокислый магний |
| Хим. формула | Mg3(PO4)2 |
| Физические свойства | |
| Молярная масса | 262,855 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 1357 °C |
| Химические свойства | |
| Растворимость | |
| • в воде | 3,9·10–26 г/100 мл |
| Классификация | |
| Рег. номер CAS | 7757-87-1 |
| PubChem | 24439 |
| Рег. номер EINECS | 231-824-0 |
| SMILES |
[O-]P(=O)([O-])[O-].[O-]P(=O)([O-])[O-].[Mg+2].[Mg+2].[Mg+2] |
| InChI |
InChI=1S/3Mg.2H3O4P/c;;;2*1-5(2,3)4/h;;;2*(H3,1,2,3,4)/q3*+2;;/p-6 GVALZJMUIHGIMD-UHFFFAOYSA-H |
| Кодекс Алиментариус | E343 |
| ChEBI | 190298 |
| ChemSpider | 22847 |
| Безопасность | |
| NFPA 704 |
0 1 0 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. |
Ортофосфат магния — неорганическое соединение, соль магния и ортофосфорной кислоты с формулой Mg3(PO4)2. Бесцветные кристаллы почти не растворимые в воде. Образует несколько кристаллогидратов.
Получение[править | править код]
- Смешиванием растворов разбавленного сульфата магния смесью гидрофосфата натрия и гидрокарбоната натрия:
- Из водных растворов кристаллизуется в виде кристаллогидратов вида Mg3(PO4)2•4H2O, Mg3(PO4)2•6H2O и Mg3(PO4)2•8H2O.
- Спеканием оксида магния и пирофосфата натрия получается безводная соль:
Применение[править | править код]
- В продуктах питания в качестве пищевой добавки E343 как регулятор кислотности, добавки, препятствующей слёживанию и комкованию сыпучих веществ, а также разрыхлителя.
- В аналитической химии[1].
Ссылки[править | править код]
- MeSH Magnesium+phosphate
- B05XA10
- PubChem 24439
- PubChem 123955
Примечания[править | править код]
- ↑ В.Н.Тихонов. Аналитическая химия магния. — Москва: “Наука”, 1973. — С. 61-63.
Литература[править | править код]
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 1. — 560 с.
Фосфат магния – это неорганическое соединение, состоящее из металла и остатка ортофосфорной кислоты. Широко применяется в аналитической химии, а также индустрии питания. Зарегистрирован как пищевая добавка, которой присвоен код Е343. Существуют сведения об опасности, однако она разрешена в России и многих странах Европы.
Содержание
- Что такое фосфат магния
- Физические свойства, внешний вид
- Химические свойства, реакции
- Производство и получение
- Применение
- Применение магния фосфата в пищевой промышленности
- Применение магния фосфата в химии и других областях
- Опасность
- Где купить и сколько стоит
- Перевозка, хранение
- Заключение
Что такое фосфат магния
Фосфат магния – это соль из двух компонентов: щелочноземельного металла магния, для которого характерен заряд +2 и кислотного остатка, заряженного отрицательно: -3. Формула магния фосфата – Mg3(PO4)2. К фосфатам относят группу схожих веществ, которые описываются разными формулами:
- формула магния фосфата однозамещённого – HMg3(PO4)2;
- формула магния фосфата двузамещённого – HMgPO4;
- формула магния фосфата трёхзамещённого – Mg3(PO4)2.
Чистый фосфат магния имеет синтетическое происхождение, его невозможно найти в природе, но его обнаруживают с некоторыми примесями в минералах. Бобьерит образуется в водных экосистемах, он очень мягкий и пластичный, чрезвычайно распространён по всему миру. Его жёлтые и голубые клиновидные кристаллы со стеклянным блеском и твёрдостью по шкале Мооса в 2-2,5 образуют розетки и агрегаты, внутри которых находятся полости. Впервые его описал француз Пьер Бобьера, название дано в честь этого химика-почвоведа.
Физические свойства, внешний вид

Фосфат магния при нормальных условиях – это бесцветный порошок без вкуса и запаха, высоко гигроскопичен, быстро поглощает влагу из воздуха, легко слёживается. Молекулярная масса – 262,855 г/моль. Плавится при температурном режиме, достигающем 1357 °С. Растворимость в воде крайне низкая, почти не растворяется при 25 °С. Это обусловлено значительной силой электростатических взаимодействий между структурными элементами фосфата магния, они не позволяют молекулам воды разорвать связи.
Химические свойства, реакции
Фосфат магния демонстрирует качества, схожие с другими солями фосфатами. Так, в уравнении реакции магния фосфата с кислотой выделяется гидрофосфат:
Mg3(PO4)2 + H3PO4 → 3MgHPO4
В реакции магния фосфата с хлороводородом выделяется хлорид магния:
Mg3(PO4)2 + 6HCl → MgCl2 + 2H3PO4
Вещество реагирует и с гидроксидами. Протекает реакция магния фосфата с едким натром:
Mg3(PO4)2 + 6NaOH → 2Na3PO4 + 3Mg(OH)2
Производство и получение
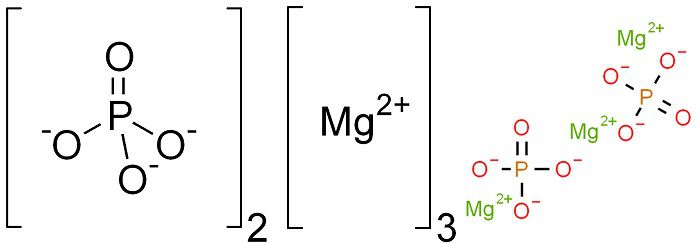
Фосфат магния в лаборатории получают прямым взаимодействием составляющих:
Mg + 2H3PO4 → Mg3(PO4)2 +3H2↑
Получение описывается уравнением магния фосфата из оксида:
3MgO + 2H3PO4 → Mg3(PO4)2 + 3H2O
Синтез проводят также путём ионного обмена, сопровождающегося осаждением соли фосфата магния, калия (если используется фосфорнокислый калий):
3MgSO4 + 2Na3PO4 → Mg3(PO4)2 + 3Na2SO4
Добыча ведётся путём нейтрализации, уравнение магния фосфата из гидроокиси:
3Mg(OH)2 + 3H3PO4 → Mg3(PO4)2 + 6H2O
Фосфат магния синтезируют в ходе реакции фосфорного ангидрида и жжённой магнезии при подогревании. Результат виден в уравнении:
P2O5 + 3MgO → Mg3(PO4)2
Применение
Сферы применения магния фосфата – органическая и неорганическая химия, производство продуктов питания. Это ценный реагент для производства фосфорсодержащих соединений, он необходим для добычи фосфатных смесей, выпуска средств для ухода за зубами. Применение магния фосфата как пластификатора оправдано при изготовлении изделий из пластмасс. За счёт адсорбирующего действия он используется в многокомпонентных системах очистки воды от органических загрязнений, других металлов, в том числе свободного магния, калия.
Применение магния фосфата в пищевой промышленности
Пищевая добавка Е343 – антислёживающий агент, стабилизатор и эмульгатор, антиокислитель. Он стабилизирует неустойчивые составы, которые созданы из несмешивающихся ингредиентов: масляные, солёные, молочные. Фосфат магния проявляет себя как улучшитель муки и разрыхлитель. В тесте соли фосфатов магния способствует улучшению эластичности, делает его послушным. Готовая выпечка с добавлением Е343 мягкая с хрустящей корочкой. Такая продукция дольше сохраняет воздушность и приятные внешние качества, привлекательный товарный вид.
Фосфат магния – это мощный антиоксидант. В пище он замедляет окисление органики, продлевая тем самым срок годности. Он защищает продукцию от агрессивного кислорода воздуха, перекисных окислителей. С этим тесно связана функция пищевой добавки Е343 как регулятора кислотности. Пищевая добавка обеспечивает постоянство водородного показателя среды, pH остаётся одинаковым на протяжении длительного времени, что благоприятно сказывается на качестве и препятствует развитию патогенных микроорганизмов.
Фосфат магния поддерживает вязкость смесей, формирует густоту нужной степени. Его встречают в таких продуктах:
- хлебобулочные изделия;
- мука и разрыхлители;
- сухие супы быстрого приготовления;
- спортивное питание;
- безалкогольные напитки;
- мороженое и фруктовый лёд;
- концентраты бульонов;
- ароматизированные сиропы;
- сливки;
- соусы;
- панировка;
- сыр;
- яйцепродукты;
- макароны;
- спред и маргарин;
- рыбные и мясные консервы;
- чипсы и снеки.
Применение магния фосфата в химии и других областях
Фосфат магния – это распространённый реагент. Сложность его применения заключается в том, что для многих процессов необходима водная среда, а фосфат является нерастворимым. Тем не менее, его используют на производствах для синтеза веществ, содержащих фосфор и магний благодаря подходящей формуле.
В косметологии фосфат магния вносят в зубные пасты как абразив. Благодаря мелким частицам и особой формуле он полирует поверхность эмали, очищая от налёта и осветляя её. Е343 добавляют в шампуни, гели для душа, крема и другие косметические средства. Он поддерживает баланс кислотности и поддерживает текстуру косметики для ухода за кожей и волосами.
Фосфат магния можно встретить в сыпучих моющих средствах. Он не позволяет порошку скомкиваться и поглощать излишки влаги, утрамбовываться, надолго сохраняет его чистящую способность.
Опасность
Фосфат магния отрицательно влияет на здоровье человека. Вещество повышает артериальное давление, усиливая нагрузку на сердечнососудистую систему, вызывая гипертензию. Длительный приём приводит к нарушению работы желудочно-кишечного тракта. Возникает тошнота, вздутие, боли и проблемы с отхождением стула. Установлена максимальная допустимая доза приёма пищевой добавки Е343 – 70 мг на 1 кг массы тела.
Фосфат магния относится к 4 классу (малоопасные вещества). При работе с ними необходимо соблюдать технику безопасности и правила личной гигиены: работать в перчатках, после эксплуатации тщательно мыть руки и споласкивать рот, рекомендуется надевать маску или респиратор.
Где купить и сколько стоит
Фосфат магния продают заводы-производители по оптовым ценам от 150 рублей за 1 кг при минимальной закупке в 25 кг. На рынке в изобилии представлены зарубежные поставщики, сбывающие ортофосфат от 2$/кг. Е343 можно приобрести в специализированных интернет-магазинах, цена от 5000 руб/кг. Высокая стоимость обусловлена чистотой реактива.
Перевозка, хранение
Фосфат магния транспортируют всеми видами крытого транспорта в оригинальных упаковках. Упаковывают кристаллический порошок в полиэтиленовые, бумажные, а затем тканевые мешки. Реагент хранят в сухом помещении с относительной влажностью воздуха не более 50%, в темноте.
Заключение
Фосфат магния применяется в различных областях. Несмотря на сведения о негативном воздействии, в допустимых концентрациях его используют для улучшения широкого спектра пищевой продукции, а также косметики, гигиенических товаров. Вещество востребовано в аналитике, выпуске пластиковых полимеров.
Читайте также:
- Хлорид магния Е511: описание, применение, инструкция, польза и вред
- Фосфат калия: получение, свойства, реакции, польза и вред, применение
- Фосфат кальция: свойства, применение, виды, формула и реакции
- Фосфат натрия: описание, реакции, вред, применение
Сайт предоставляет информацию в справочных целях, только для ознакомления. Поставить диагноз и назначить адекватное лечение может только врач! Медикаменты и народные средства должны назначаться специалистом, так как имеют противопоказания и побочные действия! Посещение и консультации квалифицированного специалиста строго обязательны!
![]() Загрузка…
Загрузка…
Содержание
- Формы фосфата магния и нейтральность его зарядов
- Фосфаты магния с другими катионами
- Состав
- Свойства
- Приложения
- Ссылки
В фосфат магния представляет собой термин, который используется для обозначения семейства неорганических соединений, образованных магнием, щелочноземельным металлом и оксоанионфосфатом. Простейший фосфат магния имеет химическую формулу Mg.3(PO4)2. Формула показывает, что на каждые два аниона PO43– есть три катиона Mg2+ взаимодействуя с ними.
Точно так же эти соединения могут быть описаны как соли магния, полученные из ортофосфорной кислоты (H3PO4). Другими словами, магний «объединяется» между фосфатными анионами, независимо от их неорганического или органического происхождения (MgO, Mg (NO3)2, MgCl2, Mg (OH)2, так далее.).

По этим причинам фосфаты магния можно найти в виде различных минералов. Некоторые из них: каттеит -Mg3(PO4)2 · 22ч2О-, струвит – (NH4) MgPO46H2Или, микрокристаллы которого представлены на верхнем изображении- холтедалит -Mg2(PO4) (OH) – и бобьеррит -Mg3(PO4)28H2ИЛИ-.
В случае бобьеррита его кристаллическая структура моноклинная, с агрегатами кристаллов в форме вееров и массивных розеток. Однако фосфаты магния характеризуются богатой структурной химией, а это означает, что их ионы принимают множество кристаллических структур.
Формы фосфата магния и нейтральность его зарядов
Фосфаты магния образуются в результате замещения протонов H3PO4. Когда ортофосфорная кислота теряет протон, она остается в виде дигидрофосфат-иона H2PO4–.
Как нейтрализовать отрицательный заряд, чтобы получить соль магния? Да Mg2+ считается за два положительных заряда, то вам нужно два H2PO4–. Таким образом, двухкислотный фосфат магния Mg (H2PO4)2.
Затем, когда кислота теряет два протона, ион гидрофосфата, HPO, остается42–. Как же нейтрализовать эти два отрицательных заряда? Как Mg2+ ему нужны только два отрицательных заряда, чтобы нейтрализовать себя, он взаимодействует с одним ионом HPO42–. Таким образом получают кислый фосфат магния: MgHPO4.
Наконец, когда все протоны потеряны, фосфат-анион PO остается.43–. Для этого требуется три катиона магния.2+ и из другого фосфата для сборки в кристаллическое твердое вещество. Математическое уравнение 2 (-3) + 3 (+2) = 0 помогает понять эти стехиометрические отношения для магния и фосфата.
В результате этих взаимодействий образуется трехосновный фосфат магния: Mg3(PO4)2. Почему трехосновный? Поскольку он способен принимать три эквивалента H+ чтобы снова сформировать H3PO4:
PO43–(ac) + 3H+(ac) <=> H3PO4(ac)
Фосфаты магния с другими катионами
Компенсация отрицательных зарядов также может быть достигнута с участием других положительных видов.
Например, чтобы нейтрализовать ПО43–, ионы K+, Na+, Руб.+, NH4+и т. д., также могут вмешиваться, образуя соединение (X) MgPO4. Если X равно NH4+образуется безводный минерал струвит (NH4) MgPO4.
Учитывая ситуацию, когда вмешивается другой фосфат и увеличиваются отрицательные заряды, другие дополнительные катионы могут присоединиться к взаимодействиям, чтобы нейтрализовать их. Благодаря этому можно синтезировать многочисленные кристаллы фосфата магния (Na3RbMg7(PO4)6, например).
Состав

Изображение выше иллюстрирует взаимодействие между ионами Mg.2+ и ПО43– которые определяют кристаллическую структуру. Однако это только изображение, которое скорее демонстрирует тетраэдрическую геометрию фосфатов. Итак, в кристаллическую структуру входят фосфатные тетраэдры и магниевые сферы.
В случае Mg3(PO4)2 безводные ионы принимают ромбоэдрическую структуру, в которой Mg2+ он координирован с шестью атомами O.
Сказанное выше проиллюстрировано на изображении ниже, с обозначением, что синие сферы являются кобальтовыми, достаточно заменить их зелеными магниевыми сферами:

Прямо в центре структуры может быть расположен октаэдр, образованный шестью красными сферами вокруг голубоватой сферы.
Точно так же эти кристаллические структуры способны принимать молекулы воды, образуя гидраты фосфата магния.
Это потому, что они образуют водородные связи с фосфат-ионами (HOH-O-PO33–). Кроме того, каждый фосфатный ион способен принимать до четырех водородных связей; то есть четыре молекулы воды.
Как Mg3(PO4)2 он имеет два фосфата, он может принимать восемь молекул воды (что происходит с минералом бобьеррит). В свою очередь, эти молекулы воды могут образовывать водородные связи с другими или взаимодействовать с положительными центрами Mg.2+.
Свойства
Это белое твердое вещество, образующее кристаллические ромбические пластинки. Он также не имеет запаха и вкуса.
Он очень нерастворим в воде, даже в горячем состоянии, из-за высокой энергии кристаллической решетки; Это продукт сильного электростатического взаимодействия между поливалентными ионами Mg.2+ и ПО43–.
То есть, когда ионы поливалентны и их ионные радиусы не сильно различаются по размеру, твердое вещество проявляет сопротивление растворению.
Он плавится при 1184 ºC, что также свидетельствует о сильных электростатических взаимодействиях. Эти свойства варьируются в зависимости от того, сколько молекул воды он поглощает, и от того, находится ли фосфат в некоторых из своих протонированных форм (HPO42– или H2PO4–).
Приложения

Он использовался как слабительное при запорах и изжоге. Однако его вредные побочные эффекты, проявляющиеся в виде диареи и рвоты, ограничивают его применение. Кроме того, это может вызвать повреждение желудочно-кишечного тракта.
В настоящее время изучается использование фосфата магния для восстановления костной ткани, исследуется применение Mg (H2PO4)2 как цемент.
Эта форма фосфата магния отвечает требованиям: она биоразлагаема и гистосовместима. Кроме того, его рекомендуется использовать для регенерации костной ткани из-за его стойкости и быстрого схватывания.
Оценивается возможность использования аморфного фосфата магния (AMP) в качестве биоразлагаемого неэкзотермического ортопедического цемента. Для создания этого цемента порошок AMP смешивают с поливиниловым спиртом для образования замазки.
Основная функция фосфата магния состоит в том, чтобы служить источником Mg для живых существ. Этот элемент участвует в многочисленных ферментативных реакциях в качестве катализатора или промежуточного продукта, необходимого для жизни.
Дефицит Mg у людей связан со следующими эффектами: снижение уровня кальция, сердечная недостаточность, задержка натрия, снижение уровня калия, аритмии, устойчивые мышечные сокращения, рвота, тошнота, низкий уровень циркулирующего азота. гормон паращитовидной железы, желудочные и менструальные спазмы, среди прочего.
Ссылки
- SuSanA Секретариат. (17 декабря 2010 г.). Струвит под микроскопом. Получено 17 апреля 2018 г. с: flickr.com
- Публикация минеральных данных. (2001-2005). Bobierrite. Получено 17 апреля 2018 г. с сайта handbookofmineralogy.org.
- Инь Ю, Чао Сюй, Хунлянь Дай; Приготовление и определение характеристик разлагаемого костного цемента на основе фосфата магния,Регенеративные биоматериалы, Volume 3, Issue 4, 1 декабря 2016 г., страницы 231–237, doi.org
- Сахар Муса. (2010). Исследование по синтезу материалов из фосфата магния. Бюллетень исследования фосфора Том 24, стр 16-21.
- Smokefoot. (28 марта 2018 г.). EntryWithCollCode38260. [Рисунок]. Получено 17 апреля 2018 г. с: commons.wikimedia.org.
- Википедия. (2018). Фосфат магния трехосновный. Получено 17 апреля 2018 г. с сайта en.wikipedia.org.
- Pubchem. (2018). Фосфат магния безводный. Получено 17 апреля 2018 г. с сайта pubchem.ncbi.nlm.nih.gov.
- Бен Хамед, Т., Бухрис, А., Бадри, А., и Бен Амара, М. (2017). Синтез и кристаллическая структура нового фосфата магния Na3RbMg7 (PO4) 6. Acta Crystallographica Раздел E: Кристаллографические сообщения, 73 (Pt 6), 817–820. doi.org
- Барби, Э., Лин, Б., Гоэль, В.К. и Бхадури, С. (2016) Оценка неэкзотермического ортопедического цемента на основе аморфного фосфата магния (АМФ). Биомедицинский мат. Том 11 (5): 055010.
- Yu, Y., Yu, CH. и Дай, Х. (2016). Приготовление разлагаемого костного цемента из магния. Регенеративные биоматериалы. Том 4 (1): 231
Magnesium phosphate, Mg3(PO4)2, is a mineral that can be found in bones, many plant seeds, and a variety of minerals. It’s used to supplement one’s diet with magnesium. The interaction of magnesium chloride or sulfate with the phosphate salt can produce tribasic magnesium phosphate. It’s simple to make the solution by stirring some salt with carbon dioxide-free water for several hours.
Magnesium Phosphate Formula
Magnesium phosphate has the chemical formula Mg3(PO4)2 and comprises the ions magnesium (Mg2+) and phosphate (PO3–4). Magnesium and phosphate ions are linked via an ionic connection. As a result, it is classified as an ionic compound.
Magnesium Phosphate Structure

Physical Properties of Magnesium Phosphate
The following are the physical properties of magnesium phosphate,
- Magnesium phosphate is a crystalline white powder.
- The majority of phosphate salts are water-soluble. Magnesium phosphate, on the other hand, is insoluble in water due to the fact that magnesium salts are normally insoluble in water. Magnesium cations are insoluble in most cases. It can be dissolved in salt solutions.
- Magnesium phosphate has a melting point of 1457K.
Chemical Properties of Magnesium Phosphate
The following are the chemical characteristics of magnesium phosphate,
- The reaction of Magnesium phosphate with Hydrochloric Acid: When magnesium phosphate combines with hydrochloric acid, it produces magnesium chloride salt and phosphoric acid. The chemical equation for the reaction is as follows,
Mg3(PO4)2 + 6HCl → 3MgCl2 + 2H3PO4
- The reaction of Magnesium phosphate with Sodium Hydroxide: Sodium phosphate and magnesium hydroxide are formed when magnesium phosphate interacts with sodium hydroxide. The chemical equation for the reaction is as follows,
Mg3(PO4)2 + 6NaOH → 2Na3PO4 + 3Mg(OH)2
Uses of Magnesium Phosphate
- Magnesium phosphate is mostly used in food as an acidity control.
- Fertilizers contain it.
- It’s a polishing agent for dentifrices.
- Cosmetics, shampoos, toothpaste, perfumes, and other products include it.
- It’s utilized as an adsorbent, a plastic stabilizer, and more.
- It’s also utilized in agricultural goods that aren’t pesticides.
- Vitamin E insufficiency is also treated with it.
- Magnesium phosphate is a nutritional supplement that helps people with magnesium insufficiency.
- It’s utilized as an anti-caking agent in cleaning products that contain silicate.
Sample Questions
Question 1: What is magnesium phosphate used for?
Answer:
Magnesium phosphate is a common ingredient in medications that help muscles relax. This chemical is also used to keep muscles from cramping. Vitamin E insufficiency is also prevented by magnesium phosphate.
Question 2: What are the physical properties of magnesium phosphate?
Answer:
- Magnesium phosphate is a white powder with a crystalline structure.
- Water is soluble in the majority of phosphate salts. Magnesium phosphate, on the other hand, is water insoluble since magnesium salts are generally water insoluble. In most circumstances, magnesium cations are insoluble. Salt solutions can be used to dissolve it.
- The melting point of magnesium phosphate is 1457K.
Question 3: What will happen when Magnesium phosphate reacts with Sodium Hydroxide?
Answer:
When magnesium phosphate reacts with sodium hydroxide, sodium phosphate and magnesium hydroxide are produced.
Mg3(PO4)2 + 6NaOH → 2Na3PO4 + 3Mg(OH)2
Question 4: What are the uses of Magnesium phosphate?
Answer:
Magnesium phosphate is a common ingredient in medications that help muscles relax. This chemical is also used to keep muscles from cramping. Vitamin E insufficiency is also prevented by magnesium phosphate.
Question 5: What will happen when Magnesium phosphate reacts with Hydrochloric Acid?
Answer:
Magnesium phosphate creates magnesium chloride salt and phosphoric acid when it reacts with hydrochloric acid.
Mg3(PO4)2 + 6HCl → 3MgCl2 + 2H3PO4
Question 6: When magnesium phosphate is combined with water, what happens?
Answer:
Magnesium phosphate undergoes a chemical reaction with water, yielding magnesium hydroxide and phosphoric acid as the end products.
Question 7: How many moles of magnesium phosphate Mg3(PO4)2 will contain 0.25 mole of oxygen atoms?
Answer:
There are 8 oxygen atoms in each molecule of magnesium phosphate. As a result, one mole of magnesium phosphate contains 8 moles of oxygen.
As a result, there are 0.25 moles of oxygen atoms in 1/8 × 0.25 = 3.125 × 10−2 moles of magnesium phosphate.
Last Updated :
13 Apr, 2022
Like Article
Save Article




