Универса́льная га́зовая постоя́нная — константа, численно равная работе расширения одного моля идеального газа в изобарном процессе при увеличении температуры на 1 К. Равна произведению постоянной Больцмана на число Авогадро. Обозначается латинской буквой R.
Общая информация[править | править код]
И. П. Алымов (1865)[1][2][3], Цейнер (1866)[4], Гульдберг (1867)[5], Горстман (1873)[6] и Д. И. Менделеев (1874)[7][2][3] пришли к выводу, что произведение индивидуальной для каждого газа постоянной в уравнении Клапейрона на молекулярный вес μ газа должно быть постоянной для всех газов величиной. Д. И. Менделеев вычислил[8][9] значение константы R, используя закон Авогадро, согласно которому 1 моль различных газов при одинаковом давлении и температуре занимает одинаковый объём 
Входит в уравнение состояния идеального газа


В Международной системе единиц (СИ) универсальная газовая постоянная, в силу точно установленных численных значений постоянных Авогадро и Больцмана, в точности равна
- R = 8,314 462 618 153 24 Дж/(моль∙К).
В системе СГС универсальная газовая постоянная равна R = 83 144 626,181 532 4 эрг/(моль∙К) (точно).
Универсальная газовая постоянная равна разности молярных теплоёмкостей идеального газа при постоянном давлении и постоянном объёме: 

У идеального газа показатель адиабаты связан с числом степеней свободы f молекулы соотношением 




Эти соотношения обусловлены законом равнораспределения энергии по степеням свободы, утверждающим, что в тепловом равновесии при температуре T на одну степень свободы вращательного и поступательного движения молекулы приходится в среднем энергия, равная (1/2)kT, а на одну колебательную степень свободы — энергия kT[10]; здесь k — постоянная Больцмана. Для большинства двухатомных газов при комнатной температуре колебательные степени свободы не возбуждаются (это проявление квантового характера осцилляций молекулы), и их не нужно учитывать. При увеличении температуры на 1 К при постоянном объёме энергия каждой молекулы газа по каждой кинетической степени свободы в среднем увеличивается на k/2, а энергия 1 моля газа (число Авогадро молекул, NA) — на NAk/2. Так, энергия молекулы одноатомного газа увеличивается на 


Универсальная газовая постоянная возникает и в приложениях термодинамики, относящихся к жидкостям и твёрдым телам. Так, эмпирический закон Дюлонга — Пти утверждает, что при комнатной температуре молярная теплоёмкость твёрдых простых веществ близка к 3R. Он объясняется тем, что атом в кристаллической решётке имеет три колебательные степени свободы, то есть согласно закону равнораспределения на каждый атом приходится в среднем 3kT/2 кинетической и столько же потенциальной энергии. Отсюда моль атомов обладает тепловой энергией 
Иногда рассматривается также индивидуальная газовая постоянная конкретного газа, равная отношению R к молекулярной массе данного газа (или к средней молекулярной массе смеси газов): R′ = R / μ. Для сухого воздуха R′ ≈ 287 Дж/(кг∙К), для водорода 4125 Дж/(кг∙К).
Связь между газовыми константами[править | править код]
Как показано выше, универсальная газовая постоянная выражается через произведение постоянной Больцмана на число Авогадро[11]:
Постоянную Больцмана используют в формулах, описывающих изучаемое явление или поведение рассматриваемого объекта с микроскопической точки зрения (см. Молекулярно-кинетическая теория, Статистическая физика, Физическая кинетика), тогда как универсальная газовая постоянная более удобна при расчетах, касающихся макроскопических систем, когда число частиц задано в молях.
См. также[править | править код]
- Постоянная Больцмана
- Число Авогадро
- Уравнение состояния идеального газа
Примечания[править | править код]
- ↑ Алымов И., 1865, с. 106.
- ↑ 1 2 Кипнис А. Я., 1962.
- ↑ 1 2 Гельфер Я. М., 1981, с. 123.
- ↑ Zeuner G., 1866, p. 105.
- ↑ Partington J. R., 1913, p. 135.
- ↑ Partington J. R., 1949, p. 644.
- ↑ Голоушкин В. Н., 1951.
- ↑ Менделеев Д. И. О сжимаемости газов (Из лаборатории С.-Петербургского Университета) // Журнал русского химического общества и физического общества. — 1874. — Т. 6. — С. 309—352. Архивировано 30 июня 2015 года.
- ↑ Д. Менделеев. Объ упругости газовъ. 1875 г. Дата обращения: 12 января 2013. Архивировано 6 декабря 2015 года.
- ↑ Разница в два раза объясняется тем, что для вращательных и поступательных степеней свободы играет роль лишь кинетическая энергия, а для колебательных — кинетическая и потенциальная.
- ↑ Больцмана постоянная, 1988.
Литература[править | править код]
- Partington J. R. A Text-book of Thermodynamics (with Special Reference to Chemistry). — London: Constable & Company LTD, 1913. — x + 544 p.
- Partington J. R. An Advanced Treatise on Physical Chemistry. Vol. 1. Fundamental Principles. The Properties of Gases. — London — New York — Toronto: Longmans, Green and Co, 1949. — xlii + 943 p.
- Zeuner G. Grundzüge der mechanischen Wärmetheorie. — 2. vollständig umgearbeitete Auflage. — Leipzig: Verlag von Arthur Felix, 1866. — xvi + 568 + xxv p.
- Алымов И. Научные выводы относительно водяного пара // Морской сборник. — 1865. — Т. 77, № 3. — С. 87—113.
- Больцмана постоянная // Физическая энциклопедия. — 1988. — Т. 1. — С. 222.
- Гельфер Я. М. История и методология термодинамики и статистической физики. — 2-е изд., перераб. и доп. — М.: Высшая школа, 1981. — 536 с.
- Голоушкин В. Н. Уравнение состояния идеального газа Д.И. Менделеева // Успехи физических наук. — 1951. — Т. 45, № 4. — С. 616—621. — doi:10.3367/UFNr.0045.195112c.0616.
- Кипнис А. Я. К истории установления уравнения состояния идеального газа // Вопросы истории естествознания и техники. — Изд-во АН СССР, 1962. — № 13. — С. 91—94.
From Wikipedia, the free encyclopedia
| Value of R[1] | Unit |
|---|---|
| SI units | |
| 8.31446261815324 | J⋅K−1⋅mol−1 |
| 8.31446261815324 | m3⋅Pa⋅K−1⋅mol−1 |
| 8.31446261815324 | kg⋅m2⋅s−2⋅K−1⋅mol−1 |
| Other common units | |
| 8314.46261815324 | L⋅Pa⋅K−1⋅mol−1 |
| 8.31446261815324 | L⋅kPa⋅K−1⋅mol−1 |
| 0.0831446261815324 | L⋅bar⋅K−1⋅mol−1 |
| 8.31446261815324×107 | erg⋅K−1⋅mol−1 |
| 0.730240507295273 | atm⋅ft3⋅lbmol−1⋅°R−1 |
| 10.731577089016 | psi⋅ft3⋅lbmol−1⋅°R−1 |
| 1.985875279009 | BTU⋅lbmol−1⋅°R−1 |
| 297.031214 | inH2O⋅ft3⋅lbmol−1⋅°R−1 |
| 554.984319180 | torr⋅ft3⋅lbmol−1⋅°R−1 |
| 0.082057366080960 | L⋅atm⋅K−1⋅mol−1 |
| 62.363598221529 | L⋅Torr⋅K−1⋅mol−1 |
| 1.98720425864083… | cal⋅K−1⋅mol−1 |
| 8.20573660809596…×10−5 | m3⋅atm⋅K−1⋅mol−1 |
The molar gas constant (also known as the gas constant, universal gas constant, or ideal gas constant) is denoted by the symbol R or R. It is the molar equivalent to the Boltzmann constant, expressed in units of energy per temperature increment per amount of substance, i.e. the pressure–volume product, rather than energy per temperature increment per particle. The constant is also a combination of the constants from Boyle’s law, Charles’s law, Avogadro’s law, and Gay-Lussac’s law. It is a physical constant that is featured in many fundamental equations in the physical sciences, such as the ideal gas law, the Arrhenius equation, and the Nernst equation.
The gas constant is the constant of proportionality that relates the energy scale in physics to the temperature scale and the scale used for amount of substance. Thus, the value of the gas constant ultimately derives from historical decisions and accidents in the setting of units of energy, temperature and amount of substance. The Boltzmann constant and the Avogadro constant were similarly determined, which separately relate energy to temperature and particle count to amount of substance.
The gas constant R is defined as the Avogadro constant NA multiplied by the Boltzmann constant k (or kB):
Since the 2019 redefinition of SI base units, both NA and k are defined with exact numerical values when expressed in SI units.[2] As a consequence, the SI value of the molar gas constant is exactly 8.31446261815324 J⋅K−1⋅mol−1.
Some have suggested that it might be appropriate to name the symbol R the Regnault constant in honour of the French chemist Henri Victor Regnault, whose accurate experimental data were used to calculate the early value of the constant. However, the origin of the letter R to represent the constant is elusive. The universal gas constant was apparently introduced independently by Clausius’ student, A.F. Horstmann (1873)[3][4]
and Dmitri Mendeleev who reported it first on Sep. 12, 1874.[5]
Using his extensive measurements of the properties of gases,[6][7]
Mendeleev also calculated it with high precision, within 0.3% of its modern value.[8]
The gas constant occurs in the ideal gas law:
where P is the absolute pressure, V is the volume of gas, n is the amount of substance, m is the mass, and T is the thermodynamic temperature. Rspecific is the mass-specific gas constant. The gas constant is expressed in the same unit as are molar entropy and molar heat.
Dimensions[edit]
From the ideal gas law PV = nRT we get:
where P is pressure, V is volume, n is number of moles of a given substance, and T is temperature.
As pressure is defined as force per area of measurement, the gas equation can also be written as:
Area and volume are (length)2 and (length)3 respectively. Therefore:
Since force × length = work:
The physical significance of R is work per degree per mole. It may be expressed in any set of units representing work or energy (such as joules), units representing degrees of temperature on an absolute scale (such as kelvin or rankine), and any system of units designating a mole or a similar pure number that allows an equation of macroscopic mass and fundamental particle numbers in a system, such as an ideal gas (see Avogadro constant).
Instead of a mole the constant can be expressed by considering the normal cubic meter.
Otherwise, we can also say that:
Therefore, we can write R as:
And so, in terms of SI base units:
- R = 8.314462618… kg⋅m2⋅s−2⋅K−1⋅mol−1.
Relationship with the Boltzmann constant[edit]
The Boltzmann constant kB (alternatively k) may be used in place of the molar gas constant by working in pure particle count, N, rather than amount of substance, n, since
where NA is the Avogadro constant.
For example, the ideal gas law in terms of the Boltzmann constant is
where N is the number of particles (molecules in this case), or to generalize to an inhomogeneous system the local form holds:
where ρN = N/V is the number density.
Measurement and replacement with defined value[edit]
As of 2006, the most precise measurement of R had been obtained by measuring the speed of sound ca(P, T) in argon at the temperature T of the triple point of water at different pressures P, and extrapolating to the zero-pressure limit ca(0, T). The value of R is then obtained from the relation
where:
- γ0 is the heat capacity ratio (5/3 for monatomic gases such as argon);
- T is the temperature, TTPW = 273.16 K by the definition of the kelvin at that time;
- Ar(Ar) is the relative atomic mass of argon and Mu = 10−3 kg⋅mol−1 as defined at the time.
However, following the 2019 redefinition of the SI base units, R now has an exact value defined in terms of other exactly defined physical constants.
Specific gas constant[edit]
| Rspecific for dry air |
Unit |
|---|---|
| 287.052874 | J⋅kg−1⋅K−1 |
| 53.3523 | ft⋅lbf⋅lb−1⋅°R−1 |
| 1,716.46 | ft⋅lbf⋅slug−1⋅°R−1 |
| Based on a mean molar mass for dry air of 28.964917 g/mol. |
The specific gas constant of a gas or a mixture of gases (Rspecific) is given by the molar gas constant divided by the molar mass (M) of the gas or mixture.
Just as the molar gas constant can be related to the Boltzmann constant, so can the specific gas constant by dividing the Boltzmann constant by the molecular mass of the gas.
Another important relationship comes from thermodynamics. Mayer’s relation relates the specific gas constant to the specific heat capacities for a calorically perfect gas and a thermally perfect gas.
where cp is the specific heat capacity for a constant pressure and cv is the specific heat capacity for a constant volume.[9]
It is common, especially in engineering applications, to represent the specific gas constant by the symbol R. In such cases, the universal gas constant is usually given a different symbol such as R to distinguish it. In any case, the context and/or unit of the gas constant should make it clear as to whether the universal or specific gas constant is being referred to. [10]
In case of air, using the perfect gas law and the standard sea-level conditions (SSL) (air density ρ0 = 1.225 kg/m3, temperature T0 = 288.15 K and pressure p0 = 101325 Pa), we have that Rair = P0/(ρ0T0) = 287.052874247 J·kg−1·K−1. Then the molar mass of air is computed by M0 = R/Rair = 28.964917 g/mol.[11]
U.S. Standard Atmosphere[edit]
The U.S. Standard Atmosphere, 1976 (USSA1976) defines the gas constant R∗ as:[12][13]
- R∗ = 8.31432×103 N⋅m⋅kmol−1⋅K−1 = 8.31432 J⋅K−1⋅mol−1.
Note the use of kilomoles, with the resulting factor of 1000 in the constant. The USSA1976 acknowledges that this value is not consistent with the cited values for the Avogadro constant and the Boltzmann constant.[13] This disparity is not a significant departure from accuracy, and USSA1976 uses this value of R∗ for all the calculations of the standard atmosphere. When using the ISO value of R, the calculated pressure increases by only 0.62 pascal at 11 kilometers (the equivalent of a difference of only 17.4 centimeters or 6.8 inches) and 0.292 Pa at 20 km (the equivalent of a difference of only 33.8 cm or 13.2 in).
Also note that this was well before the 2019 SI redefinition, through which the constant was given an exact value.
References[edit]
- ^ “2018 CODATA Value: molar gas constant”. The NIST Reference on Constants, Units, and Uncertainty. NIST. 20 May 2019. Retrieved 2019-05-20.
- ^ “Proceedings of the 106th meeting” (PDF). 16–20 October 2017.
- ^ Jensen, William B. (July 2003). “The Universal Gas Constant R“. J. Chem. Educ. 80 (7): 731. Bibcode:2003JChEd..80..731J. doi:10.1021/ed080p731.
- ^ “Ask the Historian: The Universal Gas Constant — Why is it represented by the letter R?” (PDF).
- ^ Mendeleev, Dmitri I. (September 12, 1874). “An exert from the Proceedings of the Chemical Society’s Meeting on Sept. 12, 1874”. Journal of Russian Chemical-Physical Society, Chemical Part. VI (7): 208–209.
- ^ Mendeleev, Dmitri I. (1875). On the elasticity of gases [Объ упругости газовъ]. A.M. Kotomin, St.-Petersburg.
- ^ D. Mendeleev. On the elasticity of gases. 1875 (in Russian)
- ^ Mendeleev, Dmitri I. (March 22, 1877). “Mendeleef’s researches on Mariotte’s law 1”. Nature. 15 (388): 498–500. Bibcode:1877Natur..15..498D. doi:10.1038/015498a0.
- ^ Anderson, Hypersonic and High-Temperature Gas Dynamics, AIAA Education Series, 2nd Ed, 2006
- ^ Moran and Shapiro, Fundamentals of Engineering Thermodynamics, Wiley, 4th Ed, 2000
- ^ Manual of the US Standard Atmosphere (PDF) (3 ed.). National Aeronautics and Space Administration. 1962. pp. 7–11.
- ^ “Standard Atmospheres”. Retrieved 2007-01-07.
- ^ a b NOAA, NASA, USAF (1976). U.S. Standard Atmosphere, 1976 (PDF). U.S. Government Printing Office, Washington, D.C. NOAA-S/T 76-1562.
{{cite book}}: CS1 maint: multiple names: authors list (link) Part 1, p. 3, (Linked file is 17 Meg)
External links[edit]
- Ideal gas calculator Archived 2012-07-15 at the Wayback Machine – Ideal gas calculator provides the correct information for the moles of gas involved.
- Individual Gas Constants and the Universal Gas Constant – Engineering Toolbox
1.1 Цель работы
Цель работы –
экспериментальное определение газовой
постоянной воздуха, получение навыков
проведения эксперимента по определению
параметров состояния идеального газа
(воздуха)
1.2 Задание
1) Экспериментальным
путем найти значение газовой постоянной
воздуха.
2) Расчетным путем
по формуле (1.6) найти расчетное значение
газовой постоянной воздуха.
3) Сравнить
экспериментальное значение газовой
постоянной воздуха
(1.12)
с его расчетным
по формуле (1.14) и литературным
=287Дж/(кг*К)
значениями
по формуле (1.15).
4) Определить
погрешность эксперимента по формуле
(1.16).
5) Составить и
защитить отчет по выполненной работе.
1.3 Краткие теоретические сведения
Воздух представляет
собой газовую смесь, состоящую из
кислорода
,
азота
,
углекислого газа
,
аргона
,
водяных паров и одноатомных газов.
Объемные доли r
этих газов в воздухе соответственно
равны:
=0,7803;
=0,21;
=0,0003;
=
0,0093.
При давлениях,
близких к атмосферному, и комнатной
температуре воздух обладает свойствами
идеального газа. Под идеальным газом
понимают воображаемый газ, в котором
отсутствуют силы взаимодействия между
молекулами, а объемом самих молекул
можно пренебречь по сравнению с объемом
газом. Все реальные газы при высоких
температурах и малых давлениях по своим
свойствам практически не отличаются
от идеального газа.
Характеристическое
уравнение или уравнение состояния
идеального газа связывает между собой
основные параметры состояния – давление,
объем и температуру – и может бать
представлено уравнением Клапейрона
(для 1 кг идеального газа)
P
=RT
или P=ρRT,
(1.1)
где Р,Т
– абсолютные давления, Па, и температура,
К; ρ=1/
=m/V
– плотность газа
;
=V/m
– удельный объем,
;
R
– (индивидуальная) газовая постоянная
для 1 кг газа, Дж/(кг*К);
V,m
– объем,
и масса воздуха, кг.
Для произвольной
массы (m,
кг) газа уравнение состояния идеального
газа можно получить путем умножения
обеих частей (1.1) на массу
m:
P
m=mRT
или PV=mRT.
(1.2)
Для 1 кмоль
газа уравнение состояния (уравнение
Клапейрона-Менделеева) можно получить
путем умножения обеих частей (1.1) на
молярную массу газа μ
P
μ=
μRT
или P
=μRT=
T
, (1.3)
где
=μ
– объем 1 кмоля
газа,
.
При нормальных условиях физических
условиях (
=1,01325*
Па;
=273,15
К)
для всех газов
=22,41
;
=μR
8314,2
Дж/(кмоль*К)
– универсальная газовая постоянная
для 1 кмоль
газа, одинаковая для всех газов; μ
– молярная
масса газа,
кг/кмоль.
Численное значение
можно получить из уравнения (1.3), записав
его, например, для нормальных условий:
=
/
=1,01325*
*22,41/273,15=8314,2
Дж/(кмоль*К)
(1.4)
Универсальное
уравнение состояния, отнесенное к 1
кмоль газа
(1.3) может быть переписано в виде
P
=8314,2*Т.
(1.5)
Индивидуальная
газовая постоянная (R)
есть работа 1 кг идеального газа в
процессе при постоянном давлении и при
изменении температуры на один градус
(°С
или К).
Газовую постоянную
(воздуха) смеси идеальных газов, если
заданы массовые доли
-x
компонентов смеси
можно определить по формуле
.
(1.6)
Среднюю молярную
массу смеси можно выразить через
молекулярные массы компонентов и их
объемные доли формулой
.
(1.7)
Согласно закону
Амага для идеального газа молярная доля
равна объемной доле
-й
компоненты газа. Молярные массы газов
берут из приложения А.
Если абсолютное
давление
в сосуде больше барометрического
(атмосферного)
,
то
определяется по формуле
=
+
,
(1.8) а если меньше, то по формуле
=
–
.
(1.9)
В уравнениях
(1.8) и (1.9)
и
– избыточное (манометрическое) и
вакуумметрическое (разрежение) давления,
Па,
измеряемые соответственно манометром
и вакуумметром.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
На практике часто встречаются такие изменения состояния газа, когда одновременно изменяются все три параметра – объем VV, давление pp и температура TT. В таких случаях зависимость между параметрами определяется уравнением состояния газа.
Уравнение Клапейрона
Рассмотрим процесс, в результате которого газ перешел из нормального состояния с параметрами V0V_0, p0p_0, T0T_0 в состояние с другими параметрами V1V_1, p1p_1, T1T_1.
Такой переход от начального к конечному состоянию газа можно осуществить с помощью двух известных процессов (например, сначала изобарического, а затем изотермического) по схеме:
I.V0,p0,T0;V′,p0,T;V′=V0TT0I.{{V}_{0}},{{p}_{0}},{{T}_{0}};{V}’,{{p}_{0}},T;{V}’={{V}_{0}}frac{T}{{{T}_{0}}}
II.V′,p0,T;V,p,T;p0V′=pVII.{V}’,{{p}_{0}},T;V,p,T;{{p}_{0}}{V}’=pV
Исключив из двух полученных уравнений объем V′V’ для промежуточного состояния газа, получим
pVT=p0V0T0frac{pV}{T}=frac{{{p}_{0}}{{V}_{0}}}{{{T}_{0}}}
то есть получим уравнение:
pV=ВТpV = ВТ.
Это уравнение вывел французский ученый Б. П. Э. Клапейрон в 1834 году. Постоянная BB в нем – постоянная зависимости от природы газа и его количества. Эту постоянную, рассчитанную для единицы массы газа, называют удельной газовой постоянной B0B_0.
В качестве примера вычислим удельный газовую постоянную для воздуха. Объем 1 кг воздуха – удельный объем воздуха в нормальных условиях (давление 1,013 · 105 Па и температура 273,15 К)
V0=1ρ0=11,293(м3кг){{V}_{0}}=frac{1}{{{rho }_{0}}}=frac{1}{1,293}(frac{{{м}^{3}}}{кг})
Отсюда:
B0=p0V0T0=p0V0273=1,013⋅1051,293⋅273=287,1(Джкг⋅К){{B}_{0}}=frac{{{p}_{0}}{{V}_{0}}}{{{T}_{0}}}=frac{{{p}_{0}}{{V}_{0}}}{273}=frac{1,013cdot {{10}^{5}}}{1,293cdot 273}=287,1(frac{Дж}{кгcdot К})
Аналогично вычислено, что удельная газовая постоянная для водорода равна 4125, для кислорода – 295,7; для азота – 296,7 Дж / (кг · К) и т. д.
Преобразования Менделеева
В 1874 г. русский химик Д. И. Менделеев, воспользовавшись законом Авогадро, предоставил уравнение Клапейрона в более удобном для использования виде. При этом оказалось целесообразным рассчитывать постоянную для газов, взятых в количестве 1 моль или 1 кмоль:
Rm=p0V0mT0=1,013⋅105⋅0,0224273=8,31(Джмоль⋅K){{R}_{m}}=frac{{{p}_{0}}{{V}_{0m}}}{{{T}_{0}}}=frac{1,013cdot {{10}^{5}}cdot 0,0224}{273}=8,31(frac{Дж}{мольcdot K})
Постоянную RmR_m (или просто RR) называют универсальной газовой постоянной. Уравнение состояния в расчете на 1 моль идеального газа имеет вид, аналогичный уравнению Клапейрона:
pV=RmTpV={{R}_{m}}T
В таком виде уравнения состояния идеального газа называют уравнением Клапейрона-Менделеева.
Кроме единицы количества вещества – моль – разрешается применять кратные и дольные от ее величины. В пересчете на кмоль RR составит:
R=1,013⋅105⋅22,4273=8,31⋅103(Джкмоль⋅K)R=frac{1,013cdot {{10}^{5}}cdot 22,4}{273}=8,31cdot {{10}^{3}}(frac{Дж}{кмольcdot K})
В расчете на 1 кмоль идеального газа уравнение записывают так:
pV=RTpV = RT,
а для любой массы mm – так:
pV=mμRTpV=frac{m}{mu }RT
где μμ – масса, которую имеет кмоль газа.
Для удобства расчетов преимущественно пользуются именно этой формой уравнения.
По данному уравнению легко находим зависимость плотности газа от давления и температуры, а именно:
mV=μpRTfrac{m}{V}=frac{mu p}{RT},
ρ=μpRTrho =frac{mu p}{RT}
Таковы в общем виде эмпирические закономерности в свойствах идеального газа.
Физическая суть постоянной
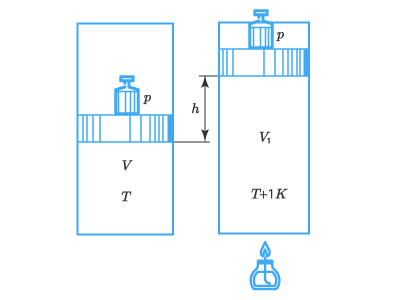
Для выяснения физической сути постоянной RR представим 1 кмоль газа под поршнем в некоем цилиндре:
При этом давление в нем составляет рр, температура – ТТ, а площадь поршня SS.
Повысим температуру газа внутри цилиндра от ТТ до (Т+1КТ + 1 К). Газ расширяется и выполняет работу, поднимая поршень на высоту hh. Эта работа составит:
А=pShА = pSh,
но Sh=ΔVSh = ΔV – прирост объема газа при расширении;
поэтому А=pΔVА = pΔV.
Данное выражение определяет работу газа в изобарическом процессе.
Применив уравнение Клапейрона-Менделеева к начальному и конечному состояниям газа, получим:
pV=RT;pV1=R(T+1K)pV=RT;p{{V}_{1}}=R(T+1K)
Отняв от второго уравнения первое, получим:
p(V1−V)=R;R=pΔVp({{V}_{1}}-V)=R;R=pDelta V
Сопоставим данное равенство с уравнением работы по подъему и найдем, что R=АR = А, то есть универсальная газовая постоянная численно равна работе расширения одного кмоль газа при изобарическом нагревании на 1К1 К.
Тест по теме: “Уравнение Клапейрона-Менделеева”
Газовая постоянная, справочная таблица
| Азот газовая постоянная азота |
297 (Джоуль / (Килограмм · Кельвин)) |
| Аммиак газовая постоянная аммиака |
488 (Джоуль / (Килограмм · Кельвин)) |
| Аргон газовая постоянная аргона |
208 (Джоуль / (Килограмм · Кельвин)) |
| Ацетилен газовая постоянная ацетилена |
320 (Джоуль / (Килограмм · Кельвин)) |
| Бутан газовая постоянная бутана |
143 (Джоуль / (Килограмм · Кельвин)) |
| Водород газовая постоянная водорода |
4125 (Джоуль / (Килограмм · Кельвин)) |
| Водяной пар (100°C) газовая постоянная водяного пара |
461 (Джоуль / (Килограмм · Кельвин)) |
| Воздух газовая постоянная воздуха |
287 (Джоуль / (Килограмм · Кельвин)) |
| Гелий газовая постоянная гелия |
2078 (Джоуль / (Килограмм · Кельвин)) |
| Двуокись углерода газовая постоянная углекислого газа |
189 (Джоуль / (Килограмм · Кельвин)) |
| Кислород газовая постоянная кислорода |
260 (Джоуль / (Килограмм · Кельвин)) |
| Метан газовая постоянная метана |
519 (Джоуль / (Килограмм · Кельвин)) |
| Неон газовая постоянная неона |
412 (Джоуль / (Килограмм · Кельвин)) |
| Окись углерода газовая постоянная угарного газа |
297 (Джоуль / (Килограмм · Кельвин)) |
| Пропан газовая постоянная пропана |
189 (Джоуль / (Килограмм · Кельвин)) |
| Пропилен газовая постоянная пропилена |
198 (Джоуль / (Килограмм · Кельвин)) |
| Фреон газовая постоянная фреона |
68.7 (Джоуль / (Килограмм · Кельвин)) |
| Этан газовая постоянная этана |
277 (Джоуль / (Килограмм · Кельвин)) |
| Этилен газовая постоянная этилена |
297 (Джоуль / (Килограмм · Кельвин)) |
Газовая постоянная – справочная таблица |
стр. 862 |
|---|