ПЕРИОДИЧЕСКАЯ ТАБЛИЦА МЕНДЕЛЕЕВА
Еще в школе, сидя на уроках химии, все мы помним таблицу на стене класса или химической лаборатории. Эта таблица содержала классификацию всех известных человечеству химических элементов, тех фундаментальных компонентов, из которых состоит Земля и вся Вселенная. Тогда мы и подумать не могли, что таблица Менделеева бесспорно является одним из величайших научных открытий, который является фундаментом нашего современного знания о химии.

На первый взгляд, ее идея выглядит обманчиво просто: организовать химические элементы в порядке возрастания веса их атомов. Причем в большинстве случаев оказывается, что химические и физические свойства каждого элемента сходны с предыдущим ему в таблице элементом. Эта закономерность проявляется для всех элементов, кроме нескольких самых первых, просто потому что они не имеют перед собой элементов, сходных с ними по атомному весу. Именно благодаря открытию такого свойства мы можем поместить линейную последовательность элементов в таблицу, очень напоминающую настенный календарь, и таким образом объединить огромное количество видов химических элементов в четкой и связной форме. Разумеется, сегодня мы пользуемся понятием атомного числа (количества протонов) для того, чтобы упорядочить систему элементов. Это помогло решить так называемую техническую проблему «пары перестановок», однако не привело к кардинальному изменению вида периодической таблицы.
В периодической таблице Менделеева все элементы упорядочены с учетом их атомного числа, электронной конфигурации и повторяющихся химических свойств. Ряды в таблице называются периодами, а столбцы группами. В первой таблице, датируемой 1869 годом, содержалось всего 60 элементов, теперь же таблицу пришлось увеличить, чтобы поместить 118 элементов, известных нам сегодня.
Периодическая система Менделеева систематизирует не только элементы, но и самые разнообразные их свойства. Химику часто бывает достаточно иметь перед глазами Периодическую таблицу для того, чтобы правильно ответить на множество вопросов (не только экзаменационных, но и научных).
The YouTube ID of 1M7iKKVnPJE is invalid.
Периодический закон
Существуют две формулировки периодического закона химических элементов: классическая и современная.
Классическая, в изложении его первооткрывателя Д.И. Менделеева: свойства простых тел, а также формы и свойства соединений элементов находятся в периодической зависимости от величин атомных весов элементов.
Современная: свойства простых веществ, а также свойства и формы соединений элементов находятся в периодической зависимости от заряда ядра атомов элементов (порядкового номера).
Графическим изображением периодического закона является периодическая система элементов, которая представляет собой естественную классификацию химических элементов, основанную на закономерных изменениях свойств элементов от зарядов их атомов. Наиболее распространёнными изображениями периодической системы элементов Д.И. Менделеева являются короткая и длинная формы.

Группы и периоды Периодической системы
Группами называют вертикальные ряды в периодической системе. В группах элементы объединены по признаку высшей степени окисления в оксидах. Каждая группа состоит из главной и побочной подгрупп. Главные подгруппы включают в себя элементы малых периодов и одинаковые с ним по свойствам элементы больших периодов. Побочные подгруппы состоят только из элементов больших периодов. Химические свойства элементов главных и побочных подгрупп значительно различаются.
Периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров. В периодической системе имеются семь периодов: первый, второй и третий периоды называют малыми, в них содержится соответственно 2, 8 и 8 элементов; остальные периоды называют большими: в четвёртом и пятом периодах расположены по 18 элементов, в шестом — 32, а в седьмом (пока незавершенном) — 31 элемент. Каждый период, кроме первого, начинается щелочным металлом, а заканчивается благородным газом.
Физический смысл порядкового номера химического элемента: число протонов в атомном ядре и число электронов, вращающихся вокруг атомного ядра, равны порядковому номеру элемента.

Свойства таблицы Менделеева
Напомним, что группами называют вертикальные ряды в периодической системе и химические свойства элементов главных и побочных подгрупп значительно различаются.
Свойства элементов в подгруппах закономерно изменяются сверху вниз:
- усиливаются металлические свойства и ослабевают неметаллические;
- возрастает атомный радиус;
- возрастает сила образованных элементом оснований и бескислородных кислот;
- электроотрицательность падает.
Все элементы, кроме гелия, неона и аргона, образуют кислородные соединения, существует всего восемь форм кислородных соединений. В периодической системе их часто изображают общими формулами, расположенными под каждой группой в порядке возрастания степени окисления элементов: R2O, RO, R2O3, RO2, R2O5, RO3, R2O7, RO4, где символом R обозначают элемент данной группы. Формулы высших оксидов относятся ко всем элементам группы, кроме исключительных случаев, когда элементы не проявляют степени окисления, равной номеру группы (например, фтор).
Оксиды состава R2O проявляют сильные основные свойства, причём их основность возрастает с увеличением порядкового номера, оксиды состава RO (за исключением BeO) проявляют основные свойства. Оксиды состава RO2, R2O5, RO3, R2O7 проявляют кислотные свойства, причём их кислотность возрастает с увеличением порядкового номера.
Элементы главных подгрупп, начиная с IV группы, образуют газообразные водородные соединения. Существуют четыре формы таких соединений. Их располагают под элементами главных подгрупп и изображают общими формулами в последовательности RH4, RH3, RH2, RH.
Соединения RH4 имеют нейтральный характер; RH3 — слабоосновный; RH2 — слабокислый; RH — сильнокислый характер.
Напомним, что периодом называют горизонтальный ряд элементов, расположенных в порядке возрастания порядковых (атомных) номеров.
В пределах периода с увеличением порядкового номера элемента:
- электроотрицательность возрастает;
- металлические свойства убывают, неметаллические возрастают;
- атомный радиус падает.

Элементы таблицы Менделеева
Щелочные и щелочноземельные элементы
К ним относятся элементы из первой и второй группы периодической таблицы. Щелочные металлы из первой группы — мягкие металлы, серебристого цвета, хорошо режутся ножом. Все они обладают одним-единственным электроном на внешней оболочке и прекрасно вступают в реакцию. Щелочноземельные металлы из второй группы также имеют серебристый оттенок. На внешнем уровне помещено по два электрона, и, соответственно, эти металлы менее охотно взаимодействуют с другими элементами. По сравнению со щелочными металлами, щелочноземельные металлы плавятся и кипят при более высоких температурах.
Показать / Скрыть текст
| Щелочные металлы | Щелочноземельные металлы |
| Литий Li 3 | Бериллий Be 4 |
| Натрий Na 11 | Магний Mg 12 |
| Калий K 19 | Кальций Ca 20 |
| Рубидий Rb 37 | Стронций Sr 38 |
| Цезий Cs 55 | Барий Ba 56 |
| Франций Fr 87 | Радий Ra 88 |
Лантаниды (редкоземельные элементы) и актиниды
Лантаниды — это группа элементов, изначально обнаруженных в редко встречающихся минералах; отсюда их название «редкоземельные» элементы. Впоследствии выяснилось, что данные элементы не столь редки, как думали вначале, и поэтому редкоземельным элементам было присвоено название лантаниды. Лантаниды и актиниды занимают два блока, которые расположены под основной таблицей элементов. Обе группы включают в себя металлы; все лантаниды (за исключением прометия) нерадиоактивны; актиниды, напротив, радиоактивны.
Показать / Скрыть текст
| Лантаниды | Актиниды |
| Лантан La 57 | Актиний Ac 89 |
| Церий Ce 58 | Торий Th 90 |
| Празеодимий Pr 59 | Протактиний Pa 91 |
| Неодимий Nd 60 | Уран U 92 |
| Прометий Pm 61 | Нептуний Np 93 |
| Самарий Sm 62 | Плутоний Pu 94 |
| Европий Eu 63 | Америций Am 95 |
| Гадолиний Gd 64 | Кюрий Cm 96 |
| Тербий Tb 65 | Берклий Bk 97 |
| Диспрозий Dy 66 | Калифорний Cf 98 |
| Гольмий Ho 67 | Эйнштейний Es 99 |
| Эрбий Er 68 | Фермий Fm 100 |
| Тулий Tm 69 | Менделевий Md 101 |
| Иттербий Yb 70 | Нобелий No 102 |
Галогены и благородные газы
Галогены и благородные газы объединены в группы 17 и 18 периодической таблицы. Галогены представляют собой неметаллические элементы, все они имеют семь электронов во внешней оболочке. В благородных газахвсе электроны находятся во внешней оболочке, таким образом с трудом участвуют в образовании соединений. Эти газы называют «благородными, потому что они редко вступают в реакцию с прочими элементами; т. е. ссылаются на представителей благородной касты, которые традиционно сторонились других людей в обществе.
Показать / Скрыть текст
| Галогены | Благородные газы |
| Фтор F 9 | Гелий He 2 |
| Хлор Cl 17 | Неон Ne 10 |
| Бром Br 35 | Аргон Ar 18 |
| Йод I 53 | Криптон Kr 36 |
| Астат At 85 | Ксенон Xe 54 |
| — | Радон Rn 86 |
Переходные металлы
Переходные металлы занимают группы 3—12 в периодической таблице. Большинство из них плотные, твердые, с хорошей электро- и теплопроводностью. Их валентные электроны (при помощи которых они соединяются с другими элементами) находятся в нескольких электронных оболочках.
Показать / Скрыть текст
| Переходные металлы |
| Скандий Sc 21 |
| Титан Ti 22 |
| Ванадий V 23 |
| Хром Cr 24 |
| Марганец Mn 25 |
| Железо Fe 26 |
| Кобальт Co 27 |
| Никель Ni 28 |
| Медь Cu 29 |
| Цинк Zn 30 |
| Иттрий Y 39 |
| Цирконий Zr 40 |
| Ниобий Nb 41 |
| Молибден Mo 42 |
| Технеций Tc 43 |
| Рутений Ru 44 |
| Родий Rh 45 |
| Палладий Pd 46 |
| Серебро Ag 47 |
| Кадмий Cd 48 |
| Лютеций Lu 71 |
| Гафний Hf 72 |
| Тантал Ta 73 |
| Вольфрам W 74 |
| Рений Re 75 |
| Осмий Os 76 |
| Иридий Ir 77 |
| Платина Pt 78 |
| Золото Au 79 |
| Ртуть Hg 80 |
| Лоуренсий Lr 103 |
| Резерфордий Rf 104 |
| Дубний Db 105 |
| Сиборгий Sg 106 |
| Борий Bh 107 |
| Хассий Hs 108 |
| Мейтнерий Mt 109 |
| Дармштадтий Ds 110 |
| Рентгений Rg 111 |
| Коперниций Cn 112 |
Металлоиды
Металлоиды занимают группы 13—16 периодической таблицы. Такие металлоиды, как бор, германий и кремний, являются полупроводниками и используются для изготовления компьютерных чипов и плат.
Показать / Скрыть текст
| Металлоиды |
| Бор B 5 |
| Кремний Si 14 |
| Германий Ge 32 |
| Мышьяк As 33 |
| Сурьма Sb 51 |
| Теллур Te 52 |
| Полоний Po 84 |
Постпереходными металлами
Элементы, называемые постпереходными металлами, относятся к группам 13—15 периодической таблицы. В отличие от металлов, они не имеют блеска, а имеют матовую окраску. В сравнении с переходными металлами постпереходные металлы более мягкие, имеют более низкую температуру плавления и кипения, более высокую электроотрицательность. Их валентные электроны, с помощью которых они присоединяют другие элементы, располагаются только на внешней электронной оболочке. Элементы группы постпереходных металлов имеют гораздо более высокую температуру кипения, чем металлоиды.
Показать / Скрыть текст
| Постпереходные металлы |
| Алюминий Al 13 |
| Галлий Ga 31 |
| Индий In 49 |
| Олово Sn 50 |
| Таллий Tl 81 |
| Свинец Pb 82 |
| Висмут Bi 83 |
Неметаллы
Из всех элементов, классифицируемых как неметаллы, водород относится к 1-й группе периодической таблицы, а остальные — к группам 13—18. Неметаллы не являются хорошими проводниками тепла и электричества. Обычно при комнатной температуре они пребывают в газообразном (водород или кислород) или твердом состоянии (углерод).
Показать / Скрыть текст
| Неметаллы |
| Водород H 1 |
| Углерод C 6 |
| Азот N 7 |
| Кислород O 8 |
| Фосфор P 15 |
| Сера S 16 |
| Селен Se 34 |
| Флеровий Fl 114 |
| Унунсептий Uus 117 |
А теперь закрепите полученные знания, посмотрев видео про таблицу Менделеева и не только.
Отлично, первый шаг на пути к знаниям сделан. Теперь вы более-менее ориентируетесь в таблице Менделеева и это вам очень даже пригодится, ведь Периодическая система Менделеева является фундаментом, на котором стоит эта удивительная наука.
Лиля Калиде
Просветленный
(27035)
9 лет назад
ИМХО:
смотри столбец инертных.
они в определенных условиях газы.
остальные: чтоб разорвать молекулы до уровня одноатомных газов(а в таблице только одноатомное) -скорее будет плазма, а не газ
Александр Жилинский
Искусственный Интеллект
(166651)
9 лет назад
в нормальных услових?
ну поехали:
H2, He, N2,O2, F2, Ne, Cl2, Ar, Kr, Xe, Rn,
у унуоктия (московия) период полураспада порядка миллисекунды, так что этот “газ” практически сразу “выпадет в осадок” на глазах изумлённой публики..
про плазму я бы поспорил..думаю, что в большинстве случаев газ (не плазму) удастся получить вариацией давления и температуры и чаще просто сильного нагрева будет достаточно.
Источник: школа

Открытие и список инертных газов
Инертные газы относятся к 18-й группе химических элементов периодической таблицы Менделеева. Всего существует 6 элементов, которые имеют следующие названия и формулы:
- гелий (He);
- неон (Ne);
- аргон (Ar);
- криптон (Kr);
- ксенон (Xe);
- радиоактивный радон (Rn).
Они довольно широко представлены во вселенной. По современным подсчетам космическая масса вселенной состоит на 76% из водорода, на 23% из гелия и только 1% приходится на другие элементы.

Водород и гелий ученые относят к элементам первичной материи вселенной. В атмосфере Земли благородных газов около одного процента. В основном это аргон. Их открытие — одна из увлекательнейших страниц истории науки.
Содержание инертных газов в природе:

- В космосе особенно много гелия, образующегося там из водорода в результате термоядерной реакции. После водорода, это самый распространенный элемент. На Земле гелий можно обнаружить в составе природных горючих газов.
- Неон присутствует в атмосфере и в земной коре — 0,00005 г/т.
- Аргон — это самый распространенный на планете инертный газ. (в земной коре его ничтожно мало, а в атмосфере почти один процент).
- Криптон, ксенон и радон обнаруживается в земной атмосфере и в отдельных минералах, содержащих уран.
- Радон относится к радиоактивным элементам, среди всех он один из самых тяжелых, он определяет степень естественной радиоактивности воздуха.
Первым из этих элементов был открыт гелий. В 1868 году его обнаружили в солнечном спектре. В Парижской академии газ назвали гелий или «солнечный». Британский химик Уильям Рамзай открыл гелий и на Земле, но уже после того, как был открыт аргон.
В 1892 году в Лондоне химик Джон Уильям Стретт (лорд Рэлей) опубликовывает обращение к ученым в журнале «Природа». Он обнаружил, что азот, полученный из воздуха, имеет больший вес, чем азот, полученный химическим путем. Как объяснить это явление — задал Рэлей вопрос своим коллегам?
Рамзай высказал предположение: в азоте воздуха содержится неизвестный газ. Два года совместных исследований привели к сенсационным результатам. Был открыт новый газ, он оказался инертным. Он стал называться аргон — «медленный» или «неактивный».
Физические свойства
Менделеев открытие аргона расценивал как испытание периодического закона. Ведь если аргон существует, то он должен стоять на месте калия, однако это противоречило бы закону периодической повторяемости свойств элементов.
Испытание было выдержано с успехом. Открытие гелия на Земле позволило предположить наличие отдельной группы. Из-за инертности газов их выделили в нулевую группу. Рамзай был непоколебимым сторонником периодического закона Менделеева и, опираясь на него, предсказал, а потом уже открыл неон, криптон и ксенон.
Радон был обнаружен в 1900 году, как результат распада радиоактивного радия. Сам он также подвергался дальнейшему распаду. Превращаемость элементов, стала доказанным фактом и новые открытия, обусловленные развитием техники.
Инертные газы имеют следующие физические свойства:
- они не обладают ни цветом, ни запахом;
- их с трудом можно обратить в жидкое состояние;
- с возрастанием поляризуемости молекул от гелия к радону, повышается их способность растворяться в воде;
- они могут легко растворяться в органических растворителях, например, спирте или бензине;
- они способны адсорбироваться на поверхности активированного угля при низких температурах, что дает возможность проводить их очистку и разделение;
- у гелия очень высока способность проникать в другие химические элементы, он может просачиваться сквозь стенки различных сосудов (стеклянных, пластмассовых и некоторых металлических).
При помощи масс-спектрографа у всех инертных газов обнаружены изотопы. В природе у гелия наименьшее количество стабильных изотопов — 2, у ксенона — наибольшее 9. У радона стабильных изотопов не обнаружено.
Строение атомов
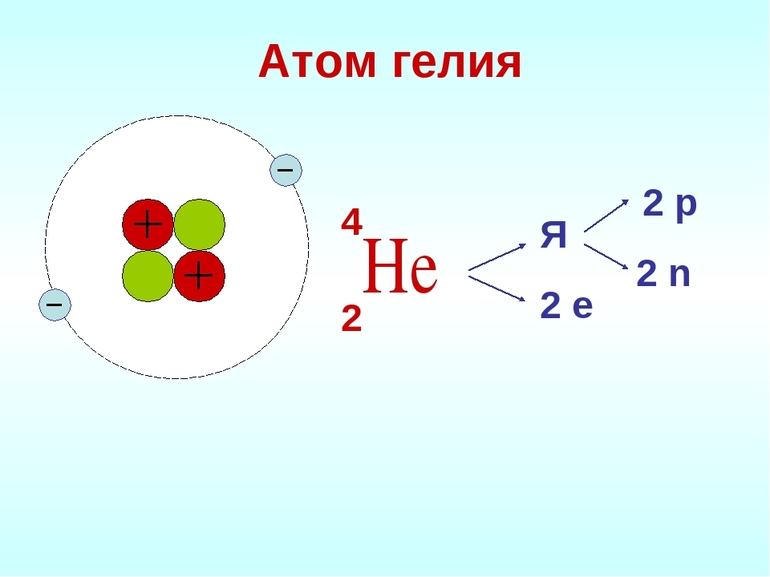
Причина инертности благородных газов в строении атомов. Исследования показали, что у них максимально заполненные энергетические уровни. Гелий обозначается как 1s2 элемент. Он имеет самую прочную структуру атома среди всех химических элементов.
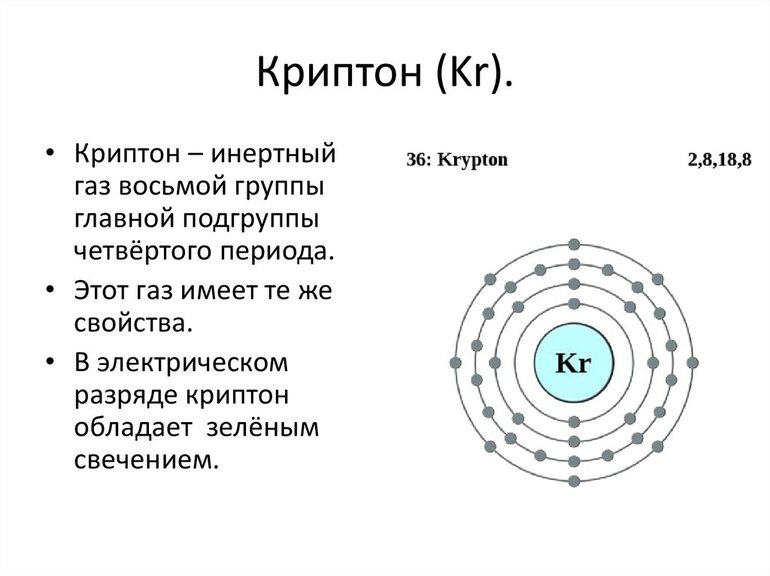
Остальные благородные газы — это p элементы. Электронное строение атома определяет многие свойства этих газов. Их молекулы одноатомные. У них низкая энергия сродства к электрону.
Завершенность внешнего энергетического уровня обусловливает диамагнитность благородных газов. Высокие потенциалы ионизации, также прямое следствие замкнутости и устойчивости электронных оболочек атомов.
С ростом порядкового номера элемента его потенциал ионизации уменьшается. При сравнении видно, что начиная с криптона, у инертных газов ионизационный потенциал уже ниже, чем у кислорода и фтора. Это обусловливает возможность взаимодействия этих элементов.
Опровержение теории химической инертности
По плотности они делятся на легкие: гелий и неон и тяжелые — все остальные. Гелий самый легкий газ в природе, он легче воздуха в 7 раз. Аргон открывает группу тяжелых газов. Жидкий аргон тяжелее не только воздуха, но и воды.

С увеличением поляризуемости от гелия к радону, увеличиваются радиусы атомов, а также возрастает растворимость в воде и абсорбируемость. Газообразный гелий с трудом можно собрать в закрытый сосуд. Аргон, по сравнению с гелием, уже более вязкий. Его можно перелить из сосуда в сосуд. С увеличением атомной массы и радиуса атома у газов уменьшается теплопроводность, повышается температура кипения. Кроме того, увеличивается возможность деформации внешних электронных слоёв, а значит создается предпосылка химической связи.
Для сжижения благородных газов нужны сверхнизкие температуры, особенно для гелия. У жидкого гелия обнаружено уникальное свойство — сверхтекучесть.
Это подтверждается простым опытом. Если погрузить пробирку в сосуд с жидким гелием, то жидкость будет ползти вверх по наружной стенке пробирки и опускаться по внутренней. Если пробирку приподнять, то гелий начинает двигаться в обратную сторону, выравнивая уровни. Когда пробирку вынимают, то гелий продолжает стекать по ней и капать вниз.

Это свойство у гелия открыл советский физик, академик Петр Леонидович Капица. В 1962 году канадский химик Нил Бартлетт, наконец, опроверг теорию химической инертности благородных газов. Ему удалось в процессе гетерогенного катализа синтезировать соединение ксенона с гексафторидом платины (Xe+PtF6=Xe (PtF6)x).
Событие это было также сенсационно, как заявление Рамзая об инертности аргона. Это позволило инертным газам покинуть нулевую группу. Инертные газы в таблице Менделеева справедливо заняли свое место в восьмой группе.
Правда, еще до открытия Бартлетта были получены клатратные соединения тяжелых инертных газов. При относительно высоких давлениях молекулы газов, в этом случае криптона, плотно окружаются молекулами гидрохинона и включаются в них.
В клатратных соединениях связь молекулярная, валентные электроны в них не взаимодействуют. Клатраты нестойкие соединения, в растворах они быстро распадаются на составные части. Их можно использовать как удобные формы для хранения благородных газов.
Фториды и оксиды ксенона
После работ Бартлетта, следующим шагом стали явились опыты по непосредственному соединению ксенона с фтором. Из смеси одного объема ксенона, варьируя условия реакции, получают фториды с различной степенью окисления ксенона. Самый устойчивый из них — тетрафторид ксенона.
Фториды ксенона довольно летучие вещества. Хранят их в тефлоновых сосудах. Они хорошие окислители и фторирующие агенты. Фториды ксенона подвержены гидролизу. В результате реакции образуются оксофториды или оксиды. Триоксид ксенона в сухом виде легко взрывается. Сила взрыва такая же, как у тротила.
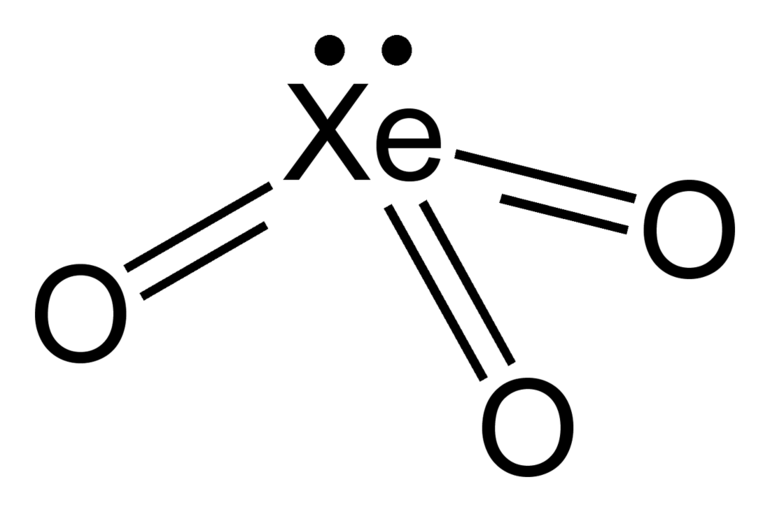
Оксиды обладают кислотными свойствами. При взаимодействии с основаниями образуют соли. Триоксид образует ксенаты. Реакция диспропорционирования ксенатов приводит к образованию перксенатов. Ксенаты являются солями ксенонистой кислоты, а перксенаты — ксеноновой. Ксеноновая кислота, в свою очередь, является производной тетраоксида ксенона.
Оксиды ксенона, так же как и фториды, являются сильными окислителями. При реакции с йодом калия образуется йод и ксенон. Кристаллы дифторида ксенона можно получить, если смесь газов в кварцевой ампуле подвергнуть ультрафиолетовому облучению. Его можно получить также при помощи электрического разряда.
Химия инертных газов — это прежде всего химия ксенона. Это синтезированные и комплексные соединения фторидов, полученные катионные и анионные формы комплексов.
Получение и использование аргона
В промышленности благородные газы получили широкое применение. Наиболее доступный из них — аргон. Его получают из воздуха методом двойной ректификации при низких температурах. Воздух очищают от углекислоты и влаги, сжижают с помощью глубокого холода и подают в ректификационную колонну.

Сравнительно легко выделяют азот, а вот с кислородом труднее. Температура кипения его и аргона близки. Способом двойной ректификации кислород отделяется, и сырой аргон поступает в блок тонкой адсорбционной очистки.
Адсорбция идет на синтетических цеолитах, так называемых молекулярных ситах. Благодаря этому методу аргон получается очень чистым, практически без примеси.
Основная область применения аргона — металлургическая и металлообрабатывающая промышленность. Аргонодуговая сварка очень высокопроизводительна и обеспечивает хорошее качество шва.
Другой способ получения аргона, а также криптона и ксенона основан на методе адсорбции из отходящих газов при синтезе аммиака.
Использование в промышленности гелия и радона
Гелий получают из природных газов, которые предварительно очищаются от примесей и влаги.
Сухой газ, проходя несколько этапов, охлаждается до такой температуры, когда все его компоненты конденсируются в жидкость, лишь гелий остается газообразным. Через верхнюю часть разделительного аппарата он выводится наружу. Налажено производство и жидкого гелия. Он играет большую роль в современной физике и криогенной технике.
В газообразном виде легкий и инертный гелий — идеальный наполнитель для дирижаблей. Благодаря налаженному промышленному получению гелия, идея дирижаблестроения в стране возрождается.
Находят применение и радиоактивные изотопы благородных газов. Радиоизотопы ксенон-133 используется для исследования спинного мозга и кровотока головного мозга. Прибор, регистрирующий радиоактивность, определяет локализацию изотопа ксенона и помогает ставить правильный диагноз.

Радон — радиоактивный газ, он дочерний элемент изотопа радия-226. Используя хорошую растворимость радона в воде, медицина поставила его на службу человека. Растворенный радон диффундирует через кожу и оказывает благотворительное воздействие на центральную нервную систему, а через нее и на другие органы человека. Поэтому широко распространено лечение радоновыми ваннами.
В геологии изотопом аргон-40 определяют абсолютный возраст горных пород по методу советского ученого Герлинга. В основе метода лежит процесс распада радиоактивного изотопа калия-40 с образованием основного изотопа аргона-40.
В электровакуумной промышленности используют свойство инертных газов светиться, если через них пропускать электрический разряд. Промышленность выпускает очень широкий ассортимент газоразрядных источников света.
На основе изучения благородных газов складывался ряд фундаментальных научных законов. Все отчетливее выявляется их значение в познании Земли и космоса.
Вы абсолютно правы.
Данный перенос был произведен без согласия Менделеева. Он был категорически против этого. Его поставили перед выбором, либо перенос, либо ему бы не присвоили звание академика. Он отказался от звания и настаивал на своем до конца, почему и был преследуем до конца жизни.
По мнению некоторых ученных, это было сделано, чтобы повести всю науку по ложному сценарию, что мы и наблюдаем в настоящее время, потому что правильное расположение атомов в корне переворачивает все мировоззрение людей. Даже 2-х валентный Кислород заметьте, находится в современной таблице в 6-ой валентной группе, о чем учителя химии упоминают вскользь, как о некоем несоответствии. Менделеев действительно показал миру таблицу всех веществ, но не успел ее довести до конца, ему просто не позволили этого сделать.
В действительности перенос всех инертных газов был произведен с целью скрыть существование эфира, то есть скрыть существование 2-х атомов, еще легче Водорода.
|
|
1
2
3
4
5
6
7
8
L
8
1
8
2
8
3
8
4
8
5
8
6
8
7
8
8
L
M
8
8
1
8
8
2
8
9
2
8
10
2
8
11
2
8
13
1
8
13
2
8
14
2
8
15
2
8
16
2
8
18
1
8
18
2
8
18
3
8
18
4
8
18
5
8
18
6
8
18
7
8
18
8
L
M
N
8
18
8
1
8
18
8
2
8
18
9
2
8
18
10
2
8
18
12
1
8
18
13
1
8
18
13
2
8
18
15
1
8
18
16
1
8
18
18
8
18
18
1
8
18
18
2
8
18
18
3
8
18
18
4
8
18
18
5
8
18
18
6
8
18
18
7
8
18
18
8
L
M
N
O
8
18
18
8
1
8
18
18
8
2
8
18
32
10
2
8
18
32
11
2
8
18
32
12
2
8
18
32
13
2
8
18
32
14
2
8
18
32
15
2
8
18
32
17
1
8
18
32
18
1
8
18
32
18
2
8
18
32
18
3
8
18
32
18
4
8
18
32
18
5
8
18
32
18
6
8
18
32
18
7
8
18
32
18
8
L
M
N
O
P
8
18
32
18
8
1
8
18
32
18
8
2
8
18
32
32
10
2
8
18
32
32
11
2
8
18
32
32
12
2
8
18
32
32
13
2
8
18
32
32
14
2
8
18
32
32
15
2
8
18
32
32
17
1
8
18
32
32
17
2
8
18
32
32
18
2
8
18
32
32
18
3
8
18
32
32
18
4
8
18
32
32
18
5
8
18
32
32
18
6
8
18
32
32
18
7
8
18
32
32
18
8
L
M
N
O
P
Q
8
18
18
9
2
8
18
19
9
2
8
18
21
8
2
8
18
22
8
2
8
18
23
8
2
8
18
24
8
2
8
18
25
8
2
8
18
25
9
2
8
18
27
8
2
8
18
28
8
2
8
18
29
8
2
8
18
30
8
2
8
18
31
8
2
8
18
32
8
2
8
18
32
9
2
8
18
32
18
9
2
8
18
32
18
10
2
8
18
32
20
9
2
8
18
32
21
9
2
8
18
32
22
9
2
8
18
32
24
8
2
8
18
32
25
8
2
8
18
32
25
9
2
8
18
32
27
8
2
8
18
32
28
8
2
8
18
32
29
8
2
8
18
32
30
8
2
8
18
32
31
8
2
8
18
32
32
8
2
8
18
32
32
8
3
