Определе́ние по́ла, или детермина́ция по́ла, — биологический процесс, в ходе которого развиваются половые характеристики организма. Большинство видов организмов имеет два пола. Иногда встречаются также гермафродиты, сочетающие признаки обоих полов. Некоторые виды имеют лишь один пол и представляют собой самок, размножающихся без оплодотворения путём партеногенеза, в ходе которого на свет появляются также исключительно самки.
Варианты механизмов определения пола[1]
Половое размножение и проявление полового диморфизма широко распространено в различных таксономических группах. Для механизмов полоопределения характерно большое разнообразие, что свидетельствует о неоднократности и независимости возникновения пола в различных таксонах[2].
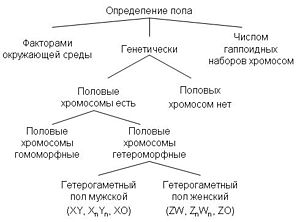
Во многих случаях пол определяется генетически. Генетическая детерминация пола — наиболее распространённый способ определения пола у животных и растений, пол при этом может определяться серией аллелей одного или нескольких аутосомных генов, или детерминация пола может происходить при помощи половых хромосом с пол-определяющими генами (см. Хромосомное определение пола)[2]. При хромосомном определении пола набор половых хромосом у самцов и самок, как правило, разный из-за их гетероморфности, и пол определяется комбинациями половых хромосом: ХY, ZW, X0, Z0. В других случаях пол определяется факторами окружающей среды. Например, у всех крокодилов, некоторых ящериц, черепах, рыб и гаттерии пол зависит от температуры, при которой развивалась особь. У муравьёв, пчёл, ос и некоторых других насекомых существует ещё один механизм: пол зависит от числа хромосомных наборов. Гаплоидные самцы развиваются из неоплодотворённых яиц, а диплоидные самки — из оплодотворённых[1]. Некоторые виды не имеют константного пола и могут менять его под действием внешних стимулов. Детали некоторых механизмов определения пола ещё не полностью ясны.
Следует отличать детерминацию пола от дифференцировки пола. После детерминации пола по какому-либо из упомянутых выше механизмов запускается половая дифференцировка. Этот запуск, как правило, осуществляется главным геном — половым локусом, вслед за ним по каскадному механизму в процесс включаются остальные гены.
Классификация механизмов полоопределения[править | править код]
Половая принадлежность организма может определяться на разных этапах относительно момента оплодотворения, в зависимости от этого выделяют 3 типа определения пола:
- прогамное определение пола осуществляется до оплодотворения в процессе оогенеза, и пол определяется свойствами яйцеклетки, прогамное определение пола встречается у небольшого числа животных (см. Прогамное определение пола);
- сингамное определение пола происходит при оплодотворении, и пол определяется генетически.
- при эпигамном (метагамном) определении пола пол зародыша устанавливается после оплодотворения и зависит от факторов окружающей среды, что может рассматриваться как модификационная изменчивость[3].
Прогамное определение пола[править | править код]
Как писалось выше, прогамное определение пола происходит до оплодотворения, в процессе формирования яйцеклеток. Это имеет место, например, у коловраток. Они образуют яйцеклетки двух сортов: крупные, с двумя наборами хромосом
(диплоидные) и большим объёмом цитоплазмы и мелкие, с одним набором хромосом — гаплоидные. Из гаплоидных неоплодотворённых яиц развиваются гаплоидные самцы, продуцирующие гаплоидные гаметы. Если теперь гаплоидный самец оплодотворит гаплоидное яйцо, то разовьётся самка. Из крупных диплоидных яиц также развиваются самки, но в этом случае они появляются не в результате оплодотворения, а партеногенетически, то есть без оплодотворения. Таким образом, пол особи, развивающейся из диплоидного яйца, определяется ещё на стадии формирования яйцеклетки (на этом этапе закладывается её диплоидность), а пол особи, развивающейся из мелкого яйца, зависит от того, будет оно оплодотворено или нет[4].
Хромосомное определение пола[править | править код]
У растений и животных наиболее распространён хромосомный механизм определения пола. В зависимости от того, какой пол является гетерогаметным, выделяют следующие типы хромосомного определения пола:
- самки гомогаметны, самцы гетерогаметны
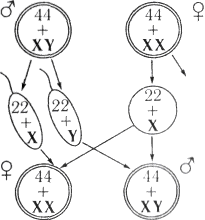
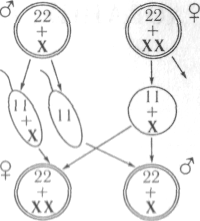
- самки XX; самцы XY
- самки XX; самцы X0
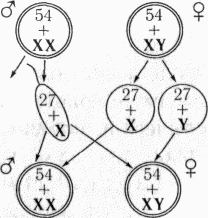
- самки гетерогаметны, самцы гомогаметны
- самки ZW; самцы ZZ
- самки Z0; самцы ZZ
У особей гомогаметного пола ядра всех соматических клеток содержат диплоидный набор аутосом и две одинаковые половые хромосомы, которые обозначаются как XX (ZZ). Организмы такого пола продуцируют гаметы только одного класса — содержащие по одной X (Z) хромосоме. У особей гетерогаметного пола в каждой соматической клетке, помимо диплоидного набора аутосом, содержатся либо две разнокачественные половые хромосомы, обозначаемые как Х и Y (Z и W), либо только одна — X (Z) (тогда количество хромосом получается нечётным). Соответственно у особей такого пола образуются два класса гамет: либо несущие X/Z-хромосомы и Y/W-хромосомы, либо несущие X/Z-хромосомы и не несущие никаких половых хромосом[5].
У многих видов животных и растений гомогаметен женский пол, а гетерогаметен мужской. К ним относятся млекопитающие[6], некоторые насекомые[7], некоторые рыбы[8] и некоторые растения[9] и др.
Гомогаметный мужской пол и гетерогаметный женский имеют птицы, бабочки и некоторые рептилии[10].
Происхождение половых хромосом[править | править код]
Псевдоаутосомный регион на X и Y хромосомах человека (выделен зелёным).
Половые хромосомы могут быть очень сходными, различающимися только небольшим участком (гомоморфными), однако в большинстве случаев половые хромосомы являются гетероморфными. В последнем случае одна из половых хромосом — крупная и богатая генами (X или Z), а другая содержит малое количество генов, протяжённые гетерохроматиновые участки и имеет маленький размер (Y или W)[11]. Гетероморфные половые хромосомы не способны к синапсису и рекомбинации в мейозе, за исключением небольших районов, называемых псевдоаутосомными.
По современным представлениям, половые хромосомы возникли из пары гомологичных аутосомных хромосом. Ключевым событием в трансформации этих хромосом в половые являлось возникновение в них участка, в котором подавлен кроссинговер, то есть на прото-гоносомах появился участок, в котором не происходит рекомбинация. Предположительно данный участок содержал два гена, один из которых определял пол, а второй обладал половым антагонизмом, то есть аллели этого гена противоположно сказывались на приспособленности полов. Участок с «запертым» кроссинговером объединил на Y (W) хромосоме аллели этих двух генов таким образом, что аллель, определяющий гетерогаметный пол, оказался в устойчивой комбинации с аллелем второго гена, который повышал приспособленность этого пола[12][13]. Нерекомбинирующий участок Y (W) хромосомы, как правило, затем расширялся и накапливал со временем мутации в основном за счёт механизма, называемого храповиком Мёллера. Помимо храповика Мёллера в процесс накопления мутаций на Y (W) хромосоме вносили свой вклад также и другие процессы, такие как фоновый отбор[en], эффект Хилла-Робертсона[en] и эффект попутного транспорта[en][14]. Накопление вредных мутаций вело к дегенерации Y (W)-хромосом: они становились более гетерохроматиновыми, генетически инертными, количество функциональных генов у них быстро уменьшалось. При этом вторая хромосома из исходной аутосомной пары, имеющая возможность рекомбинировать с такой же хромосомой у особей гомогаметного пола, сохраняла исходный генный состав.
Сравнительное изучение половых хромосом в группе млекопитающих позволило указать на ещё один механизм, оказавший влияние на морфологию половых хромосом. В 1995 году профессор Дженни Грейвс (Jenny Marshall Graves) из Австралийского национального университета высказала гипотезу, что прото-гоносомы были маленькими и увеличивались за счёт нескольких циклов добавления фрагментов различных аутосом с последующей деградацией этих фрагментов на Y-хромосоме. Согласно этой гипотезе, псевдоаутосомные регионы, которые сохраняют способность к синапсису в профазе I мейоза, представляют собой последние добавленные к гоносомам фрагменты[15].
Общепринятым мнением относительно эволюции половых хромосом XY и ZW в группе амниот у млекопитающих, птиц и змей является то, что они возникли независимо из разных аутосомных пар предковой рептилии, пол которых определялся температурой[16][17]. При этом у млекопитающих развилась XY-система определения пола, а у змей и птиц независимо друг от друга — ZW-система[17].
У млекопитающих одна хромосома из исходной аутосомной пары — теперь Y-хромосома — претерпела мутацию в гене SOX3, в результате чего он превратился в ген SRY, а бывшая аутосома стала определять пол[17][18][19]. После этой мутации участок прото-Y-хромосомы, содержащий SRY, был захвачен внутрихромосомной перестройкой, а именно хромосомной инверсией. Это привело к запрету рекомбинации на этом участке. Из-за отсутствия партнёра для рекомбинации Y-хромосома стала накапливать мутации, и со временем она дегенерировала[17]. Участки Х- и Y-хромосом, сохранившие гомологичность друг другу, известные как псевдоаутосомные области, являются результатом более позднего переноса генетического материала с одной из аутосом на гоносомы[15][20].
Существуют виды, у которых половые хромосомы находится на ранней стадии дифференциации. Например, у рыбки японская медака (Oryzias latipes) половые хромосомы являются гомоморфными за исключением небольшого локуса длиной 258 тыс. п. о., в котором существует запрет на рекомбинацию[21]. Y-хромосома у медаки продолжает в остальных участках обмениваться генами с X-хромосомой[22].
Таким образом, сравнительный анализ половых хромосом в различных таксонах позволяет выделить их основные признаки: гетероморфность, проявляющаяся морфологически и на генетическом уровне; гетерохроматизация Y(W)-хромосом, приводящая к генетической инертности; наличие псевдоаутосомных регионов и района запрета рекомбинации с пол-детерминирующими аллелями; компенсация дозы X(Z)-хромосом. Последовательность эволюционных событий по обособлению Y(W)-хромосом включает следующие этапы: пара аутосом → появление пол-детерминирующих аллелей → появление района запрета рекомбинации → расширение границ района запрета рекомбинации → дегенерация Y(W)-хромосомы[23].
XY-определение пола[править | править код]
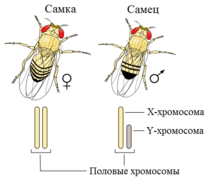
XY-определение пола является наиболее распространённым; такая система определения пола работает у человека, также как и у подавляющего большинства млекопитающих. В этой системе женские особи имеют две одинаковые половые хромосомы XX, а у мужских имеется две различные половые хромосомы X и Y. Пара половых хромосом XY не похожи друг на друга по форме, размеру и генному составу, что отличает их от пар аутосомных гомологов. Половые хромосомы X и Y носят также название «гоносомы». У некоторых видов, в том числе и человека, на Y-хромосоме имеется ген SRY, определяющий мужское начало. У других, например, плодовой мушки (Drosophila melanogaster) пол зависит от соотношения числа Х-хромосом (Х) и наборов аутосом (А). Если оно равно 1, из неё развивается самка, если 0,5 — самец. При промежуточном соотношении (0,67) развиваются интерсексы — нечто среднее между самцами и самками. При соотношении > 1 развиваются метасамки (сверхсамки), при соотношении < 0,5 — метасамцы (сверхсамцы). И сверхсамцы, и сверхсамки слабы и рано погибают. При этом Y-хромосома роли в определении пола не играет, но она необходима для образования спермы[24].
У видов, чья Y-хромосома имеет пол-детерминирующий ген SRY, могут встречаться жизнеспособные особи с кариотипом XXY[25] . У человека при этом развивается синдром Клайнфельтера. У человека пол определяется наличием гена SRY. Когда он активируется, клетки зачатков гонад начинают производить тестостерон и анти-мюллеров гормон, запуская развитие мужских половых органов[25]. У женщин эти клетки выделяют эстроген, направляющий развитие тела по женскому пути. Не все организмы остаются без половых признаков некоторое время после зачатия; например, у плодовых мушек пол определяется почти сразу же после оплодотворения[25]. При определении пола по наличию Y-хромосомы ген SRY — не единственный, влияющий на развитие пола. Хотя SRY и является главным геном, определяющим мужское начало, для развития яичек требуется действие множества генов. У мышей, имеющих систему XY, отсутствие гена DAX1 на Х-хромосоме приводит к стерильности, однако у человека в этом случае развивается Х-связанная врождённая адреналовая гипоплазия[26]. Если же Х-хромосома несёт избыток генов DAX1, то развивается женский пол, несмотря на наличие гена SRY[27]. Также, если организм женского пола имеет две нормальные половые Х-хромосомы, дупликация или экспрессия гена SOX9 приводит к развитию яичек[28][29]. У зрелых самцов мышей возможна постепенная смена пола на женский, если им пересадить ген FOXL2 от самки[30]. Хотя ген DMRT1 содержится в половых локусах птиц, виды с системой XY также зависят от DMRT1, который располагается на 9-й хромосоме, для половой дифференцировки в некоторых точках развития[25].
XY-система определения пола имеется у подавляющего большинства млекопитающих, также как и у некоторых насекомых. Некоторые рыбы также используют варианты этой системы. Например, у пецилии многоцветной (Xiphophorus variatus), помимо пары половых хромосом XY имеется вторая Y-хромосома, обозначаемая как Y’. Благодаря этому появляются самки XY’ и самцы YY’[22]. Некоторые грызуны, например, некоторые полёвковые (Arvicolinae) (полёвки и лемминги) также примечательны своими необычными механизмами определения пола.
В 2004 году учёные из Австралийского национального университета в Канберре обнаружили, что утконос (Ornithorhynchus anatinus) имеет 10 половых хромосом. Соответственно, комбинация XXXXXXXXXX даёт самку, а XYXYXYXYXY — самца. На всех X- и Y-хромосомах утконоса имеются гомологичные псевдоаутосомные районы, благодаря которым X- и Y-хромосомы конъюгируют друг с другом во время профазы I мейоза у самцов. Это приводит к тому, что все половые хромосомы во время профазы I мужского мейоза связаны в единый комплекс, при последующем мейотическом делении они способны к упорядоченной сегрегации. В результате у самцов образуются сперматозоиды, имеющие наборы половых хромосом XXXXX или YYYYY. Когда сперматозоид XXXXX оплодотворяет яйцеклетку, рождаются утконосы женского пола, если сперматозоид YYYYY — утконосы мужского пола. Хотя утконос и имеет XY-систему, его половые хромосомы не обнаруживают гомологов среди половых хромосом плацентарных (Eutheria)[31]. В то же время гомолог половых хромосом плацентарных локализован на 6-й хромосоме утконоса. Это значит, что половые хромосомы плацентарных были аутосомами в то время, когда однопроходные отделились от зверей (Theria) (сумчатых и плацентарных). Однако на X-хромосомах утконоса обнаружены гены, характерные для Z-хромосомы птиц, включая ген Dmrt1, который у птиц, предположительно, играет основную роль в определении пола[32]. В целом геномные исследования показали, что пять половых X-хромосом утконоса имеют участки, гомологичные Z-хромосоме птиц[33]. Для определения конкретного гена, определяющего пол у утконоса, необходимы дополнительные исследования[34]. Для него характерна неполная дозовая компенсация, недавно описанная у птиц. Видимо, механизм определения пола утконоса сходен с таковым у его предков-рептилий.
X0-определение пола[править | править код]
Эта система представляет собой вариант XY-системы. Самки имеют две копии половой хромосомы (XX), а самцы — только одну (X0). 0 означает отсутствие второй половой хромосомы. В этом случае, как правило, пол определяется количеством генов, экспрессируемых на обеих половых хромосомах. Эта система встречается у некоторых насекомых, в том числе кузнечиков и сверчков из отряда прямокрылые (Orthoptera), а также тараканов (Blattodea). У небольшого числа млекопитающих также отсутствует Y-хромосома. К ним относятся мышевидные грызуны Tokudaia osimensis и Tokudaia tokunoshimensis, а также обыкновенная бурозубка (Sorex araneus) из землеройковых (Soricidae). Горная слепушонка (Ellobius lutescens) также имеет форму X0-определения пола, в которой у обоих полов отсутствует вторая половая хромосома[27]. В этом случае механизм определения пола ещё не до конца понятен[35].
У нематоды C. elegans самец имеет одну половую хромосому (Х0); две же половые хромосомы (ХХ) соответствуют гермафродиту[36]. Главным половым геном у неё является XOL, который кодирует белок XOL-1, а также контролирует экспрессию генов TRA-2 и HER-1. Эти гены уменьшают или увеличивают активность мужских генов[37].
ZW-определение пола[править | править код]
ZW-определение пола встречается у птиц, рептилий, некоторых насекомых (бабочек) и других организмов. ZW-система обратна XY-системе: самки имеют две различные половые хромосомы (ZW), а самцы — одинаковые (ZZ). У курицы ген DMRT1 является ключевым полообразующим геном[38]. У птиц гены FET1 и ASW, имеющиеся в W-хромосоме самок, сходны с геном SRY Y-хромосомы[25]. Однако не у всех организмов пол зависит от наличия W-хромосомы. Например, у молей и бабочек самки имеют кариотип ZW, но встречаются также самки Z0 и ZZW[36]. Кроме того, хотя у самок млекопитающих инактивируется одна из Х-хромосом, у самцов бабочек этого не наблюдается, и они образуют вдвое больше нормального количества ферментов, так как имеют две Z-хромосомы[36]. Поскольку ZW-определение пола широко варьирует, до сих пор неизвестно, как именно большинство видов определяют свой пол. Несмотря на сходства между XY и ZW, эти хромосомы возникли раздельно. В случае куриц их Z-хромосома наиболее похожа на человеческую 9-ю хромосому[39]. Куриная Z-хромосома также предположительно является родственной Х-хромосомам утконоса[40]. Когда ZW-виды, например, комодский варан (Varanus komodoensis), размножаются партеногенетически, рождаются только самцы. Это происходит из-за того, что гаплоидные яйца удваивают свои хромосомы, в результате чего получается ZZ или WW. Из ZZ развиваются самцы, в то время как WW нежизнеспособны и не развиваются далее яйца[41].
Вероятно, исходным для бабочек механизмом определения пола был механизм Z0 самка/ZZ самец[42]. Затем, путём хромосомных перестроек, возникла система определения пола WZ самка/ZZ самец, характерная для 98 % видов бабочек. У тутового шелкопряда (система WZ/ZZ) обнаружен отвечающий за развитие женского пола ген Fem в W-хромосоме.
Z0-определение пола[править | править код]
При Z0-системе определения пола мужские особи имеют кариотип ZZ, а женские — Z0. Иными словами, у видов с системой Z0/ZZ определение пола зависит от соотношения числа пар половых хромосом и аутосом. Такое определение пола встречается у некоторых молей[43][44].
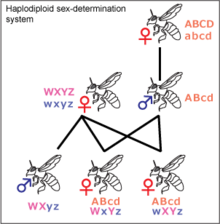
Гаплодиплоидность[править | править код]
Гаплодиплоидное определение пола
Сущность гаплоидиплоидности заключается в том, что генотипы самцов и самок различаются на геномном, а не хромосомном, уровне: гаплоидный организм развивается в самца, а диплоидный — в самку[45]. Гаплодиплоидность встречается у насекомых отряда Перепончатокрылые (Hymenoptera), например, муравьёв и пчёл. Неоплодотворённые яйца развиваются в гаплоидных самцов[45]. Диплоидные особи, развивающиеся из оплодотворённых яиц, как правило, являются самками[45], но могут быть и стерильными самцами. У самцов не может быть отцов и сыновей. Если пчелиная матка спаривается с одним трутнем, её дочери имеют ¾ общих генов, а не ½, как в XY- и ZW-системах. Предполагается, что это имеет важное значение для развития эусоциальности, поскольку это увеличивает роль кин-отбора, но такая точка зрения оспаривается[46]. Большинство самок перепончатокрылых могут выбирать пол своих потомков, сохраняя полученную сперму в сперматеке и выпуская или не выпуская её в яйцевод. Это позволяет им создавать больше рабочих особей в зависимости от состояния колонии[47].
UV-определение пола[править | править код]
Большинство диплоидных организмов позволяют генетически определить пол во время диплоидной фазы (некоторые растения, человек, млекопитающие). Но существуют организмы, у которых пол определяется генетически в гаплоидной фазе (гаметофит) систем определения пола. Хромосомы, содержащие область, определяющую пол, называются половыми хромосомами U и V[48]. В большинстве таких случаев женские особи несут U-хромосому, тогда как мужские несут V-хромосому. U/V-хромосомы относительно распространены среди эукариот и возникали независимо в разных группах эукариот несколько раз в ходе эволюции. Однако в течение многих лет исследования были сосредоточены исключительно на системах XY и ZW, оставляя в значительной степени без внимания U/V-хромосомы и гаплоидное определение пола. Обозначение UV относится к организмам с мужским и женским полом, а не к организмам с изогамным типом спаривания, но это различие несколько искусственно. Например, у зеленых водорослей хромосома, содержащая локус спаривания МТ- у изогамных видов, филогенетически соответствует V-хромосоме, которую несут самцы, а хромосома с локусом МТ+ соответствует U-хромосоме[49].
Эпигамное определение пола[править | править код]
Температурозависимое определение пола[править | править код]
У аллигаторов пол потомства определяется температурой гнезда.
Помимо генетических, существует много других механизмов определения пола. У некоторых рептилий пол определяется температурой, в которой развивалось яйцо в течение температурочувствительного периода. Это явление носит название температурозависимого определения пола (англ. temperature-dependent sex determination (TSD)).
К видам с температурозвисимым определением пола относятся все крокодилы, большинство черепах, некоторые виды ящериц[50], а также гаттерии[51]. Обычно при низких температурах (ниже 27 ºС) из яиц вылупливаются особи одного пола, при высоких (выше 30 ºС) — другого, и только в небольшом промежуточном интервале — особи обоих полов. Так, у черепах при низких температурах появляются только самцы, у ящериц — только самки. Существуют отклонения от этой схемы. У каймановой черепахи при температурах от 20 до 30 ºС преобладают самцы, за пределами этого интервала — самки[50]. Эти температурные пороги обозначаются как порог I и порог II соответственно. Температуры, необходимые для развития каждого пола, называются женскими и мужскими благоприятствующими температурами (англ. the female and the male promoting temperature)[52] .
У миссисипского аллигатора только самки рождаются при температуре ниже 30 ºС, только самцы — при температуре выше 34 ºС. Температура в гнезде, однако, зависит от его месторасположения. В гнёздах, устроенных на береговом валу, температура обычно выше (34 и более ºС), во влажных маршах — ниже (30 и менее ºС)[50][53]. Кроме того, температура может быть различной в верхней и нижней части гнезда.
Температурная детерминация пола происходит в определённый период эмбрионального развития. У каймановой черепахи это средняя треть инкубационного периода[50], у миссисипского аллигатора — период между 7 и 21 сутками инкубации[53].
Существует гипотеза, что температурная детерминация пола была характерна для динозавров, что явилось одним из фактором их вымирания при изменении климата в ареале[53].
Среди птиц не обнаружено температурозависимого определения пола (это относится и к сорным курам (Megapodiidae), у которых, как раньше считалось, имеет место этот феномен, но на самом деле от температуры зависит смертность их зародышей)[51].
Температурная зависимость пола обусловлена синтезом в организме различных ферментов. Виды, определение пола у которых зависит от температуры, не имеют гена SRY, но имеют другие гены, например, DAX1, DMRT1 и SOX9, которые экспрессируются или не экспрессируются в зависимости от температуры[52]. У некоторых видов, например, нильской тилапии (Oreochromis niloticus), некоторых сцинковых (Scincidae) и агамовых (Agamidae) пол определяется хромосомами, но впоследствии он может быть изменён при воздействии на яйца определённых температур[22]. Эти виды, вероятно, находятся на промежуточном этапе эволюции.
Неизвестно, как именно проходило развитие температуро-зависимого определения пола[54]. Возможно, оно появилось у тех полов, которые были приурочены к определённому ареалу, удовлетворявшему их температурным требованиям. Например, тёплые районы хорошо подходили для гнездования, так что в них рождалось больше самок, чтобы повысить число гнездований в следующем сезоне. Однако эта версия — пока всего лишь гипотеза[54].
-
Температурная детерминация пола у некоторых видов черепах
-
Температурная детерминация пола у некоторых видов ящериц
Другие системы определения пола[править | править код]
В то время как температурное определение пола распространено относительно широко, существует много других систем определения пола, зависящих от факторов окружающей среды. Некоторые виды, например, некоторые улитки, практикуют смену пола: изначально взрослая особь имеет мужской пол, затем становится самкой[55]. У тропических рыб-клоунов (Amphiprioninae) доминирующая особь в группе становится самкой, в то время как другие особи являются самцами[56]. У талассомы синеголовой (Thalassoma bifasciatum) пол также может меняться[56]. У морского червя эхиуриды Bonellia viridis личинка становится самцом, если она попадёт на хоботок или тело самки, и самкой, если она попадёт на дно. Направление развития личинки, попавшей на самку, по мужскому пути вызывается химическим веществом, выделяемым кожей самки, — бонеллином[57]. Самцы и самки Bonellia viridis имеют одинаковый генотип, но при этом у них имеет место крайне выраженный половой диморфизм — самцы паразитуют в половых протоках самки, выполняя свою единственную функцию — оплодотворение яйцеклеток[58].
У некоторых видов, однако, вовсе нет системы определения пола. Такие животные, как дождевой червь и некоторые улитки, являются гермафродитами[55][56]. Небольшое число видов рыб, рептилий и насекомых размножаются партеногенезом и все являются самками. Существуют рептилии, например, обыкновенный удав (Boa constrictor) и комодский варан, которые могут размножаться половым путём, если есть возможность спаривания, и партеногенезом в противном случае[59]. В случае обыкновенного удава партеногенетическое потомство может быть представлено как самками, так и самцами. У некоторых членистоногих пол может определяться инфекцией, а именно бактерией Wolbachia, способной изменять пол заражённого животного[8]. Некоторые виды целиком состоят из особей ZZ, и пол определяет присутствие Wolbachia[60].
Некоторые другие механизмы определения пола описаны ниже:
| Организм | Фото | Систематическое положение |
Механизм определения пола |
|---|---|---|---|
| Данио-рерио (Danio rerio) |  |
Класс Лучепёрые рыбы (Actinopterygii), отряд Карпообразные (Cypriniformes) | На начальных этапах развития — мальковый гермафродитизм, механизм дальнейшего определения пола неизвестен[22]. |
| Обыкновенная пецилия (Xiphophorus maculatus) |  |
Класс Лучепёрые рыбы (Actinopterygii), отряд Карпозубообразные (Cyprinodontiformes) | Имеются половые хромосомы X, Y и W. При этом WY, WX и XX — самки, а YY и XY — самцы[22]. |
| Зелёный меченосец (Xiphophorus hellerii) |  |
Класс Лучепёрые рыбы (Actinopterygii), отряд Карпозубообразные (Cyprinodontiformes) | Способны менять пол. Присутствие более развитого самца вызывает созревание самок и подавляет созревание молодых самцов вблизи него[61][62]. |
| Обыкновенная менидия (Menidia menidia) |  |
Класс Лучепёрые рыбы (Actinopterygii), отряд Атеринообразные (Atheriniformes) | Нерестятся с марта по июль. Если личинки развиваются при низкой температуре, то большинство особей становится самками. Если личинки развиваются при высокой температуре, то большинство особей становится самцами[63]. |
| Золотистый спар (Sparus aurata) |  |
Класс Лучепёрые рыбы (Actinopterygii), отряд Окунеобразные (Perciformes) | Молодые рыбы сначала нерестятся как самцы, в дальнейшем они могут менять пол на женский (протандрический гермафродитизм)[64]. |
| Хирономус (Chironomus) (на фото — Chironomus plumosus) |  |
Класс Насекомые (Insecta), отряд Двукрылые (Diptera), семейство Комары-звонцы (Chironomidae) | У Chironomus нет половых хромосом как таковых, а политенные хромосомы одинаковы у самцов и самок и содержат участок, предположительно соответствующий Y-хромосоме. Пол же определяется сложным взаимодействием мужских и женских генов с участием генов-регуляторов[65]. |
| Бугорчатая лягушка (Rana rugosa) |  |
Отряд Бесхвостые (Anura) | Этот вид, обитающий в Японии, представлен двумя географически разобщёнными популяциями. В одной из этих популяций имеется XY-система определения пола, а в другой — ZW[66]. Считается, что ZW-система у этой лягушки возникла дважды и независимо[66]. |
| Северная лейопельма (Leiopelma hochstetteri) |  |
Отряд Бесхвостые (Anura) | Эндемик Новой Зеландии. Самцы имеют 22 аутосомы, а самки 22 аутосомы и одну W-хромосому. Эта W-хромосома крупнее аутосом, и количество гетерохроматина в ней варьирует в разных популяциях[67]. В одной популяции W вообще не найдена, и многие учёные рассматривают данную W-хромосому скорее не как половую, а как дополнительную В-хромосому, сохраняющуюся в кариотипе благодаря повышенной вероятности попадания в яйцеклетку и на которую случайно оказался перенесён ген-триггер пола. По другой версии, северная лейопельма просто утратила W-хромосому[67]. Как бы то ни было, такой механизм определения пола уникален среди животных[67]. |
| Пауки (Araneae) (на фото — Araneus diadematus) |  |
Класс Паукообразные (Arachnida) | Y-хромосом нет, но зато имеется (в наиболее частом случае) две пары негомологичных Х-хромосом[68]. |
| Австралийская ехидна (Tachyglossus aculeatus) |  |
Отряд Однопроходные (Monotremata) | Как и у утконоса, у ехидны нет гена SRY, определяющего мужское начало у зверей, а гомолог человеческой X-хромосомы локализован в 16-й хромосоме ехидны[69]. У ехидны имеется 9 половых хромосом: 5 Х-хромосом и 4 Y-хромосом (Y-хромосомы имеются только у самцов). В профазе первого деления мейоза у ехидны образуется не 4 бивалента XY и один унивалент X, как можно было предположить, а единственный унивалент, хромосомы в котором конъюгируют по цепочке[70]. Это возможно потому, что плечи пяти Х и четырёх Y-хромосом гомологичны друг другом «со сдвигом» на одно плечо. |
Растения[править | править код]
В настоящее время считается, что системы определения пола у растений возникали множество раз и в относительно недавнее время от гермафродитных предков (в том числе и однодомных растений с раздельнополыми мужскими и женскими цветками), то есть двудомные растения возникли от однодомных и растений с гермафродитными цветками[9]. Свидетельством этому может быть то, что, например, у некоторых двудомных растений, имеющих предков с гермафродитными цветками, в однополых цветках имеются рудименты половых органов противоположного пола. О том, что двудомность возникла недавно и независимо у различных групп растений, говорит её низкая распространённость и наличие у различных таксономически разобщённых групп растений. Системы половых хромосом у растений также возникали несколько раз в течение эволюции цветковых растений. В ходе неё возникло множество генов, определяющих пол, в том числе факторы мужской и женской стерильности, причём эти гены могут быть локализованы не только в ядре, но и в цитоплазме (например, у кукурузы известно явление цитоплазматической мужской стерильности). Помимо цветковых, у других растений, например, мхов, также представляют интерес независимо появившиеся половые хромосомы[71].
В отличие от большинства животных, проявление генетического определения пола у растений может в значительной мере изменяться под действием различных факторов внешней среды. Поэтому процесс формирования пола у растений подвержен большим колебаниям в процессе онтогенеза, чем у животных. Под действием различных факторов может происходить даже полное переопределение пола. Это связано с регуляторными процессами, обусловленными действием условий внешней среды, и внутренними изменениями метаболического характера[72].
Генетическое определение пола у растений[править | править код]
Половые хромосомы растений[править | править код]
Сцепленное с полом наследование и половые хромосомы растений удивительно похожи на таковые у животных, только различия между половыми хромосомами у растений выражены не так чётко, как у животных[72]. В подавляющем большинстве случаев гетерозиготными являются мужские особи, или, если между половыми хромосомами имеются видимые различия, гетерогаметными (примерно у половины растений имеется разделение между полами[73]). Есть, однако, и исключения: например, у земляники (Fragaria) и некоторых других цветковых гомогаметный пол — мужской[74]. Мужской генотип в случае гетерогаметного мужского пола должен содержать доминантный супрессор женской фертильности — SuF. Тогда, если гомозиготы по SuF жизнеспособны, при самоопылении будет наблюдаться расщепление 3:1 (мужские особи : женские особи), в противном случае расщепление будет 2:1[9].
Так же, как и у животных, у растений хромосомы Х и Y неспособны к рекомбинации. Это предотвращает рекомбинацию между половыми локусами, поскольку рекомбинация может привести к появлению дефектных, вплоть до полностью стерильных, особей. Предполагается, что причиной сближения половых локусов (частота кроссинговера пропорциональна расстоянию между локусами) могли быть инверсии и/или транслокации[9].
Эволюция половых хромосом растений тесно связана с дегенерацией Y-хромосомы. Поскольку, по сравнению с животными, Y-хромосома растений появилась относительно недавно, мы имеем возможность пронаблюдать на их примере ранние этапы дегенерации Y-хромосомы. Впрочем, у некоторых растений эволюция Y-хромосомы ещё только начинается, а сам факт дегенерации этой хромосомы является спорным, но в наиболее изученных на данный момент случаях, в самом деле, показана некоторая дегенерация. Например, у щавеля кислого (Rumex acetosa) Y-хромосома состоит из гетерохроматина[75][76][77]. С другой стороны, показана некоторая транскрипционная активность этой хромосомы[75], возможно, из-за наличия рассеянных транскрибируемых элементов вроде транспозонов, так что в обеспечении активных физиологических процессов щавеля она практически не участвует. Имеются не до конца проверенные данные о высокой частоте хромосомных перестроек[78] и вариабельности в строении Y-хромосомы этого вида[79], которые неизбежно приводят к потере части генетического материала, как у Y-хромосомы животных. В некоторых случаях мутации в Х-хромосоме щавеля кислого не покрываются Y-хромосомой[80], демонстрируя тем самым классическое сцепленное с полом наследование, наблюдаемое у некоторых животных. Иными словами, Y-хромосома гемизиготна по части генов, локализованных в Х-хромосоме. Этот факт также говорит о том, что Y-хромосома утратила часть генов, присущих её бывшему гомологу — Y-хромосоме. Наконец, у большинства изученных видов гомозиготы YY нежизнеспособны, хотя и здесь есть исключения. Однако самым основным положением, говорящим о дегенерации Y-хромосомы, говорит отсутствие рекомбинации между ней и Х-хромосомой. Так что если у растений, как и у животных, Y-хромосома в самом деле дегенерирует, то можно говорить о всеобъемлющем характере этого процесса[9].
Генетические механизмы определения пола у растений[править | править код]
Генетические механизмы определения пола у растений очень разнообразны[81], в них вовлечены как половые хромосомы, так и аутосомы.
В нижеследующей таблице приведены примеры различных механизмов определения пола у растений[74]:
| Растение | Фото | Систематическое положение |
Механизм определения пола |
|---|---|---|---|
| Сферокарпус (Sphaerocarpus) | Отдел Печёночные мхи (Marchantiophyta) | Мужской гаметофит 7А + Y, женский 7A + X. После оплодотворения зигота и развивающийся из неё диплоидный спорофит содержит 14А + XY или 14А + XX у мужских и женских особей соответственно[82]. | |
| Ceratopteris richardii | Отдел Папоротниковидные (Pteridophyta) | Равноспоровый папоротник. Споры никак не отличаются друг от друга, и потенциально каждая из них может развиться в мужское, на котором формируются только антеридии, или гермафродитное (однодомное) растение, имеющее как антеридии, так и архегонии. Половая принадлежность споры определяется феромоном ACE (от англ. antheridiogen Ceratopteris), выделяемым однодомным растением, растущим рядом с местом попадания споры в землю (он направляет развитие по мужскому пути, в его отсутствие развивается гермафродитное растение)[81]. | |
| Переступень двудомный (Bryonia dioica) |  |
Семейство Тыквенные (Cucurbitaceae) | Двудомное растение с XY-определением пола и гомоморфными половыми хромосомами[83]. Наличие Y-хромосомы определяет развитие мужского организма. |
| Папайя (Carica papaya) |  |
Семейство Кариковые (Caricaceae) | Имеется две Y-хромосомы: одна определяет развитие мужского организма (Y), другая — обоеполого (Yh[84]). Гомозиготы по любой Y-хромосоме нежизнеспособны[84]. |
| Смолёвка белая (Silene latifolia) |  |
Семейство Гвоздичные (Caryophyllaceae) | Пол зависит не только от наличия половых хромосом, но и от активности их отдельных участков. Y-хромосома содержит участки I—IV, а Х-хромосома — V—VI. Участок I блокирует развитие плодолистиков, и при его инактивации по тем или иным причинам формируется гермафродитный цветок. Участки II—IV этой хромосомы предположительно отвечают за развитие пыльников и пыльцевых зёрен. Участок V X-хромосомы определяет развитие женских частей цветка. Y-хромосома высокоактивна, поэтому особи XXXY имеют только мужские цветки, и только у XXXXY образуются гермафродитные цветки. Кроме того, у женских растений, поражённых грибком Ustilago violacea, возможна смена пола на мужской[85]. |
| Спаржа лекарственная (Asparagus officinalis) |  |
Семейство Спаржевые (Asparagaceae) | Мужские особи могут иметь генотипы XY и YY, так что у спаржи гены, содержащиеся в Х-хромосоме, не являются жизненно важными. Мужской пол в данном случае ведёт себя как обычный доминирующий признак, давая в F2 расщепление 3:1[86]. |
| Бешеный огурец (Ecballium elaterium) |  |
Семейство Тыквенные (Cucurbitaceae) | Пол определяется тремя аллелями одного гена: aD > a+ > ad. aD обусловливает мужской пол, a+ — гермафродитизм, ad — женский пол[87]. |
| Щавель воробьиный (Rumex acetosella) |  |
Семейство Гречишные (Polygonaceae) | Y-хромосома неактивна, пол определяется соотношением аутосом и Х-хромосом[88]. |
Факторы внешней среды[править | править код]
Как отмечалось выше, факторы внешней среды имеют исключительное значение для определения пола у растений. Замечено, что определённые факторы вызывают феминизацию (женскую сексуализацию) или маскулинизацию (мужскую сексуализацию). Особенно сильна действие феминизирующих факторов у двудольных. Эти факторы приведены в следующей таблице[74][72]:
| Факторы, усиливающие феминизацию | Факторы, усиливающие маскулинизацию |
|---|---|
| Низкие температуры | Высокие температуры |
| Соединения азота в почве | Соединения калия в почве |
| Коротковолновый свет | Длинноволновый свет |
| Высокая влажность | Низкая влажность |
| Цитокинины, ауксины[89], этилен | Гиббереллины |
| Обработка окисью углерода (СО) | Отсутствие СО |
Уровень фитогормонов в растении определяется не только действием внешней среды, но и коррелятивными взаимосвязями между органами растения, поэтому удаление тех или иных органов растения также оказывает влияние на формирование пола. Например, удаление корней у конопли и шпината способствовало увеличению числа мужских растений, а удаление листьев способствовало возрастанию количества женских особей[72].
Действие некоторых фитогормонов определяют следующим. Цитокинины, образующиеся в корнях, передвигаясь в апекс, включают программу, обусловливающую проявление женского пола (пестичные цветки), тогда как гиббереллины, образующиеся в листьях, включают программу, связанную с маскулинизацией (тычиночные цветки)[72].
Одноклеточные эукариоты[править | править код]
Протисты (а также одноклеточные организмы, относимые к другим царствам) в основном размножаются бесполым путём, переходя на половое размножение лишь в неблагоприятных условиях. Кроме того, гаметы как таковые (яйцеклетки и сперматозоиды) образуют далеко не все одноклеточные, и только у них можно говорить о поле в типичном понимании (женский пол образует яйцеклетки, мужской — сперматозоиды). Чаще же вместо гамет сливаются вегетативные клетки, а у инфузорий обмен генетической информацией между особями осуществляется и вовсе без слияния вегетативных клеток. Установлено, что часто каждая вегетативная клетка сливается не с любой другой вегетативной клеткой, а лишь с клетками определённых типов. Поэтому в этом случае говорят не о поле клеток, а о типах спаривания, или половых типах[90]. Иногда среди них выделяют мужской тип, являющийся донором генетической информации, и женский тип — реципиент генетической информации донора.
Простейшие[править | править код]
Наиболее известным примером полового процесса у простейших является конъюгация у инфузорий. У простейших система половых типов может быть как биполярной (например, у инфузории Paramecium aurelia, причём противоположные половые типы наследуются как рецессивный (rr) и доминантный (Rr, RR) и контролируются аллелями одного гена). Помимо этого, возможны тетраполярная система, контролируемая двумя генами (Paramecium bursaria), а также октополярная, контролируемая тремя генами (различие хотя бы по одному из трёх генов определяет отдельный половой тип). Известны также случаи множественных половых типов, при этом в половой тип может определяться как несколькими генами, так и несколькими аллелями одного гена, доминирующими друг над другом. Так, у инфузории Tetrahymena thermophila семь типов спаривания, а у Euplotes — 12[91]. В половой процесс могут вступить только клетки различных половых типов[92].
Недавно был описан молекулярный механизм определения типа спаривания у Tetrahymena thermophila. Как писалось выше, у неё существует 7 половых типов, и для каждого из них существует специфичная кассета, содержащая MT-гены (МТА и МТВ) — гены, кодирующие «белки спаривания» (МТ-белки). В микронуклеусе каждой инфузории присутствуют все семь кассет, но только в одной из них, соответствующей типу спаривания инфузории, имеются гены, отвечающие за закрепление МТ-белков на мембране. Из других кассет они необратимо удаляются[93].
Если в микронуклеусе в том или ином виде имеются все 7 кассет, то в макронуклеусе присутствует лишь одна кассета, соответствующая половому типу инфузории. Остальные кассеты целиком исключаются. Механизм этого исключения предположительно заключается в следующем. Недостающий участок ДНК, определяющий закрепление MT-белка на мембране, передаётся от кассеты к кассете в ходе гомологичной рекомбинации или просто негомологичного соединения концов. Кассеты, отдающие недостающий участок, при этом вырезается. Процесс длится до тех пор, пока не останется одна кассета[93].
У некоторых амёб описано явление паракопуляции, при котором объединяются две многоядерные особи, полностью сливаются и позже разделяются на две. Генетика этого процесса ещё не изучена[94].
Дрожжи[править | править код]
Расположение неактивных локусов HML и HMR и активного MAT на хромосоме III
У дрожжей S. cerevisiae вегетативные почкующиеся клетки гаплоидны и представляют собой аскоспоры, при половом процессе образуется зигота, которая делится мейозом. Установлено, что у S. cerevisiae есть гены HMR и HML, определяющие тип спаривания a и α соответственно. Они находятся в разных локусах III хромосомы. Оба они неактивны. Тип спаривания же определяется аллелью локуса МАТ — МАТa или МАТα. Спариваться могут только клетки с разными типами спаривания. Это взаимодействие обеспечивается специфичными феромонами, привлекающими только клетки противоположных типов спаривания друг к другу. При первых делениях аскоспоры происходит реверсия пола — замена гена на другой в МАТ-локусе путём направленной специфичной внутрихромосомной конверсии. Эта конверсия регулируется продуктом гена НО — сайт-специфической эндонуклеазой, которая осуществляет разрыв в локусе МАТ, вырезая находящуюся в нём аллель. В образовавшийся разрыв один из двух неактивных локусов — HMR или HML — и посылает свою копию вместо вырезанного аллеля MAT. Такое переключение пола осуществляется по типу кассетного механизма («кассетами» служат молчащие локусы HMR или HML). Он был предложен в конце 70-х гг. XX в. А. Херсковицем, Дж. Хиксом и Дж. Стразнером[95].
Информация, заключённая в кассетах, не экспрессируется в гаплоидных клетках из-за наличия специальных последовательностей — глушителей (сайленсеров), влияющих на характер компактизации хроматина в кассетах. Глушители контролируются специальными генами SIR, локализованными в других хромосомах. Возле локуса MAT глушителей нет[95].
С аллеля MATα (а также копии HML в локусе MAT) считываются (за счёт альтернативного сплайсинга) два белка — α1 активирует гены, необходимые для развития фенотипа α-типа спаривания; белок α2 подавляет гены, необходимые для развития типа спаривания а. При отсутствии белка α2 развивается тип спаривания а. Аллель МАТa кодирует синтез белка a1, ответственного за проявление типа спаривания a.
В зиготе есть и МАТа, и МАТα. В ней с МАТа считывается белок а1. Он подавляет транскрипцию мРНК белка α1 (поэтому признаки типа спаривания α у зиготы отсутствуют). Белок же α2 продолжает считываться (поэтому фенотип типа спаривания а тоже не развивается). В результате зигота беспола, она не сливается с другими клетками и не выделяет феромонов[96]. Совместное действие белков а1 и α2 включает гены, необходимые для прохождения мейоза и образования спор.
Подобный кассетный механизм был обнаружен и у другого вида дрожжей — Schiz. pombe[95]. Похожие механизмы определения пола действуют у некоторых базидиомицетов[97], однако у них имеется множество аллелей, ответственных за половой тип, а не только два, и число типов спаривания доходит нескольких тысяч[98].
Водоросли[править | править код]
Различные формы изогамии: A) изогамия подвижных гамет, B) изогамия неподвижных гамет, C) конъюгация
Различные типы анизогамии (гетерогамии) в зависимости от подвижности и размеров гамет
Водоросли представляют собой достаточно разнообразную группу растительных организмов, среди них есть как многоклеточные, так и одноклеточные представители. Половые процессы, имеющее место у водорослей, также разнообразны: изогамия, анизогамия (гетерогамия), оогамия, хологамия и конъюгация[99]. Только в случае оогамии можно говорить о поле, поскольку только при этом процессе сливающиеся гаметы заметно различаются как по размерам, так и форме. В остальных же случаях наиболее применимо понятие «тип спаривания»: наиболее примитивный тип полового процесса — хологамия — заключается в слиянии не специализированных половых клеток, а обычных вегетативных[99]; при изогамии сливаются одинаковые внешне гаметы, но различных типов спаривания (противоположные типы спаривания обозначают «+» и «-»); анизогамия сопровождается слиянием одинаковых по структуре, но различных по размерам гамет (иногда более крупную гамету именуют женской, а более мелкую — мужской)[100]. Наконец, конъюгация сопровождается слиянием содержимого двух внешне сходных вегетативных клеток[101].
Наиболее изученной водорослью, чей половой процесс протекает в форме изогамии, является хламидомонада Chlamydomonas reinhardtii. Её жизненный цикл включает несколько этапов, причём редукция числа хромосом происходит при первом делении зиготы, то есть вегетативные клетки гаплоидны[102].
Тип спаривания вегетативной клетки определяется наличием у неё одной из двух аллелей локуса MT, ответственного за тип спаривания. Различают аллели MT+ и MT–, определяющие тип спаривания «+» и «-» соответственно. У обоих типов спаривания локус MT претерпел несколько крупных инверсий и транслокаций, препятствующих возможной рекомбинации в этом локусе. Вдобавок к перестройкам, MT+ содержит 3 участка ДНК и два тандемно повторяющихся гена (Ezy2 и OTU2), отсутствующих в MT–. В то же время MT– тоже содержит 3 участка, отсутствующих в MT+. Гены, содержащиеся в регионах FUS1, MTD1 и MID, обусловливают специфичные функции локуса MT при гаметогенезе и оплодотворении[102].
После оплодотворения и завершения кариогамии, то есть слияния ядер, в новой зиготе запускаются специфичные для зиготы гены, благодаря активности которых хламидомонада переживает неблагоприятные условия (а к половому размножению хламидомонада переходит только при ухудшении условий внешней среды, точнее, при понижении содержания азота во внешней среде), в частности, новая зигота окружается плотной клеточной стенкой. При улучшении условий зигота делится мейозом, давая начало четырём гаплоидным вегетативным клеткам[102].
Подобный механизм определения пола (на основе локуса MT) встречается и у видов, имеющих другие формы полового процесса — анизогамию и оогамию. В частности, это касается родственников хламидомонады — вольвоксовых водорослей[103]: гониума[104], вольвокса[105], пандорины[106], эвдорины и др. Однако если у хламидомонады имеется достаточно примитивная форма полового процесса[100], то в дальнейшем её изогамия эволюционирует в анизогамию[100] пандорины. Наконец, у вольвокса имеется наиболее высокоорганизованная форма полового процесса — оогамия[103].
Грибы[править | править код]
Хотя у большинства организмов имеется только два различных половых типа, среди грибов имеются представители, число типов спаривания у которых доходит до нескольких тысяч. Установлено, что у грибов имеется две основных системы половых типов: биполярная и тетраполярная. В случае биполярной системы половой тип определяется единственным локусом MAT, имеющем две альтернативные формы — a и α (их называют идиоморфами). Виды с биполярной системой обнаружены среди аскомицетов, базидиомицетов и зигомицетов, что доказывает то, что именно эта система явилась предковой для тетраполярной. У многих базидиомицетов имеется тетраполярная система, при которой имеется два несвязанных локуса, определяющих тип спаривания. Один локус кодирует гомеодоменные транскрипционные факторы, а другой отвечает за феромоны и рецепторы к феромонам. Для совместимости двух организмов оба эти локуса должны различаться, поэтому отдельный тип спаривания может быть несовместим не только с самим собой, как у инфузорий, но и с некоторыми другими типами спаривания (например, у навозника (Coprinus) возможно 48 совместимых вариантов и 16 несовместимых)[107]. У многих видов эти локусы имеют множество аллелей, благодаря чему у них имеются тысячи половых типов. Во многих независимых случаях происходил переход от тетраполярной системы к биполярной, в некоторых случаях из-за слияния двух несвязанных половых локусов в один участок. Возможно, это иллюстрирует то, что эволюционный отбор ограничивает число половых типов/полов до двух[108].
У многих описанных на данный момент грибов половой процесс не описан (их относят к группе несовершенных грибов). Тем не менее, у многих из них показано наличие локуса типа спаривания и механизм, необходимый для спаривания и мейоза. В некоторых случаях, кроме этого, выявлено равное распространение противоположных типов спаривания в природе и доказана рекомбинация. Поэтому, вероятно, существует небольшая группа действительно бесполых грибов, у многих же (и, возможно, большинства) половой процесс протекает скрытно и его ещё предстоит описать[108].
Бактерии[править | править код]
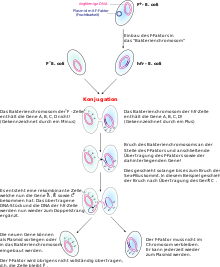
Схема конъюгации у бактерий между F+– и F–-клетками
Схема конъюгации между клетками Hfr и F–
Конъюгацией у бактерий называется непосредственный контакт между клетками бактерий, сопровождаемый переносом генетического материала из клеток донора в клетки реципиента. Клетки донора при этом называют мужскими и обозначают F+, реципиент же называют женской клеткой (F–)[109].
Установлено, что за перенос генетического материала у E. coli ответственна F-плазмида. Имеющие её клетки, то есть мужские клетки, имеют несколько изменённый фенотип: на их поверхности имеются так называемые половые пили, по-видимому, необходимые для удержания клеток вместе во время конъюгации[110]. Кроме того, на половых пилях адсорбируются некоторые бактериофаги[111], так что вместе с половой плазмидой клетка получает и устойчивость к ним.
При конъюгации реципиент получает только одну цепь плазмиды, которую впоследствии и донор, и реципиент достраивают до двойной цепи[109].
F-плазмида может интегрировать в бактериальную хромосому. При этом образуются так называемые клетки Hfr (англ. High frequency recombination). При их конъюгации с клетками F– F-плазмида очень редко передаётся реципиенту и он сохраняет свойства F–-клетки, но зато он получает значительную долю (а в некоторых случаях — и целый геном) генов клетки Hfr. Это повышает частоту появления рекомбинантов и делает Hfr высокоэффективным донором[109].
Интегрированная плазмида может исключаться из хромосомы, вновь давая клетки типа F+. Но в некоторых случаях подобное вырезание происходит с ошибкой, и тогда участок собственно бактериальной хромосомы замечает участок фактора F. При этом образуется F’-(F-прим) фактор, который может переносит бактериальные гены независимо от хромосомы, но вместе с F-плазмидой. Это явление называется сексдукцией[109].
Описанные выше процессы приводят к рекомбинации генетического материала у прокариот, что может повышать, например, их устойчивость к антибиотикам и приводить к появлению новых фенотипических свойств у клеток, ранее их не имевших.
Определение пола у млекопитающих и человека[править | править код]
У млекопитающих, в том числе и человека, развитие мужского организма невозможно без наличия Y-хромосомы, то есть прежде всего половая принадлежность у человека определяется сочетанием половых хромосом в его кариотипе. Однако установлено, что для развития организма мужского пола недостаточно только наличия гена SRY на Y-хромосоме, который определяет дифференцировку мужских половых желёз и синтез ими тестостерона. Ткани-мишени, на которые действует тестостерон, должны быть чувствительны к нему. Для этого необходим белок-рецептор, являющийся продуктом особого гена, локализованного в Х-хромосоме (локус Xq11-Xq12)[112]. Он обеспечивает проникновение гормона в клетки нужных тканей. Если в этом гене происходит мутация, нарушающая образование нормального белка-рецептора, то ткани-мишени становятся нечувствительны к тестостерону. Не использовав возможность формирования мужского фенотипа на определённом этапе онтогенеза, организм осуществляет развитие по женскому типу. В итоге формируется особь с кариотипом XY, но внешне схожая с женщиной. Такие субъекты бесплодны, поскольку их семенники недоразвиты, а выводные протоки нередко формируются по женскому типу (недоразвитая матка, влагалище). Вторичные половые признаки характерны для женского пола. Такое нарушение у человека известно как синдром Морриса[113]. Таким образом, пол у человека формируется как результат комплементарного взаимодействия неаллельных генов[114].
Зародыши млекопитающих развиваются по пути самки, если организм не содержит яичек, в противоположном случае, зародыш развивается по пути самца. В случае, если половые железы удалены до формирования яичек или яичников, организм также развивается в самку, независимо от того, какие хромосомы содержит геном. Для развития женских половых органов требуются и другие факторы, например, яичники млекопитающих не развиваются без сигнального белка Wnt4.[115]
Введение гена Sry в геном ХХ-зиготы мыши приводит к развитию зародыша по пути самца, хотя остальные гены Y-хромосомы у такого эмбриона отсутствуют. Подобные мыши с «обращенным полом» не способны к сперматогенезу, так как их геном не содержит других генов Y-хромосомы, которые необходимы для образования спермы. Ген Sry экспрессируется в соматических клетках развивающихся половых желез и вызывает их дифференцировку этих клеток в клетки Сертоли. Последние направляют развитие организма по мужскому пути, в том числе, стимулируют превращение клеток яичка в клетки Лейдига, секретирующие тестостерон в кровь[115].
Белок Sry связывает соответствующие участки ДНК и запускает транскрипцию других генов, принимающих участие в формировании клеток Сертоли. Одним из важных генов, активируемых Sry, является ген Sox9, который экспрессируется у всех самцов позвоночных. В отсутствие генов Sry или Sox9, у XY-зародышей млекопитающих вместо яичек формируются яичники, а вместо клеток Сертоли формируются фолликулярные клетки. Остальные клетки половых желез вместо клеток Лейдига превращаются в клетки теки, которые, в пубертатный период начинают секретировать эстроген[115].
См. также[править | править код]
- Соотношение полов
- Механизм определения пола у человека
- Геномный импринтинг
- Wolbachia
Примечания[править | править код]
- ↑ 1 2 Коряков, Жимулёв, 2009, с. 122—125.
- ↑ 1 2 Асланян, Солдатова, 2010, с. 23—26.
- ↑ Билич, Крыжановский, 2009, с. 767—775.
- ↑ T Ramakrishna Rao. The Secret Sex Lives of Rotifers: Sex, Asex and Cannibalism // RESONANCE. — 2000.
- ↑ King R.C.; Stansfield W.D.; Mulligan P.K. A Dictionary of Genetics (неопр.). — 7th. — Oxford, 2006. — С. 204.
- ↑ Gilbert S. F. Chromosomal Sex Determination in Mammals // Developmental Biology. — 6th. — Sunderland (MA): Sinauer Associates, 2000. — ISBN 0-87893-243-7.
- ↑ Daisuke Kageyama, Satoko Narita, Masaya Watanabe. Insects sex determination is manipulated by their endosymbionts: incidences, meschanisms and implications // Insects. — 2012. — № 3. — С. 161—199. — ISSN 2075-4450. — doi:10.3390/insects3010161.
- ↑ 1 2 Robert H. Devlin, Yoshitaka Nagahama. Sex determination and sex differentiation in fish: an overview of genetic, physiological, and environmental influences // Aquaculture. — 2002. — № 208. — С. 191—364. Архивировано 24 декабря 2012 года.
- ↑ 1 2 3 4 5 D. Charlesworth. Plant sex determination and sex chromosomes // Heredity. — 2002. — № 88. — С. 94—101. — doi:10.1038/sj.hdy.6800016.
- ↑ Perspectives on genetics: anecdotal, historical, and critical commentaries, 1987–1998 (англ.) / James Franklin Crow, William F. Dove. — Madison, WI: University of Wisconsin Press, 2000. — ISBN 978-0-299-16604-5.
- ↑ Коряков, Жимулёв, 2009, с. 125—130.
- ↑ Бородин П. М., Башева Е. А., Голенищев Ф. Н. Взлёт и падение Y-хромосомы. Природа; 2012; № 1: С.45-50 (http://evolution2.narod.ru/y.pdf (недоступная ссылка))
- ↑ van Doorn GS, Kirkpatrick M. Transitions Between Male and Female Heterogamety Caused by Sex-Antagonistic Selection. Genetics 2010; 186(2): 629—645. PMID 20628036
- ↑ Попадьин К. Ю., Мамирова Л. А. История одинокой хромосомы // Природа. — Наука, 2004. — № 9. — С. 11—16.
- ↑ 1 2 Graves J. A. The origin and function of the mammalian Y chromosome and Y-borne genes–an evolving understanding (англ.) // Bioessays (англ.) (рус. : journal. — 1995. — April (vol. 17, no. 4). — P. 311—320. — doi:10.1002/bies.950170407. — PMID 7741724.
- ↑ Namekawa, Satoshi. XY and ZW: Is Meiotic Sex Chromosome Inactivation the Rule in Evolution? (англ.) : journal. — Public Library of Science, 2009. — Vol. 5, no. 5. — P. 3. — doi:10.1371/journal.pgen.1000493.
- ↑ 1 2 3 4 Vallender, Eric, Bruce T. Lahn. Multiple independent origins of sex chromosomes in amniotes (англ.) : journal. — Proceedings of the National Academy of Sciences, 2006. — 28 November (vol. 103, no. 5). — doi:10.1073/pnas.0608879103. — PMID 17116892. — PMC 1838700.
- ↑ Graves, Jennifer. Sex Chromosome Specialization and Degeneration in Mammals (англ.) // Cell : journal. — Cell Press, 2006. — 10 March (vol. 124, no. 5). — P. 901—914. — doi:10.1016/j.cell.2006.02.024. — PMID 16530039.
- ↑ University of Chicago Medical Center (28 October 1999). The evolution of the sex chromosomes: Step by step. Пресс-релиз. Архивировано из первоисточника 4 октября 2013. Проверено 23 October 2011.
- ↑ Charlesworth, Brian. The organization and evolution of the human Y chromosome (англ.) // BioMed Central (англ.) (рус. : journal. — 2003. — 14 August (vol. 4, no. 9). — P. 226. — doi:10.1186/gb-2003-4-9-226. — PMID 12952526. — PMC 193647.
- ↑ Асланян, Солдатова, 2010, с. 32—33.
- ↑ 1 2 3 4 5 Schartl, Manfred. A comparative view on sex determination in medaka (англ.) // Mechanisms of Development (англ.) (рус. : journal. — 2004. — July (vol. 121, no. 7—8). — P. 639—645. — doi:10.1016/j.mod.2004.03.001.
- ↑ Асланян, Солдатова, 2010, с. 36—41.
- ↑ Инге-Вечтомов, 2010, с. 155.
- ↑ 1 2 3 4 5 Hake, Laura. Genetic Mechanisms of Sex Determination (неопр.) // Nature Education. — 2008. — Т. 1, № 1.
- ↑ Goodfellow, P.N. DAX-1, an ‘antitestis’gene (англ.) // Cellular and Molecular Life Sciences : journal. — 1999. — Vol. 55. — P. 857—863. — doi:10.1007/PL00013201. — PMID 10412368.
- ↑ 1 2 Chandra, H.S. Another way of looking at the enigma of sex determination in Ellobius lutescens (англ.) // Current Science (англ.) (рус. : journal. — 1999. — 25 April (vol. 76, no. 8). — P. 1072.
- ↑ Cox, James J. A SOX9 Duplication and Familial 46,XX Developmental Testicular Disorder (англ.) // New England Journal of Medicine : journal. — 2011. — 6 January (vol. 364). — P. 91—93.
- ↑ Huang, Bing. Autosomal XX sex reversal caused by duplication of SOX9 (англ.) // American Journal of Medical Genetics (англ.) (рус. : journal. — 1999. — 7 December (vol. 87, no. 4). — P. 349—353.
- ↑ Uhlenhaut, Henriette N. Somatic Sex Reprogramming of Adult Ovaries to Testes by FOXL2 Ablation (англ.) // Cell : journal. — Cell Press, 2009. — 11 December (vol. 139). — P. 1130—1142. — doi:10.1016/j.cell.2009.11.02.
- ↑ Warren, W.C.; Hillier, Ladeana W.; Marshall Graves, Jennifer A.; Birney, Ewan; Ponting, Chris P.; Grützner, Frank; Belov, Katherine; Miller, Webb; Clarke, Laura. Genome analysis of the platypus reveals unique signatures of evolution (англ.) // Nature : journal. — 2008. — Vol. 453, no. 7192. — P. 175—U1. — doi:10.1038/nature06936. — PMID 18464734. — PMC 2803040.
- ↑ Шевченко А. И., Захарова И. С., Закиян С. М. Эволюционный путь процесса инактивации Х-хромосомы у млекопитающих // Acta Naturae. — 2013. — Т. 5, № 2. — С. 40—54. (недоступная ссылка)
- ↑ Warren, Wesley C. Genome analysis of the platypus reveals unique signatures of evolution (англ.) // Nature : journal. — 2008. — 8 May (vol. 453, no. 7192). — P. 175—183. — doi:10.1038/nature06936.
- ↑ Gruetzner, F., T. Ashley, D. M. Rowell, and J. A. M. Graves. Analysis of the platypus reveals unique signatures of evolution (англ.) // Chromosoma : journal. — 2006. — Vol. 115, no. 2. — P. 75—88. — doi:10.1007/s00412-005-0034-4. — PMID 16344965.
- ↑ Kuroiwa A., Handa S., Nishiyama C., Chiba E., Yamada F., Abe S., Matsuda Y. Additional copies of CBX2 in the genomes of males of mammals lacking SRY, the Amami spiny rat (Tokudaia osimensis) and the Tokunoshima spiny rat (Tokudaia tokunoshimensis) (англ.) // Chromosome Res : journal. — 2011. — 8 June (vol. 19). — P. 635—644. — doi:10.1007/s10577-011-9223-6. — PMID 21656076.
- ↑ 1 2 3 Majerus, 2003, p. 60.
- ↑ Patricia E. Kuwabara, Peter G. Okkema, Judith Kimble. tra-2 Encodes a Membrane Protein and May Mediate Cell Communication in the Caenorhabditis elegans Sex Determination Pathway (англ.) // Molecular Biology of the Cell : journal. — 1992. — April (vol. 3, no. 4). — P. 461—473. — PMID 1498366. — PMC 275596.
- ↑ Smith C. A., Roeszler K. N., Ohnesorg T., et al. The avian Z-linked gene DMRT1 is required for male sex determination in the chicken (англ.) // Nature : journal. — 2009. — September (vol. 461, no. 7261). — P. 267—271. — doi:10.1038/nature08298. — PMID 19710650.
- ↑ Stiglec R., Ezaz T., Graves J. A. A new look at the evolution of avian sex chromosomes (англ.) // Cytogenetic and Genome Research (англ.) (рус. : journal. — Karger Publishers (англ.) (рус., 2007. — Vol. 117, no. 1—4. — P. 103—109. — doi:10.1159/000103170. — PMID 17675850.
- ↑ Grützner, F.; Rens, W., Tsend-Ayush, E., El-Mogharbel, N., O’Brien, P.C.M., Jones, R.C., Ferguson-Smith, M.A. and Marshall, J.A. In the platypus a meiotic chain of ten sex chromosomes shares genes with the bird Z and mammal X chromosomes (англ.) // Nature : journal. — 2004. — Vol. 432, no. 7019. — P. 913—917. — doi:10.1038/nature03021. — PMID 15502814.
- ↑ Virgin births for giant lizards, BBC News (20 декабря 2006). Архивировано 4 января 2007 года. Дата обращения: 13 марта 2008.
- ↑ W. Trauta, K. Saharab, F. Marecc. Sex Chromosomes and Sex Determination in Lepidoptera. Sex Dev 2007;1:332-346 (DOI: 10.1159/000111765)
- ↑ Genetic Mechanisms of Sex Determination | Learn Science at Scitable. Дата обращения: 24 апреля 2013. Архивировано 19 августа 2017 года.
- ↑ Handbuch D Zoologie Bd 4/36 Kristensen:lepidoptera 2 Ae – Google Books. Дата обращения: 30 апреля 2013. Архивировано 11 марта 2016 года.
- ↑ 1 2 3 King R.C; Stansfield W.D. and Mulligan P.K. 2006. A dictionary of genetics. 7th ed, Oxford University Press, p194. ISBN 0-19-530761-5
- ↑ Edward O. Wilson. Kin selection as the key to altruism: its rise and fall (англ.) // Social Research (англ.) (рус. : journal. — 2005. — 12 September (vol. 72). — P. 1—8.
- ↑ Ellen van Wilgenburg. Single locus complementary sex determination in Hymenoptera: an “unintelligent” design? (англ.) // BioMed Central (англ.) (рус. : journal. — 2006. — 5 January (vol. 3, no. 1). — doi:10.1186/1742-9994-3-1.
- ↑ Doris Bachtrog, Mark Kirkpatrick, Judith E. Mank, Stuart F. McDaniel, J. Chris Pires. Are all sex chromosomes created equal? (англ.) // Trends in Genetics. — 2011-09-01. — Vol. 27, iss. 9. — P. 350–357. — ISSN 0168-9525. — doi:10.1016/j.tig.2011.05.005.
- ↑ Sa Geng, Peter De Hoff, James G. Umen. Evolution of Sexes from an Ancestral Mating-Type Specification Pathway (англ.) // PLOS Biology. — 8 июл. 2014 г.. — Vol. 12, iss. 7. — P. e1001904. — ISSN 1545-7885. — doi:10.1371/journal.pbio.1001904.
- ↑ 1 2 3 4 Гилберт С. Биология развития: В 3-х т. Т. 3: Пер. с англ. — М.: Мир, 1995. — с. 254.
- ↑ 1 2 Göth, Ann; Booth, David T. Temperature-dependent sex ratio in a bird (англ.) // Biology Letters : journal. — Royal Society Publishing, 2005. — March (vol. 1). — P. 31—33. — doi:10.1098/rsbl.2004.0247. — PMID 17148121. — PMC 1629050.
- ↑ 1 2 Maldonado, L. C. Torres; A. Landa Piedra, N. Moreno Mendoza, A. Marmolejo Valencia. Expression profiles of Dax1, Dmrt1, and Sox9 during temperature sex determination in gonads of the sea turtle Lepidochelys olivacea (англ.) // General and Comparative Endocrinology (англ.) (рус. : journal. — 2002. — 20 August (vol. 129). — P. 20—26. (недоступная ссылка)
- ↑ 1 2 3 Ferguson M.W.J., Joanen T. (1982) Temperature of egg incubation determines sex in Alligator mississippiensis, Nature, 296, 850—853.
- ↑ 1 2 Valenzuela, Nicole; Fredric J. Janzen. Nest-site philopatry and the evolution of temperature-dependent sex determination (англ.) // Evolutionary Ecology Research : journal. — 2001. — Vol. 3. — P. 779—794.
- ↑ 1 2 Apple snail: reproductive system. Дата обращения: 3 мая 2013. Архивировано 27 мая 2013 года.
- ↑ 1 2 3 Kiran Rasal; Makwana Nayan; Amar Gaikwad; Rashmi Ambulkar. Sex-Determination System In Fishes. Дата обращения: 3 мая 2013. Архивировано 4 февраля 2013 года.
- ↑ Echiurans: Echiura – Echiurans And People. Дата обращения: 4 мая 2013. Архивировано 12 февраля 2013 года.
- ↑ Инге-Вечтомов, 2010, с. 528.
- ↑ Watts, Phillip C.; Kevin R. Buley, Stephanie Sanderson, Wayne Boardman, Claudio Ciofi & Richard Gibson. Parthenogenesis in Komodo dragons (англ.) // Nature. — 2006. — 21 December (vol. 444). — P. 1021—1022. — doi:10.1038/4441021a. — PMID 17183308.
- ↑ Jiggens, Francis M.; Gregory D.D Hurst and Michael E.N Majerus. Sex-ratio-distorting Wolbachia causes sex-role reversal in its butterfly host (англ.) // Proceedings of the Royal Society : journal. — 2000. — January (vol. 267, no. 1438). — P. 69—73. — doi:10.1098/rspb.2000.0968.
- ↑ In the science of sexual attraction, size matters, Yahoo! Science News, Yahoo! Inc (13 февраля 2007). Архивировано 30 июня 2013 года. Дата обращения: 14 июня 2013.
- ↑ Choi, Charles Q.. Male Bling Makes Female Fish Mature Faster, LiveScience Animaldomain, Imaginova Corp. (13 февраля 2007). Архивировано 3 июля 2012 года. Дата обращения: 14 февраля 2007.
- ↑ Conover, D. O., Kynard, B. E. Environmental sex determination: interaction of temperature and genotype in a fish (англ.) // Science : journal. — 1981. — Vol. 213, no. 4507. — P. 577—579.
- ↑ Rafaella Franch, Bruno Louro, Matina Tsalavouta, Dimitris Chatziplis, Costas S.
Tsigenopoulos, Elena Sarropoulou, Jenny Antonello, Andonis Magoulas, Constantinos C. Mylonas, Massimiliano Babbucci, Tomaso Patarnello,
Deborah M. Power, Giorgos Kotoulas, Luca Bargelloni. A Genetic Linkage Map of the Hermaphrodite Teleost Fish Sparus aurata L // Genetics Society of America. — 2006. — doi:10.1534/genetics.106.059014. - ↑ The Unusual Sex Determination System of Chironomus. Дата обращения: 25 апреля 2013. Архивировано из оригинала 27 апреля 2013 года.
- ↑ 1 2 M. Ogata, Y. Hasegawa, H. Ohtan, M. Mineyama, I. Miura. The ZZ/ZW sex-determining mechanism originated twice and independently during evolution of the frog, Rana rugosa // Heredity. — 2008. — № 100. — С. 92—99.
- ↑ 1 2 3 David M. Green. Cytogenetics of the endemic New Zealand frog, Leiopelma hochstetteri: extraordinary supernumerary chromosome variation and a unique sex-chromosome system // Chromosoma : journal. — 1988. — Vol. 97, № 1. — P. 55—70. — doi:10.1007/BF00331795.
- ↑ Leticia Aviles, Wayne Maddison. WHEN IS THE SEX RATIO BIASED IN SOCIAL SPIDERS?: CHROMOSOME STUDIES OF EMBRYOS AND MALE MEIOSIS IN ANELOSIMUS SPECIES (ARANEAE, THERIDIIDAE) // The Journal of Arachnology. — 1991. — № 19. — С. 126—135.
- ↑ M. C. Wallis, P. D. Waters, M. L. Delbridge, P. J. Kirby, A. J. Pask, F. Grützner, W. Rens, M. A. Ferguson-Smith, J. A. M. Graves. Sex determination in platypus and echidna: autosomal location of SOX3 confirms the absence of SRY from monotremes // Chromosome Research. — 2007. — № 15(8). — С. 949—959. — ISSN 1573-6849. — doi:10.1007/s10577-007-1185-3.
- ↑ Willem Rens, Patricia CM O’Brien, Frank Grützner, Oliver Clarke, Daria Graphodatskaya, Enkhjargal Tsend-Ayush, Vladimir A Trifonov1, Helen Skelton, Mary C Wallis1, Steve Johnston, Frederic Veyrunes, Jennifer AM Graves, Malcolm A Ferguson-Smith. The multiple sex chromosomes of platypus and echidna are not completely identical and several share homology with the avian Z (англ.) // BioMed Central (англ.) (рус.. — 2007. — No. 8. — doi:10.1186/gb-2007-8-11-r243.
- ↑ Okada S., Sone T., Fujisawa M., Nakayama S., Takenaka M., Ishizaki К., et al. The Y chromosome in the liverwort Marchantia polymorpha has accumulated unique repeat sequences harboring a male-specific gene // Proc Natl Acad Sci USA. — 2001. — № 98. — С. 9454—9459.
- ↑ 1 2 3 4 5 Физиология растений: определение пола у растений. Дата обращения: 29 апреля 2013. Архивировано 12 января 2013 года.
- ↑ Westergaard, M. The mechanism of sex determination in dioecious plants // Adv Genet. — 1958. — № 9. — С. 217—281.
- ↑ 1 2 3 Билич, Крыжановский, 2009, с. 777—781.
- ↑ 1 2 Clark M.S., Parker J.S., Ainsworth C.C. Repeated DNA and heterochromatin structure in Rumex acetosa // Heredity. — 1993. — № 70. — С. 527—536.
- ↑ Réjon C.R., Jamilena M., Ramos M.G., Parker J.S., Rejon M.R. Cytogenetic and molecular analysis of the multiple sex-chromosome system of Rumex acetosa // Heredity. — 1994. — № 72. — С. 209—215.
- ↑ Lengerova M., Vyskot B. Sex chromatin and nucleolar analyses in Rumex acetosa L // Protoplasma. — 2001. — № 217. — С. 147—153.
- ↑ Wilby A.S., Parker J.S. Mendelian and non-Mendelian inheritance of newly-arisen chromosome rearrangements // Heredity. — 1988. — № 60. — С. 263—268.
- ↑ Wilby A.S., Parker J.S. Continuous variation in Y-chromosome structure of Rumex acetosa // Heredity. — № 57. — С. 247—254.
- ↑ Smith B.W. The mechanism of sex determination in Rumex hastatulus (англ.) // Genetics. — 1963. — P. 1265—1288.
- ↑ 1 2 Cristina Juarez, Jo Ann Banks. Sex determination in plants (англ.) // Current Opinion in Plant Biology. — Elsevier, 1998. — No. 1. — P. 68—72. — ISSN 1369-5266.
- ↑ Dale H. Vitt. Sex determination in mosses // The Michigan Botanist. — 1968. — С. 195—293.
- ↑ Stefanie M. Volz. Evolution of dioecy in the Cucurbitaceae genus Bryonia — a phylogenetic, phylogeographic, and SCAR-marker approach. — 2008.
- ↑ 1 2 Ray Minga, Qingyi Yu, Paul H. Moore. Sex determination in papaya // Seminars in Cell & Developmental Biology. — 2007. — № 18. — С. 401—408.
- ↑ C.P. Scutt, T. Li, S.E. Robertson, M.E. Willis, P.M. Gilmartin. Sex determination in dioecious Silene latifolia. Effects of the Y chromosome and the parasitic smut fungus (Ustilago violacea) on gene expression during flower development (англ.) // Plant Physiology. — American Society of Plant Biologists, 1997. — No. 114. — P. 969—979.
- ↑ Charles M. Rick, G. C. Hanna. Determination of Sex in Asparagus officinalis L (англ.) // American Journal of Botany. — Botanical Society of America, 1943. — No. 30(9). — P. 711—714.
- ↑ Fernando Galán. Sex determination and phenogenetic in Ecballium elaterium (L.) Richard. The sexual inflorescence type on the stem. Дата обращения: 3 мая 2013. Архивировано из оригинала 20 ноября 2011 года.
- ↑ R. B. Singh, Ben W. Smith. The mechanism of sex determination in Rumex acetosella // Theoretical and Applied Genetics. — 1971. — № 41(8). — С. 360—364. — ISSN 1432-2242. — doi:10.1007/BF00277336.
- ↑ Stephen L. Dellaporta, Alejandro Calderon-Urrea. Sex Determination in Flowering Plants // The Plant Cell. — 1993. — № 5. — С. 1241—1251. Архивировано 5 августа 2014 года.
- ↑ Инге-Вечтомов, 2010, с. 233.
- ↑ Элементы: Как инфузория тетрахимена выбирает себе пол. Дата обращения: 11 мая 2013. Архивировано 14 мая 2013 года.
- ↑ Инге-Вечтомов, 2010, с. 233—234.
- ↑ 1 2 Marcella D. Cervantes, Eileen P. Hamilton, Jie Xiong, Michael J. Lawson, Dongxia Yuan, Michalis Hadjithomas, Wei Miao, Eduardo Orias. Selecting One of Several Mating Types through Gene Segment Joining and Deletion in Tetrahymena thermophila // PLoS Biology. — 2013. — № 11. — doi:10.1371/journal.pbio.1001518.
- ↑ Инге-Вечтомов, 2010, с. 238.
- ↑ 1 2 3 Инге-Вечтомов, 2010, с. 518—520.
- ↑ Yeast Mating Type Switching. Дата обращения: 7 мая 2013. Архивировано из оригинала 4 марта 2016 года.
- ↑ Jacques Labarère, Thierry Noel. Mating type switching in teterapolar basidiomycete Agrocybe aegerita // Genetics society of America. — 1992.
- ↑ Lorna A. Casselton, Natalie S. Olesnicky. Molecular Genetics of Mating Recognition in Basidiomycete Fungi // Microbiology and molecular biology reviews. — 1998. — № 62.
- ↑ 1 2 Биология размножения водорослей. Дата обращения: 11 мая 2013. Архивировано 6 марта 2016 года.
- ↑ 1 2 3 Hiroyuki Matsuda, Peter A. Abrams. Why are equally sized gametes so rare? The instability of isogamy and the cost of anisogamy // Evolutionary Ecology Research. — 1999. — № 1. — С. 769—784. (недоступная ссылка)
- ↑ Конъюгация — статья из Большой советской энциклопедии.
- ↑ 1 2 3 Ursula Goodenough, Huawen Lin, Jae-Hyeok Lee. Sex determination in Chlamydomonas // Seminars in Cell & Developmental Biology. — 2007. — № 18. — С. 350—361.
- ↑ 1 2 James G. Umen. Evolution of sex and mating loci: An expanded view from Volvocine algae // Curr Opin Microbiol.. — 2011. — № 14(6). — С. 634—641. — doi:10.1016/j.mib.2011.10.005. (недоступная ссылка)
- ↑ Hamaji, T., Ferris, P. J., Coleman, A. W., Waffenschmidt, S., Takahashi, F., Nishii, I., & Nozaki, H. Identification of the minus-dominance gene ortholog in the mating-type locus of Gonium pectoral (англ.) // Genetics : journal. — 2008. — Vol. 178, no. 1. — P. 283—294. — doi:10.1534/genetics.107.078618.
- ↑ Ferris, P. J., Olson, B., de Hoff, P. L., Douglass, S., Casero, D., Prochnik, S. E., Geng, S., et al. Evolution of an expanded sex-determining locus in Volvox (англ.) // Science : journal. — 2010. — Vol. 328, no. 5976. — P. 351—354. — doi:10.1126/science.1186222. — PMID 20395508. — PMC 2880461.
- ↑ Smith, GM. Phytoplankton of Inland Lakes of Wisconsin, Part I, Wisconsin Geological and Natural History Survey, Madison, WI. (1920).
- ↑ Ursula Kües, Lorna A. Casselton. The origin of multiple mating types in mushrooms (англ.) // Journal of Cell Science (англ.) (рус.. — The Company of Biologists (англ.) (рус., 1993. — No. 104. — P. 227—230.
- ↑ 1 2 Banu Metin, Keisha Findley, Joseph Heitman. The Mating Type Locus (MAT) and Sexual Reproduction of Cryptococcus heveanensis: Insights into the Evolution of Sex and Sex-Determining Chromosomal Regions in Fungi.
- ↑ 1 2 3 4 Инге-Вечтомов, 2010, с. 241—250.
- ↑ Langmuir. 2008 Jun 1;24(13):6796-802. Epub 2008 Jun 4.
Evidence of DNA transfer through F-pilus channels during Escherichia coli conjugation. Shu AC, Wu CC, Chen YY, Peng HL, Chang HY, Yew TR. - ↑ Bacteriophage ecology / Staphen T. Abedon. — Cambridge. — P. 7. — 464 p.
- ↑ Brown C. J., Goss S. J., Lubahn D. B., Joseph D. R., Wilson E. M., French F. S., Willard H. F. Androgen receptor locus on the human X chromosome: regional localization to Xq11-12 and description of a DNA polymorphism (англ.) // Am. J. Hum. Genet. (англ.) (рус. : journal. — 1989. — February (vol. 44, no. 2). — P. 264—269. — PMID 2563196. — PMC 1715398.
- ↑ Galani A., Kitsiou-Tzeli S., Sofokleous C., Kanavakis E., Kalpini-Mavrou A. Androgen insensitivity syndrome: clinical features and molecular defects (англ.) // Hormones (Athens) : journal. — 2008. — Vol. 7, no. 3. — P. 217—229. — PMID 18694860.
- ↑ Ярыгин В.Н., Васильева В.И., Волков И.Н., Синельщикова В.В. Биология. В 2 кн / Ярыгин В.Н.. — М.: Высшая школа, 2010. — Т. 1. — С. 159—160. — 432 с.
- ↑ 1 2 3 Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter. Molecular Biology of the Cell. — 5. — Garland Science, 2008. — 1392 с. — ISBN 0815341059.
Литература[править | править код]
- Асланян М. М., Солдатова О. П. . Генетика и происхождение пола. Учебное пособие для студентов, обучающихся по направлению «биология». — М.: Авторская академия; Товарищество научных изданий КМК, 2010. — 114 с. — ISBN 978-5-91902-001-1.
- Билич Г. Л., Крыжановский В. А. . Биология. Полный курс: в 4 т. 5-е изд. Т. 1. — М.: Оникс, 2009. — 864 с. — ISBN 978-5-488-02311-6.
- Инге-Вечтомов С. Г. . Генетика с основами селекции. — СПб.: Издательство Н-Л, 2010. — 718 с. — ISBN 987-5-94869-105-3.
- Коряков Д. Е., Жимулёв И. Ф. . Хромосомы. Структура и функции. — Новосибирск: Изд-во СО РАН, 2009. — 258 с. — ISBN 978-5-7692-1045-7.
- Majerus M. E. N. . Sex Wars: Genes, Bacteria, and Biased Sex Ratios. — Princeton: Princeton University Press, 2003. — xxi + 250 p. — ISBN 0-691-00981-3.
Ссылки[править | править код]
- Боголюбова, Аполлинария. Что такое пол? // Сайт Biomolecula.ru (15 апреля 2014). Дата обращения: 31 марта 2018. Архивировано 18 марта 2018 года.
- Ястребова, Светлана. Мальчики налево, девочки направо… А остальные? // Сайт Biomolecula.ru (19 мая 2015). Дата обращения: 31 марта 2018. Архивировано 18 марта 2018 года.
- Кондратенко, Юлия. Зачатий мальчиков происходит столько же, сколько зачатий девочек. // Сайт Biomolecula.ru (28 апреля 2015). Дата обращения: 31 марта 2018. Архивировано 18 марта 2018 года.
- Лебедев, Виктор. Мальчик или девочка? // Сайт Biomolecula.ru (3 июня 2016). Дата обращения: 31 марта 2018. Архивировано 18 марта 2018 года.
- Лебедев, Виктор. Женский взгляд. // Сайт Biomolecula.ru (8 марта 2015). Дата обращения: 31 марта 2018. Архивировано 18 марта 2018 года.
- Нестеренко, Ольга. Могут ли условия жизни птиц влиять на пол потомства? // Сайт Biomolecula.ru (16 ноября 2016). Дата обращения: 31 марта 2018. Архивировано 18 марта 2018 года.
- Кондратенко, Юлия. Если птицы испытывают дефицит мест для гнездования, их птенцы более агрессивны. // Сайт Biomolecula.ru (10 марта 2015). Дата обращения: 31 марта 2018. Архивировано 18 марта 2018 года.
- Агапов, Алексей; Флямер, Илья. Половая жизнь хроматина. // Сайт Biomolecula.ru (3 апреля 2017). Дата обращения: 31 марта 2018. Архивировано 18 марта 2018 года.
Теория наследования пола была разработана в начале (20) столетия Т. Морганом.
Пол — это совокупность признаков и свойств организма, обеспечивающих воспроизведение себе подобных и передачу наследственной информации следующему поколению.
Пол наследственно запрограммирован и обычно определяется одной парой хромосом, которые называют половыми хромосомами. Хромосомы, одинаковые у особей мужского и женского пола, называют аутосомами.
Половые хромосомы — хромосомы, различающиеся у особей женского и мужского пола.
Обычно половые хромосомы обозначают в генетических записях буквами
X
и
Y
. В этих хромосомах содержатся гены, определяющие синтез белков, которые регулируют работу половых желез (женских или мужских) и определяют половые признаки организма.
При образовании гамет в них попадает одна половая хромосома.
Пол, образующий одинаковые гаметы, называется гомогаметным.
Пол, образующий разные гаметы, называется гетерогаметным.
Пол будущего организма, как правило, определяется в момент оплодотворения.
Известно несколько типов определения пола.
Известно много видов животных, у которых женский пол гомогаметный, а мужской — гетерогаметный. Самка образует один вид гамет, а самец — два. Пол будущего организма зависит от того, какая из мужских гамет участвует в оплодотворении.
Рис. (1). Гетерогаметный пол мужской
Так определяется пол у дрозофилы, человека, млекопитающих.
Пример:
у дрозофилы в хромосомном наборе (6) аутосом и две половые хромосомы. Хромосомный набор самки (6A) (+)
XX
, хромосомный набор самца (6A) (+)
XY
.
Самка образует один тип гамет с хромосомным набором (3A) (+)
X
, а самец — два типа гамет: (3A) (+)
X
и (3A) (+)
Y
.
Пример:
в хромосомном наборе человека (44) аутосомы и две половые хромосомы: у женщины — (44A) (+)
XX
, у мужчины — (44A) (+)
XY
.
Все женские гаметы имеют одинаковый набор хромосом. Они содержат (22) аутосомы и одну (X)-хромосому ((22A) (+)
X
). Мужской организм образует два вида гамет (сперматозоидов): (22A) (+)
X
и (22A) (+)
Y
.
Другой вариант — гетерогаметный женский пол, гомогаметный мужской пол. Такой тип определения пола наблюдается у птиц, бабочек. В этом случае пол будущего организма определяется женскими гаметами.
Рис. (2). Гетерогаметный пол женский
Гомогаметный пол имеет две
X
-хромосомы и диплоидный набор хромосом в клетке, а гетерогаметный — только одну
X
-хромосому и непарный хромосомный набор.
Рис. (3). Тип наследования пола
X0
Пример:
у самок некоторых видов клопов в клетках содержится по (14) хромосом ((12A) (+)
XX
), а у самцов — по (13) хромосом ((12A) (+)
X0
). Самка образует гаметы (6A) (+)
X
, а самец — (6A) (+)
X
и (6A) (+)
0
.
III. Диплоидный женский пол, гаплоидный мужской пол
У пчёл и муравьёв половых хромосом нет. Самки имеют диплоидный набор хромосом, а самцы — гаплоидный.

Рис. (4). Определение пола у пчёл
IV. Пол организма зависит от условий среды
У некоторых животных пол определяется условиями внешней среды. Так, у некоторых видов крокодилов и черепах пол зависит от температуры, при которой происходит развитие зародыша в яйце: при высокой температуре появляется больше самок, при низкой — больше самцов.
Источники:
Рис. 1. Гетерогаметный пол мужской. © ЯКласс
Рис. 2. Гетерогаметный пол женский. © ЯКласс
Рис. 3. Тип наследования пола
X0
. © ЯКласс
Рис. 4. Определение пола у пчёл. © ЯКласс
Особенности генетического механизма определения пола
Суть генетического механизма в определении пола
Генетическое определение пола — это определенные закономерности наследования разнообразными животными и людьми половых признаков.
Почти всех животные представлены особями двух полов: женским и мужским. По принадлежности к полу расщепление происходит в соотношении 1:1. Это значит, что количество самцов и самок в определенном биологическом виде примерно одинаковое.
Если говорить о растениях, то им свойственна двудомность: женские и мужские цветы располагаются на одном растении.
Прежде чем мы перейдем к генетическим механизмам определения пола, дадим определение понятию «пол».
Пол представляет собой совокупность признаков, по которым особи и клетки разделяются между собой. В основе такого разделения лежат морфологические и физиологические особенности, благодаря которым в процессе полового размножения осуществляется комбинирование в потомках наследственных родительских задатков.
Пол — важная характеристика любого организма, так как от него зависит важнейшее свойство живого организма: самовоспроизведение.
Благодаря ученому Г. Менделю стало известно, что признаки в потомстве расщепляются по определенному признаку в одном случае. А именно, когда особь или родитель была гетерозиготной (то есть, имела генотип Аа) по конкретному признаку, а другая особь обладала рецессивным генотипом и была гомозиготной по гену, имевшему возможность определять половую принадлежность организма.
Т. Морган и его последователи в начале 20 века сформулировали теорию наследования пола, закрепленного генетически. Ими было установлено, что самцы и самки различаются набором хромосом. Такой прорыв дал возможность генетике как науке уйти далеко вперед и начать новый этап в развитии.
Хромосомные пары в организмах обоих полов ничем не различаются. Исключение — одна пара половых хромосом.
Одинаковые пары хромосом в генотипе называются аутосомы.
Половые хромосомы — пара хромосом, которая содержит половые признаки.
Основные механизмы хромосомного определения пола
Рассмотрим основные типы хромосомного определения пола.
Половые хромосомы содержат множество наследуемых вместе с полом признаков. Отличающаяся от других пара хромосом называется парой половых хромосом.
К примеру, у самцов и самок мух дрозофил в каждой клетке есть три пары аутосом и одна пара половых хромосом: у самок — две X-хромосомы, а у самцов — хромосомы X и Y.
Механизм определение пола будущей особи происходит в процессе оплодотворения. Все зависит от того, какая хромосома содержится в сперматозоиде: если X-хромосома, то из оплодотворенной яйцеклетки произойдет развитие самки, если Y-хромосома — самца (соотношение половых хромосом у него будет иметь вид XY).
Такое скрещивание всегда дает соотношение полов, равное 1:1.
Для самок дрозофил характерно образование яйцеклеток, содержащих только X-хромосомы. Поэтому женский пол дрозофил получил название гомогамного. У самцов образуются сперматозоиды либо с хромосомой X, либо с хромосомой Y — в равном соотношении. Поэтому мужской пол называют гетерогаметным.
Как и когда определяется пол человека?
Мужской пол у людей определяется Y-хромосомой: она передается по мужской линии от сына к отцу в процессе оплодотворения. Из этого следует, что пол будущего организма зависит от попадания в зиготу конкретной половой хромосомы отцовского организма.
В Y-хромосоме человека содержит в себе белки генов, необходимых для того, чтобы мужские половые железы и мужские половые признаки нормально развивались. Железы — источник выделения мужских половых гормонов, формирующих половую систему организма.
Механизм определения пола следующий.
Если в ходе оплодотворения сливаются яйцеклетка и сперматозоид, содержащий X-хромосому, то в клетках развивающегося зародыша не будет Y-хромосомы и, соответственно, специфических мужских белков, которые она кодирует. Поэтому в зародыше получат развитие женские половые признаки, а также яичники и половые пути.
У человека и дрозофилы гомогаметный женский пол. У этих двух видов отмечается одинаковость общей схемы наследования пола. Также совпадают и закономерности наследования половых признаков.
Некоторые виды живых организмов отличаются другим хромосомным механизмом определением пола:
- у птиц, бабочек и рептилий самцы гомогамные: их пол обозначается в виде ZZ;
- самки этих особей являются гетерогаметными: они обозначаются как ZW.
К слову, обозначения выше — условные: латинские буквы можно менять на другие, но важно соблюдать правильную закономерность.
В случае партеногенетического размножения ZW-видов рождаются только самцы. Так происходит у комодских варанов (varanus komodoensis).
Отдельные насекомые, такие как прямокрыле, к примеру, отличаются наличием всего одной хромосомы в половом наборе самцов. Этот половой набор обозначается как XO. Самки являются гомогаметными: генетический набор имеет вид XX.
Для пчел и муравьев вообще не свойственно хромосомное определение пола, так как половые хромосомы у них вообще отсутствуют. Для самок характерны клетки тела с диплоидным набором, а для самцов характерно развитие при помощи партеногенеза.
Для такого тапа полового размножения свойственно:
- отсутствие оплодотворения;
- «запуск» процесса деления в случае накопления нужного количества питательных веществ внутри половой клетки.
Образованные при помощи партеногенеза самцы отличаются гаплоидным набором хромосом. Сперматозоиды у самцов развиваются без мейоза, поэтому сокращение хромосомного набора бессмысленно.
У крокодилов тоже нет половых хромосом. Развивающийся при оплодотворении в яйце зародыш получает определенный пол в результате определенных температурных условий окружающей среды. Высокая температура формирует самок, а низкая — самцов.
Генетический механизм определения пола для различных организмов свой. Почти всегда он имеет определенные оригинальные особенности, зависящие от ряда факторов.
Генетика пола
Пол характеризуется
комплексом признаков, определяемых
генами, расположенными в хромосомах. В
клетках организма человека хромосомы
составляют парные диплоидные наборы.
У видов с раздельнополыми особями
хромосомный комплекс самцов и самок
неодинаков и различается по одной паре
хромосом (половые хромосомы). Одинаковые
хромосомы этой пары назвали X (икс)
-хромосомой, непарную, отсутствующую у
другого пола — У (игрек) -хромосомой;
остальные, по которым нет различий, —
аутосомами (А).
Клетки женщины
содержат две одинаковые половые
хромосомы, которые обозначаются XX, у
мужчин они представлены двумя непарными
хромосомами X и Y. Таким образом, набор
хромосом мужчины и женщины отличается
только одной хромосомой: хромосомный
набор женщины содержит 44 аутосомы + XX,
мужчины — 44 аутосомы + XY.
Во время деления и
созревания половых клеток у человека
образуются гаметы с гаплоидным числом
хромосом: яйцеклетки, как правило,
содержат 22 + Х-хромосомы. Таким образом,
у женщин образуется только один тип
гамет (гаметы с Х-хромосомой). У мужчин
гаметы содержат 22 + X или 22 + Y хромосом,
и образуется два типа гамет (гамета с
Х-хромосомой и гамета с Y-хромосомой).
Если при оплодотворении в яйцеклетку
попадает сперматозоид с Х-хромосомой,
формируется зародыш женского пола, а с
Y-хромосомой — мужского пола.
Следовательно,
определение пола человека зависит от
наличия в мужских половых клетках —
сперматозоидах, оплодотворяющих
яйцеклетку, X- или Y-хромосом.
Существует
четыре основных типа хромосомного
определения пола:
1. Мужской
пол гетерогаметен; 50% гамет несут Х-, 50%
-У – хромосому например, человек,
млекопитающие, двукрылые, жуки, клопы
(Слайд
4).
2. Мужской
пол гетерогаметен; 50% гамет несут Х-,
50%– не имеют половой хромосомы, например,
кузнечики, кенгуру (Слайд
7).
3. Женский
пол гетерогаметен; 50% гамет несут Х- ,
50% гамет– У– хромосому, например, птицы,
пресмыкающиеся, хвостатые амфибии,
шелкопряд (Слайд
7).
4. Женский
пол гетерогаметен; 50% гамет несут Х- ,
50% не имеют половой хромосомы, например,
моль.
|
Человек |
Кузнечик |
|
|
|
|
Шелкопряд |
Моль |
|
|
|
Наследование
признаков, гены которых локализованы
в половых хромосомах, называют
наследованием, сцепленным
с полом.
26. Генотип как целостная система. Взаимодействие генов, множественное действие генов.
Генотип
как целостная система
Свойства
генов.
На основании знакомства
с примерами наследования признаков при
моно- и дигибридном скрещивании может
сложиться впечатление, что генотип
организма слагается из суммы отдельных,
независимо действующих генов, каждый
из которых определяет развитие только
своего признака или свойства. Такое
представление о прямой и однозначной
связи гена с признаком чаще всего не
соответствует действительности. На
самом деле существует огромное количество
признаков и свойств живых организмов,
которые определяются двумя и более
парами генов, и наоборот, один ген часто
контролирует многие признаки. Кроме
того, действие гена может быть изменено
соседством других генов и условиями
внешней среды. Таким образом, в онтогенезе
действуют не отдельные гены, а весь
генотип как целостная система со сложными
связями и взаимодействиями между ее
компонентами. Эта система динамична:
появление в результате мутаций новых
аллелей или генов, формирование новых
хромосом и даже новых геномов приводит
к заметному изменению генотипа во
времени.
Характер
проявления действия гена в составе
генотипа как системы может изменяться
в различных ситуациях и под влиянием
различных факторов. В этом можно легко
убедится, если рассмотреть свойства
генов и особенности их проявления в
признаках:
-
Ген дискретен
в своем действии, т. е. обособлен в своей
активности от других генов. -
Ген специфичен
в своем проявлении, т. е. отвечает за
строго определенный признак или свойство
организма. -
Ген может
действовать градуально, т. е. усиливать
степень проявления признака при
увеличении числа доминантных аллелей
(дозы гена). -
Один ген
может влиять на развитие разных признаков
— это множественное, или плейотропное,
действие гена. -
Разные гены
могут оказывать одинаковое действие
на развитие одного и того же признака
(часто количественных признаков) — это
множественные гены, или полигены. -
Ген может
взаимодействовать с другими генами,
что приводит к появлению новых признаков.
Такое взаимодействие осуществляется
опосредованно — через синтезированные
под их контролем продукты своих реакций. -
Действие
гена может быть модифицировано изменением
его местоположения в хромосоме (эффект
положения) или воздействием различных
факторов внешней среды.
Взаимодействия
аллельных генов.
Явление,
когда за один признак отвечает несколько
генов (аллелей), называется взаимодействием
генов.
Если это аллели одного и того же гена,
то такие взаимодействия называются
аллельными,
а в случае аллелей разных генов
—неаллельными.
Выделяют
следующие основные типы аллельных
взаимодействий: доминирование, неполное
доминирование, сверхдоминирование и
кодоминирование.
Доминирование
—тип взаимодействия двух аллелей одного
гена, когда один из них полностью
исключает проявление действия другого.
Такое явление возможно при следующих
условиях: 1) доминантный аллель в
гетерозиготном состоянии обеспечивает
синтез продуктов, достаточный для
проявления признака такого же качества,
как и в состоянии доминантной гомозиготы
у родительской формы; 2) рецессивный
аллель совсем неактивен, либо продукты
его активности не взаимодействуют с
продуктами активности доминантного
аллеля.
Примерами
такого взаимодействия аллельных генов
может служить доминирование пурпурной
окраски
цветков гороха над белой, гладкой формы
семян над морщинистой, темных волос над
светлыми, карих глаз над голубыми у
человека и т. д.
Неполное
доминирование,
или промежуточный
характер наследования,
наблюдается в том случае, когда фенотип
гибрида (гетерозиготы) отличается от
фенотипа обеих родительских гомозигот,
т. е. выражение признака оказывается
промежуточным, с большим или меньшим
уклонением в сторону одного или другого
родителя. Механизм этого явления состоит
в том, что рецессивный аллель неактивен,
а степень активности доминантного
аллеля недостаточна для того, чтобы
обеспечить нужный уровень проявления
доминантного признака.
Примером
неполного доминирования является
наследование окраски
цветков у растений ночной красавицы
(рис. 3.5). Как видно из схемы, гомозиготные
растения имеют либо красные (АА),
либо белые (аа)
цветки, а гетерозиготные (Аа)
— розовые. При скрещивании растения с
красными цветками и растения с белыми
цветками в F1,
у всех растений цветки розовые, т. е.
наблюдается промежуточный
характер наследования.
При скрещивании гибридов с
розовой окраской цветков в F2
имеет место совпадение расщепления по
фенотипу и генотипу, так как доминантная
гомозигота (АА)
отличается от гетерозиготы (Аа).
Так, в рассматриваемом примере с
растениями ночной красавицы расщепление
в F2
по окраске цветков обычно следующее —
1 красная (АА):
2
розовые (Аа):
1 белая (аа).
Рис. 3.5.
Наследование
окраски цветков при неполном доминировании
у ночной красавицы.
Неполное
доминирование оказалось широко
распространенным явлением. Оно наблюдается
в наследовании курчавости волос у
человека, масти крупного рогатого скота,
окраски оперения у кур, многих других
морфологических и физиологических
признаков у растений, животных и человека.
Сверхдоминирование
— более сильное проявление признака у
гетерозиготной особи (Аа),
чем у любой из гомозигот (АА
и аа).
Предполагается, что это явление лежит
в основе гетерозиса (см. § 3.7).
Кодаминирвание—
участие обоих аллелей в определении
признака у гетерозиготной особи. Ярким
и хорошо изученным примером кодоминирования
может служить наследование IV группы
крови у человека (группа АВ).
Эритроциты
людей этой группы имеют два типа
антигенов: антиген А
(детерминируемый геном / имеющимся в
одной из хромосом) и антиген В
(детерминируемый геном /а,
локализованным в другой гомологичной
хромосоме). Только в этом случае проявляют
свое действие оба аллеля — 1А
(в
гомозиготном состоянии контролирует
II группу крови, группу А) и IB
(в гомозиготном состоянии контролирует
III группу крови, группу В). Аллели 1А
и IB
работают в гетерозиготе как бы независимо
друг от друга.
Пример
наследования групп
крови иллюстрирует и прояв-ление
множественного
аллелизма:
ген/может быть представлен тремя разными
аллелями, а есть гены, имеющие десятки
аллелей. Все аллели одного гена получили
название серии
мно-жественных аллелей,
из которых каждый диплоидный организм
может иметь два любых аллеля (и только).
Между этими аллелями возможны все
перечисленные варианты аллельных
взаимодействий.
Явление
множественного аллелизма распространено
в природе. Известны обширные серии
множественных аллелей, определяющих
тип совместимости при оплодотворении
у грибов, опылении у семенных растений,
детерминирующих окраску шерсти животных
и т. д.
Взаимодействия
неаллельных генов.Неаллельные
взаимодействия генов описаны у многих
растений и животных. Они приводят к
появлению в потомстве дигетерозиготы
необычного расщепления по фенотипу:
9:3:4; 9:6:1; 13:3; 12:3:1; 15:1, т.е. модификации общей
менделевской формулы 9:3:3:1. Известны
случаи взаимодействия двух, трех и
большего числа неаллельных генов. Среди
них можно выделить следующие основные
типы: комплементарность, эпистаз и
полимерию.
Комплементарным,
или дополнительным,
называется такое взаимодействие
неаллельных доминантных генов, в
результате которого появляется признак,
отсутствующий у обоих родителей.
Например, при скрещивании двух сортов
душистого горошка с белыми цветками
появляется потомство с пурпурными
цветками. Если обозначить генотип одного
сорта ААbb,
а другого — ааВВ,
то
Гибрид первого
поколения с двумя доминантными генами
(А
и В)
получил биохимическую основу для
выработки пурпурного пигмента антоциана,
вто время как поодиночке ни ген А,
ни ген B не обеспечивали синтез этого
пигмента. Синтез антоциана представляет
собой сложную цепь последовательных
биохимических реакций, контролируемых
несколькими неаллельными генами, и
только при наличии как минимум двух
доминантных генов (А-В-)
развивается пурпурная окраска. В
остальных случаях {ааВ-
и A-bb)
цветки у растения белые (знак «—» в
формуле генотипа обозначает, что это
место может занять как доминантный, так
и рецессивный аллель).
При самоопылении
растений душистого горошка из F1
в F2
наблюдалось расщепление на пурпурно-
и белоцветковые формы в соотношении,
близком к 9:7. Пурпурные цветки были
обнаружены у 9/16
растений, белые — у 7/16. Решетка Пеннета
наглядно показывает причину этого
явления (рис. 3.6).
Эпистаз
— это такой тип взаимодействия генов,
при котором аллели одного гена подавляют
проявление аллельной пары другого гена.
Гены,
подавляющие действие других генов,
называются эпистатическими,
ингибиторами
или супрессорами.
Подавляемый ген носит название
гипостатический.
По изменению
числа и соотношения фенотип и чес ких
классов при дигибридном расщеплении в
F2
рассматривают несколько типов
эпистатических взаимодействий:
доминантный эпистаз (А>В
или В>А)
с расщеплением 12:3:1; рецессивный эпистаз
(а>В
или b>А),
который выражается в расщеплении 9:3:4,
и т. д.
Полимерия
проявляется в том, что один признак
формируется под влиянием
нескольких генов с одинаковым
фенотипичес-ким выражением. Такие гены
называются полимерными.
В этом случае принят принцип однозначного
действия генов на развитие признака.
Например, при скрещивании растений
пастушьей сумки с треугольными и
овальными плодами (стручочками) в F1
образуются растения с плодами треугольной
формы. При их самоопылении в F2
наблюдается расщепление на растения с
треугольными и овальными стручочками
в соотношении 15:1. Это объясняется тем,
что существуют два гена, действующих
однозначно. В этих случаях их обозначают
одинаково— А1и
A2
.
Рис. 3.6.
Наследование окраски цветков у душистого
горошка
Тогда все
генотипы (А1
,-А2,-,
А1-а2а2,
a1a1A2-)
будут иметь одинаковый фенотип —
треугольные стручочки, и только растения
а1а1а2a2
будут отличаться —- образовывать
овальные стручочки. Это случай
некумулятивной
полимерии.
Полимерные
гены могут действовать и по типу
кумулятивной
полимерии.
Чем больше подобных генов в генотипе
организма, тем сильнее проявление
данного признака, т. е. с увеличением
дозы гена (А1
А2
А3
и т. д.) его действие суммируется, или
кумулируется. Например, интенсивность
окраски эндосперма зерен пшеницы
пропорциональна числу доминантных
аллелей разных генов в тригибридном
скрещивании. Наиболее окрашенными были
зерна А1А1А2А2А3,А
3
а зерна
а1а1а2a2а3а
3
не имели пигмента.
По типу
кумулятивной полимерии наследуются
многие признаки: молочность, яйценоскость,
масса и другие признаки сельскохозяйственных
животных; многие важные параметры
физической силы, здоровья и умственных
способностей человека; длина колоса у
злаков; содержание сахара в корнеплодах
сахарной свеклы или липидов в семенах
подсолнечника
и т. д.
Таким образом,
многочисленные наблюдения свидетельствуют
о том, что проявление большей части
признаков представляет собой результат
влияния комплекса взаимодействующих
генов и условий внешней среды на
формирование каждого конкретного
признака.
Взаимодействие
генов
Отношение между
генами и признаками достаточно сложное.
В организме не всегда один ген определяет
только один признак и, наоборот, один
признак определяется только одним
геном. Чаще один ген может способствовать
проявлению сразу нескольких признаков,
и наоборот. Генотип организма нельзя
рассматривать как простую сумму
независимых генов, каждый из которых
функционирует вне связи с другими.
Фенотипное проявления того или иного
признака являются результатом
взаимодействия многих генов.
Множественное
действие генов (плейотропия) — процессы
влияния одного гена на формирование
нескольких признаков.
Например, у человека
ген, определяющий рыжую окраску волос,
обусловливает более светлую кожу и
появление веснушек.
Иногда гены,
определяющие морфологические признаки,
влияют на физиологические функции,
снижая жизнестойкость и плодовитость,
или оказываются летальными. Так, ген,
вызывающий голубую окраску у норки,
снижает ее плодовитость. Доминантный
ген серой окраски у каракулевых овец в
гомозиготном состоянии детален, поскольку
у таких ягнят недоразвит желудок и они
погибают при переходе на питание травой.
Комплементарное
взаимодействие генов. На развитие одного
признака могут влиять несколько генов.
Взаимодействие нескольких неаллельных
генов, приводящее к развитию одного
признака, называется комплементарным.
Например, у кур имеются четыре формы
гребня, проявление какой-либо из них
связано со взаимодействием двух пар
неаллельных генов. Розовидный гребень
обусловлен действием доминантного гена
одной аллели, гороховидный — доминантного
гена другой аллели. У гибридов при
наличии двух доминантных неаллельных
генов образуется ореховидный гребень,
а при отсутствии всех доминантных генов,
т.е. у рецессивной гомозиготы по двум
неаллельным генам, образуется простой
гребень.
Результатом
взаимодействия генов является окраска
шерсти у собак, мышей, лошадей, форма
тыквы, окраска цветков душистого горошка.
Полимерия — такое
взаимодействие неаллельных генов, когда
степень развития признака зависит от
общего количества доминантных генов.
По этому принципу наследуется окраска
зерен овса, пшеницы, цвет кожи у человека.
Например, у негров в двух парах неаллельных
генов 4 доминантных, а у людей с белой
кожей — ни одного, все гены рецессивные.
Сочетания разного количества доминантных
и рецессивных генов приводят к образованию
мулатов с разной интенсивностью окраски
кожи: от темной до светлой.
Различают две
основных группы взаимодействия генов:
взаимодействие между аллельными генами
и взаимодействие между неаллельнимы
генами. Однако следует понимать, что
это не физическое взаимодействие самих
генов, а взаимодействие первичных и
вторичных продуктов, которые обусловят
тот или иной признак. В цитоплазме
происходит взаимодействие между белками
– ферментами, синтез которых опрелятся
генами, или между веществами, которые
образовываются под влиянием этих
ферментов.
Возможны следующие
типы взаимодействия:
1) для образования
определенного признака необходимо
взаимодействие двух ферментов, синтез
которых опрелятся двумя неаллельнимы
генами;
2) фермент, что был
синтезирован с участием одного гена,
полностью подавляет или инактивирует
действие фермента, что был образован
другим неаллельным геном;
3) два ферменты,
образование которых контролируется
двумя неаллельми генами, влияющими на
один признак или на один процесс так,
что их совместное действие приводит к
возникновению и усилению проявления
признака.
Взаимодействие
аллельных генов
Гены, которые занимают
идентичные (гомологические) локусы в
гомологичных хромосомах, называются
аллельными. У каждого организма есть
по два аллельных гена.
Известны такие формы
взаимодействия между аллельными генами:
полное доминирование, неполное
доминирование, кодоминированием и
сверхдоминирование.
Основная форма
взаимодействия – полное доминирование,
которое впервые описано Г. Менделем.
Суть его заключается в том, что в
гетерозиготном организме проявление
одной из аллелей доминирует над
проявлением другой. При полном
доминировании расщепления по генотипу
1:2:1 не совпадает с расщеплением по
фенотипу – 3:1. В медицинской практике с
двух тысяч моногенных наследственных
болезней почти в половины имеет место
доминированое проявления патологических
генов над нормальными. В гетерозигот
патологический аллель проявляется в
большинстве случаев признаками
заболевания (доминантный фенотип).
Неполное доминирование
– форма взаимодействия, при которой у
гетерозиготного организма (Аа) доминантный
ген (А) не полностью подавляет рецессивный
ген (а), вследствие чего проявляется
промежуточный между родительскими
признак. Здесь расщепление по генотипу
и фенотипу совпадает и составляет 1:2:1
При кодоминировании
в гетерозиготных организмах каждый из
аллельных генов вызывает формирование
зависимого от него продукта, то есть
оказываются продукты обеих аллелей.
Классическим примером такого проявления
является система групп крови, в частности
система АBО, когда эритроциты человека
несут на поверхности антигены,
контролируемые обеими аллелями. Такая
форма проявления носит название
кодоминированием.
Сверхдоминирование
– когда доминантный ген в гетерозиготном
состоянии проявляется сильнее, чем в
гомозиготном. Так, у дрозофилы при
генотипе АА-нормальная продолжительность
жизни; Аа – удлиненная триватисть жизни;
аа – летальный исход.
Множественный
алелизм
У каждого организма
есть только по два аллельных гена. Вместе
с тем нередко в природе количество
аллелей может быть более двух, если
какой то локус может находится в разных
состояниях. В таких случаях говорят о
множественные аллели или множественный
аллеломорфизм.
Множественные аллели
обозначаются одной буквой с разными
индексами, например: А, А1, А3 … Аллельные
гена локализуются в одинаковых участках
гомологичных хромосом. Поскольку в
кариотипе всегда присутствуют по две
гомологичных хромосомы, то и при
множественных аллелях каждый организм
может иметь одновременно лишь по два
одинаковых или различных аллели. В
половую клетку (вместе с различием
гомологичних хромосом) попадает только
по одному из них. Для множественных
аллелей характерное влияние всех аллелей
на один и тот же признак. Отличие между
ними заключается лишь в степени развития
признака.
Второй особенностью
является то, что в соматических клетках
или в клетках диплоидных организмов
содержится максимум по две аллели из
нескольких, поскольку они расположены
в одном и том же локусе хромосомы.
Еще одна особенность
присуща множественным аллелям. По
характеру доминирования аллеломорфные
признаки размещаются в последовательном
ряду: чаще нормальный, неизмененный
признак доминирует над другими, второй
ген ряда рецессивный относительно
первого, однако доминирует над следующими
и т.д. Одним из примеров проявления
множественных аллелей у человека есть
группы крови системы АВО.
Множественный
алелизм имеет важное биологическое и
практическое значение, поскольку
усиливает комбинативну изменчивость,
особенно генотипического.
Взаимодействие
неалельних генов
Известно много
случаев, когда признак или свойства
детерминируются двумя или более
неалельнимы генами, которые взаимодействуют
между собой. Хотя и здесь взаимодействие
условно, потому что взаимодействуют не
гены, а контролируемые ими продукты.
При этом имеет место отклонение от
менделивских закономерностей расщепления.
Различают четыре
основных типа взаимодействия генов:
комплементарность, эпистаз, полимерию
и модифицирующее действие (плейотропия).
Комплементарность
это такой тип взаимодействия неаллельних
генов, когда один доминантный ген
дополняет действие другого неаллельного
доминантного гена, и они вместе определяют
новый признак, который отсутствует у
родителей. Причем соответственный
признак развивается только в присутствии
обоих неаллельних генов. Например, сера
окраска шерсти у мышей контролируется
двумя генами (А и В). Ген А детерминирует
синтез пигмента, однако как гомозиготы
(АА), так и гетерозиготы (Аа) – альбиносы.
Другой ген В обеспечивает скопления
пигмента преимущественно у основания
и на кончиках волос. Скрещивания
дигетерозигот (АаВЬ х АаВЬ) приводит к
расщеплению гибридов в соотношении
9:3:4. Числовые соотношения при комплементарном
взаимодействии могут быть как 9:7; 9:6:1
(видоизменение менделивского расщепления).
Примером комплементарного
взаимодействия генов у человека может
быть синтез защитного белка – интерферона.
Его образование в организме связано с
комплементарным взаимодействием двух
неаллельних генов, расположенных в
разных хромосомах.
Эпистаз -это такое
взаимодействие неаллельных генов, при
котором один ген подавляет действие
другого неаллельного гена. Угнетение
могут вызывать как доминантные, так и
рецессивные гены (А> В, а> В, В> А, В>
А), и в зависимости от этого розличают
эпистаз доминантный и рецессивный.
Подавляющий ген получил название
ингибитора или супрессора. Гены-ингибиторы
в основном не детерминируют развитие
определенного признака, а лишь подавляют
действие другого гена.
Ген, эффект которого
подавляется, получил название
гипостатичного. При епистатичном
взаимодействияи генов расщепление по
фенотипу в F2 составляет 13:3; 12:3:1 или 9:3:4
и др. Окрас плодов тыквы, масть лошадей
определяются этим типом взаимодействия.
29.08.2018
≈ 4 мин время прочтения
Определение пола ребенка
Содержание
-
Зачем нужно знать пол ребенка?
-
Генетические заболевания
-
Практические соображения
-
Семейные решения
-
Психологический настрой
-
Научные способы определения пола
-
Биопсия ворсин хориона
-
Анализ мочи
-
Анализ крови
-
Экспертное УЗИ
-
Альтернативные методы
-
Сравнение групп крови
-
Обновление крови
-
Календарный метод
-
Как запланировать пол малыша
-
Научное планирование пола
-
Лабораторный способ
-
Экстракорпоральное оплодотворение
-
Народные методы
Как заранее узнавать пол ребенка, научные и народные методы определения пола, можно ли запланировать пол малыша.
Зачем нужно знать пол ребенка?
Будущую маму, только узнавшую о беременности, волнует множество вопросов. Родится ли малыш здоровым? На кого он будет похож? И наконец, кого мы ждем: мальчика или девочку? С точностью около 90% ответ на последний вопрос тревожным родителям дадут во время УЗИ второго триместра, на сроке с 18-й по 21-ю неделю. Но как же трудно ждать эту волнующую новость! Кроме того, бывают ситуации, когда пол будущего малыша нужно узнать как можно раньше.
Беременность и роды
Ведение беременности: что необходимо сделать (инфографика)
Генетические заболевания
Существуют некоторые болезни, которые наследуются строго по мужской или женской линии: так, гемофилия передается от матери к сыну. В таких случаях ранняя диагностика жизненно необходима.
Практические соображения
Для многих родителей критично знать заранее, какое приданое готовить для будущего малыша. Например, если дети будут разнополыми, многие вещи придется докупить.
Семейные решения
Порой родители по тем или иным причинам хотят воспитывать только мальчика или девочку — в таком случае пол лучше узнать на раннем сроке, чтобы принять решение о сохранении беременности.
Психологический настрой
Папа всю жизнь мечтал научить сына играть в футбол, а мама уже купила для будущей дочки целую коллекцию кукол. Увы, после скринингового УЗИ один из них будет разочарован. Для того чтобы известие о поле ребенка не было шокирующим, стоит получить его пораньше.
Научные способы определения пола
Раньше УЗИ было единственным способом определить пол будущего малыша, но теперь на службе у медицины несколько методик, которые помогут беременной узнать, кого она ждет — сына или дочь.
Биопсия ворсин хориона
С помощью этой процедуры можно определить пол малыша уже на 8 – 10-й неделе. Материал для нее берут, прокалывая околоплодный пузырь через живот мамы или шейку матки. Звучит страшно, но специалисты выполняют процедуру под контролем аппарата УЗИ, определяя самое безопасное место для прокола. Через иглу вводят специальный зонд, с помощью которого забирают материал, не касаясь плода.
Несмотря на то, что биопсию проводят под местной анестезией, она все равно доставляет дискомфорт. А главное, ее последствия могут быть фатальными — от серьезного воспалительного процесса до выкидыша. Поэтому к биопсии хориона обычно прибегают в крайних случаях, если речь идет о риске генетических заболеваний.
Анализ мочи
Довольно простой и безопасный способ — определение пола по анализу мочи. Он схож с обычным тестом на беременность, отличие только в том, что исследуется не количество ХГЧ (гормона беременности), а его свойства. В утреннюю мочу добавляют специальный реагент, который окрашивает анализ в зеленый цвет, если в нем есть мужские гормоны, и в оранжевый, если их нет. Точность такого анализа — 90%, а проводится он с 8-й недели беременности. Этот тест можно купить в аптеке или через интернет, но его цена довольно высока.
Анализ крови
Один из самых точных методов определить пол ребенка на ранних сроках — анализ фетальной ДНК в крови женщины. Его можно сделать уже на 7-й неделе беременности, при этом точность результата составляет 95%, а с каждой последующей неделей — возрастает. Сама процедура проста: будущая мама на голодный желудок сдает кровь из вены, а затем в анализе выделяют ДНК малыша. Полученный образец ДНК специальными маркерами проверяют на наличие хромосомы Y: если она есть, значит будущий ребенок мальчик. Этот тест можно сделать в специализированных клиниках.
Экспертное УЗИ
Несмотря на то, что традиционно пол ребенка по УЗИ определяют на сроке от 18 – 20 недель, некоторые специалисты — их имена обычно передают из уст в уста — могут сделать это уже в 11 – 12 недель, когда гениталии малыша еще не сформированы — есть только половой бугорок, который впоследствии разовьется до мужского или женского органа. По внешнему виду и углу наклона бугорка опытный профессионал, работающий на современной аппаратуре, может с точностью около 80 – 90% определить пол ребенка.
Альтернативные методы
Несмотря на разнообразие официальных анализов для определения пола, уже с первых недель беременности будущие мамы активно пользуются околонаучными методами, пытаясь угадать, кого они ждут: сына или дочь. Конечно, о надежности этих способов говорить не приходится, но тестировать их очень увлекательно.
Сравнение групп крови
Этот метод требует минимум времени и затрат: достаточно узнать группу крови каждого из родителей и свериться с таблицей.
Обновление крови
Еще один способ учитывает цикличность обновления крови в человеческом организме. У женщины этот процесс занимает 3 года, у мужчины — 4. Необходимо разделить возраст мамы и папы соответственно на эти цифры и сравнить остатки: у кого он меньше (а значит, кровь «свежее»), тот и «отвечает» за пол будущего малыша.
Календарный метод
Если до зачатия вы вели календарь овуляции, то сможете воспользоваться этим способом. Дело в том, что сперматозоиды c женской X-хромосомой более живучие: после полового акта они могут оставаться в организме будущей мамы несколько суток, «дожидаясь» овуляции. А вот сперматозоиды с мужской Y-хромосомой быстро погибают и способны оплодотворить яйцеклетку только во время овуляции. Это значит, что, если зачатие произошло в начале или конце цикла, скорее всего, родится девочка, а если в середине — мальчик.
Многим беременным таблицы и календари кажутся скучными — куда интереснее попробовать угадать пол будущего малыша, пользуясь многовековыми народными приметами. Эти гадания не имеют под собой никакой научной основы, но очень популярны у будущих мам и, конечно, их окружения.
Вот некоторые из них:
- Выпирающий, «острый» живот — к мальчику, широкий и мягкий — к девочке;
- Если мама во время беременности расцвела — будет мальчик, если подурнела — девочка;
- Постоянная зябкость — к девочке, потливость — к мальчику;
- Сильный токсикоз, тошнота — к девочке, повышенный аппетит — к мальчику;
- Если беременную тянет на мясо, она ждет сына, если на сладкое — дочку;
- Обильный рост волос на теле — к мальчику, пигментация — к девочке;
- Если беременная спит на левом боку, будет мальчик, на правом — девочка;
- Если движения будущей мамы плавные, она ждет дочку, если неуклюжие — сына;
- Усилившаяся нежность, любовь беременной к мужу — к девочке, ухудшение отношений — к мальчику;
- Если малыш в животе больше толкается справа, он мальчик, если слева — девочка.
Важно помнить, что надежность этих примет ничем не доказана, и пользоваться ими можно лишь для развлечения. И конечно, не позволяйте злоупотреблять всевозможными гаданиями родственникам, пытающимся «предсказать» пол вашего малыша: ничего, кроме лишнего стресса, это вам не принесет.
Как запланировать пол малыша
Родители, мечтающие только о сыне или именно о дочке, могут попробовать повлиять на пол будущего ребенка до зачатия, пользуясь научными или народными методами.
Научное планирование пола
Самый популярный способ — календарный. Как мы уже говорили, сперматозоиды с женской X-хромосомой более живучи, чем с мужской Y-хромосомой. Для того чтобы зачать мальчика, стоит воздерживаться от отношений с мужем в течение всего месяца и заняться любовью строго в день овуляции. А для зачатия девочки, наоборот, необходимо полностью ограничить половую жизнь в середине цикла.
Лабораторный способ
Родители, всерьез озабоченные полом будущего малыша, могут воспользоваться ультрасовременной — и очень дорогостоящей! — методикой под названием MicroSort. Вот в чем ее суть: сперматозоиды отбирают и сортируют по половому признаку, а затем избранными (мужскими или женскими соответственно) оплодотворяют яйцеклетку. Как правило, этим методом пользуются пары, в которых есть риск генетических заболеваний.
Экстракорпоральное оплодотворение
Для процедуры ЭКО у будущей мамы забирают около пяти яйцеклеток и оплодотворяют их в лаборатории. Соответственно, получается несколько эмбрионов разного пола, и при желании будущие родители могут заранее выбрать мальчика или девочку. Впрочем, эта процедура считается не вполне этичной и во многих центрах репродуктологии запрещена.
Народные методы
Для планирования пола малыша, как и для его определения, существует множество околонаучных методов. Воспринимать их всерьез не стоит, но ознакомиться — можно.
Нужно помнить, что и научные, и народные методы определения и планирования пола малыша имеют погрешность. Ни один из них не дает стопроцентного результата, но, возможно, этого и не нужно. Малыш в любом случае будет уникальным и достойным вашей безграничной любви, вне зависимости от его пола.
Статья на нашем канале Яндекс Дзен
Список использованной литературы
- Папа Франсуа. Выбираем пол будущего ребенка. Санкт-Петербург: Издательство «Питер», 2012 — 176 с.
- Ройзен Майкл, Оз Мехмет. Дорога к счастливому материнству. Путеводитель по беременности и родам для будущих мам. Москва: Издательство «Астрель», 2012 — 432 с.
- Карпенко Т. Я жду ребенка. Ваш личный путеводитель по беременности и первым месяца жизни малыша. Москва: Издательство «АСТ», 2014 — 512 с.