Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 11 октября 2022 года; проверки требуют 6 правок.
| Гидрид лития | |
|---|---|
 |
|
| Общие | |
| Систематическое наименование |
гидрид лития |
| Традиционные названия | гидрид лития, водородистый литий |
| Хим. формула | LiH |
| Рац. формула | LiH |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 7,95 г/моль |
| Плотность | 0,82 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 692 °C |
| Энтальпия | |
| • образования | -90,7 кДж/моль |
| • плавления | −21,8 кДж/моль[1] |
| Удельная теплота плавления | 21,8 Дж/кг |
| Давление пара | 0 ± 1 мм рт.ст.[2] |
| Химические свойства | |
| Растворимость | |
| • в воде | реагирует с водой |
| Классификация | |
| Рег. номер CAS | 7580-67-8 |
| PubChem | 62714 |
| Рег. номер EINECS | 231-484-3 |
| SMILES |
[H-].[Li+] |
| InChI |
InChI=1S/Li.H/q+1;-1 SRTHRWZAMDZJOS-UHFFFAOYSA-N |
| RTECS | OJ6300000 |
| ChemSpider | 56460 |
| Безопасность | |
| Предельная концентрация | 0,1 мг/м³ |
| ЛД50 | 100-143 мг/кг |
| Токсичность | высокая |
| Пиктограммы ECB |
|
| NFPA 704 |
2 3 2
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Гидрид лития — неорганическое бинарное соединение щелочного металла лития и водорода. В расплавленном состоянии восстанавливает оксиды металлов и неметаллов. Под действием рентгеновского и ультрафиолетового излучения окрашивается в голубой цвет. Также возможен дейтерид лития с формулой LiD, применяемый в качестве горючего в термоядерных бомбах.
Получение[править | править код]
Гидрид лития получают реакцией синтеза непосредственно из элементов лития и водорода:
или восстановлением нитрида лития водородом:
Физические свойства[править | править код]
Белый, лёгкий порошок, плавится без разложения в инертной атмосфере.
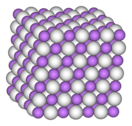
Образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, параметры ячейки a = 0,4083 нм, Z = 4, структура типа NaCl.
Под действием излучения от видимого до рентгеновского кристаллы окрашиваются в интенсивный голубой цвет из-за образования твёрдого коллоидного раствора металлического лития в гидриде лития.
Слабо растворим в диэтиловом эфире.
Химические свойства[править | править код]
Растрескавшиеся кристаллы гидрида лития
Гидрид лития относительно устойчив в сухом воздухе. Парами воды быстро гидролизуется (с водой реакция идёт бурно, возможно самовоспламенение):
При нагревании выше 850°С (а в вакууме до 450°С) начинает распадаться на элементы:
Электролизом расплава также можно разложить гидрид лития на элементы, при этом водород выделяется на аноде, т.е. в расплаве происходит электролитическая диссоциация:
С кислородом и азотом начинает взаимодействовать только при нагревании и результат зависит от температуры:
Реагирует с другими неметаллами (C, P, S, Si):
Восстанавливает оксиды металлов и неметаллов:
Может образовывать двойные гидриды:
Применение[править | править код]
Используется как осушитель, как сырье для производства алюмогидрида лития (сильный восстановитель, используемый в органическом синтезе), как замедлитель в радиационных защитах ядерных реакторов. Также гидрид лития используется как легкий и портативный источник водорода для аэростатов и спасательного снаряжения.
Дейтерид лития-6[править | править код]
Дейтерид лития-6 6LiD (или 6Li2H) используется как термоядерное топливо в термоядерном оружии.
Безопасность[править | править код]
Вещество токсично. ПДК 0,03 мг/дм³. При контакте с кожей и слизистыми оболочками (в чистом виде) гидрид лития может вызвать химический ожог.
ЛД50 на белых мышах — 140—143 мг/кг.
Имелись также данные о том, что гидрид лития является генетическим ядом, а также — антагонистом ионов натрия, которые, в свою очередь и являются обязательным макроэлементом для живых организмов.
См.также[править | править код]
- Гидрид-ион
Примечания[править | править код]
- ↑ (unspecified title)
- ↑ http://www.cdc.gov/niosh/npg/npgd0371.html
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
Физические свойства
Гидрид лития LiH — неорганическое бинарное соединение щелочного металла лития и водорода, белого цвета, легкий, плавится без разложения, разлагается при дальнейшем нагревании.
Относительная молекулярная масса = 7, 95; относительная плотность для тв. и ж. состояния = 0, 82; tпл = 680◦ C
Способ получения
Гидрид лития получают реакцией взаимодействия лития и водорода:
2Li + H2 = 2LiH
Химические свойства
Гидрид лития белый, легкий, плавится без разложения, разлагается при дальнейшем нагревании.
1. Гидрид лития — сильный восстановитель. Поэтому он реагирует почти со всеми неметаллами:
1.1. При взаимодействии с кислородом гидрид лития образует гидроксид лития:
2LiH + O2 = 2LiOH
1.2. Гидрид лития взаимодействует с хлором, образуя хлорид лития и хлороводород:
LiH + Cl2 = LiCl + HCl
1.3. Гидрид лития реагирует с серой с образованием сульфида лития и сероводорода:
2LiH + 2S = Li2S + H2S
1.4. При взаимодействии гидрида лития и азота образуется нитрид лития и аммиак:
3LiH + N2 = Li3N + NH3
1.5. Взаимодействуя с углеродом (графитом) гидрид лития образует ацетиленид лития и ацетилен:
2LiH + 4C(графит)= Li2C2 + C2H2
2. Гидрид лития взаимодействует со сложными веществами:
2.1. При взаимодействии с водой гидрид лития образует гидроксид лития и газ водород:
LiH + H2O = LiOH + H2↑
2.2. С хлороводородной кислотой гидрид лития реагирует при комнатной температуре с образованием хлорида лития и водорода:
LiH + HCl(разб.)= LiCl + H2↑
2.3. Гидрид лития может реагировать с такими оксидами, как:
2.3.1. Оксид серы IV, образуя сульфат лития и сероводород:
2LiH + 2SO2 = Li2SO4 + H2S
2.3.2. Оксид кремния, с образованием силиката лития, кремния и водорода:
4LiH + 3SiO2 = 2Li2SiO3 + Si + 2H2
2.4. Гидрид лития реагирует с аммиаком с образованием нитрида лития и водорода:
LiH + NH3 = LiNH2 + H2
 |
|
 . __Li __H. Структура гидрида лития. . __Li __H. Структура гидрида лития. |
|
 |
|
| Идентификаторы | |
|---|---|
| Номер CAS |
|
| 3D-модель (JSmol ) |
|
| ChemSpider |
|
| EC HA InfoCard | 100.028.623 |
| PubChem CID |
|
| номер RTECS |
|
| UNII |
|
| CompTox Dashboard (EPA ) |
|
InChI
|
|
УЛЫБАЕТСЯ
|
|
| Свойства | |
| Химическая формула | LiH |
| Молярная масса | 7,95 г / моль |
| Внешний вид | твердое вещество от бесцветного до серого |
| Плотность | 0,78 г / см |
| Температура плавления | 688,7 ° C (1271,7 ° F; 961,9 K) |
| Температура кипения | 900–1000 ° C (1,650–1,830 ° F; 1,170–1270 K) (разлагается) |
| Растворимость в воде | реагирует |
| Растворимость | малорастворимый в диметилформамиде. реагирует с аммиаком, диэтиловым эфиром, этанолом |
| Магнитная восприимчивость (χ) | -4,6 · 10 см / моль |
| Показатель преломления (nD) | 1,9847 |
| Структура | |
| Кристаллическая структура | fcc (NaCl-тип ) |
| Постоянная решетки | a = 0,40834 нм |
| Дипольный момент | 6,0 D |
| Термохимия | |
| Теплоемкость (C) | 3,51 Дж / (г · К) |
| Стандартная молярная. энтропия (S 298) | 170,8 Дж / (моль · К) |
| Стандартная энтальпия. образования (ΔfH298) | -90,65 кДж / моль |
| Свободная энергия Гиббса (ΔfG˚) | −68,48 кДж / моль |
| Опасности | |
| Основные опасности | чрезвычайно сильный раздражитель, высокотоксичный, высококоррозионный |
| Паспорт безопасности | ICSC 0813 |
| NFPA 704 (огненный алмаз) |  2 3 2 2 3 2 |
| самовоспламенение. температура | 200 ° C (392 ° F; 473 K) |
| летальная доза или концентрация (LD, LC): | |
| LD50(medi доза ) | 77,5 мг / кг (перорально, крыса) |
| LC50(средняя концентрация ) | 22 мг / м (крыса, 4 ч) |
| NIOSH (пределы воздействия на здоровье в США): | |
| PEL (допустимо) | TWA 0,025 мг / м |
| REL (рекомендуется) | TWA 0,025 мг / м |
| IDLH (непосредственная опасность) | 0,5 мг / м |
| Родственные соединения | |
| Другие катионы | Гидрид натрия. Гидрид калия. Гидрид рубидия. Гидрид цезия |
| Родственные соединения | Боргидрид лития. Литий гидрид алюминия |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки в ink | |
Гидрид лития представляет собой неорганическое соединение с формулой Li H. Этот гидрид щелочного металла представляет собой бесцветное твердое вещество, хотя коммерческие образцы имеют серый цвет. Характерный для солеподобного (ионного) гидрида, он имеет высокую температуру плавления и не растворяется, но вступает в реакцию со всеми органическими протонными растворителями. Он растворим и не реагирует с некоторыми расплавленными солями, такими как фторид лития, боргидрид лития и гидрид натрия. Имея молекулярную массу чуть меньше 8,0, это самое легкое ионное соединение.
Содержание
- 1 Физические свойства
- 2 Синтез и обработка
- 3 Реакции
- 4 Применения
- 4.1 Хранение водорода и топливо
- 4.2 Прекурсор сложных гидридов металлов
- 4.3 В ядерной химии и физике
- 4.3.1 Дейтерид лития
- 5 Безопасность
- 6 Ссылки
- 7 Внешние ссылки
Physical свойства
LiH представляет собой диамагнетик и ионный проводник с проводимостью, постепенно увеличивающейся от 2 × 10 Ом · см при 443 ° C до 0,18 Ом · см при 754 ° C; в этом повышении температуры плавления нет прерывания. Диэлектрическая проницаемость LiH уменьшается с 13,0 (статические, низкие частоты) до 3,6 (частоты видимого света). LiH – мягкий материал с твердостью по шкале Мооса 3,5. Его ползучесть при сжатии (за 100 часов) быстро увеличивается с < 1% at 350 °C to>100% при 475 ° C, что означает, что LiH не может обеспечить механическую поддержку при нагревании.
Теплопроводность LiH уменьшается с температурой и зависит от морфологии: соответствующие значения составляют 0,125 Вт / (см · K) для кристаллов и 0,0695 Вт / (см · K) для компактов при 50 ° C и 0,036 Вт / (см · K) для кристаллов и 0,0432 Вт / (см · К) для прессовок при 500 ° C. Линейный коэффициент теплового расширения составляет 4,2 × 10 / ° C при комнатной температуре.
Синтез и обработка
LiH получают обработкой лития металла. с газом водородом :
- 2 Li + H 2 → 2 LiH
Эта реакция особенно быстро протекает при температурах выше 600 ° C. Добавление 0,001–0,003% углерода или / и повышение температуры и / или давления увеличивает выход до 98% при 2-часовом времени пребывания. Однако реакция протекает при температуре до 29 ° C. Выход составляет 60% при 99 ° C и 85% при 125 ° C, и скорость значительно зависит от состояния поверхности LiH.
Менее распространенные способы синтеза LiH включают термическое разложение литий-алюминия. гидрид (200 ° C), борогидрид лития (300 ° C), н-бутиллитий (150 ° C) или (120 ° C), а также несколько реакции с участием соединений лития с низкой стабильностью и доступным содержанием водорода.
Химические реакции дают LiH в виде комкованного порошка, который может быть спрессован в гранулы без связующего. Более сложные формы можно получить путем литья из расплава. Затем из расплавленного порошка LiH в атмосфере водорода можно выращивать крупные монокристаллы (длиной около 80 мм и диаметром 16 мм) с помощью техники Бриджмена – Стокбаргера. Часто они имеют голубоватый цвет из-за наличия коллоидного лития. Этот цвет можно удалить путем послеростового отжига при более низких температурах (~ 550 ° C) и более низких температурных градиентах. Основными примесями в этих кристаллах являются Na (20-200 частей на миллион, частей на миллион), O (10-100 частей на миллион), Mg (0,5-6 частей на миллион), Fe (0,5-2 частей на миллион) и Cu (0,5-2 частей на миллион).

Объемные детали из LiH, полученные холодным прессованием, можно легко обрабатывать с использованием стандартных методов и инструментов с точностью микрометра. Однако литой LiH хрупкий и легко трескается во время обработки.
Более энергоэффективным способом получения порошка гидрида лития является измельчение металлического лития в шаровой мельнице под высоким давлением водорода. Проблемой этого метода является холодная сварка металлического лития из-за его высокой пластичности. Добавляя небольшое количество порошка гидрида лития, можно избежать холодной сварки.
Реакции
Порошок LiH быстро реагирует с воздухом с низкой влажностью, образуя LiOH, Li. 2O и Li. 2CO. 3. Во влажном воздухе порошок самовоспламеняется, образуя смесь продуктов, содержащих некоторые азотистые соединения. Кусковой материал вступает в реакцию с влажным воздухом, образуя поверхностное покрытие, которое представляет собой вязкую жидкость. Это тормозит дальнейшую реакцию, хотя появление пленки «потускнения» вполне очевидно. При воздействии влажного воздуха нитриды не образуются или почти не образуются. Кусковой материал, содержащийся в металлической посуде, можно нагреть на воздухе до температуры чуть ниже 200 ° C без воспламенения, хотя он легко воспламеняется при прикосновении к открытому пламени. Состояние поверхности LiH, присутствие оксидов на металлической тарелке и т. Д. Оказывают значительное влияние на температуру воспламенения. Сухой кислород не реагирует с кристаллическим LiH, если его не нагреть сильно, когда происходит почти взрывное горение.
LiH очень реактивен по отношению к воде и другим протонным реагентам:
- LiH + H 2 O → Li + H 2 + OH
LiH менее реагирует с водой, чем Li, и, таким образом, является гораздо менее мощным восстановителем для воды, спиртов и других сред, содержащих восстанавливаемые растворенные вещества. Это верно для всех бинарных солевых гидридов.
Гранулы LiH медленно расширяются во влажном воздухе, образуя LiOH; однако степень расширения составляет менее 10% в течение 24 часов при давлении водяного пара 2 Торр. Если влажный воздух содержит углекислый газ, то продукт – карбонат лития. LiH медленно реагирует с аммиаком при комнатной температуре, но реакция значительно ускоряется при температуре выше 300 ° C. LiH медленно реагирует с высшими спиртами и фенолами, но активно с низшими спиртами.
LiH реагирует с диоксидом серы:
- 2 LiH + 2 SO 2 → Li 2S2O4+ H 2
, хотя при температуре выше 50 ° C продукт представляет собой дитионит лития.
LiH реагирует с ацетиленом с образованием карбида лития и водорода. С безводными органическими кислотами, фенолами и ангидридами кислот LiH медленно реагирует с образованием газообразного водорода и литиевой соли кислоты. С водосодержащими кислотами LiH реагирует быстрее, чем с водой. Многие реакции LiH с кислородсодержащими частицами дают LiOH, который, в свою очередь, необратимо реагирует с LiH при температурах выше 300 ° C:
- LiH + LiOH → Li 2 O + H 2
Применения
Хранение водорода и топливо
При содержании водорода, пропорциональном его массе в три раза больше, чем у NaH, LiH имеет самое высокое содержание водорода среди всех гидридов. LiH периодически представляет интерес для хранения водорода, но его применение затрудняется из-за его устойчивости к разложению. Таким образом, для удаления H 2 требуются температуры выше 700 ° C, используемые для его синтеза, создание и поддержание таких температур является дорогостоящим. Соединение было однажды испытано в качестве топливного компонента в модельной ракете.
Прекурсор сложных гидридов металлов
LiH обычно не является гидрид-восстановителем, за исключением синтеза гидридов некоторых металлоидов. Например, силан образуется в реакции гидрида лития и тетрахлорида кремния с помощью процесса Сандермейера:
- 4 LiH + SiCl 4 → 4 LiCl + SiH 4
Гидрид лития используется в производстве различных реагентов для органического синтеза, таких как алюмогидрид лития (LiAlH 4) и борогидрид лития (LiBH 4). Триэтилборан реагирует с образованием супергидрида (LiBHEt 3).
В ядерной химии и физике
Гидрид лития (LiH) иногда является желательным материалом для защиты ядерные реакторы с изотопом литий-7 (Li-7), и он может быть изготовлен путем литья.
Дейтерид лития
Дейтерид лития, в форма дейтерида лития-7, является хорошим замедлителем для ядерных реакторов, поскольку дейтерий (H) имеет более низкую сечение поглощения нейтронов, чем у обычного водорода (H), и сечение для Li также низкое, что снижает поглощение нейтронов в реакторе. Li предпочтительнее для замедлителя, потому что он имеет более низкий захват нейтронов сечение, а также образует меньше трития (H) при бомбардировке нейтронами.
Соответствующий литий-6 дейтерид, LiH, или LiD, является основным термоядерным топливом в термоядерном оружии. В водородной войне В рекламе конструкции Теллера-Улама, триггер ядерного деления взрывается для нагрева и сжатия дейтерида лития-6 и бомбардировки LiD нейтронами с образованием H (тритий ) в экзотермической реакции: LiH + n → He + H. Затем дейтерий и тритий соединяются с образованием гелия, одного нейтрона и 17,59 МэВ свободной энергии в виде гамма-лучей, кинетической энергии и т. Д. Гелий является инертным побочным продуктом.
До Касл Браво испытания ядерного оружия в 1954 году считалось, что только менее распространенный изотоп Li будет воспроизводить тритий при ударе быстрыми нейтронами. Тест Castle Bravo показал (случайно), что более обильный Li также делает это в экстремальных условиях, хотя и в результате эндотермической реакции.
Безопасность
LiH бурно реагирует с водой с образованием газообразного водорода и LiOH, который является едким веществом. Следовательно, пыль LiH может взорваться во влажном или даже сухом воздухе из-за статического электричества. При концентрации в воздухе 5–55 мг / м3 пыль вызывает сильное раздражение слизистых оболочек и кожи и может вызвать аллергическую реакцию. Из-за раздражения LiH обычно отторгается, а не накапливается в организме.
Некоторые соли лития, которые могут образовываться в реакциях LiH, токсичны. Пожар LiH нельзя тушить с помощью двуокиси углерода, четыреххлористого углерода или водных огнетушителей; его следует задушить, покрыв металлическим предметом или порошком графита или доломита. Менее подходит песок, так как он может взорваться при смешивании с горящим LiH, особенно если он не высохнет. LiH обычно транспортируется в масле в контейнерах из керамики, определенных пластиков или стали, а также в атмосфере сухого аргона или гелия. Можно использовать азот, но не при повышенных температурах, так как он вступает в реакцию с литием. LiH обычно содержит металлический литий, который вызывает коррозию контейнеров из стали или кремнезема при повышенных температурах.
Ссылки
Внешние ссылки
- Саутгемптонский университет, Центр международных исследований Маунтбеттена, Рабочий документ №5 по ядерной истории.
- CDC – Карманный справочник NIOSH по химической опасности
Содержание
- Получение
- Физические свойства
- Химические свойства
- Применение
- Дейтерид лития-6
- Безопасность
- См.также
Гидрид лития — неорганическое бинарное соединение щелочного металла лития и водорода. В расплавленном состоянии восстанавливает оксиды металлов и неметаллов. Под действием рентгеновского и ультрафиолетового излучения окрашивается в голубой цвет.
| Гидрид лития | |
|---|---|
| Общие | |
| Систематическое наименование |
гидрид лития |
| Традиционные названия | гидрид лития, водородистый литий |
| Хим. формула | LiH |
| Рац. формула | LiH |
| Физические свойства | |
| Состояние | твердое |
| Молярная масса | 7,95 г/моль |
| Плотность | 0,82 г/см³ |
| Термические свойства | |
| Температура | |
| • плавления | 692 °C |
| Энтальпия | |
| • образования | -90,7 кДж/моль |
| • плавления | −21,8 кДж/моль |
| Удельная теплота плавления | 21,8 Дж/кг |
| Давление пара | 0 ± 1 мм рт.ст. |
| Химические свойства | |
| Растворимость | |
| • в воде | реагирует с водой |
| Классификация | |
| Рег. номер CAS | 7580-67-8 |
| PubChem | 62714 |
| Рег. номер EINECS | 231-484-3 |
| SMILES |
[H-].[Li+] |
| InChI |
1S/Li.H/q+1;-1 SRTHRWZAMDZJOS-UHFFFAOYSA-N |
| RTECS | OJ6300000 |
| ChemSpider | 56460 |
| Безопасность | |
| Предельная концентрация | 0,1 мг/м³ |
| ЛД50 | 100-143 мг/кг |
| Токсичность | высокая |
| NFPA 704 |
Получение
Гидрид лития получают реакцией синтеза непосредственно из элементов лития и водорода:
Физические свойства
Белый, лёгкий порошок, плавится без разложения в инертной атмосфере. Образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, параметры ячейки a = 0,4083 нм, Z = 4, структура типа NaCl.
Под действием излучения от видимого до рентгеновского кристаллы окрашиваются в интенсивный голубой цвет из-за образования твёрдого коллоидного раствора металлического лития в гидриде лития.
Слабо растворим в диэтиловом эфире.
Химические свойства
Гидрид лития относительно устойчив в сухом воздухе. Парами воды быстро гидролизуется (с водой реакция идёт бурно, возможно самовоспламенение):
При нагревании выше 850°С (а в вакууме до 450°С) начинает распадаться на элементы:
Электролизом расплава также можно разложить гидрид лития на элементы, при этом водород выделяется на аноде, т.е. в расплаве происходит электролитическая диссоциация:
С кислородом и азотом начинает взаимодействовать только при нагревании и результат зависит от температуры:
Реагирует с другими неметаллами (C, P, S, Si):
Восстанавливает оксиды металлов и неметаллов:
Может образовывать двойные гидриды:
Применение
Используется как осушитель, как сырье для производства алюмогидрида лития (сильный восстановитель, используемый в органическом синтезе), как замедлитель в радиационных защитах ядерных реакторов. Также гидрид лития используется как легкий и портативный источник водорода для аэростатов и спасательного снаряжения.
Дейтерид лития-6
Дейтерид лития-6 6LiD (или 6Li2H) используется как термоядерное топливо в термоядерном оружии.
Безопасность
Вещество токсично. ПДК 0,03 мг/дм³. При контакте с кожей и слизистыми оболочками (в чистом виде) гидрид лития может вызвать химический ожог.
ЛД50 на белых мышах — 140-143 мг/кг.
Имелись также данные о том, что гидрид лития является генетическим ядом, а также — антагонистом ионов натрия, которые, в свою очередь и являются обязательным макроэлементом для живых организмов.
См.также
- Гидрид-ион
From Wikipedia, the free encyclopedia

|
|

__Li+ __ H− |
|

|
|
| Identifiers | |
|---|---|
|
CAS Number |
|
|
3D model (JSmol) |
|
| ChemSpider |
|
| ECHA InfoCard | 100.028.623 |
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
LiH |
| Molar mass | 7.95 g·mol−1 |
| Appearance | colorless to gray solid[1] |
| Density | 0.78 g/cm3[1] |
| Melting point | 688.7 °C (1,271.7 °F; 961.9 K)[1] |
| Boiling point | 900–1,000 °C (1,650–1,830 °F; 1,170–1,270 K) (decomposes)[2] |
|
Solubility in water |
reacts |
| Solubility | slightly soluble in dimethylformamide reacts with ammonia, diethyl ether, ethanol |
|
Magnetic susceptibility (χ) |
−4.6·10−6 cm3/mol |
|
Refractive index (nD) |
1.9847[3]: 43 |
| Structure | |
|
Crystal structure |
fcc (NaCl-type) |
|
Lattice constant |
a = 0.40834 nm[3]: 56 |
|
Dipole moment |
6.0 D[3]: 35 |
| Thermochemistry | |
|
Heat capacity (C) |
3.51 J/(g·K) |
|
Std molar |
170.8 J/(mol·K) |
|
Std enthalpy of |
−90.65 kJ/mol |
|
Gibbs free energy (ΔfG⦵) |
−68.48 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
extremely strong irritant, highly toxic, highly corrosive |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H260, H301, H314 |
|
Precautionary statements |
P223, P231+P232, P260, P264, P270, P280, P301+P316, P301+P330+P331, P302+P335+P334, P302+P361+P354[?], P304+P340, P305+P354+P338[?], P316, P321, P330, P363, P370+P378, P402+P404, P405, P501 |
| NFPA 704 (fire diamond) |
3 2 2
|
|
Autoignition |
200 °C (392 °F; 473 K) |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
77.5 mg/kg (oral, rat)[5] |
|
LC50 (median concentration) |
22 mg/m3 (rat, 4 h)[6] |
| NIOSH (US health exposure limits): | |
|
PEL (Permissible) |
TWA 0.025 mg/m3[4] |
|
REL (Recommended) |
TWA 0.025 mg/m3[4] |
|
IDLH (Immediate danger) |
0.5 mg/m3[4] |
| Safety data sheet (SDS) | ICSC 0813 |
| Related compounds | |
|
Other cations |
Sodium hydride Potassium hydride Rubidium hydride Caesium hydride |
|
Related compounds |
Lithium borohydride Lithium aluminium hydride |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Lithium hydride is an inorganic compound with the formula LiH. This alkali metal hydride is a colorless solid, although commercial samples are grey. Characteristic of a salt-like (ionic) hydride, it has a high melting point, and it is not soluble but reactive with all protic organic solvents. It is soluble and nonreactive with certain molten salts such as lithium fluoride, lithium borohydride, and sodium hydride. With a molar mass of 7.95 g/mol, it is the lightest ionic compound.
Physical properties[edit]
LiH is a diamagnetic and an ionic conductor with a conductivity gradually increasing from 2×10−5 Ω−1cm−1 at 443 °C to 0.18 Ω−1cm−1 at 754 °C; there is no discontinuity in this increase through the melting point.[3]: 36 The dielectric constant of LiH decreases from 13.0 (static, low frequencies) to 3.6 (visible-light frequencies).[3]: 35 LiH is a soft material with a Mohs hardness of 3.5.[3]: 42 Its compressive creep (per 100 hours) rapidly increases from < 1% at 350 °C to > 100% at 475 °C, meaning that LiH can’t provide mechanical support when heated.[3]: 39
The thermal conductivity of LiH decreases with temperature and depends on morphology: the corresponding values are 0.125 W/(cm·K) for crystals and 0.0695 W/(cm·K) for compacts at 50 °C, and 0.036 W/(cm·K) for crystals and 0.0432 W/(cm·K) for compacts at 500 °C.[3]: 60 The linear thermal expansion coefficient is 4.2×10−5/°C at room temperature.[3]: 49
Synthesis and processing[edit]
LiH is produced by treating lithium metal with hydrogen gas:
- 2 Li + H2 → 2 LiH
This reaction is especially rapid at temperatures above 600 °C. Addition of 0.001–0.003% carbon, and/or increasing temperature and/or pressure, increases the yield up to 98% at 2-hour residence time.[3]: 147 However, the reaction proceeds at temperatures as low as 29 °C. The yield is 60% at 99 °C and 85% at 125 °C, and the rate depends significantly on the surface condition of LiH.[3]: 5
Less common ways of LiH synthesis include thermal decomposition of lithium aluminium hydride (200 °C), lithium borohydride (300 °C), n-butyllithium (150 °C), or ethyllithium (120 °C), as well as several reactions involving lithium compounds of low stability and available hydrogen content.[3]: 144–145
Chemical reactions yield LiH in the form of lumped powder, which can be compressed into pellets without a binder. More complex shapes can be produced by casting from the melt.[3]: 160 ff. Large single crystals (about 80 mm long and 16 mm in diameter) can be then grown from molten LiH powder in hydrogen atmosphere by the Bridgman–Stockbarger technique. They often have bluish color owing to the presence of colloidal Li. This color can be removed by post-growth annealing at lower temperatures (~550 °C) and lower thermal gradients.[3]: 154 Major impurities in these crystals are Na (20–200 ppm), O (10–100 ppm), Mg (0.5–6 ppm), Fe (0.5-2 ppm) and Cu (0.5-2 ppm).[3]: 155
Cracking in cast LiH after machining with a fly cutter. Scale is in inches.
Bulk cold-pressed LiH parts can be easily machined using standard techniques and tools to micrometer precision. However, cast LiH is brittle and easily cracks during processing.[3]: 171
A more energy efficient route to form lithium hydride powder is by ball milling lithium metal under high hydrogen pressure. A problem with this method is the cold welding of lithium metal due to the high ductility. By adding small amounts of lithium hydride powder the cold welding can be avoided.[7]
Reactions[edit]
LiH powder reacts rapidly with air of low humidity, forming LiOH, Li2O and Li2CO3. In moist air the powder ignites spontaneously, forming a mixture of products including some nitrogenous compounds. The lump material reacts with humid air, forming a superficial coating, which is a viscous fluid. This inhibits further reaction, although the appearance of a film of “tarnish” is quite evident. Little or no nitride is formed on exposure to humid air. The lump material, contained in a metal dish, may be heated in air to slightly below 200 °C without igniting, although it ignites readily when touched by an open flame. The surface condition of LiH, presence of oxides on the metal dish, etc., have a considerable effect on the ignition temperature. Dry oxygen does not react with crystalline LiH unless heated strongly, when an almost explosive combustion occurs.[3]: 6
LiH is highly reactive towards water and other protic reagents:[3]: 7
- LiH + H2O → Li+ + H2 + OH−
LiH is less reactive with water than Li and thus is a much less powerful reducing agent for water, alcohols, and other media containing reducible solutes. This is true for all the binary saline hydrides.[3]: 22
LiH pellets slowly expand in moist air, forming LiOH; however, the expansion rate is below 10% within 24 hours in a pressure of 2 Torr of water vapor.[3]: 7 If moist air contains carbon dioxide, then the product is lithium carbonate.[3]: 8 LiH reacts with ammonia, slowly at room temperature, but the reaction accelerates significantly above 300 °C.[3]: 10 LiH reacts slowly with higher alcohols and phenols, but vigorously with lower alcohols.[3]: 14
LiH reacts with sulfur dioxide:
- 2 LiH + 2 SO2 → Li2S2O4 + H2
though above 50 °C the product is lithium dithionite.[3]: 9
LiH reacts with acetylene to form lithium carbide and hydrogen. With anhydrous organic acids, phenols and acid anhydrides, LiH reacts slowly, producing hydrogen gas and the lithium salt of the acid. With water-containing acids, LiH reacts faster than with water.[3]: 8 Many reactions of LiH with oxygen-containing species yield LiOH, which in turn irreversibly reacts with LiH at temperatures above 300 °C:[3]: 10
- LiH + LiOH → Li2O + H2
Lithium hydride is rather unreactive at moderate temperatures with O2 or Cl2. It is, therefore, used in the synthesis of other useful hydrides,[8] e.g.,
- 8 LiH + Al2Cl6 → 2 Li[AlH4] + 6 LiCl
- 2 LiH + B2H6 → 2 Li[BH4]
Applications[edit]
Hydrogen storage and fuel[edit]
With a hydrogen content in proportion to its mass three times that of NaH, LiH has the highest hydrogen content of any hydride. LiH is periodically of interest for hydrogen storage, but applications have been thwarted by its stability to decomposition. Thus removal of H2 requires temperatures above the 700 °C used for its synthesis, such temperatures are expensive to create and maintain. The compound was once tested as a fuel component in a model rocket.[9][10]
Precursor to complex metal hydrides[edit]
LiH is not usually a hydride-reducing agent, except in the synthesis of hydrides of certain metalloids. For example, silane is produced in the reaction of lithium hydride and silicon tetrachloride by the Sundermeyer process:
- 4 LiH + SiCl4 → 4 LiCl + SiH4
Lithium hydride is used in the production of a variety of reagents for organic synthesis, such as lithium aluminium hydride (Li[AlH4]) and lithium borohydride (Li[BH4]). Triethylborane reacts to give superhydride (Li[BH(CH2CH3)3]).[11]
In nuclear chemistry and physics[edit]
Lithium hydride (LiH) is sometimes a desirable material for the shielding of nuclear reactors, with the isotope lithium-6 (Li-6), and it can be fabricated by casting.[12][13]
Lithium deuteride[edit]
Lithium deuteride, in the form of lithium-7 deuteride (7Li2H or 7LiD), is a good moderator for nuclear reactors, because deuterium (2H or D) has a lower neutron absorption cross-section than ordinary hydrogen or protium (1H) does, and the cross-section for 7Li is also low, decreasing the absorption of neutrons in a reactor. 7Li is preferred for a moderator because it has a lower neutron capture cross-section, and it also forms less tritium (3H or T) under bombardment with neutrons.[14]
The corresponding lithium-6 deuteride (6Li2H or 6LiD) is the primary fusion fuel in thermonuclear weapons. In hydrogen warheads of the Teller–Ulam design, a nuclear fission trigger explodes to heat and compress the lithium-6 deuteride, and to bombard the 6LiD with neutrons to produce tritium in an exothermic reaction:
- 6LiD + n → 4He + T + D
The deuterium and tritium then fuse to produce helium, one neutron, and 17.59 MeV of free energy in the form of gamma rays, kinetic energy, etc. The helium is an inert byproduct.
Before the Castle Bravo nuclear weapons test in 1954, it was thought that only the less common isotope 6Li would breed tritium when struck with fast neutrons. The Castle Bravo test showed (accidentally) that the more plentiful 7Li also does so under extreme conditions, albeit by an endothermic reaction.
Safety[edit]
LiH reacts violently with water to give hydrogen gas and LiOH, which is caustic. Consequently, LiH dust can explode in humid air, or even in dry air due to static electricity. At concentrations of 5–55 mg/m3 in air the dust is extremely irritating to the mucous membranes and skin and may cause an allergic reaction. Because of the irritation, LiH is normally rejected rather than accumulated by the body.[3]: 157, 182
Some lithium salts, which can be produced in LiH reactions, are toxic. LiH fire should not be extinguished using carbon dioxide, carbon tetrachloride, or aqueous fire extinguishers; it should be smothered by covering with a metal object or graphite or dolomite powder. Sand is less suitable, as it can explode when mixed with burning LiH, especially if not dry. LiH is normally transported in oil, using containers made of ceramic, certain plastics or steel, and is handled in an atmosphere of dry argon or helium.[3]: 156 Nitrogen can be used, but not at elevated temperatures, as it reacts with lithium.[3]: 157 LiH normally contains some metallic lithium, which corrodes steel or silica containers at elevated temperatures.[3]: 173–174, 179
References[edit]
- ^ a b c Lide, D. R., ed. (2005). CRC Handbook of Chemistry and Physics (86th ed.). Boca Raton (FL): CRC Press. p. 4.70. ISBN 0-8493-0486-5.
- ^ David Arthur Johnson; Open University (12 August 2002). Metals and chemical change. Royal Society of Chemistry. pp. 167–. ISBN 978-0-85404-665-2. Retrieved 1 November 2011.
- ^ a b c d e f g h i j k l m n o p q r s t u v w x y z aa ab ac ad Smith, R. L.; Miser, J. W. (1963). Compilation of the properties of lithium hydride. NASA.
- ^ a b c NIOSH Pocket Guide to Chemical Hazards. “#0371”. National Institute for Occupational Safety and Health (NIOSH).
- ^ Chambers, Michael. “ChemIDplus – 7580-67-8 – SIAPCJWMELPYOE-UHFFFAOYSA-N – Lithium hydride – Similar structures search, synonyms, formulas, resource links, and other chemical information”. chem.sis.nlm.nih.gov. Retrieved 10 April 2018.
- ^ “Lithium hydride”. Immediately Dangerous to Life or Health Concentrations (IDLH). National Institute for Occupational Safety and Health (NIOSH).
- ^ Solvent-and catalyst-free mechanochemical synthesis of alkali metal monohydrides
IZ Hlova, A Castle, JF Goldston, S Gupta, T Prost… – Journal of Materials Chemistry A, 2016 - ^ “NCERT Chemistry Textbook” (PDF).
- ^ Lex Archived 2008-07-23 at the Wayback Machine. Astronautix.com (1964-04-25). Retrieved on 2011-11-01.
- ^ Empirical laws for hybrid combustion of lithium hydride with fluorine in small rocket engines. Ntrs.nasa.gov. Retrieved on 2011-11-01.
(password-protected)
- ^ Peter Rittmeyer, Ulrich Wietelmann “Hydrides” in Ullmann’s Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a13_199
- ^ Peter J. Turchi (1998). Propulsion techniques: action and reaction. AIAA. pp. 339–. ISBN 978-1-56347-115-5. Retrieved 2 November 2011.
- ^ Welch, Frank H. (February 1974). “Lithium hydride: A space age shielding material”. Nuclear Engineering and Design. 26 (3): 440–460. doi:10.1016/0029-5493(74)90082-X.
- ^ Massie, Mark; Dewan, Leslie C. “US 20130083878 A1, April 4, 2013, NUCLEAR REACTORS AND RELATED METHODS AND APPARATUS”. U.S. Patent Office. U.S. Government. Retrieved 2 June 2016.
External links[edit]
- University of Southampton, Mountbatten Centre for International Studies, Nuclear History Working Paper No5.
- CDC – NIOSH Pocket Guide to Chemical Hazards











![{displaystyle {mathsf {4LiH+AlCl_{3} {xrightarrow { }} Li[AlH_{4}]+3LiCl}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/47ae4c0f845b22ff47ac8d77d2b9885aed77b624)
