Гомологи и изомеры. Что это такое и как их строить?
Знаток
(305),
закрыт
11 лет назад
rafael ahmetov
Высший разум
(122431)
11 лет назад
Изомеры – это вещества имеющие одинаковый атомный состав, но порядок соединения атомов между собой различается.
Гомологи – это в принципе бесконечный ряд веществ, относящихся к одному и тому же классу, отличающихся друг от друга на некоторое количество атомов углерода и удвоенное количество атомов водорода (в простейшем случае группы -СН2-). Формулы гомологов получаются так, в формуле исходного вещества разрываешь одну ординарную (простую, или сигма) связь и вставляешь туда группу (-СН2-).
Например, был этиловый спирт (этанол) СН3-СН2-ОН. В формуле этого вещества (1- три связи С-Н в метильной группе) , (2 – две связи С-Н в метиленовой группе) , (3 – одна О-Н связь в гидроксильной группе) , (4 – одна С-С- связь) , (5 – одна С-О) связь. Разрывая любую из них, и вставляя группу (-СН2-) получаем:
1) СН3-СН2-СН2-ОН – пропиловый спирт (пропанол) , тоже относится к классу спиртов, является гомологом этанола.
2) СН3-СН (СН3)-ОН – тоже получился спирт, но строение его отличается от спирта, полученного в случае 1. Это соединение называется изопропиловый спирт (изопропанол, т. е изомер пропанола, или 1-метилэтанол) . Изопропанол является гомологом по отношению к этанолу. Пропанол и изопропанол являются изомерами по отношению друг к другу.
3) СН3-СН2-О-СН3. Получилось вещество того же состава, что и в предыдущих двух случаях, но оно не относится к классу спиртов, а относится к классу простых эфиров. Называется этилметиловый эфир или метилэтиловый эфир. Это вещество является межклассовым изомером по отношению к пропанолу и изопропанолу, но гомологом этанола не является.
4) СН3-СН2-СН2-ОН, опять получился пропанол.
5) СН3-СН2-СН2-ОН, опять пропанол.
Таким образом, у этанола два следующих (высших гомолога) – пропанол и изопропанол.
Далее, аналогично из пропанола можно получить три бутанола (нормальный или первичный бутанол СН3-СН2-СН2-СН2-ОН, вторичный бутанол или бутанол-2 СН3-СН2-СН (ОН) -СН3, изобутанол или 2-метилпропанол СН3-СН (СН3)-СН2-ОН) . Из изопропанола можно получить также три бутанола (вторичный бутанол, изобутанол и третичный бутанол СН3-С (СН3)2-ОН) . Все 4 бутанола являются изомерами по отношению друг к другу, кроме того, все 4 бутанола, оба пропанола и этанол являются гомологами по отношению друг к другу. Гомолог, можно получить не только добавляя группу (-СН2), но и исключая из молекулы группу (-СН2). Так из этанола можно получить СН3-ОН – метанол, он тоже является гомологом по отношению к этанолу. Если продолжим так и дальше, то исключив из молекулы метанола группу (-СН2) получим Н-О-Н, т. е. молекулу воды. Вода не относится к классу спиртов, и не считается гомологом метанола.
Таким образом, метанол, этанол, два пропанола, четыре бутанола образуют гомологический ряд. Этот ряд можно бесконечно (по крайней мере формально) продолжить – пентанолы, гексанолы и т. д. до бесконечности. При желании можешь потренироваться, и получить все пентанолы (их 8 различных изомеров).
Like Oops
Мыслитель
(7948)
11 лет назад
Гомологи – это вещества с разным количеством атомов водорода и углерода. Они отличаются на группу (количество групп) СН2 на главной, прямой, основной линии.
Изомеры – это вещества с ОДИНАКОВЫМ количеством атомов водорода и углерода, но отличающиеся по строению (что и видно в структурных формулах) .
И.А. Голованов
Оракул
(75272)
11 лет назад
Грубо
У гомологов могут нарастать хоть до бесконечности неактивные навески в каком то из хвостов
изомеры – атомный состав одинаков, а соединение между атомами разное.
(обычно в углеводородах, но может быть в любых)
Лекция № ___
Тема: Спирты
План:
-
Понятия «Спирты»
-
Строение спиртов
-
Гомологический ряд, номенклатура, изомерия спиртов
-
Физические свойства спиртов
-
Химические свойства спиртов
Понятия «Спирты»
Атомы водорода в углеводородах могут быть замещены на группы атомов, которые определяют не только принадлежность вещества тому или иному классу соединений, но и его физические и химические свойства. Такие группы называют функциональными.
Одной из важнейших функциональных групп в органической химии является группа
–ОН, которую называют гидроксильной (или гидроксилом).
Производные углеводородов, в которых один или несколько атомов водорода замещены на гидроксильную группу – ОН, называют спиртами.
В зависимости от типа углеводородного радикала спирты подразделяют на предельные и непредельные.
В зависимости от числа гидроксильных групп в молекуле спирты делят на одноатомные (одна гидроксильная группа), двухатомные (две гидроксильные группы), трехатомные и другие многоатомные.
Предельными одноатомными спиртами (алканолами) называют органические соединения, содержащие гидроксильную группу – ОН, связанную с алкильным радикалом: CnH2n+1-ОН
Э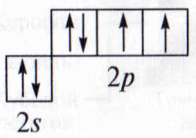 лектронное и пространственное строение гидроксильной группы. Атом кислорода в невозбужденном состоянии имеет конфигурацию внешнего электронного уровня 2s22p4; из шести электронов два являются неспаренными:
лектронное и пространственное строение гидроксильной группы. Атом кислорода в невозбужденном состоянии имеет конфигурацию внешнего электронного уровня 2s22p4; из шести электронов два являются неспаренными:
С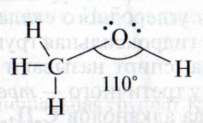 читают что атом кислорода в спиртах находится в состоянии sр3 – гибридизации. За счет двух неспаренных электронов на sp3 -орбиталях атом кислорода образует две ковалентные полярные связи с атомами водорода и углерода. На двух других орбиталях кислород содержит две пары электронов. Гидроксильная группа имеет угловую форму:
читают что атом кислорода в спиртах находится в состоянии sр3 – гибридизации. За счет двух неспаренных электронов на sp3 -орбиталях атом кислорода образует две ковалентные полярные связи с атомами водорода и углерода. На двух других орбиталях кислород содержит две пары электронов. Гидроксильная группа имеет угловую форму:
Атом кислорода за счет высокой электроотрицательности несет частичный отрицательный заряд. Атомы углерода и водорода обеднены электронной плотностью и имеют частичный положительный заряд. Таким образом, спирты представляют собой полярные соединения.
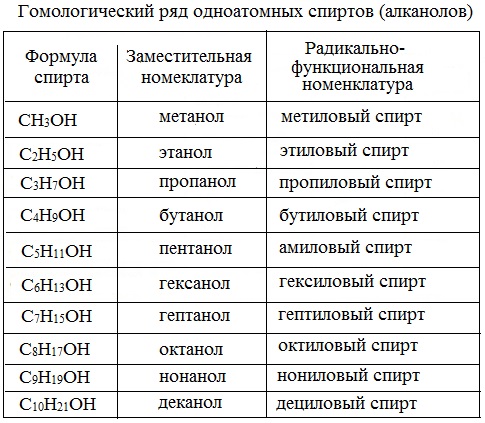
Гомологический ряд предельных одноатомных спиртов. Изомерия. Первым представителем гомологического ряда предельных одноатомных спиртов (табл. 7.1) является метиловый спирт
Таблица 7.1
Структурные формулы и названия некоторых предельных одноатомных спиртов
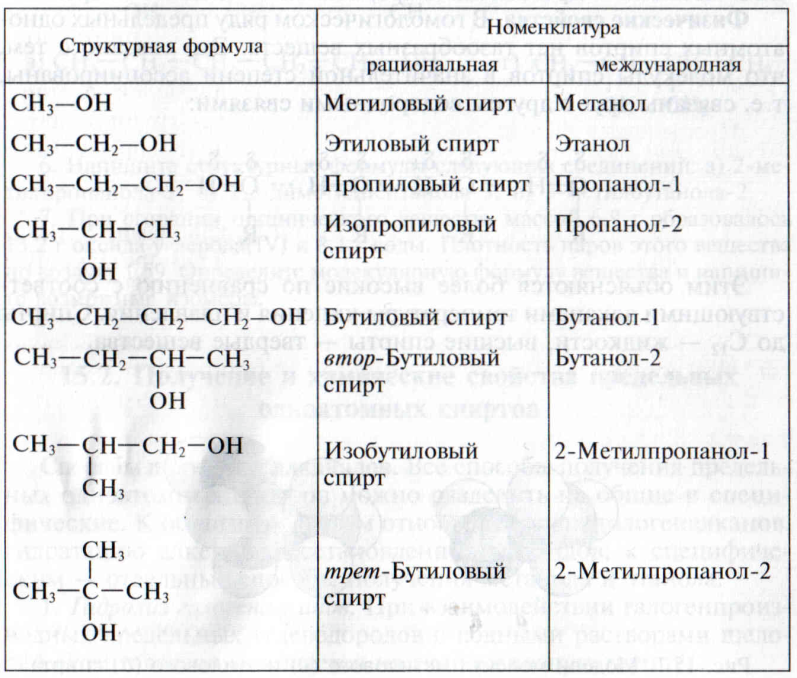
СН3ОН (метанол). За ним следует второй гомолог – этиловый спирт C2H5OH (этанол) (рис. 7.1).
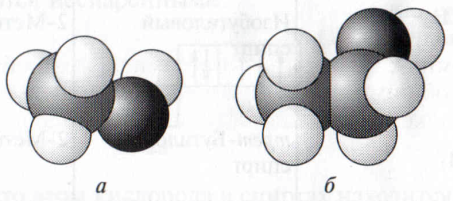
Рис. 7.1. Модели молекул метилового (а) и этилового (6) спирта
Начиная с третьего члена гомологического ряда, у спиртов появляется изомерия положения функциональной группы, а с четвертого – изомерия углеродного скелета.
Номенклатура. Если гидроксильная группа находится у первичного углеродного атома, спирт называют первичным, если у вторичного – вторичным, у третичного – третичным. Общая формула гомологического ряда алканолов СnН2n+ 1ОН.
В соответствии с правилам и международной номенклатуры при названии спиртов выбирают самую длинную цепочку углеродных атомов и нумеруют с того конца, к которому ближе гидроксильная группа. Основой служит название соответствующего углеводорода с добавлением суффикса «-ол-». Цифра после названия указывает положение гидроксильной группы в цепи.
Наряду с международной номенклатурой в русском языке широко используют иные названия спиртов. Они происходят от названия углеводородного радикала, связанного с гидроксильной группой, С добавлением слова «спирт» (например, метиловый спирт, этиловый спирт, изопропиловый спирт). Для первых членов гомологического ряда иногда применяют тривиальные названия: метанол – древесный спирт, этанол – винный спирт.
Физические свойства. В гомологическом ряду предельных одноатомных спиртов нет газообразных веществ. Это связано с тем, что молекулы спиртов в значительной степени ассоциированы, т. е. связаны друг с другом водородными связями:
![]()
Этим объясняются более высокие по сравнению с соответствующими алканами температуры кипения и плавления. Спирты до C12 – жидкости, высшие спирты – твердые вещества.
Жидкие спирты бесцветные; обладают характерным запахом. Метанол и этанол смешиваются с водой в любых соотношениях. С увеличением молекулярной массы растворимость спиртов падает. Твердые спирты в воде практически не растворимы и лишены запаха. Метанол очень ядовит. Небольшие его количества вызывают слепоту и смерть.
Получение и химические свойства предельных одноатомных спиртов
Способы получения алканолов. Все способы получения предельных одноатомных спиртов можно разделить на общие и специфические. К общим свойствам относят гидролиз галогеналканов, гидратацию алкенов, восстановление альдегидов; к специфическим – отдельные способы получения метанола и этанола.
1. Гидролиз галогеналканов. При взаимодействии галогенпроизводных предельных углеводородов с водными растворами щелочей атом галогена замещается на гидроксильную группу:
![]()
Этим способом можно получать спирты любого строения: первичные, вторичные, третичные.
2![]() . Гидратация алкенов. В присутствии кислот молекула воды присоединяется по двойной углерод-углеродной связи этиленовых углеводородов с образованием спирта. Присоединение протекает по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному атому углерода двойной связи:
. Гидратация алкенов. В присутствии кислот молекула воды присоединяется по двойной углерод-углеродной связи этиленовых углеводородов с образованием спирта. Присоединение протекает по правилу Марковникова: атом водорода присоединяется к наиболее гидрогенизированному атому углерода двойной связи:
3. Восстановление карбонильных соединений. При пропускании смеси паров альдегида (этот класс органических соединении рассмотрен в гл. 8) с водородом над никелевым катализатором происходит присоединение водорода по двойной связи углерод – кислород с образованием спирта:
![]()
4. Получение метанола. В промышленности метиловый спирт получают из водяного газа – смеси оксида углерода(II) и водорода:
![]()
Реакцию ведут при температуре 250 – 3000С в присутствии катализатора оксида цинка или оксида xpoмa(III).
5. Получение этанола. Специфическим способом получения этилового спирта является брожение растворов, содержащих сахаристые вещества, например сахарозу или глюкозу. Так, глюкоза в водном растворе под действием ферментов (органических катализаторов белковой природы) претерпевает спиртовое брожение, превращаясь в этиловый спирт:
![]()
Химические свойства спиртов. Спирты могут реагировать с разрывом связей О – Н или О – С в первом случае они проявляют очень слабые кислотные свойства. Водные растворы спиртов не действуют на индикаторы.
1. Реакции замещения атома водорода. Подобно слабым кислотам спирты взаимодействуют со щелочными металлами с образованием солей – алкоголятов – и выделением водорода. Например, металлический натрий реагирует с этиловым спиртом, образуя этилат натрия:
![]()
Алкогoляты щелочных металлов легко реагируют с водой, в результате чего образуется исходный спирт и щелочь:
C2H5ONa + Н2О C2H5OH + NaOH
2. Реакция этерификации. Важнейшим свойством спиртов является образование сложных эфиров с карбоновыми кислотами:
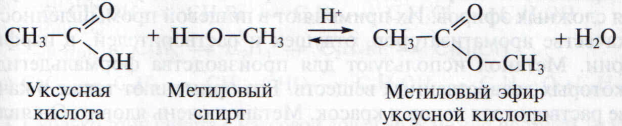
Реакции этерификации протекают в присутствии сильных кислот в качестве катализатора и являются обратимыми. (Подробнее о реакциях этерификации и сложных эфирах см. в гл. 9.)
3. Горение спиртов. Спирты горят на воздухе бледно-голубым пламенем с выделением большого количества теплоты:
C2H5OH + 3О2 2СO2 + 3H2О
Этиловый спирт рассматривают как альтернативное бензину автомобильное топливо.
4. Дегидратация спиртов. При нагревании спиртов с водоотнимающими веществами происходит отщепление молекул воды. Дегидратация может протекать как внутри одной молекулы, так и межмолекулярно.
В н у т р и м о л е к у л я р н а я дегидратация протекает при нагревании спиртов с концентрированной серной кислотой до температуры более 1800С:
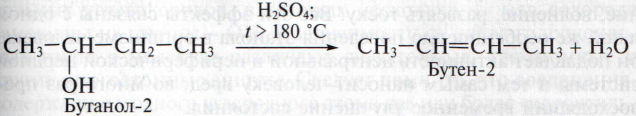
Из этилового спирта таким способом можно получить этилен. Метанол в подобную реакцию не вступает.
М е ж м о л е к у л я р н а я дегидратация спиртов происходит при более низких температурах (менее 1400С). В этом случае одна молекула воды отщепляется от двух молекул спирта и образуются соединения, относящиеся к классу простых эфиров. Они являются межклассовыми изомерами спиртов:
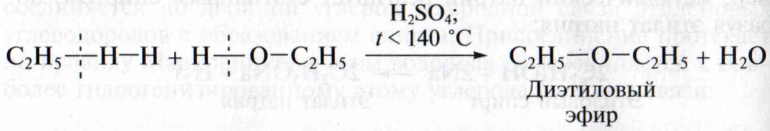
5. Взаимодействие с галогеноводородными кислотами. Спирты взаимодействуют с хлоро- и бромоводородной кислотой. При этом гидроксильная группа замещается на атом галогена:
С2Н5ОН + HBr C2H5Br + Н2О
Применение спиртов. Многие спирты используют для получения сложных эфиров. Их применяют в пищевой промышленности в качестве ароматизаторов, отдушек и растворителей, в парфюмерии. Метанол используют для производства формальдегида, некоторых лекарственных веществ. Его применяют также в качестве растворителя лаков и красок. Метанол очень ядовит. Он является нервно-сосудистым ядом. При попадании в организм от 5 до 10мл этого вещества наступает паралич зрения вследствие поражения сетчатки глаз; доза 30мл и более вызывает смерть. Наиболее широкое применение имеет этиловый спирт. В больших количествах его используют при производстве синтетического каучука. Этиловый спирт является растворителем и исходным материалом для производства лаков, медикаментов, душистых веществ, из него получают диэтиловый эфир, сложные эфиры, красители. В медицине этанол применяют как дезинфицирующее средство и растворитель для многих лекарственных форм. В ряде стран этанол используют в качестве альтернативного топлива для двигателей внутреннего сгорания.
Большое количество этилового спирта потребляет пищевая промышленность.
Алкогольные напитки могут на некоторое время улучшить самочувствие человека. Они помогают ему справиться со стрессом и расслабиться, привести в радостное состояние, снять напряжение, волнение, развеять тоску. Все эти эффекты связаны с одной и той же особенностью поведения этанола в организме человека: он подавляет активность центральной и периферической нервной системы и тем самым наносит человеку вред, во много раз превосходящий временное улучшение состояния.
Контрольные вопросы:
-
Что такое функциональная группа? Какую группу атомов называют гидроксильной?
-
Какие органические вещества называют спиртами? Как их классифицируют? Какие спирты называют предельными одноатомными?
-
Охарактеризуйте электронное строение гидроксильной группы. Как особенности химического строения предельных одноатомных спиртов отражаются на их физических свойствах?
-
Приведите названия и формулы первых пяти представителей гомологического ряда предельных одноатомных спиртов. Назовите вещества. Какова общая формула алканолов?
-
Напишите структурные формулы следующих соединений: а) 2-метилпропанола-2; б) 2,3-диметилпентанола-3; в) 3-метилбутанола-2.
-
При сгорании органического вещества массой 6,9г образовалось 13,2г оксида углерода(IV) и 8,1г воды. Плотность паров этого вещества по воздуху 1,59. Определите молекулярную формулу вещества и напишите возможные изомеры.
-
Приведите не менее трех способов получения этилового спирта. Какие из этих способов можно использовать для получения гомологов этанола?
Используемая литература:
-
Габриелян О,С. Химия: учеб для студ. Сред. Проф. Учеб. Заведений/ О.С. Габриелян, И.Г. Остроумов. – 6-е изд., стер. – М.: Издательский центр «Академия, 2009. – 336с.
-
Габриелян О,С. Химия для профессий и специальностей технического профиля: учебник/ О.С. Габриелян, И.Г. Остроумов. – М.: Издательский центр «Академия, 2009. – 256с
Гомологический ряд предельных одноатомных спиртов
Первым членом гомологического ряда спиртов является метанол Н3С–ОН, каждый последующий член гомологического ряда отличается на группу СН2.
Предельные одноатомные спирты
Насыщенные
одноатомные спирты – это производные алканов,
в молекулах которых один атом водорода замещён на гидроксильную группу.
Общая
формула насыщенных одноатомных спиртов CnH2n+1OH. В общем виде формула однотомных
спиртов R
– OH,
где R
–
алкильная группа. Кроме этого, можно использовать формулу, которая отражает
молекулярный состав насыщенных одноатомных спиртов – это CnH2n+2O.
Первым
представителем этого класса является метанол – СН3ОН. В
состав функциональной группы спиртов входит атом кислорода, который обладает
высокой электроотрицательностью, поэтому атом
кислорода оттягивает на себя электронную плотность от связанных с ним атомов и
получает частичный отрицательный заряд. Атом водорода и соседний от кислорода
атом углерода приобретают частичные
положительные заряды.
При
этом связи О – Н и С – O являются
полярными.
По
правилам номенклатуры ИЮПАК названия насыщенных одноатомных спиртов образуются от названий соответствующих алканов
с добавлением суффикса –ол.
Так,
первый представитель спиртов CH3OH называется
метанол, или метиловый спирт, второй представитель имеет формулу С2Н5OH – этанол, или этиловый спирт,
третий – СН3СН2СН2OH – пропанол-1, или пропиловый спирт, четвёртый представитель гомологического
ряда одноатомных спиртов СН3(СН2)2СН2OH называется
бутанол-1, или бутиловый спирт, пятый член этого класса соединений СН3(СН2)3СН2OH называется
пентанол-1, или амиловый спирт.
При
названии спиртов следует использовать правила: нумерация углеродных атомов
начинается с того конца, ближе к которому расположена гидроксильная группа.
Названия спиртов образуются добавлением суффикса -ол
к названию соответствующего алкана, затем цифрой
указывают положение гидроксильной группы.
Например,
назовём следующие спирты. Первый спирт называется бутанол-1, так как
гидроксильная группа отходит от первого атома углерода. Второй спирт называется
бутанол-2, потому что гидроксильная группа отходит от второго атома углерода.
Для
того, чтобы назвать спирт с разветвлённой углеродной цепью, начинать отсчёт
следует с того конца, ближе к которому расположена гидроксильная группа.
Указывают положение заместителей, названия заместителей перечисляются в
алфавитном порядке и затем цифрой указывается положение гидроксильной группой.
Назовём
следующие спирты. У первого вещества отсчёт начинаем слева, потому что с этой
стороны ближе расположена гидроксильная группа. От второго атома углерода
отходит заместитель «метил». Поэтому этот спирт называется 2-метилбутанол-2.
Нумерацию
у второго спирта начинаем справа, потому что с этой стороны ближе расположена
гидроксильная группа, от второго атома углерода отходит заместитель «этил», а от
пятого атома углерода – заместитель «метил». Поэтому полное название данного
спирта будет 5-метил-2-этилгексанол-1.
Для
насыщенных однотомных спиртов характерна структурная изомерия: изомерия
углеродного скелета и изомерия положения гидроксильной группы. Для
метанола и этанола изомеры отсутствуют. Рассмотрим изомерию спиртов на примере
вещества с формулой С4Н10О.
В
зависимости от строения углеродного скелета изомерами будут бутанол-1 и
2-метилпропанол-1.
В
зависимости от положения гидроксильной группы возможны ещё два изомера для
вещества состава С4Н10О. Это бутанол-2 и
2-метилпропанол-2.
Спирты
широко используются для различных синтезов. Во многих производствах спирты
используют как растворители. Так, метанол, или метиловый спирт используется в
синтезе при получении формальдегида, в производстве пластмасс, для синтеза
лекарственных веществ. Метанол является хорошим растворителем.
Метанол
является сильным ядом. Употребление нескольких граммов метанола приводит к
слепоте, а затем к смерти.
Этанол,
или этиловый спирт используется в лакокрасочной промышленности,
фармацевтической промышленности, при получении взрывчатых веществ, при
производстве бытовой химии, этанол применяют в кондитерском деле.
Этанол
является исходным веществом в производстве диэтилового
эфира, этилацетата, из этанола получают уксусную кислоту.
Спирт-ректификат
– это смесь этанола и воды, в котором 4,4 % воды.
Абсолютный
спирт – это безводный спирт.
Денатурат
–
это технический этанол, содержащий ядовитые и дурнопахнущие
вещества.
Этанол
оказывает негативное влияние на организм и является своего рода наркотиком.
Даже небольшие дозы этанола снижают остроту зрения, замедляют реакции и
уменьшают способность здраво рассуждать.
Длительное
употребление этого спирта приводит к тяжёлым заболеваниям нервной и
сердечно-сосудистых систем, он разрушает печень и приводит к преждевременной
смерти.
Высшие
спирты используют для изготовления медицинских препаратов, в парфюмерной и косметической
промышленности.
Ненасыщенный
аллиловый спирт применяют в производстве глицерина, в
фармацевтической и парфюмерной промышленности.
Таким
образом, насыщенные одноатомные спирты – это производные алканов,
в молекулах которых один атом водорода замещён на гидроксильную группу. Общая
формула одноатомных спиртов СnH2n+1OH. Структурная изомерия обусловлена
строением углеродного скелета и различным положением гидроксильной группы.
Спирты используют для синтеза многих органических веществ.
Характерные
особенности гомологического ряда
спиртов:
1) этиловый
спирт – один из членов гомологического
ряда;
2) другие
спирты ряда имеют аналогичное химическое
и электронное строение;
3) первый
представитель ряда – метиловый спирт;
4) в
молекулах спиртов может содержаться
не одна, а две и больше гидроксильных
групп;
5) наличие
гидроксильных групп в молекулах
обусловливает характерные химические
свойства спиртов, т. е. их химическую
функцию.
Такие
группы атомов называются функциональными
группами;
6) спиртами
называются органические вещества,
молекулы которых содержат одну или
несколько функциональных гидроксильных
групп, соединенных с углеводородным
радикалом;
7) они
могут рассматриваться как производные
углеводородов, в молекулах которых один
или несколько атомов водорода заменены
на гидроксильные группы. Спирты
приведенного выше ряда можно считать
производными предельных углеводородов,
в молекулах которых один атом водорода
заменен на гидроксильную группу;
8) это
гомологический ряд предельных одноатомных
спиртов;
9) общая
формула веществ этого ряда R-ОН.
10) по
систематической номенклатуре названия
спиртов производятся от названий
соответствующих углеводородов с
добавлением суффикса – ол; цифрой
указывают атом углерода, при котором
находится гидроксильная группа;
11) нумерация
углеродных атомов начинается с того
конца, к которому ближе функциональная
группа;
12) изомерия
спиртов обусловливается как изомерией
углеродного скелета, так и положением
гидроксильной группы. Рассмотрим ее на
примере бутиловых спиртов;
13) в
зависимости от строения углеродного
скелета изомерами будут два спирта –
производные бутана и изобутана (н-бутанол,
изобутанол);
14) в
зависимости от положения гидроксильной
группы при том и другом углеродном
скелете возможны еще изомеры (вторбутиловый
и изобутиловый спирты);
15) водородная
связь между молекулами.
Физические
свойства спиртов.
1. Прочность
водородной связи значительно меньше
прочности обычной ковалентной связи
(примерно в 10 раз).
2. За
счет водородных связей молекулы спирта
оказываются ассоциированными, как бы
прилипшими друг к другу, на разрыв этих
связей необходимо затратить дополнительную
энергию, чтобы молекулы стали свободными
и вещество приобрело летучесть.
3. Это
и является причиной более высокой
температуры кипения всех спиртов по
сравнению с соответствующими
углеводородами.
4. Вода
при такой небольшой молекулярной массе
имеет необычно высокую температуру
кипения.
40. Химические свойства и применение предельных одноатомных спиртов
Как
вещества, содержащие углерод и водород,
спирты горят при поджигании, выделяя
теплоту, например:
С2Н5ОН
+ 3O2
→ 2СO2
+ 3Н2О
+1374 кДж,
При
горении у них наблюдаются и различия.
Особенности
опыта:
1) необходимо
налить по 1 мл различных спиртов в
фарфоровые чашки и поджечь жидкости;
2) будет
заметно, что спирты – первые представители
ряда – легко воспламеняются и горят
синеватым, почти несветящимся пламенем.
Особенности
этих явлений:
а) из
свойств, обусловленных наличием
функциональной группы ОН, известно о
взаимодействии этилового спирта с
натрием: 2С2Н5ОН
+ 2Na → 2C2H5ONa
+ Н2;
б) продукт
замещения водорода в этиловом спирте
называется этилатом натрия, он может
быть выделен после реакции в твердом
виде;
в) реагируют
со щелочными металлами другие растворимые
спирты, которые образуют соответствующие
алкоголяты;
г) взаимодействие
спиртов с металлами идет с ионным
расщеплением полярной связи О-Н;
д) в
подобных реакциях у спиртов проявляются
кислотные свойства – отщепление водорода
в виде протона.
Понижение
степени диссоциации спиртов по сравнению
с водой можно объяснить влиянием
углеводородного радикала:
а) смещение
радикалом электронной плотности связи
С-О в сторону атома кислорода ведет к
увеличению на последнем частичного
отрицательного заряда, при этом он
прочнее удерживает атом водорода;
б) степень
диссоциации спиртов можно повысить,
если в молекулу ввести заместитель,
притягивающий к себе электроны химической
связи.
Это
можно объяснить следующим образом.
1. Атом
хлора смещает к себе электронную
плотность связи Сl-С.
2. Атом
углерода, приобретая вследствие этого
частичный положительный заряд, чтобы
компенсировать его, смещает в свою
сторону электронную плотность связи
С-С.
3. По
этой же причине электронная плотность
связи С-О несколько смещается к атому
углерода, а плотность связи О-Н – от
атома водорода к кислороду.
4. Возможность
отщепления водорода в виде протона от
этого возрастает, при этом степень
диссоциации вещества повышается.
5. У
спиртов может вступать в химические
реакции не только гидроксильный атом
водорода, но и вся гидроксильная группа.
6. Если
в колбе с присоединенным к ней холодильником
нагревать этиловый спирт с галогеноводородной
кислотой, например бромоводородной
(для образования бромоводорода берут
смесь бромида калия или бромида натрия
с серной кислотой), то через некоторое
время можно заметить, что в приемнике
под слоем воды собирается тяжелая
жидкость – бромэтан.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
