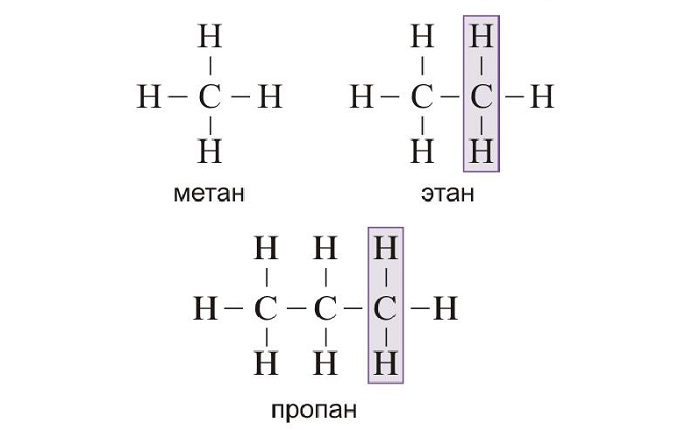
При изучении органической химии, отличающейся сложностью своих закономерностей, первое и основное, что следует понять – свойства и законы гомологических рядов.
Гомология, гомологи, гомологический ряд – определения и примеры
Гомология – химическое явление, при котором соединения отличаются друг от друга на определённое количество групп, обладают сходной характеристикой и проявляют похожие свойства.
Гомологический ряд – последовательность однотипных органических соединений, каждое из последующих имеет с предыдущим определённую гомологическую разность. При этом свойства веществ, состоящих в рядах, то есть гомологов, изменяются с определённой закономерностью.
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
-
этин — C2H2;
-
пропин — C3H4;
-
бутин — C4H6;
-
пентин — C5H8 и т. д.
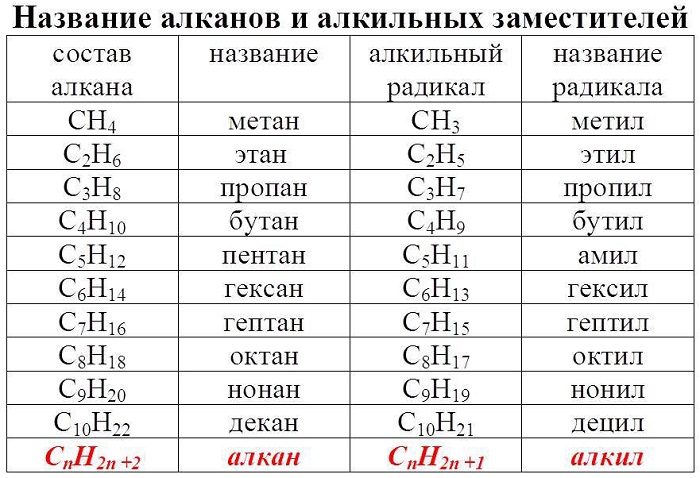
Гомологический ряд алканов в таблице
Алканы – ациклические предельные углеводороды:
-
всеобщая формула алканов — СnH2n+2;
-
названия веществ имеют суффикс -ан-.
Алканы обладают следующими свойствами:
-
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
-
нерастворимы в воде, но могут растворяться в неполярных растворителях;
-
используются в промышленности (метан – топливо, пропан – автомобильное топливо, бутан – сырье для производства каучука, пропан и бутан – балонные газы).
|
Метан |
СН4 |
|
Этан |
С2Н6 |
|
Пропан |
С3Н8 |
|
Бутан |
С4Н10 |
|
Пентан |
С5Н12 |
|
Гексан |
С6Н14 |
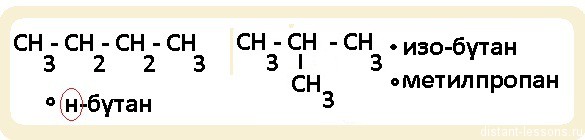
При изучении алканов стоит обращать внимание на их изомеры. Например, структурным изомером бутана является метилпропан, а пентана – метилбутан.
Алканы могут вступать в следующие реакции:
-
Горение в кислороде: СН4 + 2О2 = СО2 + 2Н2О.
-
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
-
Разложение при высокой температуре: СН4 = C + 2H2.
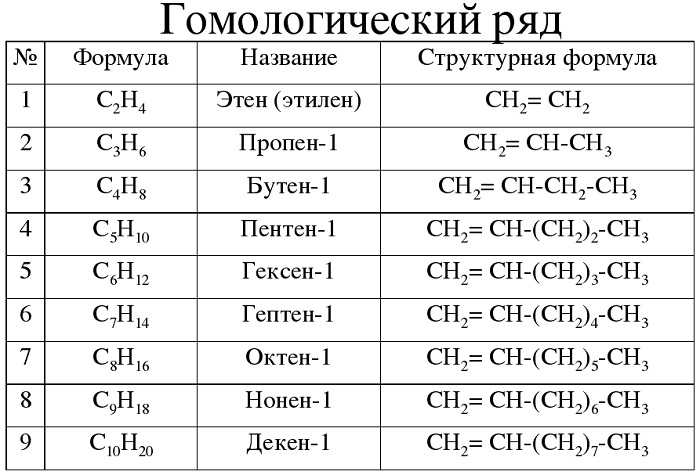
Гомологический ряд алкенов в таблице
Алкены – углеводороды, имеющие ациклический непредельный характер.
Краткая характеристика:
-
общая формула — CnH2n;
-
имеют суффикс -ен-.
Алкены обладают следующими свойствами:
-
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
-
имеют очень высокую температуру плавления и кипения;
-
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
|
Этилен |
C2H4 |
|
Пропен |
C3H6 |
|
Бутен |
C4H8 |
|
Пентен |
C5H10 |
|
Гексен |
C6H12 |
Алкены участвуют в следующих химических реакциях:
-
Горение в кислороде: C2H4 + 3O2 = 2CO2 + H2O.
-
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
-
Присоединение к водороду (гидрирование): CH2=CH-CH3 + H2 = CH3-CH2-CH3.
-
Гидратация (присоединение к воде): CH2=CH2 + H2O = CH3-CH2OH.
-
Полимеризация: nCH2=CH2 = (-CH2-CH2-) * n.
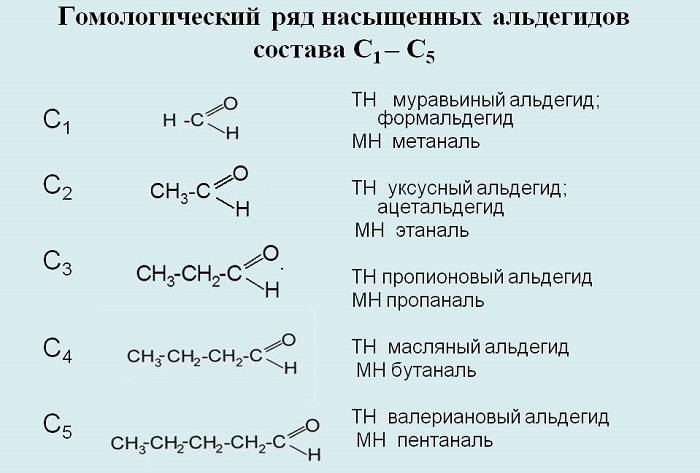
Гомологический ряд альдегидов
Альдегиды – органические вещества, имеющие в своём составе группу -CHO.
Делятся на насыщенные и алифатические насыщенные, общая молекулярная формула первых – СnH2nO, вторых – СnH2n+1CHO соответственно.
Названия составляются с помощью суффикса -аль-.
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
-
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
-
Присоединение спиртов: CH3-CH = O + C2H5OH = CH3-CH(OH)-O-C2H5.
-
Присоединение аминов: C6H5CH = O + H2NC6H5 = C6H5CH = NC6H5 + H2O.
-
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
-
низшие представители класса имеют резкий запах;
-
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
-
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
Гомологи – это вещества близкие по строению и свойствам, которые
отличаются на одну или несколько групп – СН2.
Каждый класс органических соединений имеет свою общую формулу и для
каждого класса органических соединений можно составить их гомологический ряд.
Например, алканы имеют общую
формулу CnH2n+2, где n –
число атомов углерода, причём каждый член гомологического ряда будет отличаться
от предыдущего на группу – СН2. Такая последовательность соединений
называется гомологическим рядом (от греческого homolog – «сходный»), отдельные
члены этого ряда называются гомологами, а группа атомов, на которую
отличаются соседние гомологи (группа – СН2) – гомологической
разностью.
Гомологический ряд легко построить, для этого нужно к каждому последующему
представителю добавить один атом углерода и 2 атома водорода, то есть группу –
СН2. Так, первым представителем алканов
является метан – СН4 содержит один атом углерода (Н – СН2
– Н). Второй член гомологического ряда, у которого 2 атома углерода – этан – С2Н6
(Н – СН2 – СН2 – Н). Третий член гомологического – С3Н8, у него 3 атома углерода и он отличается
от предыдущего на группу – СН2 (Н – СН2 – СН2
– СН2 – Н). Четвёртый представитель гомологического ряда алканов также отличается от предыдущего на группу – СН2,
у него уже четыре атома углерода (Н – СН2 – СН2 – СН2
– СН2 – Н).
Понятно, что гомологи отличаются молярной массой, а значит физическими
свойствами. Как правило, с увеличение числа атомов углерода в молекуле
увеличиваются температуры кипения и плавления, увеличивается плотность.
Для алкенов характерна общая формула СnH2n. Первый член
гомологического ряда имеет формулу С2Н4 и называется этен, второй представитель алкенов
– пропен – С3Н6, третий –
бутен-1,четвёртый – пентен-1. И так далее, то есть в
данном гомологическом ряду также каждый последующий член гомологического ряда
отличается от предыдущего на группу – СН2.
Для алкинов также можно составить
гомологический ряд. Общая формула алкинов – СnH2n-2, поэтому первым
представителем этого ряда будет этин, али ацетилен –
С2Н2, вторым членом ряда является пропин
– С3Н4, третим – бутин-1 – С4Н6,
четвёртым – пентин-1 – С5Н8.
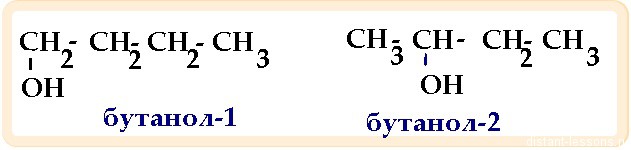
Общая формула спиртов – СnH2n+1OH. Первым членом
гомологического ряда спиртов является метанол – СН3ОН, или метиловый
спирт, затем С2Н5ОН – этанол, или этиловый спирт, третьим
представителем ряда спиртов является пропанол-1, или пропиловый
спирт – С3Н7ОН, четвёртым – бутанол-1, или бутиловый
спирт – С4Н9ОН, пятым – пентанол-1, или амиловый спирт –
С5Н11ОН. Таким образом, в этом гомологическом ряду каждый
последующий представитель отличается от предыдущего на группу -СН2.
Составим гомологический ряд альдегидов. Учитывая, что общая формула альдегидов
СnH2n+1CHO, то первым
представителем данного гомологического ряда будет метаналь,
или муравьиный альдегид – НСОН, вторым членом ряда – этаналь,
или уксусный альдегид – СН3СНО, третьим – пропаналь,
или пропионовый альдегид – СН3СН2СНО,
четвёртым – бутаналь, или масляный альдегид – СН3СН2СН2СНО
и так далее.
Аналогично и для карбоновых кислот. Так, общая формула насыщенных
одноосновных карбоновых кислот – CnH2n+1COOH. Поэтому первым
представителем данного гомологического ряда является метановая кислота, или
муравьиная – НСООН, вторым – этановая кислота, или
уксусная – СН3СООН, третьим – пропановая,
или пропионовая кислота – СН3СН2СООН,
четвёртым – бутановая, или масляная кислота – СН3СН2СН2СООН,
пятым – пентановая, или валериановая кислота – СН3СН2СН2СН2СООН.
Таким образом, для каждого класса органических соединений можно составить
гомологический ряд, учитывая общую формулу данного класса. Каждый последующий
член гомологического ряда отличается от предыдущего на группу – СН2,
которую называют гомологической разность. А сами вещества этого ряда называются
гомологами. Как правило, с увеличением числа атомов углерода в гомологическом
ряду увеличиваются температуры плавления и кипения, увеличивается плотность.
Строение органических соединений
28-Май-2013 | комментария 2 | Лолита Окольнова
Вопрос A13 ЕГЭ по химии —
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Темы, которые нужно знать:
- Номенклатура ИЮПАК
- Органическая химия
- Алканы
- Алкены
- Циклоалканы
- Алкины
- Алкадиены
- Бензол и его гомологи
Эти вопросы входят в анализ строения каждого класса веществ в органической химии, но в данном вопросе нам нужно свести все эти знания воедино. Давайте рассмотрим каждое определение, каждый пункт этого вопроса, исходя из знаний строения всех органических веществ.
Изомеры и гомологи
Не вдаваясь в сложные формулировки, давайте определим, что такое гомологи и изомеры.
Гомологи — относятся к одному классу веществ (например, алканы). Это значит, что у них:
- Одинаковая общая формула (на примере алканов — (СnH2n+2) и
- Схожие химические свойства, которые определяются одинаковым строением веществ.
- Гомологи отличаются друг от друга на одну или несколько -CH2— групп
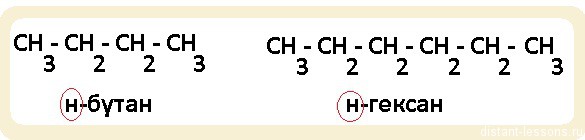
Обратите внимание, именно н-бутан и н-гексан будут относится к гомологам. Если мы возьмем н-алкан (линейная молекула) и разветвленный алкан, то, хотя у них будет одна и та же общая формула (СnH2n+2), по химическим свойствам они будут несколько различаться, т.к. разветвленное строение этих органических соединений будет оказывать влияние на направление протекания реакций.
Изомеры —химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим)
Виды изомерии:
- Структурная изомерия — (изомерия углеродного скелета)
- Межклассовая изомерия — характерна для соединений, имеющих одинаковую общую формулу, но принадлежащих к разным классам (и следовательно, иемющим разные химические и физические свойства)
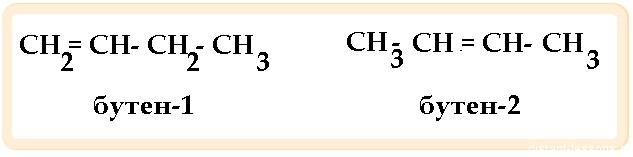
- Изомерия положения кратной связи — вид изомерии, характерный для соединений с количеством атомов углерода больше 3-х и имеющих двойные или тройные связи:
- Изомерия положения функциональной группы -вид изомерии, характерный для кислород- и азотсодержащих органических соединений:
- Пространственная изомерия — в школьном курсе подготовки к ЕГЭ рассматривают пространственную цис-транс-изомерию алкенов. Этот вид изомерии характерен для симметричных относительно двойной связи алкенов:
Виды химической связи в органической химии
Т.к. органическая химия — это химия соединений углерода, то основным видом химической связи является ковалентная химическая связь.
- В углеводородах эта связь — ковалентная малополярная;
- В кислород-, азот- и серасодержащих органических соединениях — ковалентная полярная;
- В случаях алкоголятов или солей органических кислот — ионная (CH3COONa например).
Как и в неорганических соединениях, в органических вид химической связи определяют исходя из строения вещества.
Когда ковалентная связь -С-С- или -C-H разрывается, образуются частицы — радикалы. Это частицы, имеющие один электрон: (СH3• — метил ). Называют их соответственно классу соединения с окончанием -ил.
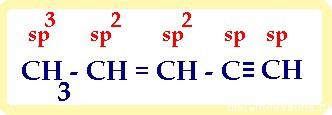
Тип гибридизации атомов в органических соединениях
Как образуется гибридизация атомных орбиталей в молекуле мы подробно рассматривали при изучении каждого класса органических соединений, здесь мы рассмотрим практическое применение этих знаний.
На что нужно обратить внимание:
1) в молекуле, имеющей не только один вид связи, каждый атом имеет свой тип гибридизации:
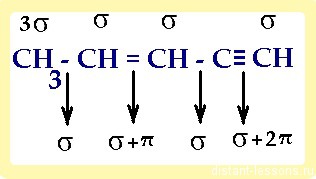
2) если нужно посчитать суммы s -и π-связей, то нужно учитывать не только связи -С-С-, но и -С-H:
итого: 10 сигма- и 3 π-связей
Давайте систематизируем все эти вопросы по классам углеводородов
| Класс соединения | Общая формула | Тип гибридизации атомов С | Виды изомерии |
| Алканы | СnH2n+2 | Sp3 |
углеродного скелета |
| Алкены | СnH2n | Sp3 и Sp2 |
углеродного скелета положения кратной связи пространственная изомерия межклассовая |
| Алкины | СnH2n-2 | Sp и Sp3 |
углеродного скелета положения кратной связи межклассовая |
| Циклоалканы | СnH2n | Sp3 | углеродного скелета, межклассовая (циклоалкалканы изомерны алкенам) |
| Алкадиены | СnH2n-2 | Sp2 и Sp3 |
углеродного скелета положения кратной связи межклассовая |
| Бензол и его гомологи | СnH2n-6 | Sp2 и (Sp3 — в боковой цепи) | углеродного скелета (в боковых цепях) |
| Алифатические спирты | СnH2n+1OH | Sp3 | углеродного скелета положения функциональной группы межклассовая — (спирты изомерны простым эфирам) |
| Ароматические спирты | СnH2n-7OH | Sp2 и (Sp3 — в боковой цепи) |
углеродного скелета положения функциональной группы межклассовая |
| Простые эфиры | СnH2n+1O | Sp3 | углеродного скелетамежклассовая (простыеэфиры изомерны спиртам) |
| Альдегиды и кетоны | СnH2nO | Sp2 (-С=O) и Sp3 | углеродного скелета — альдегиды изомерны кетонам |
| Кислоты | СnH2n+1COOH | Sp2 (-С=O) и Sp3 |
углеродного скелета положения функциональной группы межклассовая |
| Сложные эфиры | СnH2n+1COO | Sp2 (-С=O) и Sp3 |
углеродного скелета межклассовая |
Какое бы задание вам не попалось, все сводится к определению строения органического соединения, поэтому чтобы не ошибиться, рисуйте структурные формулы данных соединений, а уже из этого вы определите и тип связи, и гибридизацию, и виды изомерии.
Кстати, ответы на наши примеры вопросов:
А13 первый вариант: изомером гексена-2 не является гексадиен-1, 3 Ответ: 4)
А 13 второй вариант: только Sp2 гибридизация — в молекуле бутадиена Ответ: 4)
А 13 третий вариант: гомологами являются: пропан и пентан Ответ: 1)
[TESTME 50]
Обсуждение: “Строение органических соединений”
(Правила комментирования)
1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Предельными (насыщенными) углеводородами называются углеводороды, в молекулах которых атомы углерода связаны между собой простой связью, причём все единицы валентности, не затраченные на связь между атомами углерода, насыщены атомами водорода.
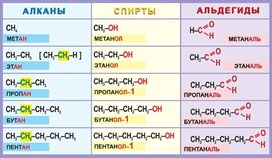
Если рассматривать углеводороды ряда метана, то нетрудно заметить, что каждый последующий углеводород можно произвести от соответствующего предыдущего замещением одного атома водорода группой CH3 (метил). Таким образом, состав молекулы последующего углеводорода увеличивается на группу CH2.
Ряд химических соединений одного структурного типа, отличающихся друг от друга на одну или несколько структурных единиц (обычно на группу CH2), называется гомологическим рядом, а каждый из углеводов – членом гомологического ряда или гомологом. Если расположить гомологи в порядке возрастания их относительной молекулярной массы, они образуют гомологический ряд.
Группа CH2 называется гомологической разностью или гомологической разницей. Общая формула предельных углеводородов CnH2n + 2, где n – число атомов углерода в молекуле.
Если от молекулы углеводорода отнять атом водорода, то остаток молекулы с открытой связью называется углеводородным радикалом (обозначается буквой R). В свободном виде радикалы из-за большой реакционной способности не существуют.
Явление гомологии – существование рядов органических соединений, в которых формула любых двух соседей ряда отличается на одну и ту же группу (чаще всего CH2). Физико-химические свойства соединений изменяются по ходу гомологического ряда. В органической химии в основе понятие гомология основывается на фундаментальном положении о том, что химические и физические свойства соединения обусловлены структурой его молекул: эти свойства определяются и функциональными группами соединения, и его углеродным скелетом.
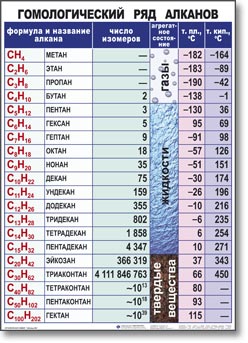
При отсутствии изомерии в случае подобия углеродных скелетов соединений формулу гомологичных соединений можно записать как X–(СН2)n–Y, соединения с различным числом n метиленовых звеньев являются гомологами и принадлежат к одному классу соединений. Итак, соединения-гомологи принадлежат к одному классу соединений, а свойства ближайших гомологов наиболее близки.
В гомологических рядах наблюдается определённая закономерное изменение свойств от младших членов ряда к старшим, но такая закономерность соблюдается не всегда, в некоторых случаях она может нарушаться. Чаще всего это происходит в начале ряда, потому что образуются водородные связи при наличии функциональных групп, способных к их образованию.
Примером гомологического ряда может служить ряд предельных углеводородов (алканов). Простейший его представитель – метан СН4. Гомологами метана являются: этан C2H6; пропан C3H8; бутан C4H10; пентан C5H12; гексан C6H14, гептан C7H16, октан – С8Н18, нонан – С9Н20, декан – С10Н22, ундекан – С11Н24, нодекан – С12Н26, тридекан – С13Н28, тетрадекан – С14Н30, пентадекан – С15Н32, эйкозан – С20Н42, пентакозан – С25Н52, триаконтан – С30Н62, тетраконтан – С40Н82, гектан – С100Н202.
Остались вопросы? Не знаете, что такое гомологический ряд?
Чтобы получить помощь репетитора – зарегистрируйтесь.
Первый урок – бесплатно!
Зарегистрироваться
© devblog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.