Как написать электронно-графическую формулу
Чтобы научиться составлять электронно-графические формулы, важно понять теорию строения атомного ядра. Ядро атома составляют протоны и нейтроны. Вокруг ядра атома на электронных орбиталях находятся электроны.
Вам понадобится
- – ручка;
- – бумага для записей;
- – периодическая система элементов (таблица Менделеева).
Инструкция
Электроны в атоме занимают свободные орбитали в последовательности, называемой шкалой энергии:1s / 2s, 2p / 3s, 3p / 4s, 3d, 4p / 5s, 4d, 5p / 6s, 4d, 5d, 6p / 7s, 5f, 6d, 7p. На одной орбитали могут располагаться два электрона с противоположными спинами – направлениями вращения.
Структуру электронных оболочек выражают с помощью графических электронных формул. Для записи формулы используйте матрицу. В одной ячейке могут располагаться один или два электрона с противоположными спинами. Электроны изображаются стрелками. Матрица наглядно показывает, что на s-орбитали могут располагаться два электрона, на p-орбитали – 6, на d – 10, на f -14.
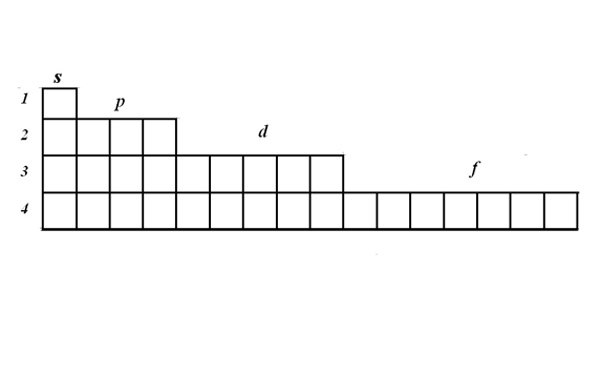
Рассмотрите принцип составления электронно-графической формулы на примере марганца. Найдите марганец в таблице Менделеева. Его порядковый номер 25, значит в атоме 25 электронов, это элемент четвертого периода.
Запишите порядковый номер и символ элемента рядом с матрицей. В соответствии со шкалой энергии заполоните последовательно 1s, 2s, 2p, 3s, 3p, 4s уровни, вписав по два электрона в ячейку. Получится 2+2+6+2+6+2=20 электронов. Эти уровни заполнены полностью.
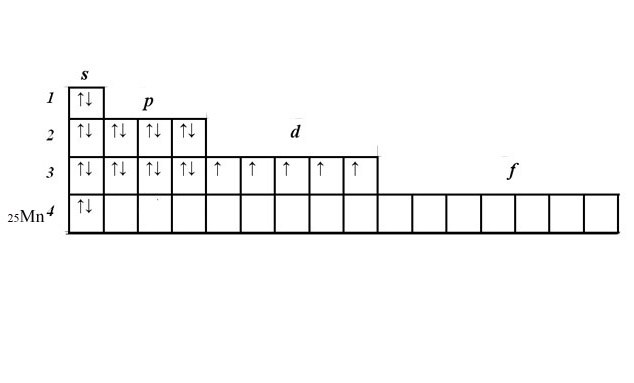
У вас осталось еще пять электронов и незаполненный 3d-уровень. Расположите электроны в ячейках d-подуровня, начиная слева. Электроны с одинаковыми спинами расположите в ячейках сначала по одному. Если все ячейки заполнены, начиная слева, добавьте по второму электрону с противоположным спином. У марганца пять d-электронов, расположенных по одному в каждой ячейке.
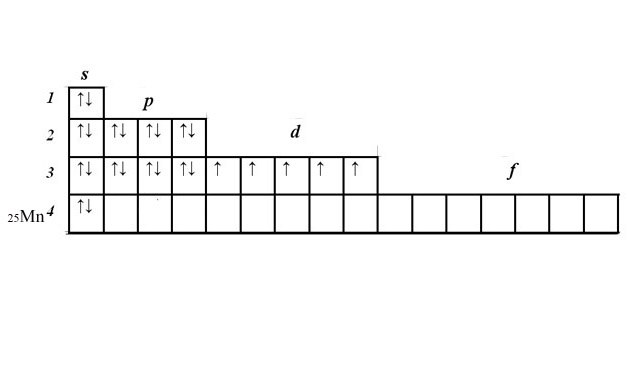
Электронно-графические формулы наглядно показывают количество неспаренных электронов, которые определяют валентность.
Обратите внимание
Помните, что химия – наука исключений. У атомов побочных подгрупп Периодической системы встречается «проскок» электрона. Например, у хрома с порядковым номером 24 один из электронов с 4s-уровня переходит в ячейку d-уровня. Похожий эффект есть у молибдена, ниобия и др. Кроме того, есть понятие возбужденного состояния атома, когда спаренные электроны распариваются и переходят на соседние орбитали. Поэтому при составлении электронно-графических формул элементов пятого и последующих периодов побочной подгруппы сверяйтесь со справочником.
Источники:
- как составить электронную формулу химического элемента
Войти на сайт
или
Забыли пароль?
Еще не зарегистрированы?
This site is protected by reCAPTCHA and the Google Privacy Policy and Terms of Service apply.
Содержание
- Электронная и электронно-графическая формула
- Что такое электронная и электронно-графическая формула
- Составление электронной и электронно-графической формулы
- Примеры решения задач
- Электронная формула элемента.
- Химия. Строение атома и составление электронно-графических формул.
Электронная и электронно-графическая формула
Что такое электронная и электронно-графическая формула
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
Составление электронной и электронно-графической формулы
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным, что наиболее наглядно отражается при составлении электронно-графических формул.
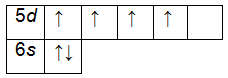
Электронно-графические формулы обычно изображают для валентных электронов. В такой формуле все электроны помечаются стрелочками, а ячейками (квадратиками) – орбитали. В одной ячейке не может находиться более двух электронов. Рассмотрим на примере ванадия. Сначала записываем электронную формулу и определяем валентные электроны:
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента алюминия. |
| Ответ | Алюминий имеет порядковый номер 13 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 13 протонов, а вокруг ядра имеется три оболочки, по которым движутся 13 электронов. |
Электронная формула алюминия выглядит следующим образом:
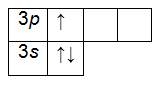
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Электронно-графическая формула имеет следующий вид:
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента хлора. |
| Ответ | Хлор имеет порядковый номер 18 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 17 протонов, а вокруг ядра имеется три оболочки, по которым движутся 17 электронов. |
Электронная формула хлора выглядит следующим образом:
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Электронно-графическая формула имеет следующий вид:
Источник
Электронная формула элемента.
Алгоритм составления электронной формулы элемента:
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей:
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s 2 , на втором – максимум 8 (два s и шесть р: 2s 2 2p 6 ), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s 2 3p 6 3d 10 ).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
1. Составим электронную формулу азота. В периодической таблице азот находится под №7.


Энергетическая диаграмма азота.
2. Составим электронную формулу аргона. В периодической таблице аргон находится под №18.

Энергетическая диаграмма аргона.
3. Составим электронную формулу хрома. В периодической таблице хром находится под №24.

Энергетическая диаграмма цинка.
4. Составим электронную формулу цинка. В периодической таблице цинк находится под №30.
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10
Обратим внимание, что часть электронной формулы, а именно 1s 2 2s 2 2p 6 3s 2 3p 6 – это электронная формула аргона.
Электронную формулу цинка можно представить в виде:
Источник
Химия. Строение атома и составление электронно-графических формул.
Прежде, чем перейти непосредственно к составлению электронно-графических формул, стоит кратко сказать о природе электрона. Дело в том, что электрон не представляет собой материальную частицу, и сказать, где он находится в данный момент времени нельзя. Вместо этого оперируют таким понятием, как атомная орбиталь.
Атомная орбиталь — область вокруг ядра атома, в которой вероятность нахождения электрона максимальна (более 90%).
В настоящее время достоверно известно о четырех видах орбиталей: s, p, d, f. Элементы, в которых превалирует та или иная орбиталь изображены в периодической системе.
Как правило, s-элементы обозначают красным, p-элементы — желтым, d-элементы — синим или зеленым, f-элементы — зеленым или фиолетовым.
У каждой орбитали имеется своя форма. s — шар, p — «восьмерка», d — две перекрещенные «восьмерки», f — «восьмерка» с описанной торой (фигура, похожая на бублик).
Для описания состояния конкретного электрона используются так называемые квантовые числа. Всего их четыре:
1) главное квантовое число (N) — описывает энергию, которую имеет электрон, и принимает значения от 1 до бесконечности. Когда N равно бесконечности, электрон отрывается от атома.
2) побочное квантовое число (l) — отвечает за количество подуровней. Принимает значения, равные N-1.
3) магнитное квантовое число(m(l)) — отвечает за форму орбитали и принимает значения от -l до l, включая l=0. Также это число отвечает за число возможных положений орбитали в пространстве.
Эти положения изображаются в виде так называемых квантовых ячеек, и их количество равно числу положений.
4) Спиновое число (m(s)) — отвечает за направление вращения электрона (спин). Принимает значения +1/2 или -1/2.
Переходим непосредственно к заполнению атома электронами. Оно выполняется по следующим правилам:
1) Принцип наименьшей энергии — сначала заполняются уровни, энергия которых минимальна. 1s
2) Правило Гунда — суммарный спин электронов должен быть максимальным. Высчитать его просто: нужно сложить спин всех электронов. Стрелка, направленная вверх обозначает спин +1/2, вниз — -1/2.
3) Принцип Паули — в атоме не може быть двух электронов, обладающих одинаковым набором квантовых чисел.
Источник
Содержание
- Электронная и электронно-графическая формула
- Что такое электронная и электронно-графическая формула
- Составление электронной и электронно-графической формулы
- Примеры решения задач
- Химические формулы веществ
- Знаки химических элементов
- Таблица 1: Информация, которую дает химический знак
- Случаи, когда название химического знака читается иначе, приведены в таблице 2:
- Химические формулы простых веществ
- Таблица 3: Информация, которую дает химический знак
- Химические формулы сложных веществ
- Таблица 4: Информация, которую дает химическая формула сложного вещества
- Графические формулы
- Для составления графической (структурной) формулы вещества необходимо:
Электронная и электронно-графическая формула
Что такое электронная и электронно-графическая формула
Наиболее часто электронные формулы записывают для атомов в основном или возбужденном состоянии и для ионов.
Существует несколько правил, которые необходимо учитывать при составлении электронной формулы атома химического элемента. Это принцип Паули, правила Клечковского или правило Хунда.
Составление электронной и электронно-графической формулы
При составление электронной формулы следует учитывать, что номер периода химического элемента определяет число энергетических уровней (оболочек) в атоме, а его порядковый номер количество электронов.
Согласно правилу Клечковского, заполнение энергетических уровней происходит в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n:
1s 2 2s 2 2p 6 3s 1 .
При заполнение электронами энергетических подуровней также необходимо соблюдать правило Хунда: в данном подуровне электроны стремятся занять энергетические состояния таким образом, чтобы суммарный спин был максимальным, что наиболее наглядно отражается при составлении электронно-графических формул.
Электронно-графические формулы обычно изображают для валентных электронов. В такой формуле все электроны помечаются стрелочками, а ячейками (квадратиками) – орбитали. В одной ячейке не может находиться более двух электронов. Рассмотрим на примере ванадия. Сначала записываем электронную формулу и определяем валентные электроны:
Внешний энергетический уровень атома вольфрама содержит 6 электронов, которые являются валентными. Энергетическая диаграмма основного состояния принимает следующий вид:

Примеры решения задач
| Задание | Изобразите электронную и электронно-графическую формулу химического элемента алюминия. |
| Ответ | Алюминий имеет порядковый номер 13 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 13 протонов, а вокруг ядра имеется три оболочки, по которым движутся 13 электронов. |
Электронная формула алюминия выглядит следующим образом:
На внешнем энергетическом уровне алюминия находится три электрона, все электроны 3-го подуровня. Электронно-графическая формула имеет следующий вид:

| Задание | Изобразите электронную и электронно-графическую формулу химического элемента хлора. |
| Ответ | Хлор имеет порядковый номер 18 и расположен в третьем периоде Периодической системы Д.И. Менделеева, следовательно, атом этого химического элемента состоит из положительно заряженного ядра, внутри которого находится 17 протонов, а вокруг ядра имеется три оболочки, по которым движутся 17 электронов. |
Электронная формула хлора выглядит следующим образом:
На внешнем энергетическом уровне атома хлора находится семь электронов, все они считаются валентными. Электронно-графическая формула имеет следующий вид:
Источник
Химические формулы веществ
Химические формула – это изображение качественного и количественного состава вещества с помощью символов химических элементов.
Знаки химических элементов
Химический знак или химический символ элемента – это первая или две первые буквы от латинского названия этого элемента.
Например: Ferrum – Fe , Cuprum – Cu , Oxygenium – O и т.д.
Таблица 1: Информация, которую дает химический знак
На примере Cl Название элемента Хлор Принадлежность элемента к данному классу химических элементов Неметалл, галоген Один атом элемента 1 атом хлора Относительная атомная масса (Ar) данного элемента Ar(Cl) = 35,5 Абсолютная атомная масса химического элемента
m = Ar · 1,66·10 -24 г = Ar · 1,66 · 10 -27 кг M(Cl) = 35,5 · 1,66 · 10 -24 = 58,9 · 10 -24 г
Название химического знака в большинстве случаев читается как название химического элемента. Например, К – калий, Са – кальций, Mg – магний, Mn – марганец.
Случаи, когда название химического знака читается иначе, приведены в таблице 2:
| Название химического элемента | Химический знак | Название химического знака |
(произношение) Азот N Эн Водород H Аш Железо Fe Феррум Золото Au Аурум Кислород O О Кремний Si Силициум Медь Cu Купрум Олово Sn Станум Ртуть Hg Гидраргиум Свинец Pb Плюмбум Сера S Эс Серебро Ag Аргентум Углерод C Цэ Фосфор P Пэ
Химические формулы простых веществ
Химическими формулами большинства простых веществ (всех металлов и многих неметаллов) являются знаки соответствующих химических элементов.
Так вещество железо и химический элемент железо обозначаются одинаково – Fe .
Если простое вещество имеет молекулярную структуру (существует в виде молекул, то его формулой является химический знак элемента с индексом внизу справа, указывающим число атомов в молекуле: H 2 , O 2 , O 3 , N 2 , F 2 , Cl 2 , Br 2 , P 4 , S 8 .
Таблица 3: Информация, которую дает химический знак
На примере C Название вещества Углерод (алмаз, графит, графен, карбин) Принадлежность элемента к данному классу химических элементов Неметалл Один атом элемента 1 атом углерода Относительная атомная масса (Ar) элемента, образующего вещество Ar(C) = 12 Абсолютная атомная масса M(C) = 12 · 1,66 · 10-24 = 19,93 · 10 -24 г Один моль вещества 1 моль углерода, т.е. 6,02 · 10 23 атомов углерода Молярная масса вещества M(C) = Ar(C) = 12 г/моль
Химические формулы сложных веществ
Формулу сложного вещества составляют путем записи знаков химических элементов, из которых это вещество состоит, с указанием числа атомов каждого элемента в молекуле. При этом, как правило, химические элементы записывают в порядке увеличения их электроотрицательности в соответствии со следующим практическим рядом:
Me , Si , B , Te , H , P , As , I , Se , C , S , Br , Cl , N , O , F
Например, H2O , CaSO4 , Al2O3 , CS2 , OF2 , NaH .
Исключение составляют:
- некоторые соединения азота с водородом (например, аммиакNH3 , гидразинN2H4 );
- соли органических кислот (например, формиат натрияHCOONa , ацетат кальция(CH3COO)2Ca) ;
- углеводороды ( CH4 , C2H4 , C2H2 ).
Химические формулы веществ, существующих в виде димеров ( NO2 , P2O3 , P2O5 , соли одновалентной ртути, например: HgCl , HgNO3 и др.), записывают в виде N2 O4 , P4 O6 , P4 O10 , Hg2 Cl2 , Hg2( NO3)2 .
Число атомов химического элемента в молекуле и сложном ионе определяется на основании понятия валентности или степени окисления и записывается индексом внизу справа от знака каждого элемента (индекс 1 опускается). При этом исходят из правила:
алгебраическая сумма степеней окисления всех атомов в молекуле должна быть равной нулю (молекулы электронейтральны), а в сложном ионе – заряду иона.
Этим же правилом пользуются при определении степени окисления химического элемента по формуле вещества или сложного иона. Обычно это элемент, имеющий несколько степеней окисления. Степени окисления остальных элементов, образующих молекулу или ион должны быть известны.
Заряд сложного иона – это алгебраическая сумма степеней окисления всех атомов, образующих ион. Поэтому при определении степени окисления химического элемента в сложном ионе сам ион заключается в скобки, а его заряд выносится за скобки.
При составлении формул по валентности вещество представляют, как соединение, состоящее из двух частиц различного типа, валентности которых известны. Далее пользуются правилом:
в молекуле произведение валентности на число частиц одного типа должно быть равным произведению валентности на число частиц другого типа.
Например:
Цифра, стоящая перед формулой в уравнении реакции, называется коэффициентом. Она указывает либо число молекул, либо число молей вещества.
Коэффициент, стоящий перед химическим знаком, указывает число атомов данного химического элемента, а в случае, когда знак является формулой простого вещества, коэффициент указывает либо число атомов, либо число молей этого вещества.
Например:
- 3Fe – три атома железа, 3 моль атомов железа,
- 2H – два атома водорода, 2 моль атомов водорода,
- H2 – одна молекула водорода, 1 моль водорода.
Химические формулы многих веществ были определены опытным путем, поэтому их называют «эмпирическими».
Таблица 4: Информация, которую дает химическая формула сложного вещества
На примере C aCO3 Название вещества Карбонат кальция Принадлежность элемента к определенному классу веществ Средняя (нормальная) соль Одна молекула вещества 1 молекула карбоната кальция Один моль вещества 6,02 · 10 23 молекул CaCO3 Относительная молекулярная масса вещества (Мr) Мr(CaCO3) = Ar(Ca)+Ar(C) +3Ar(O)=100 Молярная масса вещества (M) М(CaCO3) = 100 г/моль Абсолютная молекулярная масса вещества (m) M(CaCO3) = Mr(CaCO3) · 1,66 · 10 -24 г = 1,66 · 10 -22 г Качественный состав (какие химические элементы образуют вещество) кальций, углерод, кислород Количественный состав вещества: Число атомов каждого элемента в одной молекуле вещества: молекула карбоната кальция состоит из 1 атома кальция, 1 атома углерода и 3 атомов кислорода. Число молей каждого элемента в 1 моле вещества:
В 1 моль СаСО3 (6,02 ·10 23 молекулах) содержится 1 моль (6,02 ·10 23 атомов) кальция, 1 моль (6,02 ·10 23 атомов) углерода и 3 моль (3·6,02·10 23 атомов) химического элемента кислорода)
Массовый состав вещества: Масса каждого элемента в 1 моле вещества: 1 моль карбоната кальция (100г) содержит химических элементов: 40г кальция, 12г углерода, 48г кислорода. Массовые доли химических элементов в веществе (состав вещества в процентах по массе): Для вещества с ионной структурой (соли, кислоты, основания) – формула вещества дает информацию о числе ионов каждого вида в молекуле, их количестве и массе ионов в 1 моль вещества:
Молекула СаСО3 состоит из иона Са 2+ и иона СО3 2-
1 моль (6,02·10 23 молекул) СаСО3 содержит 1 моль ионов Са 2+ и 1 моль ионов СО3 2- ;
1 моль (100г) карбоната кальция содержит 40г ионов Са 2+ и 60г ионов СО3 2-
Молярный объем вещества при нормальных условиях (только для газов)
Графические формулы
Для получения более полной информации о веществе пользуются графическими формулами , которые указывают порядок соединения атомов в молекуле и валентность каждого элемента.
Графические формулы веществ, состоящих из молекул, иногда, в той или иной степени, отражают и строение (структуру) этих молекул, в этих случаях их можно назвать структурными .
Для составления графической (структурной) формулы вещества необходимо:
- Определить валентность всех химических элементов, образующих вещество.
- Записать знаки всех химических элементов, образующих вещество, каждый в количестве, равном числу атомов данного элемента в молекуле.
- Соединить знаки химических элементов черточками. Каждая черточка обозначает электроннуюпару, осуществляющую связь между химическими элементами и поэтому одинаково принадлежит обоим элементам.
- Число черточек, окружающих знак химического элемента, должно соответствовать валентности этого химического элемента.
- При составлении формул кислородсодержащих кислот и их солей атомы водорода и атомы металлов связываются с кислотообразующим элементом через атом кислорода.
- Атомы кислорода соединяют друг с другом только при составлении формул пероксидов.
Примеры графических формул:
Источник
Электронные формулы химических элементов


4.6
Средняя оценка: 4.6
Всего получено оценок: 652.
4.6
Средняя оценка: 4.6
Всего получено оценок: 652.
Расположение электронов на энергетических оболочках или уровнях записывают с помощью электронных формул химических элементов. Электронные формулы или конфигурации помогают представить структуру атома элемента.
Строение атома
Чтобы читать электронные формулы, необходимо понять строение атома.
Атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронов, которые располагаются вокруг ядра.
Электроны находятся на разных энергетических уровнях. Чем дальше электрон находится от ядра, тем большей энергией он обладает. Размер энергетического уровня определяется размером атомной орбитали или орбитального облака. Это пространство, в котором движется электрон.
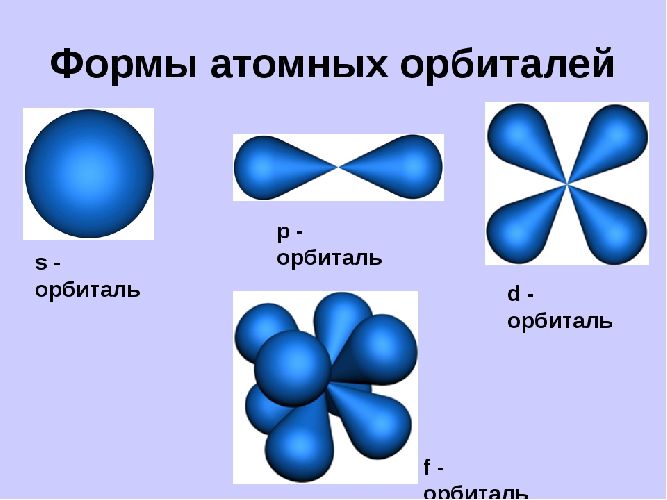
Орбитали могут иметь разную геометрическую конфигурацию:
- s-орбитали – сферические;
- р-, d и f-орбитали – гантелеобразные, лежащие в разных плоскостях.
На первом энергетическом уровне любого атома всегда располагается s-орбиталь с двумя электронами (исключение – водород). Начиная со второго уровня, на одном уровне находятся s- и р-орбитали.
Орбитали существуют вне зависимости от нахождения на них электронов и могут быть заполненными или вакантными.
Запись формулы
Электронные конфигурации атомов химических элементов записываются по следующим принципам:
- каждому энергетическому уровню соответствует порядковый номер, обозначаемый арабской цифрой;
- за номером следует буква, означающая орбиталь;
- над буквой пишется верхний индекс, соответствующий количеству электронов на орбитали.
Примеры записи:
- кальций –
1s22s22p63s23p64s2;
- кислород –
1s22s22p4;
- углерод –
Записать электронную формулу помогает таблица Менделеева. Количеству энергетических уровней соответствует номер периода. На заряд атома и количество электронов указывает порядковый номер элемента. Номер группы показывает, сколько валентных электронов находится на внешнем уровне.
Для примера возьмём Na. Натрий находится в первой группе, в третьем периоде, под 11 номером. Это значит, что атом натрия имеет положительно заряженное ядро (содержит 11 протонов), вокруг которого на трёх энергетических уровнях располагается 11 электронов. На внешнем уровне находится один электрон.
Вспомним, что первый энергетический уровень содержит s-орбиталь с двумя электронами, а второй – s- и р-орбитали. Остаётся заполнить уровни и получить полную запись:
+11 Na )2)8)1 или 1s22s22p63s1.
Для удобства созданы специальные таблицы электронных формул элемента. В длинной периодической таблице формулы также указываются в каждой клетке элемента.
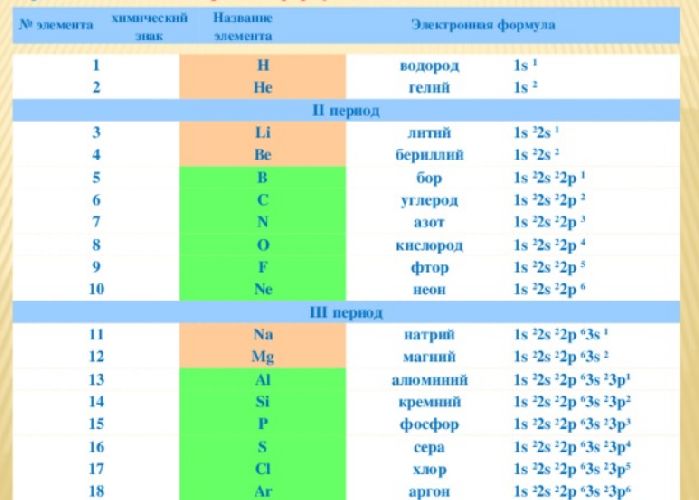
Для краткости в квадратных скобках записаны элементы, электронная формула которых совпадает с началом формулы элемента. Например, электронная формула магния – [Ne]3s2, неона – 1s22s22p6. Следовательно, полная формула магния – 1s22s22p63s2.

Что мы узнали?
Электронные формулы элементов отражают расположение электронов в атоме на разных орбиталях. Количество электронов равно порядковому номеру элемента, количество уровней – номеру периода. На последнем уровне находятся валентные электроны, соответствующие номеру группы элемента. Цифры в электронной формуле показывают уровень, буквы – орбиталь, индексы – количество электронов на уровне.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5
-

Александр Котков
5/5
-

Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 652.
А какая ваша оценка?
Здравствуйте, уважаемые читатели!
Обучение школьников составлению электронных формул химических элементов в большинстве случае производится в соответствии со следующим алгоритмом: (https://www.calc.ru/Elektronnaya-Formula-Elementa.html).
1. Определите число электронов в атоме, используя Периодическую таблицу химических элементов Д.И. Менделеева.
2. По номеру периода, в котором расположен элемент, определите число энергетических уровней; число электронов на последнем электронном уровне соответствует номеру группы.
3. Уровни разбить на подуровни и орбитали и заполнить их электронами в соответствии с правилами заполнения орбиталей:
Необходимо помнить, что на первом уровне находится максимум 2 электрона 1s2, на втором – максимум 8 (два s и шесть р: 2s22p6), на третьем – максимум 18 ( два s, шесть p, и десять d: 3s2 3p6 3d10).
- Главное квантовое число n должно быть минимально.
- Первым заполняется s-подуровень, затем р-, d- b f-подуровни.
- Электроны заполняют орбитали в порядке возрастания энергии орбиталей (правило Клечковского).
- В пределах подуровня электроны сначала по одному занимают свободные орбитали, и только после этого образуют пары (правило Хунда).
- На одной орбитали не может быть больше двух электронов (принцип Паули).
Как правило, использование этого алгоритма подразумевает распределение электронов по уровням и подуровням с помощью расчетов, т. е на основе постоянного сравнения количества уже учтенных в электронной формуле электронов с общим количеством электронов в атомов. Использование же таблицы Менделеева при этом минимально.
Это можно проследить на множестве обучающих видеоматериалов, в которых авторы обращаются к ТМ практически только за порядковым номером элемента:
или используют ее раскраску:
Проанализировав более 20 видеоматериалов на данную тему, я смогла найти только один, в котором в качестве основы составления формул использовались не расчеты и не искусственные подсказки в виде разной раскраски знаков элементов, а сама структура таблицы Менделеева (10-12 минуты видео):
Преподавание – творческий процесс, каждый преподаватель выбирает те приемы и алгоритмы, которые близки его психологическим характеристикам. Сказывается также и первоначальное знакомство с данным материалом на уроках химии, когда сам преподаватель был школьником.
Ни в коей мере не претендуя на навязывание алгоритмов, по которым работаю, хочу познакомить (или напомнить), как составлять полные и сокращенные электронные формулы с помощью таблицы Менделеева. С данным приемом я познакомилась на уроках моей мамы в далекие советские годы, а затем – на лекциях и семинарах по неорганике в МИТХТ. Об эффективности этого приема может свидетельствовать то, что электронные формулы элементов четырех периодов легко составляли даже те мои одноклассники, которые с трудом могли посчитать молярную массу.
На приведенном ниже видео я попыталась показать, как, используя 2 источника – алгоритм заполнения электронами орбиталей и таблицу Менделеева, можно легко составлять полные и сокращенные электронные формулы любого химического элемента. Заранее прошу прощения за технические и терминологические ляпы (например, “элемент” вместо “атом”), а также за “жаргонные” словечки (вроде “прощелкать по клеткам”). Дело в том, что это видео -мой первый опыт в создании видеоматериалов.
Всего доброго!
