Загрузить PDF
Загрузить PDF
Электронная конфигурация атома — это численное представление его электронных орбиталей. Электронные орбитали — это области различной формы, расположенные вокруг атомного ядра, в которых математически вероятно нахождение электрона. Электронная конфигурация помогает быстро и с легкостью сказать читателю, сколько электронных орбиталей есть у атома, а также определить количество электронов, находящихся на каждой орбитали. Прочитав эту статью, вы освоите метод составления электронных конфигураций.
-
1
Найдите атомный номер вашего атома. Каждый атом имеет определенное число электронов, связанных с ним. Найдите символ вашего атома в таблице Менделеева. Атомный номер — это целое положительное число, начинающееся от 1 (у водорода) и возрастающее на единицу у каждого последующего атома. Атомный номер — это число протонов в атоме, и, следовательно, это еще и число электронов атома с нулевым зарядом.
-
2
Определите заряд атома. Нейтральные атомы будут иметь столько же электронов, сколько показано в таблице Менделеева. Однако заряженные атомы будут иметь большее или меньшее число электронов — в зависимости от величины их заряда. Если вы работаете с заряженным атомом, добавляйте или вычитайте электроны следующим образом: добавляйте один электрон на каждый отрицательный заряд и вычитайте один на каждый положительный.
- Например, атом натрия с зарядом -1 будет иметь дополнительный электрон в добавок к своему базовому атомному числу 11. Иначе говоря, в сумме у атома будет 12 электронов.
- Если речь идет об атоме натрия с зарядом +1, от базового атомного числа 11 нужно отнять один электрон. Таким образом, у атома будет 10 электронов.
-
3
Запомните базовый список орбиталей. По мере того, как у атома увеличивается число электронов, они заполняют различные подуровни электронной оболочки атома согласно определенной последовательности. Каждый подуровень электронной оболочки, будучи заполненным, содержит четное число электронов. Имеются следующие подуровни:
- s-подуровень (любое число в электронной конфигурации, которое стоит перед буквой “s”) содержит единственную орбиталь, и, согласно Принципу Паули, одна орбиталь может содержать максимум 2 электрона, следовательно, на каждом s-подуровне электронной оболочки может находиться 2 электрона.
- p-подуровень содержит 3 орбитали, и поэтому может содержать максимум 6 электронов.
- d-подуровень содержит 5 орбиталей, поэтому в нем может быть до 10 электронов.
- f-подуровень содержит 7 орбиталей, поэтому в нем может быть до 14 электронов.
- g-, h-, i- и k-подуровни являются теоретическими. Атомы, содержащие электроны в этих орбиталях, неизвестны. g-подуровень содержит 9 орбиталей, поэтому теоретически в нем может быть 18 электронов. В h-подуровне может быть 11 орбиталей и максимум 22 электрона; в i-подуровне —13 орбиталей и максимум 26 электронов; в k-подуровне — 15 орбиталей и максимум 30 электронов.
- Запомните порядок орбиталей с помощью мнемонического приема:[1]
Sober Physicists Don’t Find Giraffes Hiding In Kitchens (трезвые физики не находят жирафов, скрывающихся на кухнях).
-
4
Разберитесь в записи электронной конфигурации. Электронные конфигурации записываются для того, чтобы четко отразить количество электронов на каждой орбитали. Орбитали записываются последовательно, причем количество атомов в каждой орбитали записывается как верхний индекс справа от названия орбитали. Завершенная электронная конфигурация имеет вид последовательности обозначений подуровней и верхних индексов.
- Вот, например, простейшая электронная конфигурация: 1s2 2s2 2p6. Эта конфигурация показывает, что на подуровне 1s имеется два электрона, два электрона — на подуровне 2s и шесть электронов на подуровне 2p. 2 + 2 + 6 = 10 электронов в сумме. Это электронная конфигурация нейтрального атома неона (атомный номер неона — 10).
-
5
Запомните порядок орбиталей. Имейте в виду, что электронные орбитали нумеруются в порядке возрастания номера электронной оболочки, но располагаются по возрастанию энергии. Например, заполненная орбиталь 4s2 имеет меньшую энергию (или менее подвижна), чем частично заполненная или заполненная 3d10, поэтому сначала записывается орбиталь 4s. Как только вы будете знать порядок орбиталей, вы сможете с легкостью заполнять их в соответствии с количеством электронов в атоме. Порядок заполнения орбиталей следующий: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p.
- Электронная конфигурация атома, в котором заполнены все орбитали, будет иметь следующий вид: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d107p6
- Обратите внимание, что приведенная выше запись, когда заполнены все орбитали, является электронной конфигурацией элемента Uuo (унуноктия) 118, атома периодической системы с самым большим номером. Поэтому данная электронная конфигурация содержит все известные в наше время электронные подуровни нейтрально заряженного атома.
-
6
Заполняйте орбитали согласно количеству электронов в вашем атоме. Например, если мы хотим записать электронную конфигурацию нейтрального атома кальция, мы должны начать с поиска его атомного номера в таблице Менделеева. Его атомный номер — 20, поэтому мы напишем конфигурацию атома с 20 электронами согласно приведенному выше порядку.
- Заполняйте орбитали согласно приведенному выше порядку, пока не достигнете двадцатого электрона. На первой 1s орбитали будут находится два электрона, на 2s орбитали — также два, на 2p — шесть, на 3s — два, на 3p — 6, и на 4s — 2 (2 + 2 + 6 +2 +6 + 2 = 20.) Иными словами, электронная конфигурация кальция имеет вид: 1s2 2s2 2p6 3s2 3p6 4s2.
- Обратите внимание: орбитали располагаются в порядке возрастания энергии. Например, когда вы уже готовы перейти на 4-й энергетический уровень, то сначала записывайте 4s орбиталь, а затем 3d. После четвертого энергетического уровня вы переходите на пятый, на котором повторяется такой же порядок. Это происходит только после третьего энергетического уровня.
-
7
Используйте таблицу Менделеева как визуальную подсказку. Вы, вероятно, уже заметили, что форма периодической системы соответствует порядку электронных подуровней в электронных конфигурациях. Например, атомы во второй колонке слева всегда заканчиваются на “s2“, а атомы на правом краю тонкой средней части оканчиваются на “d10” и т.д. Используйте периодическую систему как визуальное руководство к написанию конфигураций — как порядок, согласно которому вы добавляете к орбиталям соответствует вашему положению в таблице. Смотрите ниже:
- В частности, две самые левые колонки содержат атомы, чьи электронные конфигурации заканчиваются s-орбиталями, в правом блоке таблицы представлены атомы, чьи конфигурации заканчиваются p-орбиталями, а в нижней части атомы заканчиваются f-орбиталями.
- Например, когда вы записываете электронную конфигурацию хлора, размышляйте следующим образом: “Этот атом расположен в третьем ряду (или “периоде”) таблицы Менделеева. Также он располагается в пятой группе орбитального блока p периодической системы. Поэтому, его электронная конфигурация будет заканчиваться на …3p5
- Обратите внимание: элементы в области орбиталей d и f таблицы характеризуются энергетическими уровнями, которые не соответствуют периоду, в котором они расположены. Например, первый ряд блока элементов с d-орбиталями соответствует 3d орбиталям, хотя и располагается в 4 периоде, а первый ряд элементов с f-орбиталями соответствует орбитали 4f, несмотря на то, что он находится в 6 периоде.
-
8
Выучите сокращения написания длинных электронных конфигураций. Атомы на правом краю периодической системы называются благородными газами. Эти элементы химически очень устойчивы. Чтобы сократить процесс написания длинных электронных конфигураций, просто записывайте в квадратных скобках химический символ ближайшего благородного газа с меньшим по сравнению с вашим атомом числом электронов, а затем продолжайте писать электронную конфигурацию последующих орбитальных уровней. Смотрите ниже:
- Чтобы понять эту концепцию, полезно будет написать пример конфигурации. Давайте напишем конфигурацию цинка (атомный номер 30), используя сокращение, включающее благородный газ. Полная конфигурация цинка выглядит так: 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Однако мы видим, что 1s2 2s2 2p6 3s2 3p6 — это электронная конфигурация аргона, благородного газа. Просто замените часть записи электронной конфигурации цинка химическим символом аргона в квадратных скобках ([Ar].)
- Итак, электронная конфигурация цинка, записанная в сокращенном виде, имеет вид: [Ar]4s2 3d10.
- Учтите, если вы пишете электронную конфигурацию благородного газа, скажем, аргона, писать [Ar] нельзя! Нужно использовать сокращение благородного газа, стоящего перед этим элементом; для аргона это будет неон ([Ne]).
Реклама
-

1
Освойте периодическую таблицу ADOMAH. Данный метод записи электронной конфигурации не требует запоминания, однако требует наличия переделанной периодической таблицы, поскольку в традиционной таблице Менделеева, начиная с четвертого периода, номер периода не соответствует электронной оболочке. Найдите периодическую таблицу ADOMAH — особый тип периодической таблицы, разработанный ученым Валерием Циммерманом. Ее легко найти посредством короткого поиска в интернете.[2]
- В периодической таблице ADOMAH горизонтальные ряды представляют группы элементов, такие как галогены, инертные газы, щелочные металлы, щелочноземельные металлы и т.д. Вертикальные колонки соответствуют электронным уровням, а так называемые “каскады” (диагональные линии, соединяющие блоки s,p,d и f) соответствуют периодам.
- Гелий перемещен к водороду, поскольку оба этих элемента характеризуются орбиталью 1s. Блоки периодов (s,p,d и f) показаны с правой стороны, а номера уровней приведены в основании. Элементы представлены в прямоугольниках, пронумерованных от 1 до 120. Эти номера являются обычными атомными номерами, которые представляют общее количество электронов в нейтральном атоме.
-
2
Найдите ваш атом в таблице ADOMAH. Чтобы записать электронную конфигурацию элемента, найдите его символ в периодической таблице ADOMAH и вычеркните все элементы с большим атомным номером. Например, если вам нужно записать электронную конфигурацию эрбия (68), вычеркните все элементы от 69 до 120.
- Обратите внимание на номера от 1 до 8 в основании таблицы. Это номера электронных уровней, или номера колонок. Игнорируйте колонки, которые содержат только вычеркнутые элементы. Для эрбия остаются колонки с номерами 1,2,3,4,5 и 6.
-
3
Посчитайте орбитальные подуровни до вашего элемента. Смотря на символы блоков, приведенные справа от таблицы (s, p, d, and f), и на номера колонок, показанные в основании, игнорируйте диагональные линии между блоками и разбейте колонки на блоки-колонки, перечислив их по порядку снизу вверх. И снова игнорируйте блоки, в которых вычеркнуты все элементы. Запишите блоки-колонки, начиная от номера колонки, за которым следует символ блока, таким образом: 1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s (для эрбия).
- Обратите внимание: Приведенная выше электронная конфигурация Er записана в порядке возрастания номера электронного подуровня. Ее можно также записать в порядке заполнения орбиталей. Для этого следуйте по каскадам снизу вверх, а не по колонкам, когда вы записываете блоки-колонки: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f12.
-
4
Посчитайте электроны для каждого электронного подуровня. Подсчитайте элементы, в каждом блоке-колонке которые не были вычеркнуты, прикрепляя по одному электрону от каждого элемента, и запишите их количество рядом с символом блока для каждого блока-колонки таким образом: 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f12 5s2 5p6 6s2. В нашем примере это электронная конфигурация эрбия.
-
5
Учитывайте неправильные электронные конфигурации. Существует восемнадцать типичных исключений, относящихся к электронным конфигурациям атомов в состоянии с наименьшей энергией, также называемом основным энергетическим состоянием. Они не подчиняются общему правилу только по последним двум-трем положениям, занимаемым электронами. При этом действительная электронная конфигурация предполагает нахождение электронов в состоянии с более низкой энергией в сравнении со стандартной конфигурацией атома. К атомам-исключениям относятся:
- Cr (…, 3d5, 4s1); Cu (…, 3d10, 4s1); Nb (…, 4d4, 5s1); Mo (…, 4d5, 5s1); Ru (…, 4d7, 5s1); Rh (…, 4d8, 5s1); Pd (…, 4d10, 5s0); Ag (…, 4d10, 5s1); La (…, 5d1, 6s2); Ce (…, 4f1, 5d1, 6s2); Gd (…, 4f7, 5d1, 6s2); Au (…, 5d10, 6s1); Ac (…, 6d1, 7s2); Th (…, 6d2, 7s2); Pa (…, 5f2, 6d1, 7s2); U (…, 5f3, 6d1, 7s2); Np (…, 5f4, 6d1, 7s2) и Cm (…, 5f7, 6d1, 7s2).
Реклама
Советы
- Чтобы найти атомный номер атома, когда он записан в форме электронной конфигурации, просто сложите все числа, которые идут за буквами (s, p, d, и f). Это работает только для нейтральных атомов, если вы имеете дело с ионом, то ничего не получится — вам придется добавить или вычесть количество дополнительных или потерянных электронов.
- Число, идущее за буквой — это верхний индекс, не сделайте ошибку в контрольной.
- “Стабильности полузаполненного” подуровня не существует. Это упрощение. Любая стабильность, которая относится к “наполовину заполненным” подуровням, имеет место из-за того, что каждая орбиталь занята одним электроном, поэтому минимизируется отталкивание между электронами.
- Каждый атом стремится к стабильному состоянию, а самые стабильные конфигурации имеют заполненные подуровни s и p (s2 и p6). Такая конфигурация есть у благородных газов, поэтому они редко вступают в реакции и в таблице Менделеева расположены справа. Поэтому, если конфигурация заканчивается на 3p4, то для достижения стабильного состояния ей необходимо два электрона (чтобы потерять шесть, включая электроны s-подуровня, потребуется больше энергии, поэтому потерять четыре легче). А если конфигурация оканчивается на 4d3, то для достижения стабильного состояния ей необходимо потерять три электрона. Кроме того, полузаполненные подуровни (s1, p3, d5..) являются более стабильными, чем, например, p4 или p2; однако s2 и p6 будут еще более устойчивыми.
- Когда вы имеете дело с ионом, это значит, что количество протонов не равно количеству электронов. Заряд атома в этом случае будет изображен сверху справа (как правило) от химического символа. Поэтому атом сурьмы с зарядом +2 имеет электронную конфигурацию 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p1. Обратите внимание, что 5p3 изменилось на 5p1. Будьте внимательны, когда конфигурация нейтрального атома заканчивается на подуровни, отличные от s и p. Когда вы забираете электроны, вы можете забрать их только с валентных орбиталей (s и p орбиталей). Поэтому, если конфигурация заканчивается на 4s2 3d7 и атом получает заряд +2, то конфигурация будет заканчиваться 4s0 3d7. Обратите внимание, что 3d7 не меняется, вместо этого теряются электроны s-орбитали.
- Существуют условия, когда электрон вынужден “перейти на более высокий энергетический уровень”. Когда подуровню не хватает одного электрона до половинной или полной заполненности, заберите один электрон из ближайшего s или p- подуровня и переместите его на тот подуровень, которому необходим электрон.
- Имеется два варианта записи электронной конфигурации. Их можно записывать в порядке возрастания номеров энергетических уровней или в порядке заполнения электронных орбиталей, как было показано выше для эрбия.
- Также вы можете записывать электронную конфигурацию элемента, записав лишь валентную конфигурацию, которая представляет собой последний s и p подуровень. Таким образом, валентная конфигурация сурьмы будет иметь вид 5s2 5p3.
- Ионы не то же самое. С ними гораздо сложнее. Пропустите два уровня и действуйте по той же схеме в зависимости от того, где вы начали, и от того, насколько велико количество электронов.
Реклама
Об этой статье
Эту страницу просматривали 481 953 раза.
Была ли эта статья полезной?
Электронная формула химического элемента показывает то, как происходит распределение электронов на орбиталях в атоме по энергетическим уровням и подуровням.
Вот что нужно обязательно знать, чтобы правильно составить электронную формулу элемента:
I.
Все орбитали и находящееся на ней электроны характеризуют несколько квантовых чисел.
Среди них в первую очередь стоит выделить числа n и l.
- n – главное квантовое число, определяет общую энергию электрона на орбитали. Это число характеризует энергетический уровень и может принимать значение от 1 до 7.
- l – орбитальное квантовое число. Это число характеризует форму орбитали и энергетический подуровень.
Существует 4 вида орбиталей, различающихся своей формой и направленностью в пространстве.
- s-орбитали (l = 0),
- p-орбитали (l = 1),
- d-орбитали (l = 2),
- f-орбитали (l = 3).
Самое простое строение у s-орбитали, самое сложное – у f-орбитали.
II.
Каждый энергетический уровень содержит n подуровней (то есть чем больше главное квантовое число, тем больше подуровней).
Количество орбиталей, которое может быть на том или ином подуровне, определяется по формуле 2l + 1.
Согласно принципу Паули на одной орбитали может быть максимум 2 электрона (если находится 1 электрон, то он называется неспаренным, если 2 электрона – то это электронная пара).
Таким образом, будет нетрудно посчитать, сколько орбиталей и электронов может включать в себя каждый подуровень.
-
s-подуровень включает 2 * 0 + 1 = 1 орбиталь и 1 * 2 = 2 электрона.
-
p-подуровень включает 2 * 1 + 1 = 3 орбитали и 3 * 2 = 6 электронов.
-
d-подуровень включает 2 * 2 + 1 = 5 орбиталей и 5 * 2 = 10 электронов.
-
f-подуровень включает 2 * 3 + 1 = 7 орбиталей и 7 * 2 = 14 электронов.
III.
Заполнение орбиталей электронами осуществляется по правилу Клечковского (в порядке возрастания суммы главного и орбитального квантовых чисел (n + l), а при равных значениях этой суммы – в порядке возрастания n).
1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d и т.д.
Здесь действует принцип минимума энергии, при котором электроны заполняют орбитали начиная с подуровня с наименьшей энергией.
IV.
Максимальное количество электронов на энергетическом уровне определяется по формуле N = 2n².
Эта формула вытекает из принципа из принципа Паули.
Исходя из формулы на первом уровне может быть максимум 2 электрона (s2), на втором уровне – максимум 8 электронов (2s2 2p6), на третьем уровне – максимум 18 электронов (3s2 3p6 3d10).
V.
Заполнение орбиталей внутри одного подуровня происходит по правилу Хунда.
Согласно этому правилу каждая орбиталь подуровня заполняется сначала одним электроном, а после исчерпания свободных орбиталей к имеющемуся электрону на орбитали добавляется парный электрон.
**
При составлении электронных формул элементов также понадобится периодическая система Д.И. Менделеева.
С её помощью можно определить:
-
Количество электронов в атоме – оно равно порядковому номеру элемента в периодической таблице.
-
Число энергетических уровней – оно равно номеру периода данного элемента.
-
Число электронов на последнем уровне – оно равно номеру группы.
**
Пример.
Сера (S).
Это 16 элемент по счёту: количество электронов в атоме будет равно 16.
Находится в 3 периоде: всего будет 3 уровня.
Сначала заполняем 1 уровень: 1s2, на нём будет только 2 электрона.
Далее заполняем 2 уровень: 2s2 2p6, на нём будет 8 электронов.
Оставшиеся 6 электронов будет на 3 уровне (а это как раз номер группы): 3s2 3p4.
В результате получаем следующее:
1s2 2s2 2p6 3s2 3p4.
Электронные формулы химических элементов


4.6
Средняя оценка: 4.6
Всего получено оценок: 648.
4.6
Средняя оценка: 4.6
Всего получено оценок: 648.
Расположение электронов на энергетических оболочках или уровнях записывают с помощью электронных формул химических элементов. Электронные формулы или конфигурации помогают представить структуру атома элемента.
Строение атома
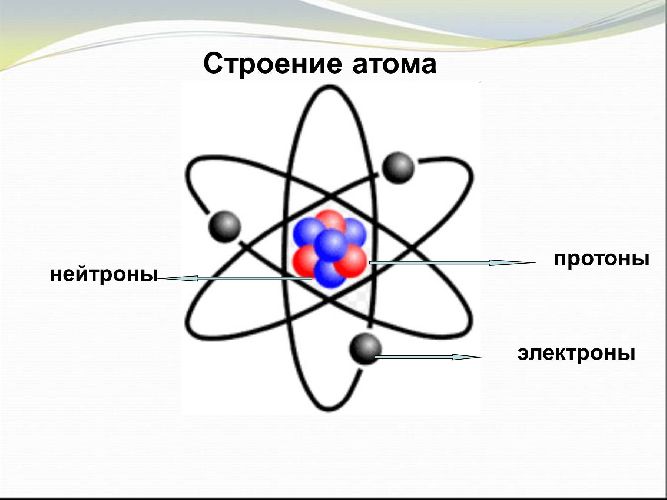
Чтобы читать электронные формулы, необходимо понять строение атома.
Атомы всех элементов состоят из положительно заряженного ядра и отрицательно заряженных электронов, которые располагаются вокруг ядра.
Электроны находятся на разных энергетических уровнях. Чем дальше электрон находится от ядра, тем большей энергией он обладает. Размер энергетического уровня определяется размером атомной орбитали или орбитального облака. Это пространство, в котором движется электрон.
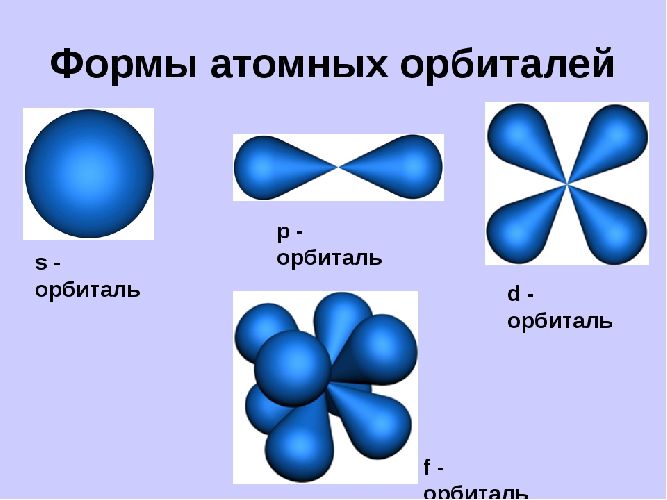
Орбитали могут иметь разную геометрическую конфигурацию:
- s-орбитали – сферические;
- р-, d и f-орбитали – гантелеобразные, лежащие в разных плоскостях.
На первом энергетическом уровне любого атома всегда располагается s-орбиталь с двумя электронами (исключение – водород). Начиная со второго уровня, на одном уровне находятся s- и р-орбитали.
Орбитали существуют вне зависимости от нахождения на них электронов и могут быть заполненными или вакантными.
Запись формулы
Электронные конфигурации атомов химических элементов записываются по следующим принципам:
- каждому энергетическому уровню соответствует порядковый номер, обозначаемый арабской цифрой;
- за номером следует буква, означающая орбиталь;
- над буквой пишется верхний индекс, соответствующий количеству электронов на орбитали.
Примеры записи:
- кальций –
1s22s22p63s23p64s2;
- кислород –
1s22s22p4;
- углерод –
Записать электронную формулу помогает таблица Менделеева. Количеству энергетических уровней соответствует номер периода. На заряд атома и количество электронов указывает порядковый номер элемента. Номер группы показывает, сколько валентных электронов находится на внешнем уровне.
Для примера возьмём Na. Натрий находится в первой группе, в третьем периоде, под 11 номером. Это значит, что атом натрия имеет положительно заряженное ядро (содержит 11 протонов), вокруг которого на трёх энергетических уровнях располагается 11 электронов. На внешнем уровне находится один электрон.
Вспомним, что первый энергетический уровень содержит s-орбиталь с двумя электронами, а второй – s- и р-орбитали. Остаётся заполнить уровни и получить полную запись:
+11 Na )2)8)1 или 1s22s22p63s1.
Для удобства созданы специальные таблицы электронных формул элемента. В длинной периодической таблице формулы также указываются в каждой клетке элемента.
Для краткости в квадратных скобках записаны элементы, электронная формула которых совпадает с началом формулы элемента. Например, электронная формула магния – [Ne]3s2, неона – 1s22s22p6. Следовательно, полная формула магния – 1s22s22p63s2.

Что мы узнали?
Электронные формулы элементов отражают расположение электронов в атоме на разных орбиталях. Количество электронов равно порядковому номеру элемента, количество уровней – номеру периода. На последнем уровне находятся валентные электроны, соответствующие номеру группы элемента. Цифры в электронной формуле показывают уровень, буквы – орбиталь, индексы – количество электронов на уровне.
Тест по теме
Доска почёта

Чтобы попасть сюда – пройдите тест.
-

Александр Котков
5/5
-

Александр Котков
5/5
-

Александр Котков
5/5
Оценка доклада
4.6
Средняя оценка: 4.6
Всего получено оценок: 648.
А какая ваша оценка?
Строение электронных оболочек атомов
На этом уроке вы узнаете, как устроена электронная оболочка атома, и сможете объяснить явление периодичности. Познакомитесь с моделями строения электронных оболочек атомов, с помощью которых можно предсказать и объяснить свойства химических элементов и их соединений.
I. Состояние электронов в атоме
Выдающийся датский физик Нильс Бор (Рис. 1) предположил, что электроны в атоме могут двигаться не по любым, а по строго определенным орбитам.
При этом электроны в атоме различаются своей энергией. Как показывают опыты, одни из них притягиваются к ядру сильнее, другие – слабее. Главная причина этого заключается в разном удалении электронов от ядра атома. Чем ближе электроны к ядру, тем они прочнее связаны с ним и их труднее вырвать из электронной оболочки. Таким образом, по мере удаления от ядра атома запас энергии электрона увеличивается.
Электроны, движущиеся вблизи ядра, как бы загораживают (экранируют) ядро от других электронов, которые притягиваются к ядру слабее и движутся на большем удалении от него. Так образуются электронные слои.
Каждый электронный слой состоит из электронов.
Электрон вращается вокруг ядра атома с невообразимой скоростью. Так, за 1 секунду он делает столько оборотов вокруг ядра атома, сколько оборотов делает пропеллер самолета вокруг оси за 5–5,5 лет непрерывной работы двигателя. Пропеллер самолета образует «облако», находящееся в одной плоскости, а электрон образует объемное облако –электронное облако, форма и размер которого зависят от энергии электрона.
Если обозначить точками все вероятные места нахождения электрона в атомном пространстве за некоторое время, то совокупность этих точек будет представлять собойэлектронное облако.
II. Электронное облако
Электронное облако – это модель, которая описывает состояние (движение) электрона в атоме.
Электронное облако не имеет строго очерченных границ и плотность его неравномерна.
Часть атомного пространства, в котором вероятность нахождения электрона наибольшая (~90%), называется орбиталью.
|
Виды электронных орбиталей |
Форма орбитали в пространстве |
Количество орбиталей в атоме. Условное обозначение орбитали – клетка: |
|||||||
|
s – орбиталь (электронное облако s – электрона) |
сфера (шар) |
Электронное облако такой формы может занимать в атоме одно положение (условное обозначение) |
|||||||
|
p – орбиталь (электронное облако p – электрона) |
гантель (восьмёрка) |
Электронное облако такой формы может занимать в атоме три положения вдоль осей координат пространства x, y и z. (условное обозначение) |
|||||||
|
d – орбиталь (электронное облако d – электрона) |
четырёхлепестковая форма |
Все d-орбитали (а их может быть уже пять) одинаковы по энергии, но по-разному расположены в пространстве. Да и по форме, напоминающей перевязанную лентами подушечку, одинаковы только четыре. (условное обозначение) |
|||||||
|
f – орбиталь (электронное облако f – электрона) |
сложная форма |
Электронное облако такой формы может занимать в атоме семь положений. (условное обозначение) |
Условное обозначение электрона – стрелка, направленная вверх↑ (электрон вращается вокруг собственной оси по часовой стрелке) или стрелка, направленная вниз↓ (электрон вращается вокруг собственной оси против часовой стрелки).
Число электронов в атоме определяют по порядковому номеру
О – 8 электронов, S – 16 электронов.
На одной орбитали могут находиться только ДВА электрона, которые вращаются вокруг своей оси в противоположных направлениях (по часовой стрелке и против часовой стрелке) – электроны с противоположными спинами:
Cледовательно, на s – орбитали максимально может разместиться два электрона (s2); на p – орбитали максимально может разместиться шесть электронов (p6) на d – орбитали максимально может разместиться десять электронов (d10); f – четырнадцать электронов (f14).
Располагаясь на различных расстояниях от ядра, электроны образуют электронные слои (энергетические уровни) – каждому слою соответствует определённый уровень энергии.
Условное обозначение уровня – скобка: )
Число энергетических уровней определяют по номеру периода, в котором находится химический элемент
О – 2 уровня, S – три уровня.

Для элементов главных подгрупп (А) число электронов на внешнем уровне = номеру группы.
+15P – V группа (А) – на внешнем уровне 5 электронов
Для элементов побочных подгрупп (В) число электронов на внешнем уровне = двум.
Исключения (один электрон) – хром, медь, серебро, золото и некоторые другие.
III. Формулы отражающие строение атомов первого и второго периодов
H +1 )1e
– схема строения атома, отображает распределение электронов по энергоуровням.
+1 Н 1s1
– электронная формула, отображает число электронов по орбиталям.
+1 Н
– электронно-графическая формула – показывает распределение электронов по орбиталям и отображает спин электрона.


У элементов второго периода начинается заполнение второго энергетического уровня — он включает восемь электронов (n = 2, N = 8). Второй период содержит восемь элементов. У неона, элемента, завершающего второй период, первый и второй энергетические уровни оказываются целиком заполненными.

Американский химик Гилберт Льюис дал объяснение этому и выдвинул правило октета, в соответствии с которым устойчивым является восьмиэлектронный слой (за исключением 1 слоя: т. к. на нем может находиться не более 2 электронов, устойчивым для него будет двухэлектронное состояние).
IV. Распределение электронов по энергетическим уровням элементов третьего и четвертого периодов ПСХЭ
1. Порядок заполнения уровней и подуровней электронами
Электронные формулы атомов химических элементов составляют в следующем порядке:
- Сначала по номеру элемента в таблице Д. И. Менделеева определяют общее число электронов в атоме;
- Затем по номеру периода, в котором расположен элемент, определяют число энергетических уровней;
- Уровни разбивают на подуровни и орбитали, и заполняют их электронами в соответствии Принципом наименьшей энергии
- Для удобства электроны можно распределить по энергетическим уровням, воспользовавшись формулой N=2n2 и с учётом того, что:
- У элементов главных подгрупп (s-;p-элементы) число электронов на внешнем уровне равно номеру группы.
- У элементов побочных подгрупп на внешнем уровне обычно дваэлектрона (исключение составляют атомы Cu, Ag, Au, Cr, Nb, Mo, Ru, Rh, у которых на внешнем уровне один электрон, у Pd на внешнем уровне нольэлектронов);
- Число электронов на предпоследнем уровне равно общему числу электронов в атоме минус число электронов на всех остальных уровнях.
Порядок заполнения электронами атомных орбиталей определяется:
Принципом наименьшей энергии
Шкала энергий:
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s…

2. Семейства химических элементов
Элементы, в атомах которых происходит заполнение электронами s-подуровня внешнегоэнергетического уровня, называются s-элементами. Это первые 2 элемента каждого периода, составляющие главные подгруппы I и II групп.
Элементы, в атомах которых электронами заполняется p-подуровень внешнегоэнергетического уровня, называются p-элементами. Это последние 6 элементов каждого периода (за исключением I и VII), составляющие главные подгруппы III–VIII групп.
Элементы, в которых заполняется d-подуровень второго снаружи уровня, называются d-элементами. Это элементы вставных декад IV, V, VI периодов.
Элементы, в которых заполняется f-подуровень третьего снаружи уровня, называются f-элементами. К f-элементам относятся лантаноиды и актиноиды.
В третьем периоде происходит заполнение третьего энергетического уровня. Третий уровень (n = 3) может максимально вмещать 18 электронов. Однако элементов в третьем периоде всего восемь. К концу третьего периода (у аргона) полностью заполняются 3s- и 3p-подуровни, а 3d-подуровень остается пустым, поэтому третий уровень не заполняется до конца.

В четвертом периоде у первых двух элементов (калия и кальция) электроны идут на четвертый энергетический уровень (4s-подуровень), а затем у последующих десяти элементов (от скандия до цинка) завершается заполнение третьего энергетического уровня (3d-подуровня).

«Проскок» или «провал» электрона
У атомов Cr, Cu, Nb, Mo, Ru, Rh, Pd, Ag, Pt, Au имеет место «провал» электрона с s-подуровня внешнего слоя на d-подуровень предыдущего слоя, что приводит к энергетически более устойчивому состоянию атома. Например, электронная формула атома меди, исходя из вышенаписанного, должна иметь вид: Cu 1s22s22p63s23p64s23d9. Однако в действительности один из двух 4s-электронов «проваливается» на 3d-подуровень, и атом меди имеет следующую конфигурацию: 1s22s22p63s23p64s13d10.
Для элементов IБ-подгруппы характерна конфигурация внешнего слоя: ns1(n−1)d10.
Для элементов Cr и Mo характерна конфигурация внешнего слоя: ns1(n−1)d5.
Особо следует отметить палладий, у которого «проваливаются» два электрона:
Pd1s22s22p63s23p64s23d104p65s04d10
V. Тест
Решите тестовые задания (один верный вариант ответа).
1. Заряд ядра атома фосфора равен
а) +30
б) +31
в) +15
г) +5
2. Количество энергоуровней в атоме равно
а) порядковому номеру элемента;
б) номеру группы;
в) заряду ядра атома;
г) номеру периода
3. Число нейтронов в атоме цинка равно
а) 30
б) 35
в) 4
г) 2
4. В ряду элементов Na, Mg, Al, Cl металлические свойства
а) убывают;
б) возрастают;
в) не изменяются;
г) сначала убывают, а затем возрастают
5. Формула высшего оксида RO2 характерна для
а) Li
б) Br
в) C
г) N
6. Электронная формула строения атома меди, это-
а) 1s22s22p63s23p64s23d10;
б) 1s22s22p63s23p64s23d9;
в) 1s22s22p63s13p64s23d10;
г) 1s22s22p63s23p64s23d11.
7. Заряд ядра атома кальция равен
а) 20
б) 2
в) 40
г) 41
8. Число электронов на внешнем энергоуровне для элементов главных подгрупп равно
а) номеру периода;
б) номеру группы;
в) порядковому номеру элемента;
г) атомной массе.
9. Число нейтронов в атоме железа равно
а) 26
б) 55
в) 56
г) 30
10. В ряду элементов C, Si, Ge, Sn способность отдавать валентные электроны
а) уменьшается;
б) не изменяется;
в) увеличивается;
г) сначала увеличивается, а затем уменьшается.
11. Формула летучего водородного соединения для элемента с электронным строением атома 1s22s22p2 – это
а) RH4;
б) RH3;
в) RH2;
г) RH.
12. Электронная формула строения атома мышьяка, это-
а) 1s22s22p63s23p64s13d114p3;
б) 1s22s22p63s23p64s23d94p4;
в) 1s22s22p63s23p64s13d104p4;
г) 1s22s22p63s23p64s23d104p4.
Тренажер №1
Тренажер №2
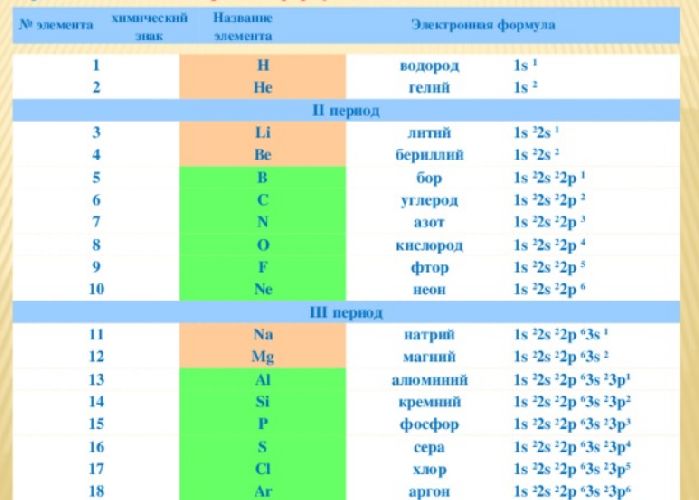
Электронные формулы атомов химических элементов (Таблица)
Таблица содержит электронные формулы атомов химических элементов (слои расположены в порядке заполнения подуровней)
Электронная формула показывает распределение электронов на орбиталях в атоме:

Формирование электронной оболочки атома происходит в соответствии с 3-мя принципами:
1. Принцип минимума энергии, который определяет заполнение атомных орбиталей с наименьшей энергией
(1s < 2s < 2p < 3s < 3p < 4s ≈ 3d < 4p < 5s ≈ 4d < 5p < 6s ≈ 4f ≈ 5d < 6p < 7s)
2. Принцип Паули, который диктует присутствие на атомной орбитали не более 2 электронов с противоположно направленными спинами
3. Правило Хунда, по которому происходит заполнение атомных орбиталей электронами так, чтобы их суммарный спин был максимальным.
Ниже показаны примеры графического изображения электронных формул атомов некоторых химических элементов:

Таблица электронных формул атомов химических элементов
|
№ элемента |
Химический знак |
Название элемента |
Электронная формула |
|
1 |
H |
водород |
1s1 |
|
2 |
He |
гелий |
1s2 |
|
II период |
|||
|
3 |
Li |
литий |
1s22s1 |
|
4 |
Be |
бериллий |
1s22s2 |
|
5 |
B |
бор |
1s22s22p1 |
|
6 |
C |
углерод |
1s22s22p2 |
|
7 |
N |
азот |
1s22s22p3 |
|
8 |
O |
кислород |
1s22s22p4 |
|
9 |
F |
фтор |
1s22s22p5 |
|
10 |
Ne |
неон |
1s22s22p6 |
|
III период |
|||
|
11 |
Na |
натрий |
1s22s22p63s1 |
|
12 |
Mg |
магний |
1s22s22p63s2 |
|
13 |
Al |
алюминий |
1s22s22p63s23p1 |
|
14 |
Si |
кремний |
1s22s22p63s23p2 |
|
15 |
P |
фосфор |
1s22s22p63s23p3 |
|
16 |
S |
сера |
1s22s22p63s23p4 |
|
17 |
Cl |
хлор |
1s22s22p63s23p5 |
|
18 |
Ar |
аргон |
1s22s22p63s23p6 |
|
IV период |
|||
|
19 |
K |
калий |
1s22s22p63s23p64s1 |
|
20 |
Ca |
кальций |
1s22s22p63s23p64s2 |
|
21 |
Sc |
скандий |
1s22s22p63s23p64s23d1 |
|
22 |
Ti |
титан |
1s22s22p63s23p64s23d2 |
|
23 |
V |
ванадий |
1s22s22p63s23p64s23d3 |
|
24 |
Cr |
хром |
1s22s22p63s23p64s13d5 |
|
25 |
Mn |
марганец |
1s22s22p63s23p64s23d5 |
|
26 |
Fe |
железо |
1s22s22p63s23p64s23d6 |
|
27 |
Co |
кобальт |
1s22s22p63s23p64s23d7 |
|
28 |
Ni |
никель |
1s22s22p63s23p64s23d8 |
|
29 |
Cu |
медь |
1s22s22p63s23p64s13d10 |
|
30 |
Zn |
цинк |
1s22s22p63s23p64s23d10 |
|
31 |
Ga |
галлий |
1s22s22p63s23p64s23d104p1 |
|
32 |
Ge |
германий |
1s22s22p63s23p64s23d104p2 |
|
33 |
As |
мышьяк |
1s22s22p63s23p64s23d104p3 |
|
34 |
Se |
селен |
1s22s22p63s23p64s23d104p4 |
|
35 |
Br |
бром |
1s22s22p63s23p64s23d104p5 |
|
36 |
Kr |
криптон |
1s22s22p63s23p64s23d104p6 |
|
V период |
|||
|
37 |
Rb |
рубидий |
1s 22s 22p 63s 23p64s 23d104p65s1 |
|
38 |
Sr |
стронций |
1s 22s 22p 63s 23p64s 23d104p65s2 |
|
39 |
Y |
иттрий |
1s 22s 22p 63s 23p64s 23d104p65s24d1 |
|
40 |
Zr |
цирконий |
1s 22s 22p 63s 23p64s 23d104p65s24d2 |
|
41 |
Nb |
ниобий |
1s 22s 22p 63s 23p64s 23d104p65s14d4 |
|
42 |
Mo |
молибден |
1s 22s 22p 63s 23p64s 23d104p65s14d5 |
|
43 |
Tc |
технеций |
1s 22s 22p 63s 23p64s 23d104p65s24d5 |
|
44 |
Ru |
рутений |
1s 22s 22p 63s 23p64s 23d104p65s14d7 |
|
45 |
Rh |
родий |
1s 22s 22p 63s 23p64s 23d104p65s14d8 |
|
46 |
Pd |
палладий |
1s 22s 22p 63s 23p64s 23d104p65s04d10 |
|
47 |
Ag |
серебро |
1s 22s 22p 63s 23p64s 23d104p65s14d10 |
|
48 |
Cd |
кадмий |
1s 22s 22p 63s 23p64s 23d104p65s24d10 |
|
49 |
In |
индий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p1 |
|
50 |
Sn |
олово |
1s 22s 22p 63s 23p64s 23d104p65s24d105p2 |
|
51 |
Sb |
сурьма |
1s 22s 22p 63s 23p64s 23d104p65s224d105p3 |
|
52 |
Te |
теллур |
1s 22s 22p 63s 23p64s 23d104p65s24d105p4 |
|
53 |
I |
йод |
1s 22s 22p 63s 23p64s 23d104p65s24d105p5 |
|
54 |
Xe |
ксенон |
1s 22s 22p 63s 23p64s 23d104p65s24d105p6 |
|
VI период |
|||
|
55 |
Cs |
цезий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s1 |
|
56 |
Ba |
барий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s2 |
|
57 |
La |
лантан |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s25d1 |
|
58 |
Ce |
церий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f2 |
|
59 |
Pr |
празеодим |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f3 |
|
60 |
Nd |
неодим |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f4 |
|
61 |
Pm |
прометий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f5 |
|
62 |
Sm |
самарий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f6 |
|
63 |
Eu |
европий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f7 |
|
64 |
Gd |
гадолиний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f75d1 |
|
65 |
Tb |
тербий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f9 |
|
66 |
Dy |
диспрозий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f10 |
|
67 |
Ho |
гольмий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f11 |
|
68 |
Er |
эрбий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f12 |
|
68 |
Tm |
тулий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f13 |
|
70 |
Yb |
иттербий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f14 |
|
71 |
Lu |
лютеций |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d1 |
|
72 |
Hf |
гафний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d2 |
|
73 |
Ta |
тантал |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d3 |
|
74 |
W |
вольфрам |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d4 |
|
75 |
Re |
рений |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d5 |
|
76 |
Os |
осмий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d6 |
|
77 |
Ir |
иридий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d7 |
|
78 |
Pt |
платина |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d9 |
|
79 |
Au |
золото |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s14f145d10 |
|
80 |
Hg |
ртуть |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d10 |
|
81 |
Tl |
таллий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p1 |
|
82 |
Pb |
свинец |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p2 |
|
83 |
Bi |
висмут |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p3 |
|
84 |
Po |
полоний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p4 |
|
85 |
At |
астат |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p5 |
|
86 |
Rn |
радон |
1s 22s 22p 63s 23p64s 23d104p65s14d105p66s24f145d106p6 |
|
VII период |
|||
|
87 |
Fr |
франций |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s1 |
|
88 |
Ra |
радий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s2 |
|
89 |
Ac |
актиний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d1 |
|
90 |
Th |
торий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s26d25f0 |
|
91 |
Pa |
протактиний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f26d1 |
|
92 |
U |
уран |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f36d1 |
|
93 |
Np |
нептуний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f46d1 |
|
94 |
Pu |
плутоний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f56d1 |
|
95 |
Am |
америций |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f7 |
|
96 |
Cm |
кюрий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f76d1 |
|
97 |
Bk |
берклий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f86d1 |
|
98 |
Cf |
калифорний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f10 |
|
99 |
Es |
эйнштейний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f11 |
|
100 |
Fm |
фермий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f12 |
|
101 |
Md |
менделеевий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f13 |
|
102 |
No |
нобелий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f14 |
|
103 |
Lr |
лоуренсий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d1 |
|
104 |
Rf |
резерфордий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d2 |
|
105 |
Db |
дубний |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d3 |
|
106 |
Sg |
сиборгий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d4 |
|
107 |
Bh |
борий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d5 |
|
108 |
Hs |
хассий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d6 |
|
109 |
Mt |
мейтнерий |
1s 22s 22p 63s 23p64s 23d104p65s24d105p66s24f145d106p67s25f146d7 |
|
s-элементы |
p-элементы |
d-элементы |
f-элементы |
