Лучший ответ
Валентина ???
Гений
(71098)
13 лет назад
Число протонов является определяющим для данного химического элемента в таблице Менделеева.
Остальные ответы
K.S.S.
Мастер
(1373)
13 лет назад
Открыть таблицу Менделеева
Linza
Мудрец
(12146)
13 лет назад
Написано в клеточке каждого элемента в периодической системе Менделеева.
Ирина Майорова
Мастер
(1962)
13 лет назад
протоны и электроны элемента – это порядковый номер элемента в периодической системе Менделеева, а атомная масса элемента находится по формуле: протоны+нейтроны.
Download Article
Download Article
Every atom in the universe is a particular element. But how do we tell which of the 100+ elements it is? A larger pile of stuff might give us helpful clues: we can tell that iron is heavy, and grey, and magnetic. As you study chemistry, you’ll learn that all of those qualities come from small differences in the structure of atoms. This understanding of atomic structure is the foundation for the tools actual scientists use to identify elements.
-
An element is defined by the number of protons in one atom. For example, every single atom of hydrogen has exactly one proton. We say that hydrogen has a proton number or atomic number of 1.[1]
The periodic table is arranged in order of proton number, which is why hydrogen is in the very first box with a 1 next to it.
Advertisement
-
The total electron count equals the atomic number. In a neutral atom, the number of electrons is exactly equal to the number of protons. This number is the atomic number of the element, which you can look up on the periodic table. If you are a little further in your chemistry studies, you might be given an electron configuration to read. All of the superscript numbers (like this) are electron counts, so add all these together to find the total number of electrons.[2]
-
Memorize the periodic table structure to read electron configurations quickly. The structure of the periodic table is closely related to how electron orbitals are filled. With a little practice you can jump directly to the right region of the periodic table.[4]
Note that the electron configuration must be in its ground state for this to work.
Advertisement
-
Compare the spectra to the known spectra of elements. In spectroscopy, scientists examine how light interacts with an unknown material. Each element releases a unique pattern of light, which you can see on the spectroscopy results, called “spectra”.[6]
- For example, a lithium spectrum has a very bright, thick green line, and several other fainter ones in different colors. If your spectrum has all those same lines on it, the light came from the element lithium.[7]
(Some types of spectra will show dark gaps instead of bright lines, but you can compare these the same way.) - Want to know why this works? Electrons only absorb and emit light at very specific wavelengths (meaning specific colors). Different elements have different arrangements of electrons, which leads to different colors of bands.[8]
- A more advanced spectroscope shows a detailed graph instead of a few lines. You can match the x-axis value at each peak to a table of known values to identify molecules. As you learn about different types of molecules, you’ll learn to focus on just a few useful spots on the graph to save time.[9]
- For example, a lithium spectrum has a very bright, thick green line, and several other fainter ones in different colors. If your spectrum has all those same lines on it, the light came from the element lithium.[7]
-
Look for elements whose atomic masses match the graph. A mass spectrometer sorts the components of a sample by mass. To read the bar graph showing the results, check the “m/z” axis for the values of the taller bars. Some values will match the atomic mass of an element that was part of the sample. Others (usually the larger ones) represent compounds, so that mass will equal the sum of masses of multiple atoms.[10]
- Let’s say the tallest bar is at m/z 18, with short bars at 1, 16, and 17. Only two of these match the atomic mass of an element: hydrogen (atomic mass 1) and oxygen (atomic mass 16). Adding these atoms together gives you the compounds HO (mass 1 + 16 = 17) and H2O (mass 1 + 1 + 16 = 18). This sample was water![11]
- Technically, a mass spectrometer ionizes the sample and sorts by the ratio of mass to charge (or m/z). But most ions will have a charge of 1, and so you can ignore the division problem and just look at mass. The smallest bars often represent small amounts of more charged particles that you can ignore for identification purposes.[12]
- Let’s say the tallest bar is at m/z 18, with short bars at 1, 16, and 17. Only two of these match the atomic mass of an element: hydrogen (atomic mass 1) and oxygen (atomic mass 16). Adding these atoms together gives you the compounds HO (mass 1 + 16 = 17) and H2O (mass 1 + 1 + 16 = 18). This sample was water![11]
Advertisement
Ask a Question
200 characters left
Include your email address to get a message when this question is answered.
Submit
Advertisement
-
Mass spectrometer readings get complicated when you sample large molecules that can break into many parts.[13]
If you can narrow down the sample to a few possibilities, you can look up the mass spectra of each one and compare that to your actual results. -
Electron configurations can also be written in noble gas notation, which uses a noble gas element symbol to stand in for that element’s electron shell.[14]
For instance,can be expanded with neon’s electron configuration into
. To identify the element by electron count, add the electrons in the expanded configuration.[15]
In this case there are 2+2+6+2+4 = 16 electrons, so this must be the sixteenth element, sulfur. -
Most periodic tables show two numbers next to each element. The smaller one (that always goes up by 1 as you go left to right) is the atomic number or proton number. The larger number is the atomic mass.
Thanks for submitting a tip for review!
Advertisement
-
If you are given an electron configuration in an excited state, you can’t use the highest energy electron to identify the element. Identify the ground state for that number of electrons first.
Advertisement
References
About This Article
Thanks to all authors for creating a page that has been read 19,077 times.
If you buy through links on our site, we may earn a commission.
Did this article help you?
Химический элемент
Химический элемент – совокупность атомов с одним и тем же зарядом ядра, числом протонов в ядре и электронов
в электронной оболочке. Закономерную связь химических элементов отражает периодическая таблица Д.И. Менделеева.
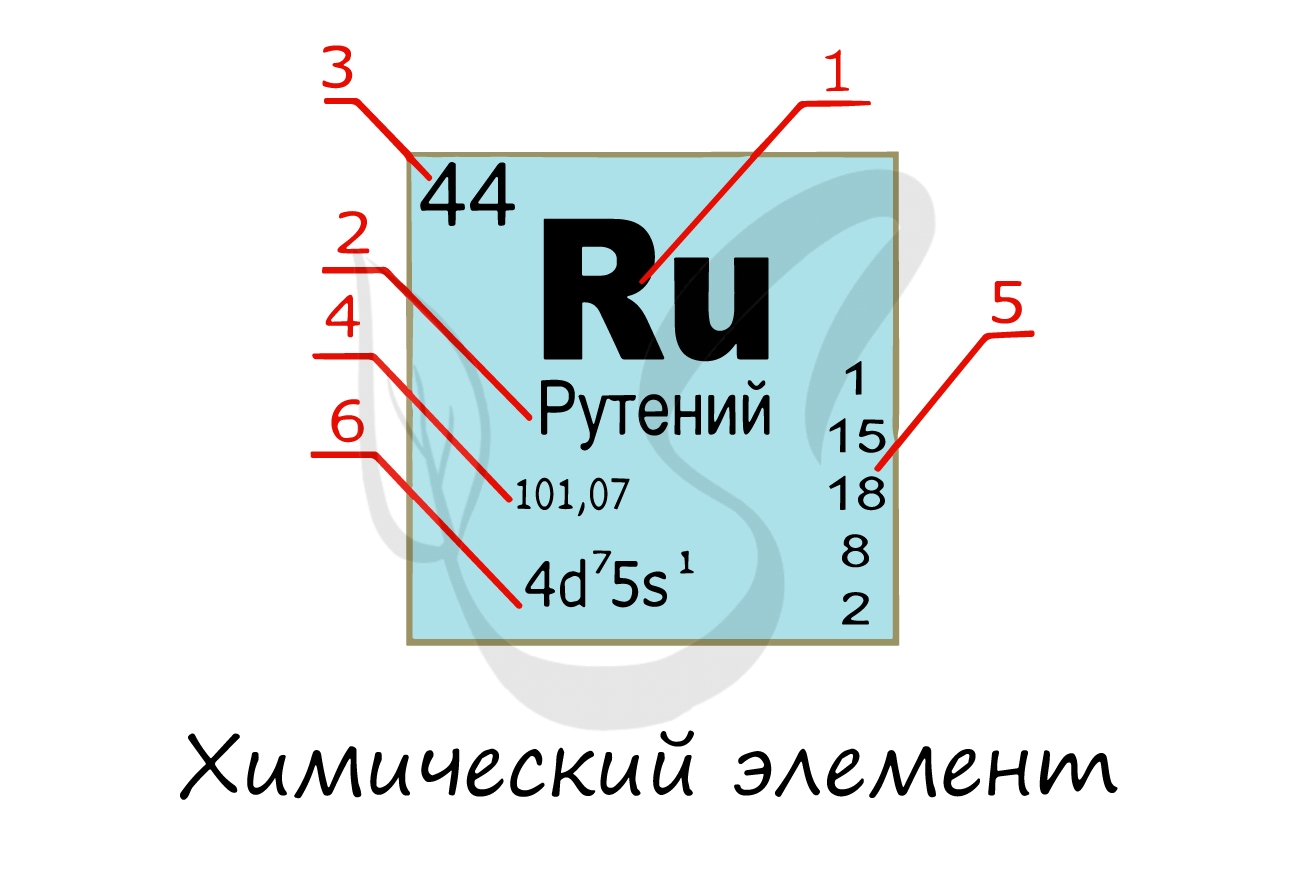
Изучая подобную карточку химического элемента, можно узнать о нем многое:
- Обозначение химического элемента
- Русское наименование
- Порядковый номер = заряд атома = число электронов = число протонов
- Атомная масса
- Распределение электронов по энергетическим уровням
- Электронная конфигурация внешнего уровня
Надо заметить, что на экзамене часто из карточки элемента скрывают распределение электронов и конфигурацию внешнего
уровня. Тем не менее, если вы успешно освоили предыдущую тему, то для вас не составит труда написать электронную
конфигурацию атома зная его порядковый номер в таблице Д.И. Менделеева (номер уж точно не тронут!))
Протоны, нейтроны и электроны
Вы уже знаете, что порядковый номер элемента в периодической таблице Д.И. Менделеева равен числу протонов, а число протонов
равно числу электронов.
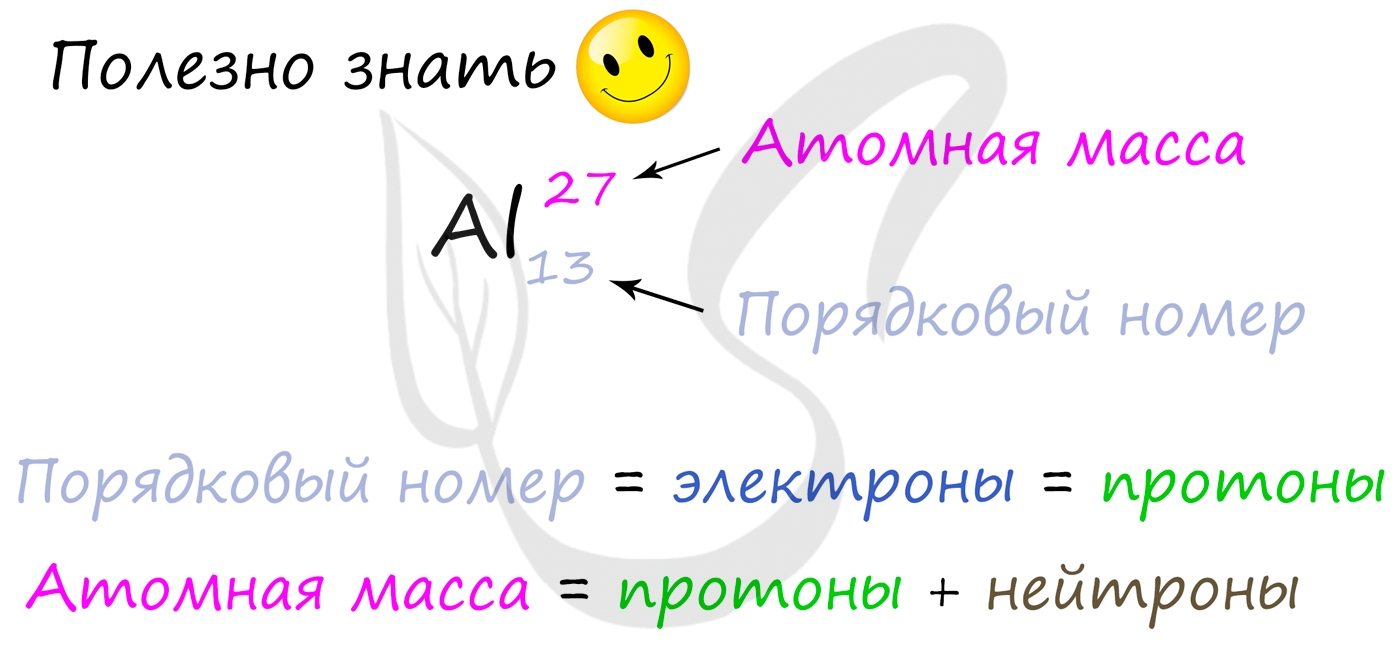
Для того чтобы найти число нейтронов в атоме алюминия, необходимо вычесть из атомной массы число протонов:
27 – 13 = 14
Получается, что в атоме алюминия 14 нейтронов. Посчитайте число нейтронов, электронов и протонов самостоятельно для атомов бериллия,
кислорода, меди. Решение вы найдете ниже.

Если вы поняли суть и научились считать протоны, нейтроны и электроны, самое время приступать к следующей теме.
Изотопы
Изотопы (греч. isos – одинаковый + topos – место) – общее название разновидностей одного и того же химического элемента,
имеющих одинаковый заряд ядра (число протонов), но разное число нейтронов.
Вероятно, вы не задумывались, но вся таблица Д.И. Менделеева и представленные в ней химические элементы – это самые распространенные
на земле изотопы.
Лучше всего объяснить, что такое изотопы наглядным примером. Широко известны три изотопа водорода: протий, дейтерий и тритий.
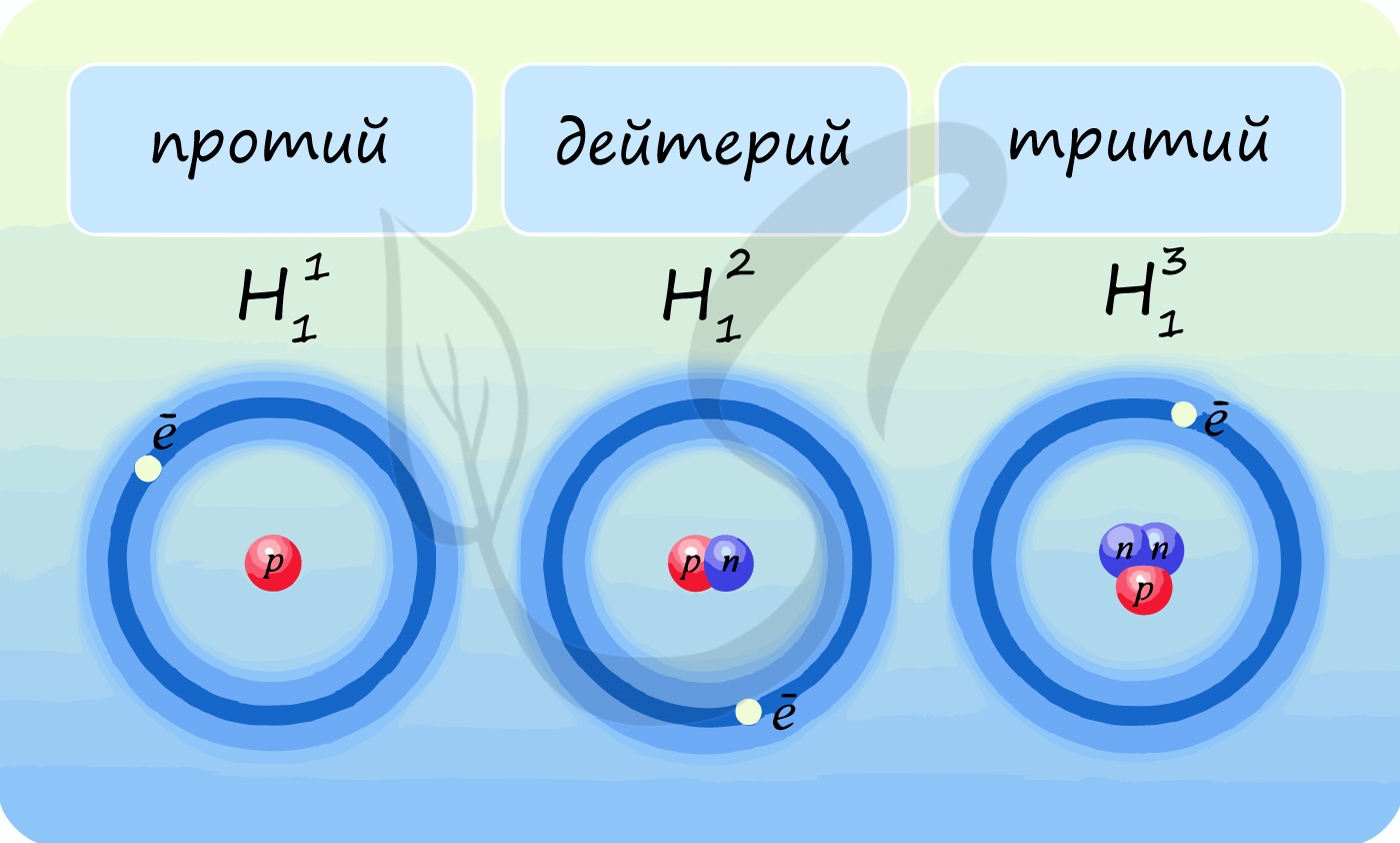
В таблице Д.И. Менделеева представлен самый распространенный из трех – протий. Он содержит 1 протон и 1 электрон, нейтроны отсутствуют. У
дейтерия 1 протон, 1 нейтрон и 1 электрон. У трития 1 протон, 2 нейтрона, 1 электрон.
Теперь очевидно, что изотопы – атомы одного и того же химического элемента, различающиеся числом нейтронов.
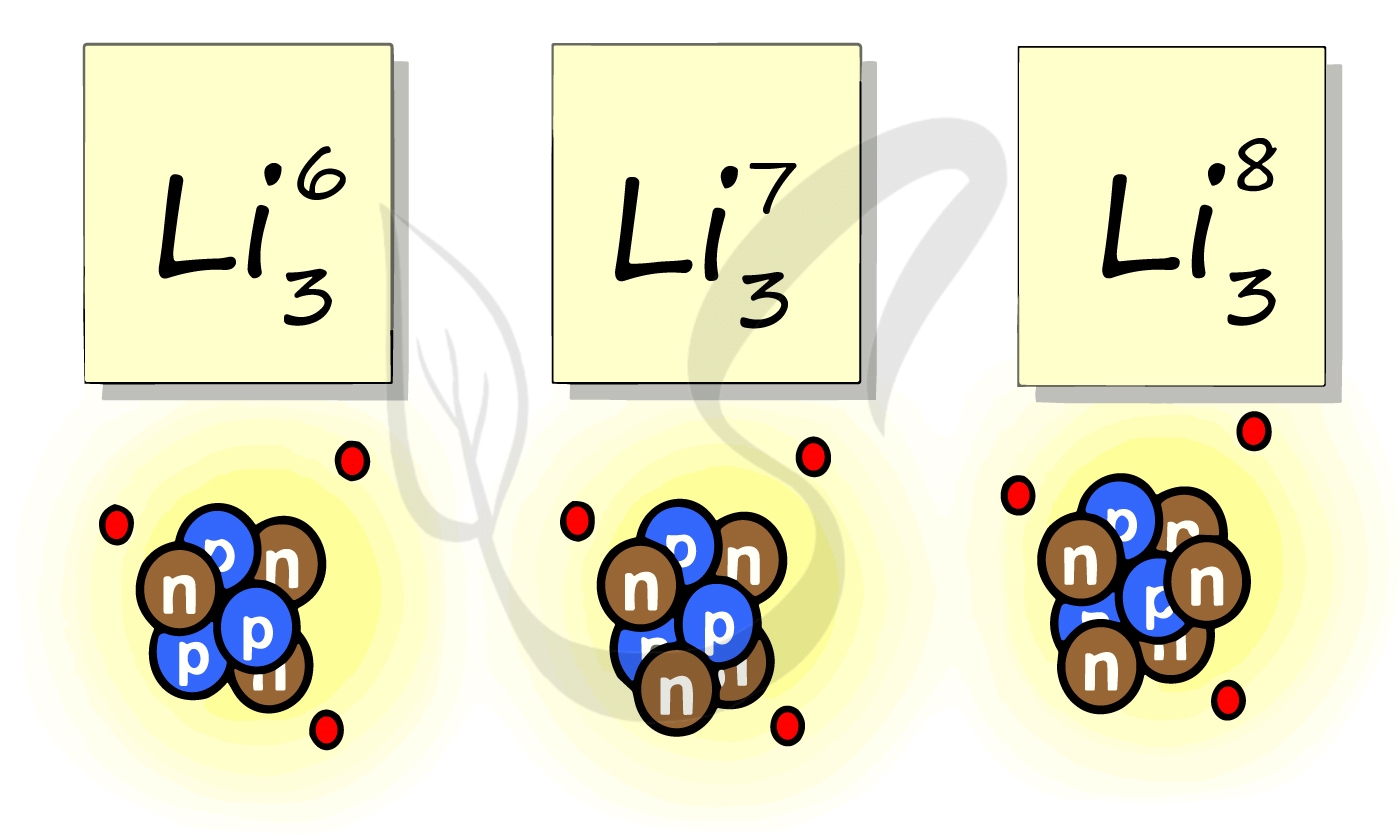
Рассмотрим пример с изотопами лития. Самостоятельно посчитайте количество нейтронов у каждого изотопа. Найдите тот, который
включен в таблицу Д.И. Менделеева.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Загрузить PDF
Загрузить PDF
Протоны, нейтроны и электроны – основные частицы, из которых состоит атом. Протоны заряжены положительно, электроны – отрицательно, а нейтроны и вовсе не имеют заряда.[1]
Масса электронов очень мала, а масса протонов и нейтронов практически одинакова.[2]
На самом деле, найти в атоме количество протонов, нейтронов и электронов довольно просто, нужно только научиться ориентироваться по периодической таблице химических элементов Д.И.Менделеева.
-
1
Возьмите периодическую таблицу элементов. Это система, в которой элементы организованы в зависимости от их атомной структуры. Цветное одно- или двухбуквенное сокращение – это название элемента в сокращенном виде. В таблице также представлена информация об атомном номере элемента и атомной массе.[3]
- Таблицу Менделеева можно найти в учебнике по химии или в Интернете.
- Во время контрольных работ периодическую таблицу обычно предоставляют.
-
2
Найдите в таблице нужный вам элемент. Каждый элемент в таблице располагается под своим номером. Все элементы можно разделить на металлы, неметаллы и метоллоиды (полуметаллы). В этих группах элементы классифицируются еще на несколько групп: щелочные металлы, галогены, инертные газы.[4]
- Группы (столбцы) и периоды (строки) нужны для систематизации, по ним легко найти нужный вам элемент.
- Если вы ничего не знаете о нужном вам элементе, просто найдите его в таблице.
-
3
Найдите атомный номер элемента. Атомный номер обозначает число протонов в ядре атома.[5]
Атомный номер располагается над символом элемента, обычно в левом верхнем углу клетки. Он покажет вам, сколько протонов содержится в одном атоме элемента.- Например, Бор (В) обозначен в таблице под номером 5, поэтому у него 5 протонов.
-
4
Определите количество электронов. Протоны – это положительно заряженные частицы в ядре атома. Электроны представляют собой частицы, которые несут отрицательный заряд. Поэтому когда элемент находится в нейтральном состоянии, то есть его заряд будет равен нулю, число протонов и электронов будет равным.
- Например, Бор (В) обозначен в таблице под номером 5, поэтому можно смело утверждать, что у него 5 электронов и 5 протонов.
- Однако если элемент содержит отрицательный или положительный ион, то протоны и электроны не будут одинаковыми. Вам придется вычислить их. Число ионов выглядит как маленький, верхний индекс после элемента.
-
5
Найдите атомную массу элемента. Чтобы найти число нейтронов, вам сначала нужно вычислить атомную массу элемента. Атомная масса – это средняя масса атомов данного элемента, ее нужно рассчитывать. Имейте в виду, что у изотопов атомная масса отличается.[6]
. Атомная масса указана под символом элемента.- Округляйте атомную массу до ближайшего целого числа. Например, атомная масса бора = 10,811, соответственно, ее можно округлить до 11.
-
6
Вычтите из атомной массы атомный номер. Чтобы определить количество нейтронов, нужно вычесть атомный номер из атомной массы. Помните, что атомный номер – это число протонов, которое вы уже определили.[7]
- Возьмем наш пример с бором: 11 (атомная масса) – 5 (атомный номер) = 6 нейтронов.
Реклама
-
1
Определите число ионов. Ион – это атом, состоящий из положительно заряженного ядра, в котором находятся протоны и нейтроны, и отрицательно заряженных электронов. Атом несет нейтральный заряд, но заряд может быть положительным и отрицательным из-за электронов, которые атом может отдавать и принимать.[8]
Поэтому число протонов в атоме не меняется, а число электронов в ионе может меняться.- Электрон несет отрицательный заряд, поэтому если атом отдает электроны, то сам становится заряженным положительно. Когда атом принимает электроны, он становится отрицательно заряженным ионом.
- Например, у N3- заряд -3, а у Ca2+ заряд +2.
- Помните, если число ионов не указано в таблице, вам не нужно делать подобные вычисления.
-
2
Вычтите заряд из атомного номера. Если ион положительно заряжен, нужно вычесть из атомного номера заряд. Если у иона положительный заряд, значит, он отдал электроны. Чтобы подсчитать оставшееся число электронов, нужно вычесть заряд от атомного номера. Если ион заряжен положительно, значит, в нем больше протонов, чем электронов.
- Например, у Ca2+ заряд +2, поэтому можно сказать, что он отдал два электрона. Атомный номер кальция = 20, поэтому у его иона 18 электронов (20-2=18).
-
3
Если ион заряжен отрицательно, чтобы узнать число электронов, нужно добавить заряд к атомному номеру. Потому что ион стал отрицательным из-за того, что принял лишние электроны. Так что нужно просто прибавить заряд к атомному номеру, тогда вы получите число электронов. Разумеется, если ион заряжен отрицательно, то электронов в нем больше, чем протонов.
- Например, у N3- заряд -3, значит, азот получил три дополнительных электрона. Атомный номер азота 7, поэтому число электронов у азота = 10. (то есть 7+3=10).
Реклама
Об этой статье
Эту страницу просматривали 952 233 раза.
Была ли эта статья полезной?
Основной структурной единицей веществ атомного строения является атом.
Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки.
Электронная оболочка – совокупность группирующихся вокруг ядра электронов.
Электрон – одна из элементарных частиц материи, обладающая массой покоя и элементарным отрицательным зарядом.
Когда говорят о массе покоя, то подразумевают, что частица может находиться в состоянии покоя и иметь массу. Существуют частицы, которые не могут находиться в состоянии покоя, например частицы света – фотоны. В этом случае говорят, что фотон не имеет массы покоя.
Заряд электрона называется элементарным, так как это наименьший отрицательный заряд в природе. По этой причине заряд электрона условно принимают равным -1.
Атомное ядро – центральная, положительно заряженная, сложно организованная часть атома, состоящая из нуклонов, связанных между собой ядерными силами.
Нуклоны – общее название двух типов частиц, протонов и нейтронов.
С точки зрения атомной физики протон и нейтрон являются двумя состояниями одной и той же частицы – нуклона.
Нуклон – структурная единица ядра атома, которая может находиться в двух состояниях, протона и нейтрона.
Нуклоны (протоны и нейтроны) состоят из кварков.
Заряд ядра атома соответствует атомному номеру (порядковому номеру) элемента в периодической системе (Z).
Заряд ядра определяется числом протонов, следовательно:
Так как атом – электронейтральная частица, то:
Массовое число (нуклонное число) – сумма числа протонов и нейтронов в ядре данного атома.
Если в условии задания не указано массовое число, то его можно взять из таблицы Д.И. Менделеева, округлив до целой величины относительную атомную массу.
О том, что такое относительная атомная масса мы поговорим чуть позже. Пока не заостряйте на этом внимание. Где её найти в таблице Д.И. Менделеева показано на рисунке ниже.
Для расчета числа нейтронов в ядре используется формула:
Для характеристик частицы (протона, нейтрона, атома) применяют следующую запись:
Определим состав атома хлора. Порядковый номер хлора в таблице Д. И. Менделеева равен 17, следовательно заряд ядра атома хлора равен +17. Если заряд ядра равен +17, то в ядре атома хлора 17 протонов, а в электронной оболочке 17 электронов.
Чтобы определить число нейтронов в ядре атома хлора, округлим до целой величины относительную атомную массу хлора, это значение равно 36. То есть, в ядре атома хлора 36 нуклонов, 17 из них являются протонами, тогда число нейтронов равно 36-17 = 19.
Кратко это можно записать следующим образом:
Атомы отличаются друг от друга радиусом, массой, зарядом ядра, количеством электронов и другими параметрами. Заряд ядра атома – это наиболее важная его характеристика. Поэтому все атомы можно условно разделить на группы (классифицировать) по заряду их ядер. Такие абстрактные группы принято называть химическими элементами.
Химический элемент – вид атомов, с определённым зарядом ядра.
Химический элемент – одно из центральных понятий науки химии.
По предложению шведского химика Й. Берцелиуса химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия элемента (1813 г).
Водород на лат. Hydrogenium (H). Ртуть на лат. Hydrargyrum (Hg) Эти буквенные обозначения называются химическими знаками или химическими символами.
Символ отдельного атома совпадает с символом соответствующего ему химического элемента. К примеру, символ S обозначает химический элемент серу или же один атом этого элемента.
Если требуется обозначить не один, а несколько атомов, то перед символом элемента ставят соответствующую цифру – коэффициент. 5S – пять атомов элемента серы.
Символы и русские названия химических элементов можно найти в таблице Д. И. Менделеева.
Несмотря на то что у ядер атомов одного и того же химического элемента одинаковый заряд, они могут отличаться друг от друга массовым (нуклонным) числом по причине разного количества нейтронов. Такие разновидности ядер атомов одного химического элемента называют изотопами.
Изотопы – ядра с одинаковым зарядом, но разным массовым числом, т.е разным числом нейтронов.
Отметим, что термин изотопы следует употреблять только во множественном числе. В единственном числе следует говорить – нуклид. Что такое нуклиды Вы узнаете чуть позже.
К примеру, химический элемент водород (H) представляет из себя смесь атомов с массовыми числами равными 1 и 2, это изотопы водорода – протий (H) и дейтерий (D). Нуклид водорода с массовым числом 3 в природе не встречается, так как его ядро чрезвычайно нестабильно и очень быстро подвергается ядерному распаду, это так называемый тритий (T).
Запишем состав изотопов водорода, пользуясь описанными выше правилами.
Мы убедились, что изотопы отличаются массовыми числами, а также количеством нейтронов в ядре. Заряд ядер изотопов одинаковый, так как они принадлежат одному химическому элементу.
Содержание изотопов в земной коре разное ввиду их разной стабильности. Чем устойчивее изотоп, тем выше его содержание.
Содержание изотопов элемента Х может быть оценено в массовых или мольных долях.
Доля – отношение части к целому.
Массовая доля (w или w%) – отношение массы части системы к массе всей системы.
О мольной доле мы поговорим позднее в соответствующей теме.
Массовая доля – величина безразмерная, её выражают в долях единицы или процентах. Для вычисления массовой доли применяются формулы:
Изотопный состав элемента водорода может быть представлен следующей схемой:
Задания по теме “Основные сведения о строении атома”
- Ядро атома некоторого элемента содержит 16 нейтронов, а электронная оболочка этого атома – 15 электронов. Назвать элемент, изотопом которого является данный атом. Привести запись его символа с указанием заряда ядра и массового числа.
- Массовое число атома некоторого элемента равно 181, в электронной оболочке атома содержится 73 электрона. Указать число протонов и нейтронов в ядре атома и название элемента.
- Укажите число протонов, нейтронов и электронов в атоме циркония.
- Укажите число протонов, нейтронов и электронов в атоме иттрия.
- Укажите число протонов, нейтронов и электронов в атоме индия.
- Укажите число протонов, нейтронов и электронов в атоме кадмия.
- Сколько нейтронов содержит ядро атома 37Cl?
- Сколько нейтронов содержит ядро атома 18O?
- Сколько нейтронов содержит ядро атома 30Si?
- Сколько нейтронов содержит ядро атома 19F?





![{displaystyle [Ne]3s^{2}3p^{4}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/55fe9da9ab2a2a425fe5dfd58085632ae7c34af9)










