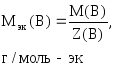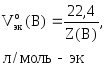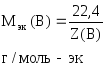Химический эквивалент является одним из основных понятий в химии. Эта характеристика вещества, несмотря на свою простоту, часто достаточно запутанна и вызывает ряд затруднений.
Содержание:
1 Химический эквивалент и фактор эквивалентности
1.1 Химический эквивалент в реакциях обмена
1.2 Химический эквивалент в окислительно-восстановительных реакциях
2 Молярная масса эквивалента
3 Химический эквивалент и количественный анализ. Закон эквивалентов
4 Химический эквивалент элемента и сложного вещества
В знаменитом толковом словаре русского языка С.И. Ожегова эквивалент трактуется как «нечто равноценное другому, вполне заменяющее его». Что это значит? Например, книга стоит 500 рублей. Таким образом, 500 рублей – это денежный эквивалент данной книги.
Понятие «эквивалент» в химии относится к реакциям окислительно-восстановительным, ионного обмена, используется при определении концентрации раствора, в реакциях электро-аналитических методов анализа.
Эквивалент является безразмерной величиной.
Химический эквивалент и фактор эквивалентности
Химический эквивалент в реакциях обмена
Разберемся с понятием «химический эквивалент» на примере реакции обмена.
Например, карбонат натрия Na2CO3 и соляная кислота HCl, взаимодействуя между собой, приведут к образованию разных продуктов реакции.

Здесь оба исходных вещества (Na2CO3 и HCl) реагируют друг с другом в соотношении 1:1, т.е. на одну частицу соли приходится одна частица кислоты. Это и есть эквивалентные количества реагирующих веществ. Химическим эквивалентом карбоната натрия в данном случае является одна частица Na2CO3, а эквивалентом соляной кислоты будет одна молекула HCl.
В другом случае оба вещества взаимодействуют иначе:

Исходные вещества реагируют в соотношениях 1:2. То есть с одной частицей соли взаимодействуют 2 молекулы кислоты. Что же здесь будет являться эквивалентом? При определении эквивалента принято сравнивать количество частиц исходного вещества с одним ионом (или атомом) водорода, с которым это исходное вещество может провзаимодействовать (или заместить) в реакции.
В данном случае ионы (атомы) водорода входят в состав соляной кислоты. Тогда в пересчете на одну молекулу HCl (или что то же самое, на один ион Н+), с ней будет реагировать только половина частицы (1/2 часть) Na2CO3. То есть соотношение реагирующих веществ будет 1/2:1. Таким образом, в данной реакции химическим эквивалентом соли является половина частицы Na2CO3. Химическим эквивалентом кислоты является одна молекула HCl.
Очевидно, что в реальности половины частицы Na2CO3 не существует. Поэтому говорят об условной частице вещества, когда определяют ее эквивалент.
Итак, химический эквивалент – это реальная или условная частица вещества, которая в данной химической реакции может прореагировать (или заместить) один атом (или ион) водорода или прореагировать с одним эквивалентом любого другого вещества.
Фактор эквивалентности ƒэкв – количественная характеристика эквивалента, он используется в расчетах.
Фактор эквивалентности показывает, какая доля частицы вещества прореагировала (заместила) в данной химической реакции один ион (атом) водорода.
Так, в первом случае, ƒэкв(Na2CO3)=1, а во втором – ƒэкв(Na2CO3)=1/2. Для соляной кислоты в обоих случаях ƒэкв(HCl)=1.
Рассмотрим другой пример реакции обмена: взаимодействие фосфорной кислоты и гидроксида калия. Определим ее эквивалент и фактор эквивалентности по отношению к одному эквиваленту гидроксида калия.
Фосфорная кислота H3PO4 является многоосновной кислотой. Для подобных кислот (двух- и трехосновных) необходимо учитывать стехиометрию конкретных реакций.

В данном случае одна молекула фосфорной кислоты реагирует с одной частицей гидроксида калия. Поэтому эквивалентом является одна молекула H3PO4. И тогда ее ƒэкв (H3PO4)=1.

А здесь одна молекула фосфорной кислоты реагирует с двумя частицами гидроксида калия. То есть в реакции участвует половина молекулы H3PO4. Это и есть ее эквивалент, который численно выражается фактором эквивалентности ƒэкв(H3PO4)=1/2.

Одна молекула H3PO4 реагирует с тремя частицами КОН. Таким образом, эквивалентом фосфорной кислоты здесь будет одна треть молекулы H3PO4. Тогда фактор эквивалентности ƒэкв(H3PO4)=1/3.
Определение эквивалента и фактора эквивалентности в реакциях обмена для оснований, солей также зависит от стехиометрии реакции.
Химический эквивалент в окислительно-восстановительных реакциях
В окислительно-восстановительных реакциях (ОВР), в отличие от реакций обмена, происходит переход электронов от одного вещества к другому, изменяются степени окисления окислителя и восстановителя. Именно эти процессы и важны при определении эквивалента и фактора эквивалентности в ОВР.
Рассмотрим примеры. Начнем с самого простого.

Взаимодействие водорода и кислорода с образованием воды – это окислительно-восстановительная реакция. В ней восстановителем является водород Н2, а окислителем – О2.
При определении эквивалентов в ОВР ориентируются на то, какая часть частицы принимает или отдает 1 (один) электрон.
Запишем еще раз каждую из полуреакций. Для восстановителя:

Одна молекула Н2 отдает 2ē. Тогда половина молекулы Н2 (а это один атом Н) отдаст 1ē. Следовательно, эквивалентом восстановителя в данной реакции будет половина (1/2 часть) молекулы Н2. И фактор эквивалентности ƒэкв(H2)=1/2.
Для окислителя:

Одна молекула О2 принимает 4ē. Тогда четверть этой молекулы (а это половина атома О) примет 1ē. Следовательно, эквивалентом окислителя в данной реакции будет 1/4 часть молекулы О2 (это условная частица, поскольку реально 1/4 часть молекулы О2 не существует). И фактор эквивалентности ƒэкв(О2)=1/4.
Рассмотрим еще один пример. Так, KMnO4 является сильным окислителем и в любых ОВР всегда проявляет только окислительные свойства. Эквивалент KMnO4 будет отличаться в зависимости от того, в какой ОВР участвует это вещество.

Реакция между сульфитом натрия и перманганатом калия протекает в кислой среде. Из полуреакции восстановления видим, что один ион MnO4— принимает 5ē для перехода в ион Mn2+. Тогда 1ē может принять условная частица, представляющая одну пятую часть (1/5) иона MnO4—. Таким образом, эквивалентом окислителя в данной реакции будет одна пятая часть (1/5) KMnO4. Для окислителя фактор эквивалентности составит ƒэкв(KMnO4)=1/5.
С тем же сульфитом натрия перманганат калия в нейтральной среде реагирует иначе.

Как ясно из приведенной полуреакции восстановления, одна третья часть (1/3) иона MnO4— принимает 1ē. Фактор эквивалентности окислителя в этом случае составит ƒэкв(KMnO4)=1/3.
Взаимодействие сульфита натрия и перманганата калия осуществляется и в щелочной среде:

В данном случае эквивалентом является одна частица KMnO4, поскольку, согласно полуреакции восстановления, речь идет о принятии 1ē. И фактор эквивалентности окислителя в таком случае составляет ƒэкв(KMnO4)=1.
Таким образом, в случае окислительно-восстановительных реакций эквивалентом является реальная или условная частица вещества, которая в данной ОВР эквивалентна 1 (одному) электрону. Эквивалент и фактор эквивалентности в ОВР не определяются стехиометрией реакции в отличие от реакций ионного обмена.
Молярная масса эквивалента
Молярная масса эквивалента (или эквивалентная масса) – это масса одного моля эквивалента вещества.
Обозначается следующим образом:

И выражается, как и молярная масса, в г/моль, поскольку фактор эквивалентности является безразмерной величиной.
Вернемся к примерам, рассмотренным выше.

В данной реакции ƒэкв (H3PO4)=1. Это в том числе означает, что фосфорная кислота вступает в реакцию в количестве 1 моль. Тогда масса 1 моль эквивалента этого вещества соответствует (и равна) его молярной массе: 98 г/моль. Можно сделать вывод, что в данном случае:

В другой реакции гидроксида калия и фосфорной кислоты:

Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/2. Тогда:

И в третьем случае:

Фактор эквивалентности кислоты ƒэкв (H3PO4)=1/3. Тогда:

Как видим, в зависимости от стехиометрии реакции молярная масса эквивалента вещества будет принимать различные значения. Так, для фосфорной кислоты это 98 г/моль, 49г/моль и 32,66 г/моль. В этом заключается отличие молярной массы эквивалента от молярной массы вещества, которая всегда постоянна, не зависимо от типа реакции (обмена, ОВР) и ее стехиометрии.
Итак, молярная масса эквивалента равна произведению фактора эквивалентности и молярной массы вещества:

Химический эквивалент и количественный анализ. Закон эквивалентов
В количественном анализе широко применяются еще два понятия, связанных с химическим эквивалентом.
Количество вещества эквивалента – количество вещества, в котором частицами являются эквиваленты.
Единицей измерения является моль. Вычисляется по формуле:
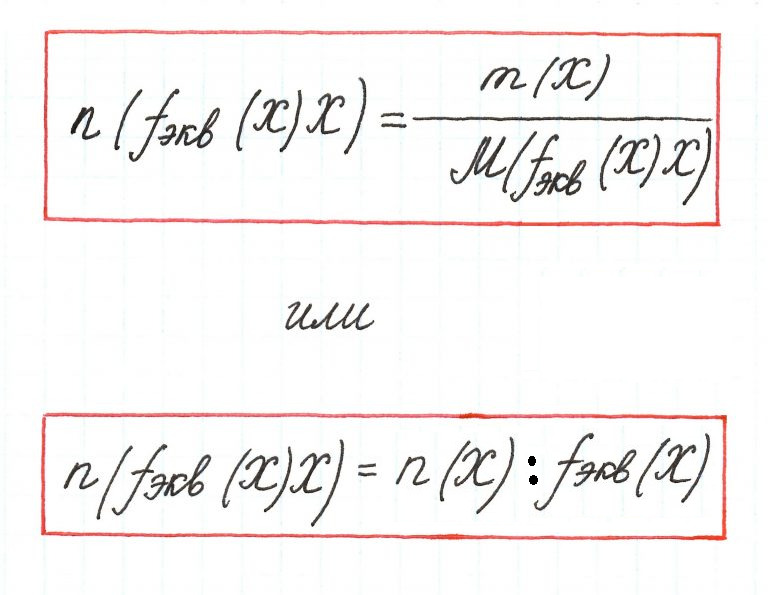
Молярная концентрация эквивалента (или нормальная концентрация, Сн) представляет собой количество вещества эквивалента, содержащееся в одном литре (или дм3) раствора (моль/л, или моль/дм3).
Иногда запись единиц измерения нормальной концентрации моль/л, или моль/дм3, заменяют более простой записью: н. Например, 0,2 моль/л записывают как 0,2 н.

Если в 1 л (1дм3) раствора содержится 1 моль эквивалентов вещества, то такой раствор называется нормальным. Если содержится 0,1 моль – децинормальным, 0,01 моль – сантинормальным, 0,001 моль – миллинормальным и т.д.
Пример 1. Какова нормальная концентрация раствора H2C2O4∙2H2O, полученного растворением 1,73334 г ее в мерной колбе вместимостью 250 мл?

Пример 2. Какую массу KMnO4 следует взять для приготовления 2 л раствора с С(1/5KMnO4) = 0,02 моль/л?

Используя нормальные концентрации, легко посчитать, какие объемы веществ должны быть смешаны, чтобы те прореагировали полностью, т.е. без остатка. Либо, зная объемы прореагировавших без остатка веществ, можно определить их концентрации.
Согласно закону эквивалентов (И.В. Рихтер), утверждающему, что вещества реагируют между собой в строго определенных (эквивалентных) количествах:

Пример 3. Определите нормальную концентрацию раствора гидроксида калия, если на полное взаимодействие 15,00 мл его раствора израсходовано 18,70 мл раствора соляной кислоты с нормальной концентрацией 0,078моль/л.

Химический эквивалент элемента и молярная масса эквивалента сложного вещества
Если речь не идет о конкретной химической реакции, то посчитать эквивалент и эквивалентную массу элемента или сложного вещества можно, воспользовавшись несколькими способами. Приведем наиболее простые из них.
Химический эквивалент элемента
Химический эквивалент элемента представляет количество элемента, способное полностью соединяться с одним атомом (ионом) водорода или замещать столько же их в химических реакциях.
Так, в молекуле хлороводорода HCl на атом Н приходится один атом Cl. В связи с этим:

У сероводорода H2S 2 атомам Н соответствует 1 атом S. Следовательно, 1 атому Н будет соответствовать 1/2 атома S. И тогда:

Аммиак NH3 характеризуется тем, что в его молекуле 3 атома водорода соединяются с 1 атомом азота. В пересчете на один атом водорода это будет 1/3 атома азота. Поэтому:

Как не трудно заметить из приведенных примеров,
фактор эквивалентности для элементов равен единице, деленной на валентность элемента:

Молярная масса эквивалента сложного вещества
Основными классами сложных веществ являются оксиды, основания, кислоты и соли.
Поскольку не будем останавливаться на факторе эквивалентности в данном случае, молярную массу эквивалента обозначим упрощенно: Мэ.
Для оксидов рассчитывается по формуле:

Например:

Для оснований:

Например:

Для кислот:

Например:

Для солей:

Например:

Подведем итог.
Химический эквивалент – это частица вещества, реальная или условная. Количественным выражением эквивалента является фактор эквивалентности. Для определения эквивалентов веществ в реакции обмена необходимо учитывать ее стехиометрию, а в окислительно-восстановительной реакции – число отданных или принятых веществом электронов.
Чтобы самыми первыми узнавать о новых публикациях на сайте, присоединяйтесь к нашей группе ВКонтакте.

Обозначение
nэк(В),
единицы измерения моль-эк.
Если известна масса вещества и молярная
масса эквивалентов, то количество
вещества эквивалентов рассчитывают по
формуле:
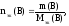 (21)
(21)
где
m(В)
– масса вещества, г;
Мэк(В)
– молярная масса эквивалентов вещества,
г/моль-эк.
Для
газообразных веществ можно рассчитать
nэк(В),
зная объем газа, который он имеет при
н.у.:
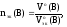 (22)
(22)
где
Vo(В)
– объем газа при н.у., л;
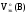 –молярный
–молярный
объем эквивалентов газа при н.у., л/моль-эк
Между
количеством вещества эквивалентов
nэк(В)
и количеством вещества n(В)
существует простая зависимость :
nэк(В)
= n(В)
· Z(В)
(23)
Пример.
Рассчитать Z(В),
Мэк(В) всех веществ, принимающих участие
в реакциях а) и б), а так же
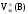 газообразных веществ в реакции а).
газообразных веществ в реакции а).
а)
Fe2O3
(т)
+ 3CO(г)
= 2Fe(т)
+ 3CO2(г)
б)
Al2(SO4)3
+ 6NaOH = 2Al(OH)3
+ 3Na2SO4
Решение.
Прежде всего необходимо определить к
какому типу реакций (обменная или
окислительно – восстановительная)
относится данная реакция, для чего
рассчитывают степени окисления атомов
или групп атомов в формульных единицах
всех веществ.
Реакция
а)
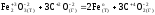
является
окислительно-восстановительной.
Находим
атомы, которые изменяют степени окисления,
и выписываем их, с учетом числа в составе
одной формульной единицы и числа отданных
и принятых электронов:
а)
для реагентов

б)
для продуктов
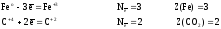
Расчеты
всех величин приведены в таблице 5.
Таблица
5
|
ФЕ |
|
Z(B) |
M(B), |
|
|
|
Fe2O3 |
6 |
6 |
160,0 |
26,7 |
– |
|
CO |
2 |
2 |
28,0 |
14,0 |
11,2 |
|
Fe |
3 |
3 |
56,0 |
18,7 |
– |
|
CO2 |
2 |
2 |
44,0 |
22,0 |
11,2 |
Реакция
б)
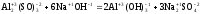
является
обменной, т.к. степени окисления атомов
и групп атомов в ходе реакции не
изменяются. Далее необходимо выбрать
те части формульных единиц (положительно
или отрицательно заряженных) по которым
будет производится расчет суммарного
заряда замещающихся ионов, а далее –
Z(B)
и Мэк(В). Расчеты приведены в таблице 6.
Таблица
6.
|
ФЕ |
Замещаю- щиеся ионы |
qi |
Ni |
Z(В)= |
М(В), г/моль |
|
|
Al2(SO4)3 |
SO4–2 |
–2 |
3 |
3·2=6 |
342,0 |
57,0 |
|
NaOH |
Na+ |
+1 |
1 |
1·1=1 |
40,0 |
40,0 |
|
Al(OH)3 |
OH– |
–1 |
3 |
3·1=3 |
78,0 |
26,0 |
|
Na2SO4 |
Na+ |
+1 |
2 |
2·1=2 |
142,0 |
71,0 |
6. Закон эквивалентов.
Согласно
закону эквивалентов все
вещества реагируют и образуются в
эквивалентных количествах.
Например,
для реакции
2CO
+ O2
= 2CO2
(24)
nэк(CO)
= nэк(O2)=nэк(CO2)
(25)
Для
реакции в общем виде:
nAA
+ nBB
= nCC
+ nDD
, (26)
где
A,B
– реагенты;
C,D
– продукты реакции;
nA,nB,nC,nD
– стехиометрические коэффициенты,
закон
эквивалентов
имеет вид:
nэк(A)
= nэк(B)
= nэк(C)
= nэк(D)
(27)
Т.е.
количество вещества эквивалентов всех
участвующих в реакции (26) веществ
(реагентов А и В и образовавшихся
продуктов C
и D)
одинаковы. Поэтому, если количество
вещества эквивалентов одного из веществ
(реагента или продукта) известно по
условию задачи, то определены и nэк
всех остальных веществ, участвующих в
реакции, и необходимость их расчета
отпадает. В этом состоит преимущество
проведения расчетов по закону эквивалентов.
Для
любой химической реакции (см. уравнение
реакции в общем виде (26)) соблюдается
условие (27), которое также может быть
представлено следующим образом:
n(А)
· Z(A)=
n(В)
· Z(B)=
n(С)
· Z(C)=
n(D)
· Z(D)
(28)
Условие
(28) упрощает определение эквивалентного
числа в сложных реакциях.
Пример.
Определить Z(Cr2(SO4)3)
в обменной реакции, выраженной уравнением
Cr2(SO4)3
+ 12KOH = 2K3[Cr(OH)6]
+ 3K2SO4
Решение.
Для приведенной реакции запишем условие
(28):
n(
Cr2(SO4)3)
· Z(Cr2(SO4)3)=
n(
KOH) · Z(KOH)
Из
уравнения реакции:
n(
Cr2(SO4)3)
= 1 n(KOH)
= 12
Поскольку
Z(KOH)
= 1 (не может быть другим, см. табл. 2), то
![]()
![]()
Если
известны массы веществ, участвующих в
реакции, то используя уравнения (21) и
(27) можно записать:
![]() (29)
(29)
или
![]() (30)
(30)
Уравнение
(30) является математическим выражением
закона эквивалентов.
Если
одно из веществ уравнения (26), например
B,
находится в газообразном состоянии и
известен его объем при н.у., то количество
вещества эквивалентов этого газа можно
рассчитать по уравнению (22), а математическая
запись закона эквивалентов для веществ
A
и B
будет иметь вид:
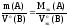 (31)
(31)
Пример.
Рассчитать массу алюминия, вступившего
в реакцию с разбавленной серной кислотой,
если в результате реакции образуется
10,2 л водорода (н.у.).
Решение.
Запишем уравнение реакции и укажем
степени окисления атомов и заряды ионов:
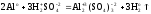
Реакция
окислительно-восстановительная. Находим
атомы, которые изменяют степени окисления,
и выписываем их, с учетом числа в составе
одной формульной единицы и числа отданных
и принятых электронов:
Alo
–
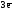 =
=
Al+3 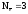 Z(Al) = 3
Z(Al) = 3
H2o
–
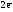 =
=
2H+1 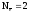 Z(H2)
Z(H2)
= 2
Согласно
закону эквивалентов:
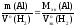 .
.
Отсюда
выражаем массу алюмиия:
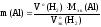
Рассчитаем
Мэк(Al)
и
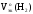 :
:
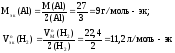
Подставив
полученные значения Мэк(Al)
и
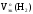 ,
,
а так жеVo(H2),
рассчитаем массу алюминия:
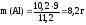
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Эквивале́нт вещества́ или просто эквивале́нт — безразмерная величина, равная количеству одного вещества, реагирующему в конкретной реакции с произвольным (часто – равным 1 моль) количеством другого вещества; общее формальное определение выглядит так:
-
- для реакции аА + bВ –> …
- эквивалент вещества В по веществу А есть отношение а/b (читается: “одна частица В эквивалентна а/b частиц А” или (что то же самое, см. ниже) “одна порция вещества В эквивалентна а/b порций вещества А”)
- (где а и b – коэффициенты перед этими веществами в уравнении реакции, а их отношение – называется также “мольное соотношение” или “мольное отношение”, или “число эквивалентности”;
- отношение b/а (то есть обратное) называется “фактор эквивалентности вещества В по веществу А”, см. ниже; также, b/а – является коэффициентом перед веществом В в приведённом по веществу А уравнении той же самой реакции). Иногда эквивалентном вещества называют непосредственно фактор эквивалентности этого вещества, не проводя между ними различий. [1]
Эквивалент – архаичная величина, которая использовалась в химии и биологии с начала ХIХ до середины ХХ веков (см. ниже раздел “история”). Говорить об эквиваленте вещества имеет смысл только относительно конкретной реакции. Само по себе понятие эквивалента используется редко; чаще встречаются обороты речи “эквивалентное соотношение веществ” и величины: “фактор эквивалентности”, “молярная масса эквивалента”, “эквивалентная масса”, “эквивалентная концентрация” (синоним: “нормальная концентрация”, устаревший синоним: “нормальность”), “количество вещества эквивалентна”.
Более частными определениями являются такие:
1) в окислительно-восстановительной реакции (по определению: в реакции, в которой происходит изменение степеней окисления атомов, то есть происходит обмен электронами) – величина мольного отношения вещества к отдаваемым или принимаемым им в данной реакции электронов (если рассматривать атомы окислителя или восстановителя – то величина изменения степени окисления такого атома в данной реакции); то есть в определении выше, А = 
2) в кислотно-основной реакции (по определению: в реакции, в которой не происходит изменения степеней окисления атомов, то есть обмениваются частицы, отличные от электронов) – величина мольного отношения вещества к отдаваемым или принимаемым им в данной реакции протонам, или гидроксил-ионам; то есть в определении выше, А = 
Фактор эквивалентности был определён выше[1]:
для реакции аА + bВ –> …
-
- фактор эквивалентности f(вещества В по веществу А) = b/а
- f = 1/Z, где Z – число эквивалентности (то есть эквивалент; число, обратное f), изменение степени окисления (количество отданных или принятых электронов), количество протонов или гидроксил-ионов в данной реакции.
Все остальные перечисленные выше “эквивалентные” величины получаются[1] умножением соответствующих не-эквивалентных величин на фактор эквивалентности f:
-
- молярная масса эквивалента вещества = молярная масса вещества * f = молярная масса вещества / Z
-
- нормальная концентрация = молярная концентрация * f
-
- количество вещества эквивалента = количество вещества * f
Кроме указанных выше, встречаются также определения фактора эквивалентности, основанные на отношении молярных масс (и до 1870 года – основанные на “эквивалентных весах элементов”), например:
“Эквивалентный вес кислоты или основания для реакций нейтрализации или любого другого соединения, которое действует путем двойного разложения, представляет собой массу соединения, которое будет давать или вступать в реакцию с 1,008 г иона водорода или 17,0074 г иона гидроксида, например, соляная кислота (HCl), 36,461 г; серная кислота (H2SO4), 98,078 г; гидроксид натрия (NaOH), 40 г; или карбонат натрия (Na2CO3), 105,9892 г.”
Также встречаются устаревшие определения фактора эквивалентности на основе понятия валентности (которое фактически не используется в химии примерно с середина ХХ века).
Также встречаются определения эквивалента с использованием понятия “мнимых” частиц и с использованием (принципиально ложной, физически противоречивой) предпосылки, что уравнение химической реакции описывает поведение неких отдельных частиц вещества, а не порций порядка молей веществ[1]:
“Эквивалентном называется некая реальная или условная частица, которая может присоединять, высвобождать или быть каким-либо другим образом эквивалентна (равносильна) в данной реакции одному иону водорода (в кислотно-основных реакциях) или одному электрону (в окислительно-восстановительных реакциях)”
Примеры использования:
В реакции 
-
- вещество
эквивалентно 1
-иону (число эквивалентности Z = 1), фактор эквивалентности фосфорной кислоты = 1/1; f(NaOH) = 1.
- вещество
В реакции 
-
- вещество
эквивалентно 2
-ионам (Z = 2), фактор эквивалентности фосфорной кислоты = 1/2: f(NaOH) = 1.
- вещество
В реакции 
-
- вещество
эквивалентно 3
-ионам (Z = 3), фактор эквивалентности фосфорной кислоты = 1/3; f(NaOH) = 1.
- вещество
В реакции 
-
- 1 условная единица вещества
эквивалентна 5 электронам (Z = 5, f(перманганата) = 0,2) и 8 порциям HCl (f(перманганата) = 1/8)
- 1 условная единица вещества
В реакции 
-
- f(перманганата по электронам) = 1; f(перманганата по гидроксиду бария) = 0,25.
В реакции 
-
- f(перманганата по электронам) = 1/3; f(перманганата по сероводороду) = 2/3; f(сероводорода по электронам) = 0,5; f(сероводорода по перманганату) = 1,5
История понятия “эквивалентов”[править | править код]
История предпосылок, понятия эквивалентов, эквивалентных масс и смены этих понятий на последующие, более обоснованные физически, сводиться к попыткам химиков ответить на вопрос: “в каком соотношении реагируют вещества?” (актуальный ответ, который мы знаем теперь, но который разработчики понятий эквивалентна не знали: в мольном соотношении; то есть в соотношении количеств частиц (атомов, молекул, электронов, ионов; количество выражается в молях), равным отношению коэффициентов перед веществами в уравнении реакции, так называемый “основной закон химической стехиометрии”[2]) и установить строение веществ, которые реагировали.
Первые эквивалентные массы кислот и оснований были опубликованы Карлом Фридрихом Венцелем в 1777 году [3][4], он же ввёл понятие “эквивалентных количеств веществ” и “эквивалента вещества” (трактат “Учение о химическом сродстве тел”). В результате экспериментов в обменными реакциями солей, Карл Венцель пришёл к выводу, что для нейтрализации одного и того же количества кислоты или основания требуются различные количества других кислот или оснований. Он предложил “закон нейтральности”:
- “Если одно и то же количество какой-либо кислоты нейтрализуется различными количествами двух или большего числа оснований, то количества последних эквивалентны и нейтрализуются одним и тем же количеством другой кислоты”
Более крупный набор таблиц был подготовлен, с опорой на работу Венцеля, немецким химиком Иеремией Бенджамином Рихтером. Основные выводы и эксперименты он опубликовал в своей книге 1972 г “Стехиометрия, или искусство измерения химических элементов”, и его “закон эквивалентов” является развитием “закона нейтральности” Венцеля.
Рихтер сформилировал закон эквивалентов:
- все вещества реагируют и образуются в эквивалентных отношениях.
- формула, выражающая закон эквивалентов: m1Э2 = m2Э1
Под Э подразумевается элемент или вещество; под m – масса.
Оба автора – Венцель и Рихтер – не признавали атомную теорию, и не смогли развить концепцию стехиометрии дальше. Их концепции для современников прошли незамеченными и далее не были развиты во что-либо; хотя их таблицы соотношений нейтрализации были перепечатаны несколькими известными химиками того времени.
Тем не менее, многие химики сочли эквивалентные веса полезным инструментом, независимо от того, придерживались ли эти химики атомной теории. Эквивалентные веса были полезным обобщением “закона определенных пропорций” (он же – “закон постоянства состава”) Джозефа Пруста (1794 г.), который позволил химии стать количественной наукой. Он развил идею о постоянстве состава веществ и о постоянстве количественных отношений, в которых вещества могут соединяться. Французский химик Жан-Батист Дюма (1800–1884 гг.) стал одним из наиболее влиятельных противников атомной теории после того, как принял ее в начале своей карьеры, но был стойким сторонником эквивалентных весов. Далее Дальтон развил идею, сформулировав”закон кратных отношений”. Дальше понятие о постоянных соотношениях реагентов получило в работах Луи Гей-Люссака и в молекулярной теории А.Авогадро.
Последним смертельным ударом по использованию эквивалентных весов элементов стало представление Дмитрием Менделеевым его периодической таблицы в 1869 году, в которой он связал химические свойства элементов с приблизительным порядком их атомных весов. Однако эквивалентные веса продолжали использоваться для многих соединений еще сто лет, особенно в аналитической химии. Эквивалентные массы обычных реагентов можно было заносить в таблицы, что упрощало аналитические расчеты до того, как электронные калькуляторы стали широко доступны: такие таблицы были обычным явлением в учебниках аналитической химии. После разработки теории строения атомов и молекул, в химии окончательно утвердилось понятие о мольном соотношении.
По состоянию на 2023 год, понятие “фактор эквивалентности” всё ещё печатается в учебниках по общей химии для ВУЗов, а также используется в аналитической химии (в титриметрическом анализе).
См. также[править | править код]
- Электрохимический эквивалент
Примечания[править | править код]
- ↑ 1 2 3 4 Васильев В.П. – “Аналитическая химия”, в 2 томах. – том 1, стр 181-182. – М.: Высшая школа, 1989
- ↑ В.В.Ерёмин, А.Я.Борщевский – “Основы общей и физической химии”. – Долгопрудный: Интеллект, 2012. – стр.28
- ↑ Фигуровский Н.А. “История химии: учебное пособие для студентов пед. ин-тов по хим. и биол. специальностям”. – М.: Просвещение, 1979. – стр. 70-76
- ↑ М.Джуа – “История химии”. – М.: МИР, 1975. – стр.163-218
Материалы из методички: Сборник задач по теоретическим основам химии для студентов заочно-дистанционного отделения / Барботина Н.Н., К.К. Власенко, Щербаков В.В. – М.: РХТУ им. Д.И. Менделеева, 2007. -155 с.
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н+ (одному иону ОН— или единичному заряду), а в данной окислительно-восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
n(экв1) = n(экв2) (2.1)
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
Мэкв(X) = М(X)× fэкв(X). (2.2)
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
nэкв(X) = m(X)/Мэкв(X). (2.3)
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
Vэкв(X) = V(X) × fэкв(X) = 22,4× fэкв(X). (2.4)
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
7. Молярная масса эквивалента сульфата металла равна молярной массе эквивалента металла плюс молярная масса эквивалента SO42-, например,
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
H3PO4 + NaOH = NaH2PO4 + H2O, fэкв(H3PO4) =1.
H3PO4 + 2NaOH = Na2HPO4 + 2H2O, fэкв(H3PO4) =1/2.
H3PO4 + 3NaOH = Na3PO4 + 3H2O, fэкв(H3PO4) =1/3.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
Во втором уравнении реакции молярное отношение реагентов H3PO4 и NaOH составляет 1:2, т.е. фактор эквивалентности H3PO4 равен 1/2 и её эквивалентом является 1/2 часть формульной единицы вещества H3PO4 .
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
fэкв(X) = 1/n, (2.5)
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
2KMnO4 + 5Na2SO3 + 3H2SO4 = 5Na2SO4 + 2MnSO4 + K2SO4 + 3H2O.
2KMnO4 + 2Na2SO3 + H2O = 2Na2SO4 + 2MnO2 + 2KOH.
2KMnO4 + Na2SO3 + 2NaOH = Na2SO4 + K2MnO4 + Na2MnO4 + H2O.
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn+7 + 5e = Mn+2
в нейтральной среде: Mn+7 + 3e = Mn+4
в щелочной среде: Mn+7 + 1e = Mn+6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Cr2O72- + 6e + 14H+ = 2 Cr3+ + 7H2O
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Al2(SО4)3 + 6 KOH = 2 Аl(ОН)3 + 3 K2SО4, fэкв(Al2(SО4)3) = 1/6,
Al2(SО4)3 + 8 KOH(изб) = 2 K[Al(OH)4 ] + 3 K2SО4, fэкв (Al2(SО4)3) = 1/8,
Al2(SО4)3 + 12KOH(изб) = 2K3[Al(OH)6] + 3K2SО4, fэкв (Al2(SО4)3) = 1/12.
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Решение.
Fe3О4 + 8 НСl = 2 FeСl3 + FeСl2 + 4 Н2О, fэкв(Fe3О4) = 1/8,
KCr(SO4)2 + 3 КОН = 2 K2SO4 + Сr(ОН)3, fэкв(KCr(SO4)2) = 1/3.
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО + 2 HCl = CrCl2 + H2О; fэкв(CrО) = 1/2,
Cr2О3 + 6 HCl = 2 CrCl3 + 3 H2О; fэкв(Cr2О3) = 1/6,
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
CrО3 + 2 KОH = K2CrО4 + H2О; fэкв(CrО3) = 1/2.
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Мэкв(Cr2О3) = 152(1/6) = 25,3 г/моль,
Мэкв(CrО3) = 100(1/2) = 50 г/моль.
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
4 NH3 + 3 О2 2 N2 + 6 H2О;
4 NH3 + 5 О2 4 NO + 6 H2О;
2 H2S + 3 О2 2 SО2 + 2 H2О.
Решение.
Vэкв(О2) = 22,4× 1/4 = 5,6 л.
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Решение.
nэкв(Ме) = nэкв(Н2) = 0,56:(22,4× 1/2) = 0,05 моль.
Мэкв(X) = m(Ме)/nэкв(Мe) = 0,45:0,05 = 9 г/моль.
Мэкв(МеxOy) = Мэкв(Ме) + Мэкв(O2) = 9 + 32× 1/4 = 9 + 8 = 17 г/моль.
Мэкв(Ме(OH)y) = Мэкв(Ме) + Мэкв(OH—) = 9+17 = 26 г/моль.
Мэкв(Меx(SO4)y) = Мэкв(Ме) + Мэкв(SO42-) = 9 + 96× 1/2 = 57 г/моль.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
Решение.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
Мэкв(K2SО3) = 158× 1/2 = 79 г/моль.
nэкв (KMnO4) = nэкв(K2SО3) = 7,9/79 = 0,1 моль.
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Решение.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
m(Ме):Мэкв(Ме) = m(кислорода):Мэкв(кислорода);
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + H2S = NiS + HCl + H2O;
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
H2O2 + 2 FeSO4 + H2SO4 = Fe2(SO4)3 + 2 H2O.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Эквивалент – это реальная или условная
частица, которая в кислотно-основных реакциях присоединяет
(или отдает) один ион Н+ или ОН–, в
окислительно-восстановительных реакциях принимает (или отдает) один
электрон, реагирует с одним атомом водорода или с одним эквивалентом
другого вещества. Например, рассмотрим следующую
реакцию:
H3PO4 + 2KOH
®
K2HPO4 + 2H2O.
В
ходе этой реакции только два атома водорода замещаются на атомы
калия, иначе, в реакцию вступают два иона Н+ (кислота
проявляет основность 2). Тогда по определению эквивалентом
H3PO4
будет являться условная частица 1/2H3PO4,
т.к. если одна молекула H3PO4
предоставляет два иона Н+, то один ион Н+ дает
половина молекулы H3PO4.
С
другой стороны, на реакцию с одной молекулой ортофосфорной кислотой
щелочь отдает два иона ОН–, следовательно, один ион ОН–
потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом
кислоты является условная частица 1/2Н3РО4, а
эквивалентом щелочи частица КОН.
Число, показывающее, какая часть молекулы
или другой частицы вещества соответствует эквиваленту, называется
фактором эквивалентности (fЭ).
Фактор эквивалентности – это безразмерная величина, которая меньше,
либо равна 1. Формулы расчета фактора эквивалентности приведены в
таблице 1.1.
Таким образом, сочетая фактор эквивалентности и формульную единицу
вещества, можно составить формулу эквивалента какой-либо частицы,
где фактор эквивалентности записывается как химический коэффициент
перед формулой частицы:
fЭ
(формульная единица вещества)
º
эквивалент
В примере, рассмотренном выше, фактор эквивалентности для кислоты,
соответственно, равен 1/2, а для щелочи КОН равен 1.
Между H3PO4
и КОН также могут происходить и другие реакции. При этом кислота
будет иметь разные значения фактора эквивалентности:
H3PO4 + 3KOH
®
K3PO4 + 3H2O
fЭ(H3PO4)
= 1/3
H3PO4 + KOH
®
KН2PO4
+ H2O fЭ(H3PO4)
= 1.
Следует учитывать, что эквивалент одного
и того же вещества может меняться в зависимости от того, в какую
реакцию оно вступает. Эквивалент элемента также может быть
различным в зависимости от вида соединения, в состав которого он
входит. Эквивалентом может являться как сама молекула или
какая-либо другая формульная единица вещества, так и ее часть.
Таблица 1.1 –
Расчет фактора эквивалентности
|
Частица |
Фактор |
Примеры |
|
Элемент |
где В(Э) – |
|
|
Простое вещество |
где |
fЭ(H2)
fЭ(O2)
fЭ(Cl2)
fЭ(O3) |
|
Оксид |
где |
|
|
Кислота |
где |
fЭ(H2SO4) или
fЭ(H2SO4) (основность равна 2) |
|
Основание |
где |
fЭ(Cu(OH)2)
fЭ(Cu(OH)2)
|
|
Соль |
где |
|
|
Частица в |
где |
Fe2+
fЭ(Fe2+)
MnO4–
fЭ(MnO4–) |
|
Ион |
где |
fЭ(SO42–) |
Пример.
Определите фактор эквивалентности и эквивалент у солей: а)
ZnCl2, б) КНСО3, в)
(MgOH)2SO4.
Решение: Для расчетов воспользуемся формулами, приведенными в
таблице 1.1.
а)
ZnCl2 (средняя соль):
![]() .
.
fЭ(ZnCl2)
= 1/2, поэтому эквивалентом ZnCl2
является частица 1/2ZnCl2.
б) КНСО3
(кислая соль):
![]() .
.
fЭ(КНСО3) = 1,
поэтому эквивалентом КНСО3 является частица КНСО3.
в) (MgOH)2SO4
(основная соль):
![]() .
.
fЭ(
(MgOH)2SO4
) = 1/2, поэтому эквивалентом
(MgOH)2SO4
является частица 1/2(MgOH)2SO4.
Эквивалент, как частица, может быть охарактеризован молярной массой
(молярным объемом) и определенным
количеством вещества
nэ.
Молярная масса эквивалента (МЭ)
– это масса одного моль эквивалента. Она равна
произведению молярной массы вещества на фактор эквивалентности:
Молярная масса
эквивалента имеет размерность «г/моль».
Молярная масса эквивалента сложного
вещества равна сумме молярных масс эквивалентов образующих его
составных частей, например:
МЭ(оксида) = МЭ(элемента)
+ МЭ(О) = МЭ(элемента)
+ 8
МЭ(кислоты) = МЭ(Н)
+ МЭ(кислотного остатка) = 1 + МЭ(кислотного
остатка)
МЭ(основания) = МЭ(Ме)
+ МЭ(ОН) = МЭ(Ме) +
17
МЭ(соли) = МЭ(Ме)
+ МЭ(кислотного остатка).
Газообразные вещества помимо молярной массы эквивалента имеют
молярный объем эквивалента (![]()
или VЭ)
– объем, занимаемый молярной массой эквивалента или объем одного
моль эквивалента. Размерность «л/моль».
При н.у. получаем:
![]()
Закон
эквивалентов был открыт в 1792 г. И. Рихтером.
Современная формулировка закона:
вещества реагируют и образуются согласно их эквивалентам.
Все вещества в уравнении реакции связаны законом эквивалентов,
поэтому:
nэ(реагента1)
= … = nэ(реагентаn)
=
nэ(продукта1)
= … =
nэ(продуктаn)
Из закона эквивалентов следует, что массы (или объемы)
реагирующих и образующихся веществ пропорциональны молярным массам
(молярным объемам) их эквивалентов. Для любых двух веществ,
связанных законом эквивалентов, можно записать:
где m1 и
m2 – массы реагентов и
(или) продуктов реакции, г;
![]() ,
, ![]() –
–
молярные массы эквивалентов реагентов и (или) продуктов реакции,
г/моль;
V1, V2
– объемы реагентов и (или) продуктов реакции, л;
![]() ,
,![]() –
–
молярные объемы эквивалентов реагентов и (или) продуктов реакции,
л/моль.
Л.А. Яковишин