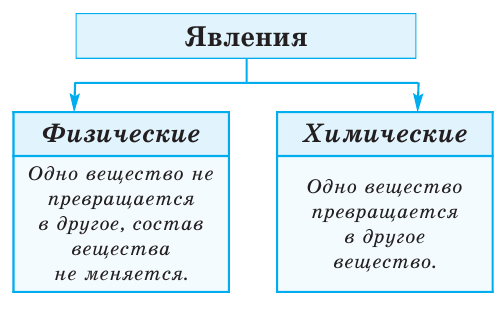
Физические и химические явления
- Признаки химических реакций
Различные изменения, происходящие с веществами, называются явлениями.
Пример. Испарение воды, плавление стекла, ржавление металлов — явления.
Явления делятся на физические и химические.
Физические явления — это явления, при которых не происходит превращения одних веществ в другие.
Пример. Изменение формы тела или агрегатного состояния вещества — физические явления.
Химические явления — это явления, в результате которых из одних веществ образуются другие, новые вещества с новыми химическими и физическими свойствами. Химические явления иначе ещё называются химическими реакциями или химическими превращениями.
Пример. Ржавление железа, горение веществ, разложение воды при высокой температуре на водород и кислород — химические явления.
О веществах, вступающих в химическую реакцию, говорят, что они реагируют, взаимодействуют между собой или одни вещества превращаются в другие.
Вещества, которые вступают в химическую реакцию, называются исходными веществами или реагентами. Новые вещества, которые образуются в результате химической реакции, называются продуктами реакции.
Пример. При взаимодействии натрия и воды образуются гидроксид натрия и водород. Натрий и вода — реагенты, а гидроксид натрия и водород — продукты реакции.
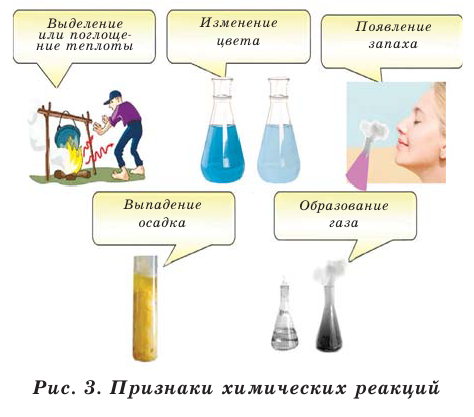
Признаки химических реакций
О том, что происходит химическая реакция можно узнать по внешним признакам. Возможные признаки протекания химических реакций:
- изменение цвета;
- образование или растворение осадка;
- выделение газа;
- появление или изменение запаха;
- выделение или поглощение теплоты;
- излучение света.
Пример. Горение веществ часто сопровождается излучением света, выделением запаха и теплоты.
Ручаюсь, вы не раз замечали что-нибудь вроде того, как мамино серебряное кольцо со временем темнеет. Или как ржавеет гвоздь. Или как сгорают до золы деревянные поленья. Ну ладно, если мама не любит серебро, а в походы вы не никогда не ходили, уж как заваривается чайный пакетик в чашке видели точно.
Что общего у всех этих примеров? А то, что все они относятся к химическим явлениям.
Химическое явление происходит тогда, когда одни вещества превращаются в другие: у новых веществ другой состав и новые свойства. Если припомнить еще и физику, то запомните, что химические явления происходят на молекулярном и атомарном уровне, но не затрагивают состав ядер атомов.
С точки же зрения химии это не что иное, как химическая реакция. А для каждой химической реакции обязательно возможно выделить характерные признаки:
- в ходе реакции может выпасть осадок;
- может измениться цвет вещества;
- следствием протекания реакции может стать выделение газа;
- может быть выделена либо поглощена теплота;
- также реакция может сопровождаться выделением света.
Мы дальше рассмотрим примеры различных химических явлений, так что этот момент станет понятнее.
Также давно определен список необходимых для протекания химической реакции условий:
- контакт: чтобы реагировать, вещества должны соприкасаться.
- измельчение: для успешного протекания реакции, вступающие в нее вещества должны быть как можно мельче измельчены, идеальный вариант – растворены;
- температура: очень многие реакции напрямую зависят от температуры веществ (чаще всего их требуется нагреть, но некоторые наоборот – охладить до определенной температуры).
Записывая буквами и цифрами уравнение химической реакции, вы тем самым описываете суть химического явления. А закон сохранения массы – одно и самых главных правил при составлении таких описаний.
Химические явления в природе
Вы, конечно, понимаете, что химия происходит не только в пробирках в школьной лаборатории. Самые впечатляющие химические явления вы можете наблюдать в природе. И значение их так велико, что не было бы никакой жизни на земле, если бы не некоторые из природных химических явлений.

Итак, первым делом поговорим про фотосинтез. Это процесс, во время которого растения поглощают углекислый газ из атмосферы и под воздействием солнечного света вырабатывают кислород. Этим кислородом мы и дышим.
Вообще фотосинтез протекает в две фазы, и освещение нужно только для одной. Ученые проводили различные опыты и выяснили, что фотосинтез протекает даже при слабом освещении. Но с увеличением количества света процесс значительно ускоряется. Также было замечено, что если одновременно увеличивать освещенность растения и повышать температуру, скорость фотосинтеза увеличивается еще больше. Происходит это до известного предела, по достижении которого дальнейшее увеличение освещенности перестает ускорять фотосинтез.
В процессе фотосинтеза задействованы фотоны, которые излучает солнце, и специальные пигментные молекулы растений – хлорофилл. В клетках растений он содержится в хлоропластах, именно благодаря которым листья зеленые.
С точки зрения химии при фотосинтезе происходит цепочка преобразований, результатом которой является кислород, вода и углеводы в качестве запаса энергии.
Первоначально считалось, что кислород образуется в результате расщепления углекислого газа. Однако позже Корнелиус Ван Ниль выяснил, что кислород образуется в результате фотолиза воды. Позднейшие исследования подтвердили эту гипотезу.
Описать суть фотосинтеза можно с помощью вот такого уравнения: 6СО2 + 12Н2О + свет = С6Н12О6 + 6О2 + 6Н2О.
Дыхание, наше с вами в том числе, – это тоже химическое явление. Мы вдыхаем выработанный растениями кислород, а выдыхаем углекислый газ.
Но не только углекислый газ образуется в результате дыхания. Главное в этом процессе то, что благодаря дыханию выделяется большое количество энергии, и этот способ ее получения очень эффективен.
Кроме того, промежуточным итогом разных этапов дыхания является большое число различных соединений. А те в свою очередь служат основой для синтеза аминокислот, белков, витаминов, жиров и жирных кислот.
Процесс дыхания сложный и разбит на несколько этапов. На каждом из которых в ход идет большое количество ферментов, выполняющих роль катализаторов. Схема химических реакций дыхания практически одинаковая у животных, растений и даже бактерий.
С точки зрения химии дыхание – это процесс окисления углеводов (как вариант: белков, жиров) с помощью кислорода, в результате реакции получаются вода, углекислый газ и энергия, которую клетки запасают в АТФ: С6Н12О6 + 6О2 = СО2 + 6Н2О + 2,87 * 106 Дж.
Кстати, мы говорили выше, что химические реакции могут сопровождаться излучением света. В случае с дыханием и сопутствующими ему химическими реакциями это тоже верно. Светиться (люминесцировать) могут некоторые микроорганизмы. Хотя при этом энергетическая эффективность дыхания снижается.
Горение тоже происходит при участии кислорода. В результате древесина (и другое твердое топливо) превращается в золу, а это вещество с совершенно другим составом и свойствами. Кроме того, в процессе горения выделяется большое количество теплоты и света, а также газа.
Горят, конечно, не только твердые вещества, просто с их помощью было удобнее привести пример в данном случае.
С химической точки зрения горение – это окислительная реакция, которая протекает с очень большой скоростью. А при очень-очень высокой скорости реакции может произойти взрыв.
Схематически реакцию можно записать так: вещество + О2 → оксиды + энергия.
Как природное химическое явление рассматриваем мы и гниение.
По сути, это тот же процесс, что и горение, только протекает он гораздо медленней. Гниение представляет собой взаимодействие сложных азотосодержащих веществ с кислородом при участии микроорганизмов. Наличие влаги является одним из факторов, способствующих возникновению гниения.
В результате химических реакций из белка образуется аммиак, жирные летучие кислоты, углекислота, оксикислоты, спирты, амины, скатол, индол, сероводород, меркаптаны. Часть из образованных в результате гниения азотосодержащих соединений ядовито.
Если снова обратимся к нашему списку признаков химической реакции, то многие из них обнаружим и в этом случае. В частности, имеется исходное вещество, реагент, продукты реакции. Из характерных признаков отметим выделение теплоты, газов (сильнопахнущих), изменение цвета.
Для круговорота веществ в природе гниение имеет очень большое значение: позволяет перерабатывать белки погибших организмов в соединения, пригодные к усвоению растениями. И круг начинается сначала.

Уверена, вы замечали, как летом легко дышится после грозы. И воздух тоже становится особенно свежим и приобретает характерный запах. Каждый раз после летней грозы вы можете наблюдать еще одно распространенное в природе химическое явление – образование озона.
Озон (О3) в чистом виде представляет собой газ синего цвета. В природе наибольшая концентрация озона – в верхних слоях атмосферы. Там он выполняет роль щита нашей планеты. Который защищает ее от солнечной радиации из космоса и не дает Земле остывать, поскольку поглощает и ее инфракрасное излучение.
В природе озон в большинстве своем образуется благодаря облучению воздуха ультрафиолетовыми лучами Солнца (3О2 + УФ свет → 2О3). А также при электрических разрядах молний во время грозы.
В грозу под воздействием молний часть молекул кислорода распадается на атомы, молекулярный и атомарный кислород соединяются, и образуется О3.
Вот почему мы ощущаем особую свежесть после грозы, нам легче дышится, воздух кажется более прозрачным. Дело в том, что озон гораздо более сильный окислитель, чем кислород. И в небольшой концентрации (как после грозы) безопасен. И даже полезен, поскольку разлагает вредные вещества в воздухе. По сути, дезинфицирует его.
Однако в больших дозах озон очень опасен для людей, животных и даже растений, для них он ядовит.
Кстати, дезинфицирующие свойства полученного лабораторным путем озона широко используются для озонирования воды, предохранения продуктов от порчи, в медицине и косметологии.
Разумеется, это далеко не полный список удивительных химических явлений в природе, которые делают жизнь на планете такой разнообразной и прекрасной. Вы сможете узнать о них больше, если будете внимательно смотреть по сторонам и держать уши открытыми. Вокруг полно удивительных явлений, которые только и ждут, чтобы вы ими заинтересовались.
Химические явления в быту
К ним относятся те, что можно наблюдать в повседневной жизни современного человека. Некоторые из них совсем простые и очевидные, любой может наблюдать их на своей кухне: например, заваривание чая. Нагретые кипятком чаинки меняют свои свойства, в результате меняется и состав воды: она приобретает другой цвет, вкус и свойства. То есть получается новое вещество.
Если в этот же чай насыпать сахар, в результате химической реакции получится раствор, который снова будет обладать набором новых характеристик. В первую очередь, новым, сладким, вкусом.
На примере крепкой (концентрированной) чайной заварки можете самостоятельно провести и еще один опыт: осветлить чай при помощи дольки лимона. Из-за кислот, содержащихся в лимонном соке, жидкость еще раз изменит свой состав.
Какие еще явления вы можете наблюдать в быту? Например, к химическим явлениям относится процесс сгорания топлива в двигателе.
Если упростить, реакцию сгорания топлива в двигателе можно описать так: кислород + топливо = вода + углекислый газ.
Вообще в камере двигателя внутреннего сгорания происходит несколько реакций, в которых задействованы топливо (углеводороды), воздух и искра зажигания. А точнее, не просто топливо – топливно-воздушная смесь из углеводородов, кислорода, азота. Перед зажиганием смесь сжимается и нагревается.
Сгорание смеси происходит в доли секунды, в итоге связь между атомами водорода и углерода разрушается. Благодаря этому высвобождается большое количество энергии, которая приводит в движение поршень, а тот – коленчатый вал.
В дальнейшем атомы водорода и углерода соединяются с атомами кислорода, образуется вода и углекислый газ.
В идеале реакция полного сгорания топлива должна выглядеть так: CnH2n+2 + (1,5n+0,5)O2 = nCO2 + (n+1)H2O. В реальности же двигатели внутреннего сгорания не настолько эффективны. Предположим, если кислорода при реакции не хватает незначительно, в результате реакции образуется СО. А при большей нехватке кислорода образуется сажа (С).

Образование налета на металлах в результате окисления (ржавчина на железе, патина на меди, потемнение серебра) – тоже из категории бытовых химических явлений.
Возьмем железо для примера. Ржавление (окисление) происходит под воздействием влаги (влажность воздуха, прямой контакт с водой). Результатом этого процесса становится гидроксид железа Fe2O3 (точнее, Fe2O3 * H2O). Вы можете увидеть его в виде рыхлого, шероховатого, оранжевого или красно- коричневого налета на поверхности металлических изделий.
Другим примером может послужить зеленый налет (патина) на поверхности изделий из меди и бронзы. Он образуется со временем под воздействием атмосферного кислорода и влажности: 2Cu + O2 + H2O + CO2 = Cu2CO5H2 (или CuCO3 * Cu(OH)2). Полученный в итоге основной карбонат меди встречается и в природе – в виде минерала малахита.
И еще один пример медленной окислительной реакции металла в бытовых условиях – это образование темного налета сульфида серебра Ag2S на поверхности серебряных изделий: украшений, столовых приборов и т.п.
«Ответственность» за его возникновение несут частички серы, которые в виде сероводорода присутствуют в воздухе, которым мы с вами дышим. Потемнеть серебро может и при контакте с серосодержащими пищевыми продуктами (яйцами, например). Реакция же выглядит так: 4Ag + 2H2S + O2 = 2Ag2S + 2H2O.
Вернемся на кухню. Здесь можно рассмотреть еще несколько любопытных химических явлений: образование накипи в чайнике одно из них.
В бытовых условиях нет химически чистой воды, в ней всегда в различной концентрации растворены соли металлов и другие вещества. Если вода насыщена солями кальция и магния (гидрокарбонатами), ее называют жесткой. Чем выше концентрация солей, тем более жесткой является вода.
Когда такая вода нагревается, эти соли подвергаются разложению на углекислый газ и нерастворимый осадок (СаСО3 и MgСО3). Эти твердые отложения вы и можете наблюдать, заглянув в чайник (а также взглянув на нагревательные элементы стиральных и посудомоечных машинок, утюгов).
Кроме кальция и магния (из которых получается карбонатная накипь), в воде также часто присутствует железо. В ходе химических реакций гидролиза и окисления из него образуются гидроксиды.
Кстати, собравшись избавиться от накипи в чайнике, вы можете наблюдать еще один пример занимательной химии в быту: с отложениями хорошо справляются обычный столовый уксус и лимонная кислота. Чайник с раствором уксуса/лимонной кислоты и воды кипятят, после чего накипь исчезает.
А без другого химического явления не было бы вкусных маминых пирогов и булочек: речь о гашении соды уксусом.
Когда мама гасит соду в ложке уксусом, происходит вот такая реакция: NaHCO3 + CH3COOH = CH3COONa + H2O + CO2. Полученный в ее результате углекислый газ стремится покинуть тесто – и тем самым изменяет его структуру, делает пористым и рыхлым.
Кстати, можете рассказать маме, что гасить соду вовсе не обязательно – она и так прореагирует, когда тесто попадет в духовку. Реакция, правда, будет проходить немного хуже, чем при гашении соды. Но при температуре от 60 градусов (а лучше 200) происходит разложение соды на карбонат натрия, воду и все тот же углекислый газ. Правда, вкус готовых пирогов и булочек может оказаться хуже.
Список бытовых химических явлений не менее впечатляющий, чем список таких явлений в природе. Благодаря им у нас есть дороги (изготовление асфальта – это химические явление), дома (обжиг кирпича), красивые ткани для одежды (окрашивание). Если задуматься об этом, становится отчетливо ясно, насколько многогранная и интересная наука химия. И сколько пользы можно извлечь из понимания ее законов.
Интересные химические явления
Среди многих и многих придуманных природой и человеком явлений есть особенные, которые сложно описать и объяснить. К ним относится и горение воды. Как такое, может быть, спросите вы, ведь вода не горит, ею тушат огонь? Как она может гореть? А дело вот в чем.
Горение воды – это химическое явление, при котором в воде с примесью солей под воздействием радиоволн разрываются кислородно-водородные связи. В результате образуется кислород и водород. И горит, конечно, не сама вода, а именно водород.
При этом он достигает очень высокой температуры горения (больше полутора тысяч градусов), плюс в ходе реакции снова образуется вода.
Это явление давно интересует ученых, мечтающих научиться использовать воду в качестве топлива. Например, для автомобилей. Пока это нечто из области фантастики, но кто знает, что ученые сумеют изобрести совсем скоро. Одна из главных загвоздок в том, чтобы при горении воды энергии выделялось больше, чем затрачивается на проведение реакции.
Кстати, нечто подобное можно наблюдать и в природе. Согласно одной из теорий, большие волны-одиночки, появляющиеся словно бы из ниоткуда, на самом деле являются следствием водородного взрыва. Электролиз воды, который к нему приводит, осуществляется благодаря попаданию электрических разрядов (молний) на поверхность соленой воды морей и океанов.

Но не только в воде, но и на суше можно наблюдать поражающие воображение химические явления. Если бы вам довелось побывать в природной пещере, наверняка вы смогли бы увидеть там причудливые, красивые природные «сосульки», свисающие с потолка – сталактиты. То, как и почему они появляются, объясняется еще одним интересным химическим явлением.
Химик, глядя на сталактит, видит, конечно, не сосульку, а карбонат кальция СаСО3. Основой для его образования служат сточные воды, природный известняк, а сам сталактит выстраивается благодаря осаждению карбоната кальция (рост вниз) и силе сцепления атомов в кристаллической решетке (рост вширь).
К слову, аналогичные образования могут подниматься от пола к потолку – их называют сталагмиты. А если сталактиты и сталагмиты встречаются и срастаются в цельные колонны, они получают название сталагнаты.
Заключение
В мире ежедневно происходит множество удивительных, прекрасных, а также опасных и пугающих химических явлений. Из многих человек научился извлекать пользу: создает строительные материалы, готовит пищу, заставляет транспорт перемещаться на огромные расстояния и многое другое.
Без многих химических явлений не было бы возможным существование жизни на земле: без озонового слоя люди, животные, растения не выжили бы из-за ультрафиолетовых лучей. Без фотосинтеза растений животным и людям нечем было бы дышать, а без химических реакций дыхания этот вопрос вообще не был бы актуальным.
Брожение позволяет готовить продукты питания, а сходное с ним химическое явление гниения разлагает белки на более простые соединения и возвращает те в круговорот веществ в природе.
Образование оксида при нагревании меди, сопровождающееся ярким свечением горение магния, плавление сахара и др. тоже считают химическими явлениями. И находят им полезное применение.
Будет здорово, если в комментариях вы расскажете нам, какие еще химические явления вы могли сами наблюдать в природе или у себя дома. И будет очень хорошо, если расскажете про эту статью своим друзьям – многие из них тоже могут захотеть поделиться своими наблюдениями.
© blog.tutoronline.ru,
при полном или частичном копировании материала ссылка на первоисточник обязательна.
Физическими называют явления, при которых не происходит превращение одних веществ в другие.
При физических явлениях могут изменяться физические свойства вещества: агрегатное состояние, температура, плотность и т. д.
К физическим явлениям относятся распространение запаха в воздухе, свечение раскалённых металлов, прохождение электрического тока по металлической проволоке, растворение сахара в воде, выделение соли из раствора при выпаривании. В этих процессах вещества не изменяют свои состав и строение.
Пример:
при нагревании вода превращается в пар. Жидкая вода и водяной пар состоят из одинаковых молекул.

Рис. (1). Испарение воды
Изменения произошли, но вода осталась водой.
Химическими называют явления, при которых происходит превращение одних веществ в другие.
К химическим явлениям относятся образование в зелёных листьях растений крахмала и кислорода из углекислого газа и воды, превращение железа в ржавчину, горение дров, гниение опавших листьев.
Химические явления называют химическими реакциями. В результате химических реакций происходит изменение состава и строения веществ. Новые вещества образуются из атомов, которые входили в состав исходных веществ.
Пример:
при пропускании электрического тока вода разлагается на водород и кислород. Молекула воды состоит из двух атомов водорода и одного атома кислорода, соединённых вместе. В результате реакции атомы разделяются и образуют молекулы водорода и кислорода.

Рис. (2). Разложение воды
Вещества, вступившие в химическую реакцию, называют реагентами, или исходными веществами. Образовавшиеся новые вещества называют продуктами реакции.
В реакции разложения воды она является исходным веществом, а водород и кислород — продуктами реакции. Этот процесс можно показать схемой, в которой исходное вещество записано слева, а продукты реакции — справа от стрелки:
вода → водород + кислород
Химические реакции человек использует для получения металлов из металлических руд, пластмасс, волокон, резины из природного газа и нефти и других полезных веществ.
Источники:
Рис. 1. Испарение воды https://image.shutterstock.com/image-vector/water-decomposition-chemical-reaction-vector-600w-1755258749.jpg
Рис. 2. Разложение воды https://image.shutterstock.com/image-vector/water-decomposition-chemical-reaction-vector-600w-1755258749.jpg
Содержание:
Физические и химические явления:


Сравните картинки. В результате какого явления гвозди ржавеют, черешня сгнивает, а вода превращается из жидкого состояния в твёрдое или газообразное состояния. Чем отличаются эти явления друг от друга? Как это можно объяснить? Какие признаки имеют химические реакции?
Каждому из нас в повседневной жизни доводилось наблюдать, как нагретая вода, превратившись в пар, «исчезает» (переходит в состояние невидимого газа), и как этот пар при соприкосновении с холодной поверхностью предмета вновь превращается в капельки воды. Точно так же все видели превращение воды в лед в выставленной наружу в холодный морозный день посуде и обратный переход его в жидкое состояние при внесении в помещение. Образуется ли новое вещество при этих превращениях?
Возьмите две миски небольшой ёмкости. В одной из мисок смешайте небольшое количество соли с водой, а в другой – сахара с водой и поставьте на слабый огонь. Что вы наблюдаете? Запишите свои мысли в тетради.
Из курса физики нам известно, что все происходящие в природе изменения называются явлением. Например, выпадение дождя, восход солнца, удар грома, землетрясение, таяние ледников и др. (рис.1).

Все происходящие в природе явления делятся на 2 группы (схема 1)
Схема 1
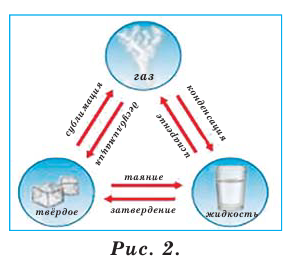
Во время физических явлений изменяются лишь агрегатное состояние, форма, размеры, объём, давление, температура и скорочть движения вещества (рис.2). Например, замерзание воды, таяние льда, кипение воды и др.
1. Нагрейте медную проволку. 2. В отстоявшуюся известковую воду с помощью трубочки вдуньте воздух или же добавьте немного раствора соды. 3. Подожгите кусочек серы размером с горошину. Что вы наблюдаете в каждом случае?
Во время химических явлений из исходного вещества образуются новые вещества. Например, такие химические явления, как горение, брожение, гниение, электролиз, разложение на составные части, ржавление (коррозия) и др. называют химическими реакциями.
Химические реакции имеют несколько признаков. Эти признаки показывают протекание химических реакций (рис. 3).
Химические явления всегда сопровождаются физическими явлениями. Например, при горении природного газа, наряду с образованием углекислого газа и воды (химическое явление), также выделяются свет и теплота (физическое явление).
Значение физических и химических явлений
Из курса «Познание мира» вам известно, какое значение имеют физические явления, происходящие вокруг нас. Так, например, испарение воды, конденсация водяных паров и выпадение дождя составляют круговорот воды в природе. В промышленном производстве, придавая металлам, пластмассам и другим материалам определенную форму (штамповка, прокатка), получают разнообразные предметы.
Химические реакции имеют огромное значение. Ими пользуются для получения различных металлов (железа, алюминия, меди, цинка, свинца, олова и др.), а также пластмасс, минеральных удобрений, лекарственных препаратов и т.д. Выделяемая при сгорании топлива энергия используется в быту и в промышленности.
Условия начала и хода химических реакций бывают разными. Для протекания ряда реакций (например, реакций горения) достаточно соприкосновения (трения) частиц веществ и подогревания до определенной температуры. Доведение реакции до конца обеспечивается за счет выделяемой тепловой энергии.
Некоторые же реакции (например, разложение воды на кислород и водород) требуют подачи дополнительной энергии до конца.
В природе физические и химические явления (реакции) протекают непрерывно, постоянно, обеспечивая этим циркуляцию веществ, климатические изменения, условия жизни для живых организмов.
Химические уравнения. Знаки сохранения массы веществ
Смочите в пробирке около 2-х г хлорида натрия небольшим количеством воды. Влив в пробирку до четверти её объёма концентрированной серной кислоты, закройте её горлышко пробкой, через которую проходит газоотводная трубка. При этом кислота должна быть концентрированной, а соль – в виде кристаллов. Пробирку с содержащимися в ней солью и серной кислотой слегка подогрейте. Что вы наблюдаете? Происходят ли изменения в массах веществ в результате реакции? Запишите уравнение реакции.
Происходящие в природе химические превращения в письменном виде выражают посредством химических уравнений. Условная запись химической реакции посредством формул, знаков и коэффициентов называется химическим уравнением.
Химическое уравнение составляется на основе нижеприведённых правил:
- Записываются химические формулы веществ, вступающих в реакцию.
- Если число вступающих в реакцию веществ два и больше, между ними ставится знак « + ».
- Затем ставится знак
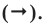
- После знака стрелки записываются химические формулы полученных веществ.
- При получении двух и более продуктов между ними ставится знак
Например, составим уравнение реакции горения водорода в кислороде:
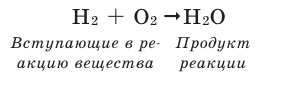
Здесь количество атомов в правой и левой частях неодинаковое. Такую запись называют схемой реакции. Для того, чтобы превратить данную схему в уравнение, следует уравнять число атомов в левой и правой частях уравнения.
Уравнивание количества атомов элементов в правой и левой частях уравнения называют коэффицированием уравнения. Определим число атомов элементов, входящих в состав веществ в реакции образования воды.
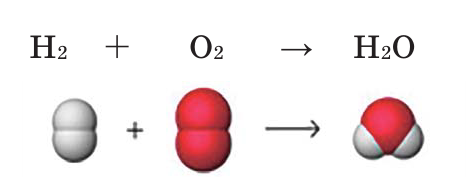
Если обратим внимание на реакцию, то увидим, что количество атомов водорода в обеих частях одинаковое. А количество атомов кислорода в правой части на единицу меньше количества атомов кислорода в левой части. Вследствие этого, вначале уравним число атомов кислорода. Для этого число атомов в правой части реакции умножается на 2, и на основе этого определяется коэффициент веществ на левой стороне.
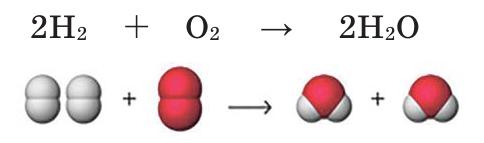
В результате количество атомов водорода и кислорода в левой и правой частях уравнивается и получается уравнение химической реакции. 2 молекулы водорода, вступая в реакцию с 1 молекулой кислорода, образуют 2 молекулы воды.
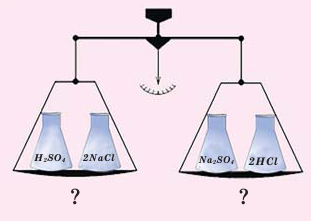
Впервые в 1748-ом году знаменитым русским учёным М.В.Ломоносовым, и независимо от него, в 1789-ом году французским учёным А.Лавуазье был открыт закон о том, что во время химических реакций сумма масс, вступающих в реакцию веществ, равна сумме масс, полученных в результате реакции веществ.
Закон сохранения массы веществ выражается следующим образом: Сумма масс веществ, вступивших в химическую реакцию, равна сумме масс веществ, полученных в результате реакции.
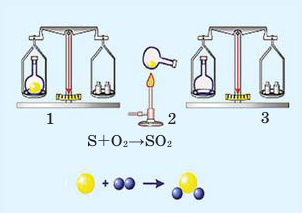
В колбу насыпают небольшое количество серы, после этого её закупоривают пробкой и взвешивают на весах (1). Затем колбу вместе с серой осторожно нагревают (2). На основе появления в колбе дыма, состоящего из частиц оксида серы (IV), можно определить протекание химической реакции.
При повторном взвешивании обнаруживается, что в результате реакции масса вещества осталась неизменной (3).
Типы химических реакций

Поместите в керамический тигель немного бихромата аммония 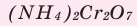 и поставьте на большую асбестовую плитку. Нагрев стеклянную палочку, прикоснитесь ею к веществу.
и поставьте на большую асбестовую плитку. Нагрев стеклянную палочку, прикоснитесь ею к веществу.
Что вы видите? Изложите свои соображения относительно происходящего процесса и запишите уравнение реакции. Почему эту реакцию называют «химическим вулканом»?
Химические реакции классифицируются по различным признакам. По количеству веществ, вступивших в реакцию и полученных в результате реакции, химические реакции подразделяются на 4 типа (схема 1):
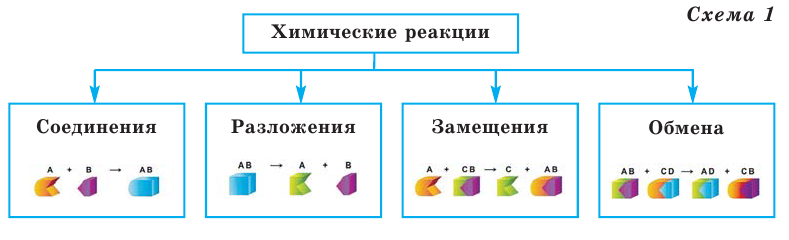
Реакции соединения
Реакции, при которых из двух и более простых или сложных веществ получают одно сложное вещество, называют реакциями соединения.
Для протекания химических реакций иногда требуется нагревание. В таком случае в уравнениях реакций над стрелкой ставится
знак t.
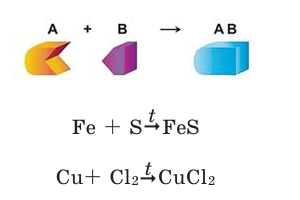
Реакции разложения
Реакции, при которых из одного сложного вещества получают два и более простых или сложных веществ, называют реакциями разложения.
Если во время реакции выделяется газ, в таком случае, рядом с её химической формулой проставляется стрелка, направленная вверх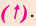
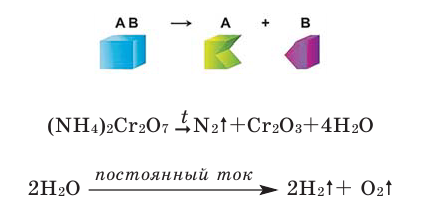
Реакции замещения
Если в реакциях, протекающих между простым и сложным веществом, атомы одного из элементов сложного вещества замещаются атомами простого вещества, то такие реакции называются реакциями замещения.
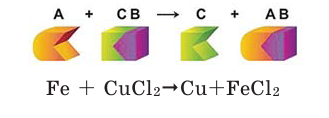
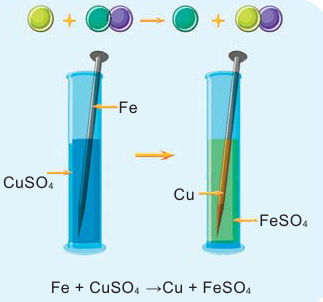
Опустите в раствор сульфата меди (II)  голубого цвета очищенный железный гвоздь или железную пластинку. Что вы наблюдаете?
голубого цвета очищенный железный гвоздь или железную пластинку. Что вы наблюдаете?
Если во время реакции выпадает осадок, в таком случае, рядом с химической формулой полученного вещества проставляется стрелка, направленная вниз 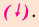
Реакции обмена
Если в реакциях, протекающих между двумя сложными веществами, составные части сложных веществ, меняясь местами, образуют новые сложные вещества, то такие реакции называются реакциями обмена.
Тепловой эффект химических реакций

Наблюдаете ли вы за тем, какие изменения происходят в вашем организме во время занятий спортом, приготовления уроков и приёма пищи? Как в это время изменяется ваша энергия?
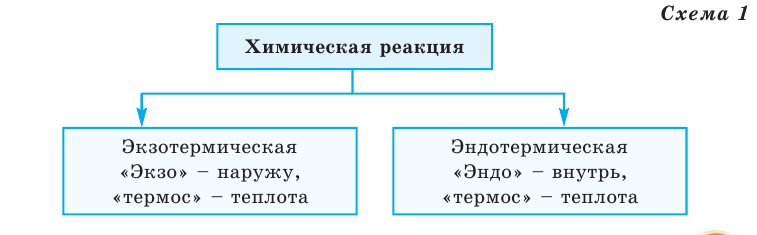
В жизни мы постоянно принимаем пищу, а также занимаемся определённой деятельностью (умственной и физической). Вначале мы, приняв пищу, увеличиваем свою энергию, а занимаясь различной деятельностью, тратим ту энергию, которую получили благодаря приёму пищи (т.е. наша энергия уменьшается), и в результате мы чувствуем себя усталыми и утомлёнными. Как и человек, каждое химическое вещество обладает определённым запасом энергии. Химические реакции веществ сопровождаются выделением или поглощением теплоты.
Количество выделяемой или поглощаемой в ходе химической реакции теплоты называется тепловым эффектом.
Тепловой эффект обозначается буквой Q, а единица его измерения — кДж. В зависимости от выделения или поглощения теплоты химические реакции делятся на 2 группы (схема 1)
Химические реакции, протекающие с выделением теплоты, называются экзотермическими реакциями. В уравнениях экзотермических реакций выделяемая теплота (Q) указывается в правой стороне реакции знаком «+» (Q>0).
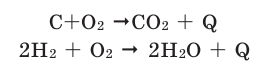
Все реакции горения – экзотермические. Реакция между азотом и кислородом – эндотермическая. (Это не реакция горения).
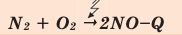
Химические реакции, протекающие с поглощением теплоты, называются эндотермическими реакциями. В уравнениях эндотермических реакций поглощённая теплота указывается в правой стороне реакции знаком «— ». То есть Q < 0:
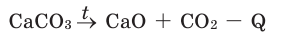
Большинство реакций разложения и некоторые реакции соединения – эндотермические. Реакция разложения монооксида азота – экзотермическая.
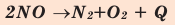
Уравнения химических реакций, в которых указаны агрегатное состояние и тепловой эффект вступающих в реакцию и полученных веществ, называются термохимическими уравнениями. В термохимических уравнениях вместо стрелки  проставляется знак
проставляется знак 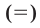 .
.
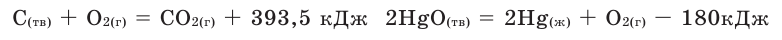
Количество тепла, выделяемого или поглощаемого во время образования 1 моля сложного вещества из простых веществ, называется теплотой образования. Теплота образования обозначается в виде 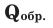 и измеряется в кДж/моль. Для вычисления теплоты образования полученного продукта в термохимическом уравнении, следует тепловой эффект реакции поделить на коэффициент продукта. Например:
и измеряется в кДж/моль. Для вычисления теплоты образования полученного продукта в термохимическом уравнении, следует тепловой эффект реакции поделить на коэффициент продукта. Например:
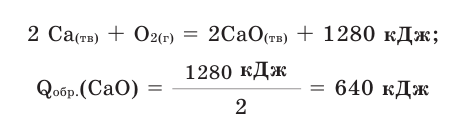
Процесс отрыва электрона от того или иного атома является эндотермическим, а присоединение к атому электрона – экзотермическим процессом. Например:
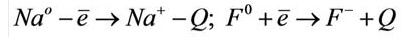
Горение. Рациональное сжигание топлива
Обратите внимание на картинки. Что вы наблюдаете, разжигая костёр?
Реакции, протекающие с выделением теплоты и света при взаимодействии веществ с кислородом, называются реакциями горения или просто горением.
Реакции горения – это процесс окисления, протекающий с большой скоростью.
Теплота, выделяемая во время полного сгорания 1 моля того или иного вещества, называется теплотой горения (измеряется в к Дж/моль). При вычислении теплоты горения тепловой эффект реакции делится на коэффициент сгорающего вещества.
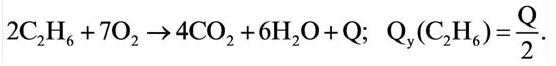
Для горения веществ нужны два условия:
Для получения тепловой энергии используют различные виды топлива в природе. По своему агрегатному состоянию топливо подразделяется на 3 вида (схема 1)
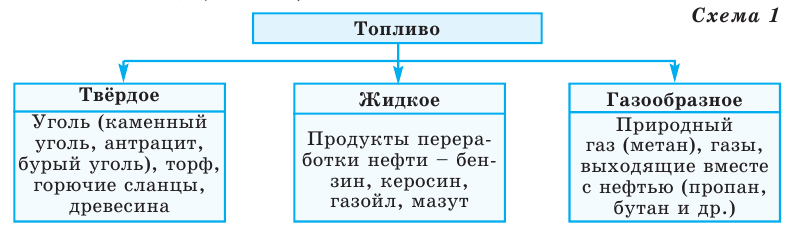
Газообразное топливо имеет ряд преимуществ по сравнению с твердым и жидким топливом: его добыча и транспортировка экономически более выгодны; упрощается регулирование процесса горения; достигается более полное сжигание топлива; устраняется загрязнение окружающей среды. Качество топлива определяется его теплотворной способностью, т.е. количеством теплоты (в кДж), выделяемой при сжигании 1 кг топлива.
А теплотворная способность топлива определяется количеством углерода в составе топлива.
Как следует поступить, если произойдёт пожар?
Для предотвращения процесса горения следует: 1) охладить температуру горящего материала с доведением её до более низкой, чем при его воспламенении, температуры; 2) предотвратить соприкосновение кислорода (или воздуха) с горящим материалом.
При погашении огня водой горящий материал одновременно и остывает и в то же время образующийся от нагрева воды пар в достаточной степени устраняет соприкосновение материала с кислородом (с воздухом). Кроме воды, соприкосновение воздуха с горящим материалом предотвращается при помощи песка, грунта, огнетушителей и некоторых взрывчатых веществ. Если огонь охватил малую площадь, то горящую часть вещества следует накрыть одеялом, паласом, плотной тканью и т.д., не пропускающими воздух (рис. 1). Если загорелась ваша одежда, следует незамедлительно принять меры, указанные выше.

Вычисления по химическим уравнениям
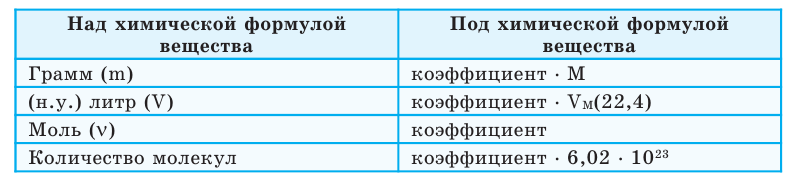
Вычисления по химическим уравнениям производятся в следующей последовательности:
- Вначале следует составить уравнение соответствующей реакции и проставить коэффициенты;
- Указанные в условии задачи данные (х) (вместе с единицей измерения) записать над соответствующей формулой вещества;
- Отметить количество веществ (v, N, m, V) под химическими формулами, учитывая соответствующие единицы измерения и их коэффициенты;
- Составив пропорцию, производить вычисления.
I. Вычисление массы и количества полученного вещества (или вступающего в реакцию другого вещества) при указании в условии задачи массы одного из вступающих в реакцию веществ (или наоборот).
Задача 1. Вычислите массу (в граммах) и количество вещества (моль) углекислого газа, полученного при полном сгорании 24 г угля: 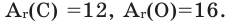
Решение:
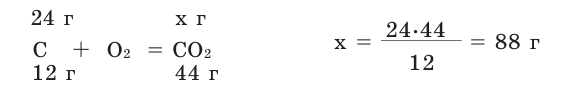
б) Находим количество вещества 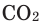 по формуле
по формуле 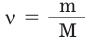
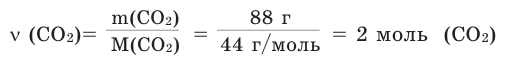
II. Вычисление количества и массы полученного вещества (или вступающего в реакцию другого вещества) при указании в условии задачи количества одного из вступающих в реакцию веществ (или наоборот).
Задача 2. Какое количество (моль) и сколько граммов кислорода необходимо для вступления в реакцию с 8 молями водорода? 
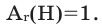
Решение:
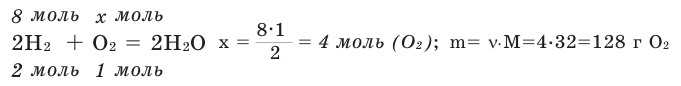
III. Правила решения задач по закону сохранения массы веществ в химических реакциях. Определение относительной атомной массы неизвестного химического элемента.
Задача 3. Определите относительную атомную массу металла, если 4,6 г одновалентного металла, вступая в реакцию с водородом, образует 4,8 г гидрида этого металла.
Решение: 4,8—4,6=0,2 г 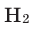 вступает в реакцию.
вступает в реакцию.

IV. Правило вычисления теплового эффекта по теплоте образования.
Тепловой эффект химической реакции равен разнице между суммой теплоты образования продуктов реакции и суммой теплоты образования исходных веществ.
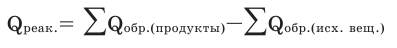
Задача 4. Вычислите тепловой эффект реакции 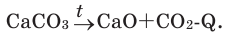
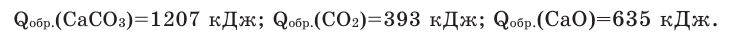
Решение: 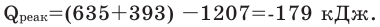
V. Закон Гесса и решение задач по данному закону.
Тепловой эффект реакции зависит не от путей протекания и количества этапов реакции, а только от природы и физического состояния вступающих в реакцию и получаемых в результате реакции веществ. Т.е. тепловой эффект общей реакции равен сумме тепловых эффектов её этапов.
Задача 5. I этап: 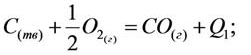
Общая реакция 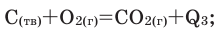 Вычислите
Вычислите 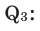 Решение:
Решение: 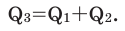
VI. Вычисление выхода продукта

Здесь 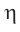 называется – эта, а
называется – эта, а 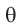 – тета.
– тета.
- Растворы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Ковалентная связь
- Простые и сложные вещества в химии
- Химическая формула
- Относительная атомная и относительная молекулярная масса
- Молярная масса в химии
