При взаимодействии основных оксидов с водой получаются основания. А вот при взаимодействии с водой кислотных оксидов получаются кислоты.
Кислоты – это большой класс химических соединений, в которых есть атом водорода и так называемый кислотный остаток.
Правильно определять кислотные остатки и понимать, как определяется их валентность, просто необходимо, иначе будет сложно составлять формулы солей. Ниже мы поговорим о классификации кислот и узнаём побольше о кислотных остатках.
Классификация кислот
Делить кислоты на группы можно по разным признакам, но нас сейчас будут интересовать два: содержание кислорода и основность.
Классификация кислот по содержанию кислорода
Тут всё просто: в составе некоторых кислот кислород есть (и они называются кислородсодержащими), в составе других кислорода нет (и эти кислоты называют бескислородными).
Примеры кислородсодержащих кислот: серная Н2SO4, фосфорная H3PO4, азотная HNO3.
Примеры бескислородных кислот: сероводородная H2S, соляная HCl, плавиковая HF.
Классификация кислот по основности
Тут мы должны остановиться более подробно.
Основность определяется числом атомов водорода в составе кислоты.
Для того, чтобы узнать основность, нужно взглянуть на формулу. Например, соляная кислота HCl одноосновная, потому что здесь только один атом водорода, сернистая кислота H2SO3 – двухосновная (здесь два атома водорода), а фосфорная H3PO4 – трёхосновная (в формуле три атома водорода). Запомните, как определять основность, тогда вам будет значительно проще составлять формулы солей при составлении химических уравнений.
Теперь давайте уделим внимание второй составной части кислоты – кислотному остатку.
Кислотный остаток – это то, что останется от кислоты, если убрать водород.
То есть, в азотной кислоте HNO3 кислотный остаток -NO3, в сероводородной Н2S кислотный остаток -S, в фосфорной кислоте H3PO4 кислотный остаток – PO4. Обратите внимание, что в кислородсодержащей кислоте остаток кислород содержит, а в бескислородной не содержит.
Валентность кислотного остатка
Говорить о валентности кислотного остатка не совсем корректно, поскольку валентность – это способность атомов образовывать химические связи. Если же речь идёт о кислотном остатке кислородсодержащей кислоты, то у нас имеется группа атомов (например, кислотный остаток –NO3). Но мы всё равно будем говорить о валентности, чтобы проще было составлять формулы.
Итак,
валентность кислотного остатка определяется числом атомов водорода.
Фактически валентность равна основности. Например, у двухосновной серной кислоты H2SO4 есть кислотный остаток –SO4, валентность которого II. И для чего же нам нужно это знание? Давайте рассмотрим примеры.
Пример 1.
Составьте формулу сульфида натрия.
Натрий – металл первой группы с валентностью I. Сульфид – соль сероводородной кислоты H2S. Когда образуется соль (в данной ситуации сульфид натрия), металл замещает водород в кислоте, то есть соль состоит из металла и кислотного остатка. Тогда в сульфиде натрия будут натрий и сера. Сероводородная кислота – двухосновная, поскольку в ней два атома водорода. Следовательно, у кислотного остатка –S валентность II. Составляем формулу, используя знания о валентности:
Ответ: формула сульфида натрия H2S.
Пример 2.
Составьте формулу сульфита калия.
Этот пример посложнее: в нём фигурирует кислородсодержащая двухосновная сернистая кислота H2SO3. Из формулы видно, что валентность кислотного остатка –SO3 будет II. Калий же – металл первой группы, его валентность I. Составляем формулу:
Ответ: формула сульфита калия К2SO3.
Пример 3.
Составьте формулу нитрата кальция.
Итак, нитрат – соль азотной кислоты HNO3. Это одноосновная кислота, поэтому кислотный остаток -NO3 имеет валентность I. Кальций – металл второй группы с валентностью II. Составляем формулу:
Ответ: формула нитрата кальция Ca(NO3)2.
Обратите внимание на очень важный момент! Мы взяли кислотный остаток NO3 в скобки и внизу поставили индекс 2. Это показывает, что в формуле два кислотных остатка! Не забывайте ставить скобки, иначе это будет ошибкой. Фактически в соединении Ca(NO3)2 один атом кальция, два атома азота и шесть атомов кислорода (если раскрыть скобки), но написание CaN2O6 ничего не показывает, а вот из формулы Ca(NO3)2 сразу видно, что у нас имеется атом кальция и два кислотных остатка азотной кислоты.
Пример 4.
В заключение самый сложный пример от репетитора по химии. Нужно составить формулу фосфата магния.
Магний – металл второй группы, его валентность II. Фосфат – соль фосфорной кислоты H3PO4. Здесь кислотный остаток PO4 и его валентность III. Составляем формулу:
Формула выглядит громоздко, но она всё предельно точно рассказывает о составе вещества: в фосфате магния имеется три атома магния и два кислотных остатка фосфорной кислоты.
Ответ: формула фосфата магния Мg3(PO4)2.
Кстати, кислоты реагируют с металлами, но не всеми. Об этом читайте в тексте «Химические свойства кислот».
Пишите, пожалуйста, в комментариях, что осталось непонятным, и я обязательно дам дополнительные пояснения. Жалуйтесь на сложности в изучении школьного курса и говорите, что вас испугало в учебнике химии. И тогда следующая статья будет рассказывать именно об этой проблеме.
Как составить химические формулы кислот соответствующих оксидам?
Ученик
(63),
закрыт
8 лет назад
Александр Титов
Гений
(50768)
9 лет назад
Просто добавить воду в формулу и записать формулу соответствующей кислоты.
На первом месте будет водород, на втором – неметалл, на третьем – кислород.
Например,
Кислотному оксиду SO3 соответствует кислота H2SO4
SO3 + H2O – всего водорода 2 атома, его на 1-е место ставим H2**, далее один атом серы – ставим его после водорода
H2S*, ещё остаётся кислород – три атома от SO3 и один от H2O – итого 4, ставим после серы и получаем H2SO4.
В случае, если атомы в молекуле можно сократить на одно и то же число – сокращаем.
Например, способом выше из N2O5 и H2O получится формально H2N2O6 – сокращаем на 2 и получаем HNO3.
Есть и особые случаи, например, оксиду P2O5 соответствует как метафосфорная (HPO3), так и ортофосфорная (H3PO4) кислота. В первом случае молекул воды условно добавили 2 штуки.
Ещё надо помнить, что не все оксиды являются солеобразующими – несолеобразующим оксидам не соответствуют никакие кислоты, таковы, например, оксиды N2O, NO, CO. Нельзя формально написать, например, H2NO2 – нет такой кислоты.
Формулы кислот
Определение и формулы кислот
Кислоты – электролиты, при диссоциации которых из положительных ионов образуются только ионы H+:
HNO3 ↔ H+ + NO3—;
CH3COOH↔ H+ +CH3COO—.
Все кислоты классифицируют на неорганические и органические (карбоновые), которые также имеют свои собственные (внутренние) классификации.
При нормальных условияхзначительное количество неорганических кислот существуют в жидком состоянии, некоторые – в твёрдом состоянии (H3PO4, H3BO3).
Органические кислоты с числом атомов углерода до 3 представляют собой легкоподвижные бесцветные жидкости с характерным резким запахом; кислоты с 4-9 атомами углерода — маслянистые жидкости с неприятным запахом, а кислоты с большим количеством атомов углерода— твёрдые вещества, нерастворимые в воде.
Химические формулы кислот
Химические формулы кислот рассмотрим на примере нескольких представителей (как неорганических, так и органических): хлороводородной кислоте –HCl, серной кислоте – H2SO4, фосфорной кислоте — H3PO4, уксусной кислоте – CH3COOH и бензойной кислоте – C6H5COOH. Химическая формула показывает качественный и количественный состав молекулы (сколько и каких атомов входит в конкретное соединение) По химической формуле можно вычислить молекулярную массу кислот (Ar(H) = 1 а.е.м., Ar(Cl) = 35,5 а.е.м., Ar(P) = 31 а.е.м., Ar(O) = 16 а.е.м., Ar(S) = 32 а.е.м., Ar(C) = 12 а.е.м.):
Mr(HCl) = Ar(H) + Ar(Cl);
Mr(HCl) = 1 + 35,5 = 36,5.
Mr(H2SO4) = 2×Ar(H) + Ar(S) + 4×Ar(O);
Mr(H2SO4) = 2×1 + 32 + 4×16 = 2 + 32 + 64 = 98.
Mr(H3PO4) = 3×Ar(H) + Ar(P) + 4×Ar(O);
Mr(H3PO4) = 3×1 + 31 + 4×16 = 3 + 31 + 64 = 98.
Mr(CH3COOH) = 3×Ar(С) + 4×Ar(H) + 2×Ar(O);
Mr(CH3COOH) = 3×12 + 4×1 + 2×16 = 36 + 4 + 32 = 72.
Mr(C6H5COOH) = 7×Ar(C) + 6×Ar(H) + 2×Ar(O);
Mr(C6H5COOH) = 7×12 + 6×1 + 2×16 = 84 + 6 + 32 = 122.
Структурные (графические) формулы кислот
Структурная (графическая) формула вещества является более наглядной. Она показывает то, как связаны атомы между собой внутри молекулы. Укажем структурные формулы каждого из вышеуказанных соединений:
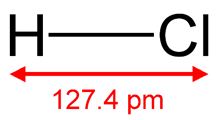
Рис. 1. Структурная формула хлороводородной кислоты.
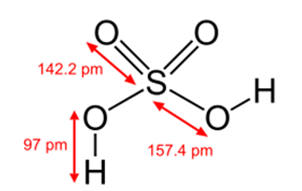
Рис. 2. Структурная формула серной кислоты.
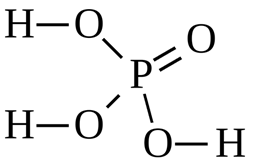
Рис. 3. Структурная формула фосфорной кислоты.
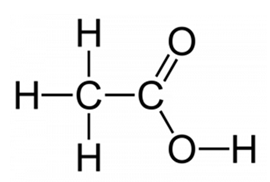
Рис. 4. Структурная формула уксусной кислоты.
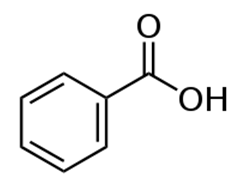
Рис. 5. Структурная формула бензойной кислоты.
Ионные формулы
Все неорганические кислоты являются электролитами, т.е. способны диссоциировать в водном растворе на ионы:
HCl ↔ H+ + Cl—;
H2SO4 ↔ 2H+ + SO42-;
H3PO4 ↔ 3H+ + PO43-.
Примеры решения задач

Классификация кислот
Материал по химии
- Определение кислот
- Классификация кислот по составу
- Классификация кислот по основности
- Сильные и слабые кислоты
- Тривиальные названия некоторых кислот
- «Протон» или «катион»?
- Кислоты и индикаторы
Определение кислот
Кислоты ‒ это вещества, способные в растворах отдавать катион (протон) водорода.
Примеры диссоциации кислот:
HCl ↔ H+ + Cl‒
H2SO4 ↔ 2H+ + SO42‒
Если пока понятие диссоциации неизвестно, легче ориентироваться по общим формулам кислот:
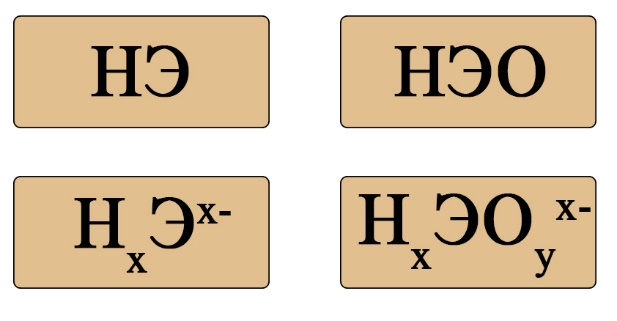
Важен не только состав, но и последовательность. На первом месте должен стоять водород, за ним – элемент, если в составе есть кислород, то он должен стоять последним. Например, HCl – кислота (соответствует формуле HЭ), H2S – тоже кислота (на первом месте водород, на втором – сера), а вот NH3 несмотря на то, что состоит из водорода и элемента, не является кислотой, это легко определить по последовательности: в этой формуле сначала стоит элемент, а за ним – водород (иногда, чтобы запутать сдающего, составитель может написать не NH3, а H3N, Вы должны помнить, что NH3 (аммиак), PH3(фосфин), AsH3 (арсин), CH4 (метан) – не являются кислотами, так как в воде либо не диссоциируют, либо диссоциируют без образования протона водорода. H2SO4 – является кислотой, так как формула имеет порядок элементов «водород → элемент → кислород», а NaOH, тоже состоящая из элемента, кислорода и водорода – кислотой не является, так как тут последовательность будет такова: «элемент → кислород → водород».
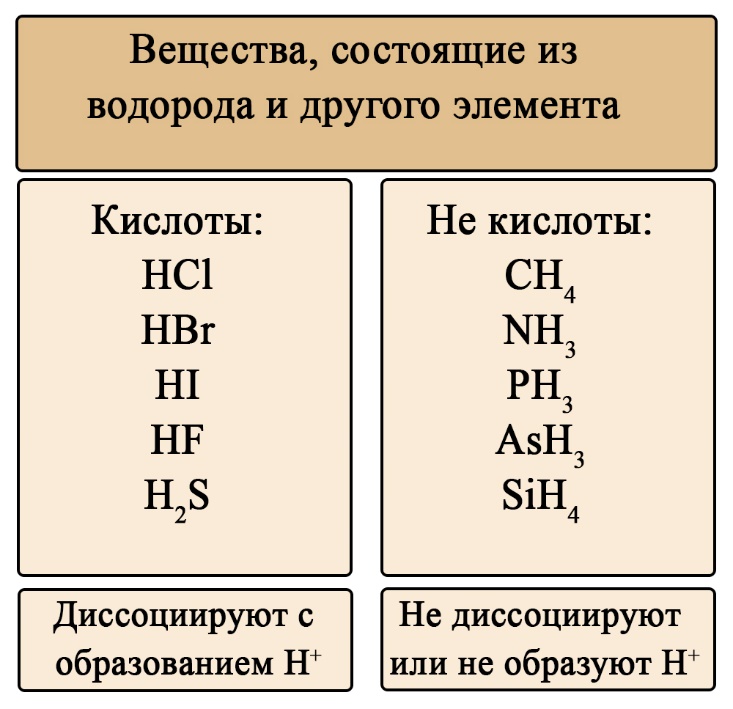
Классификация кислот по составу
Кислоты можно разделить на кислородсодержащие и бескислородные. Не трудно догадаться, что бескислородные не содержат атомов кислорода, а кислородсодержащие – содержат. Кислородсодержащие кислоты образованы соответствующими оксидами, а бескислородные образованы прямым взаимодействием простых веществ.
Таб. Примеры бескислородных и кислородсодержащих кислот, образованных одним и тем же неметаллом
|
Бескислородные |
Кислородсодержащие |
|
HCl |
HClO4 |
|
H2S |
H2SO3 |
|
HBr |
HBrO |
|
HI |
HIO2 |
Классификация кислот по основности
Кислоты могут отдать столько водорода, сколько имеется в их составе (в большинстве случаев, есть исключения). Если может отдать максимум один водород – то кислота относится к одноосновным, если может отдать максимум два протона водорода – то двухосновная и так далее.
Например:
HCl ↔ H+ + Cl‒ (одноосновная)
H2SO4 ↔ 2H+ + SO42‒ (двухосновная)
H3PO4 ↔ 3H+ + PO43- (трехосновная/многоосновная)
Таб. Примеры кислот с разной основностью
|
Одноосновные (один водород) |
Двухосновные (два водорода) |
Многоосновные (три и более протона водорода) |
|
HNO3 |
H2S |
H3PO4 |
|
HF |
H2SiO3 |
H3BO3 |
|
HBrO |
H2CO3 |
H4P2O7 |
Сильные и слабые кислоты
От чего зависит сила кислот? В первую очередь от скорости отдачи протона водорода при диссоциации (чем быстрее кислота отдает протон водорода, тем она считается сильнее). Как определить скорость «на глаз», не имея под рукой никаких справочных материалов, кроме таблицы Менделеева?
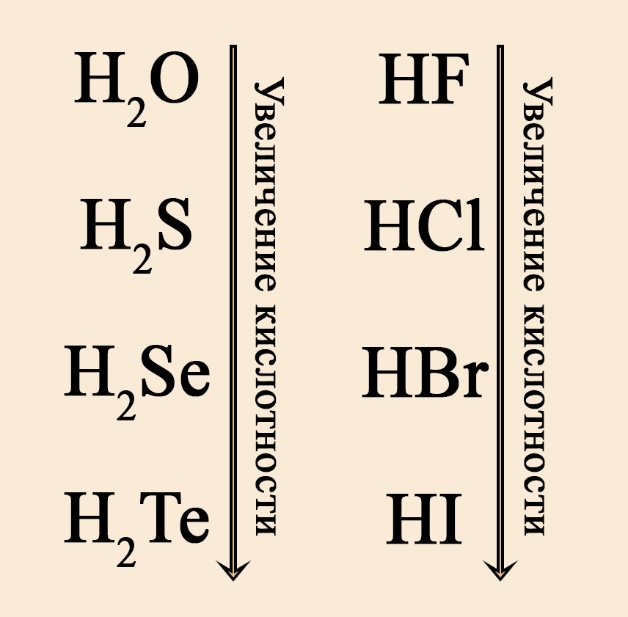
- Если кислота бескислородная, то скорость диссоциации можно определить по радиусу атома, образующего эту кислоту элемента. Напомним, что радиус увеличивается в ПС (периодической системе) сверху-вниз и справа-налево. Так, в ряду кислот HF → HCl → HBr → HI радиус увеличивается от фтора к йоду, так как йод стоит в ПС значительно ниже, чем фтор. Радиус фтора небольшой, поэтому протон водорода прочно связан со фтором, скорость диссоциации будет низкой, значит, кислота слабая. У йода пять электронных оболочек, между йодом и водородом большее расстояние, чем между фтором и водородом, поэтому молекула йодоводорода будет диссоциировать значительно быстрее, значит, кислота сильная. Аналогичную закономерность можно наблюдать в ряду кислот, образованных халькогенами (неметаллами VIА-группы): чем ниже халькоген, тем сильнее образуемая им кислота, поэтому H2S слабее H2Se, а H2Se слабее, чем H2Te.
- Если кислота кислородсодержащая, то её сила зависит от количества кислорода, не входящего в гидроксо-группы. Чем больше кислорода вне -OH группы, тем сильнее кислота. Так, дихромовая кислота сильнее хромовой, потому как дихромовая кислота имеет четыре кислорода вне гидроксо-группы, а хромовая – два кислорода вне гидроксогруппы.
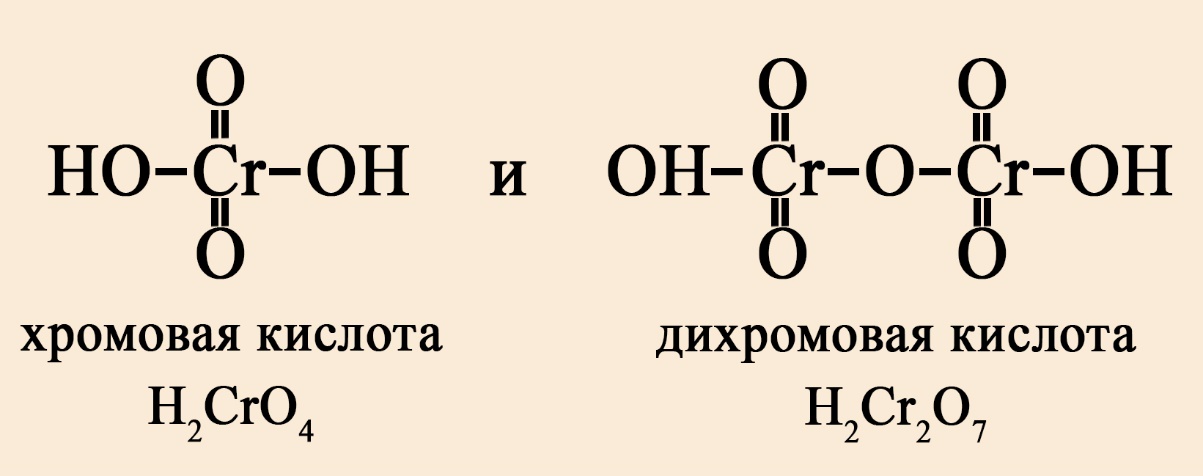
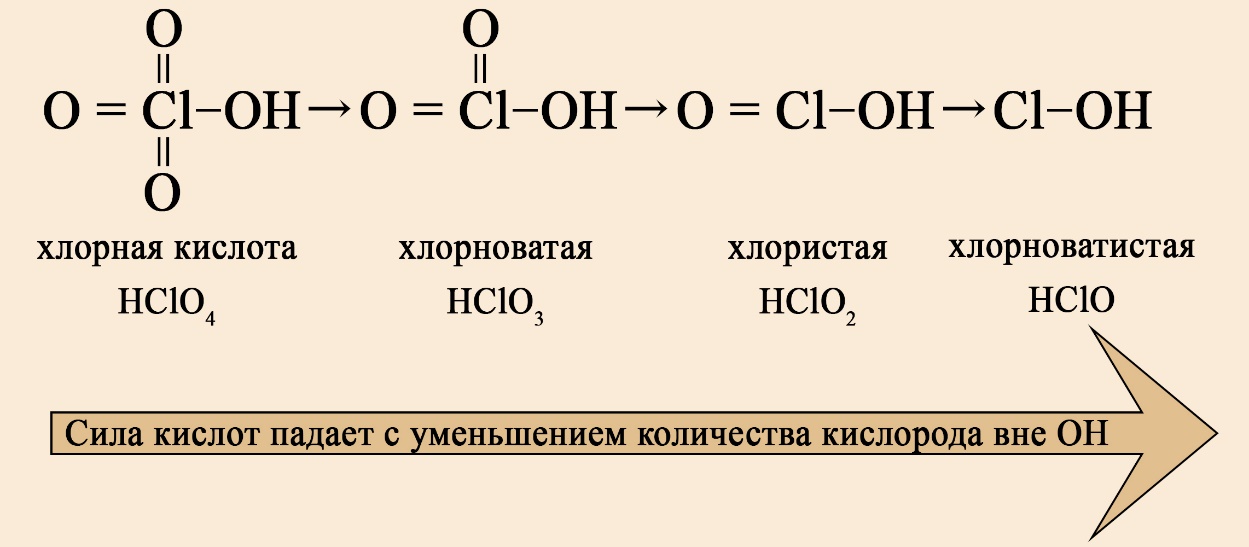
В ряду хлорсодержащих кислот наблюдается такая же закономерность:
Список сильных кислот: HI, HCl, HBr, HNO3, HClO4, HClO3, HBrO3, H2SO4, HMnO4, H2Cr2O7.
Список слабых кислот: H2S, HF, HNO2, H2SO3, H2CO3, HClO, карбоновые кислоты.
В действительности классификация кислот по их силе несколько богаче, и те кислоты, которые в школе записывают в слабые (например, ортофосфорную и фтороводородную) на самом деле относят к кислотам средней силы. Помимо классификации важно знать и названия кислот, а также их остатки. Остатками кислот называют отрицательно-заряженные ионы (анионы), которые образуются при диссоциации кислоты в воде. То есть остаток кислоты – это частица, которая остаётся, если отнять у кислоты весь водород. Вот несколько таблиц, в которых кислоты сгруппированы по силе, с указанием соответствующих кислотных остатков и примерами солей:
Таб. Самые сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HI |
йодоводородная |
I‒ |
NaI -йодид натрия |
|
HBr |
Бромоводородная |
Br‒ |
KBr – бромид калия |
|
HCl |
Хлороводородная, соляная |
Cl‒ |
CaCl2 – хлорид кальция |
|
HClO4 |
Хлорная |
ClO4‒ |
NaClO4 – перхлорат натрия |
|
H2SO4 |
Серная |
SO42‒ |
K2SO4 – сульфат калия |
|
HMnO4 |
Марганцовая |
MnO4‒ |
NaMnO4 – перманганат натрия |
Таб. Сильные кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HClO3 |
Хлорноватая |
ClO3‒ |
KClO3 – хлорат калия |
|
HBrO3 |
Бромноватая |
BrO3‒ |
Ba(BrO3)2 – бромат бария |
|
H2Cr2O7 |
Дихромовая |
Cr2O72‒ |
(NH4)2Cr2O7 – дихромат аммония |
Таб. Кислоты средней силы и их остатки (в ОГЭ и ЕГЭ считаем слабыми)
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
HNO2 |
Азотистая |
NO2‒ |
NaNO2 – нитрит натрия |
|
H3PO4 |
Фосфорная (ортофосфорная) |
PO43‒ |
(NH4)3PO4 – фосфат аммония |
|
HF |
Фтороводородная (плавиковая) |
F‒ |
CaF2 – фторид кальция |
|
HClO2 |
Хлористая |
ClO2‒ |
KClO2 – хлорит калия |
Таб. Слабые кислоты и их остатки
|
Формула |
Название |
Кислотный остаток |
Пример соли |
|
H2S |
Сероводородная |
S2‒ |
MgS – сульфид магния |
|
HCN |
Циановодородная |
CN‒ |
KCN – цианид калия |
|
H2CO3 |
Угольная |
CO32‒ |
CaCO3 – карбонат кальция |
|
H2SO3 |
Сернистая |
SO32‒ |
BaSO3 – сульфит бария |
|
HClO |
Хлорноватистая |
ClO‒ |
NaClO – гипохлорит натрия |
|
H2SiO3 |
Кремниевая |
SiO32‒ |
K2SiO3 – силикат калия |
|
CH3COOH |
Уксусная |
CH3COO‒* |
CH3COONa – ацетат натрия |
*В органических кислотах водород пишется не в начале молекулы, а в конце, например:
CH3COOH – уксусная кислота, диссоциирует следующим образом:
CH3COOH ↔ CH3COO‒ + H+
C2H5COOH – пропионовая кислота
CH3CH2COOH ↔ CH3CH2COO‒ + H+
C3H7COOH – масляная кислота.
C3H7COOH ↔ C3H7COO‒ + H+
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- H2SO2
- HCl
- HNO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородная слабая
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HNO2
- HBr
- H3PO4
- одноосновная сильная
- одноосновная слабая
- многоосновная сильная
- многоосновная слабая
Задание по образцу ФИПИ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- HF
- H2CO3
- H2SiO3
- кислородсодержащая сильная
- кислородсодержащая слабая
- бескислородная сильная
- бескислородна слабая
Тривиальные названия некоторых кислот
Многие кислоты имеют альтернативное историческое название, например, хлороводородную кислоту еще называют соляной кислотой, потому что она образует самую популярную соль – NaCl (поваренная соль, используемая в быту). Фтороводородную кислоту называют плавиковой, так как она плавит стекло (поэтому данную кислоту не хранят в стеклянной таре). Муравьиную и щавелевую кислоты назвали так по источнику получения.
«Протон» или «катион»?
Для всех положительно заряженных частиц характерен термин «катион», однако, по отношению к водороду принято говорить «протон». А дело всё в том, что другие элементы при потере внешних электронов, все равно обладают электронами внутренних слоёв, тогда как водород, содержащий всего один электрон, потеряв его, становится протоном (нейтронов в ядре тоже нет).
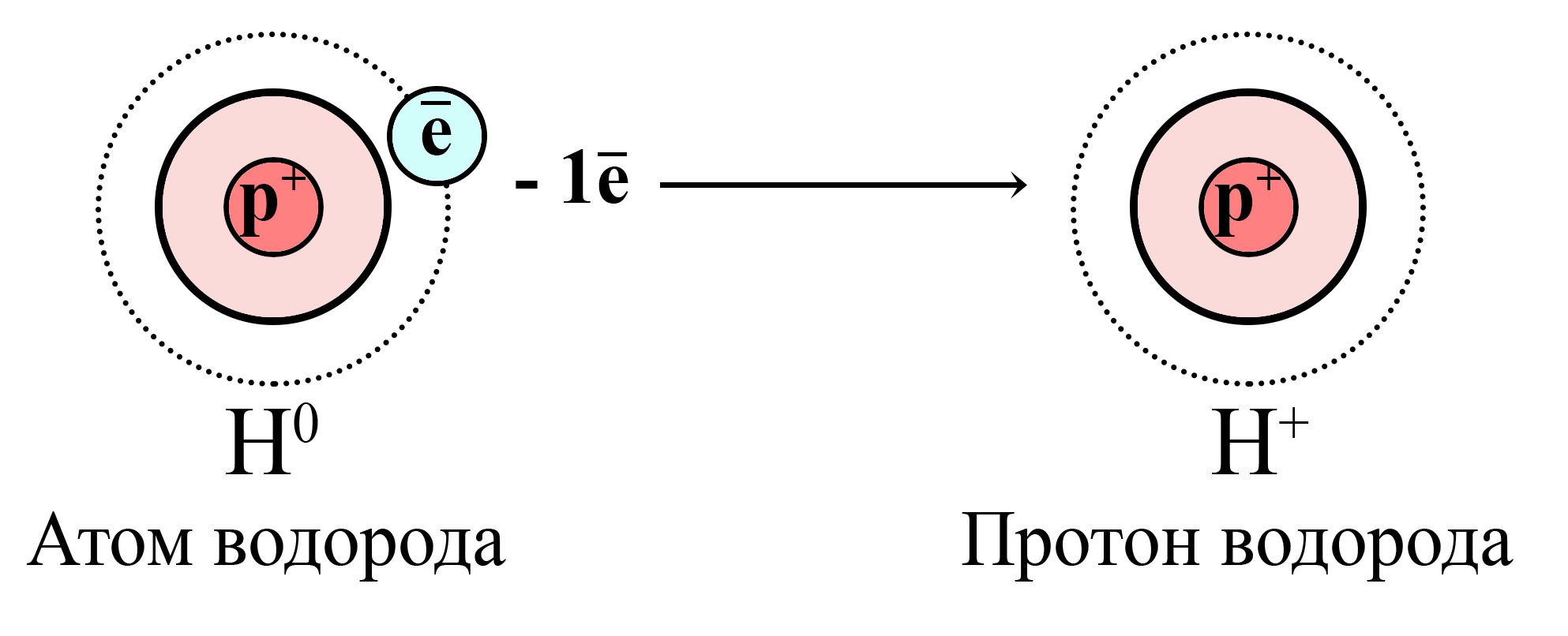
Поэтому принято говорить, что кислота отдает не катион водорода, а протон водорода.
Кислоты и индикаторы
Для определения кислот в растворах можно использовать стандартные индикаторы (вещества, меняющие цвет в определенной среде): лакмус и метиловый оранжевый, фенолфталеин кислотами не окрашивается. Лакмус в кислых растворах (рН < 7) становится красным, а метиловый оранжевый – красным или розовым.
