Как определить тип химической связи?
Домашние заданияХимические связи
Анонимный вопрос
23 декабря 2018 · 237,3 K
Люблю простые слова для вещей, toki pona. · 8 февр 2019
Алгоритм такой: смотрим на атомы вещества, если они одинаковы, далее два варианта, если элемент, образующий вещество — металл (Na, Al), связь металлическая, если — неметалл, ковалентная неполярная (O2, J2).
Если атомы вещества различны, то выбор будет между ионной связью (когда электроотрицательность элементов очень далека друг от друга (>= 1,7), например, металл и неметалл, NaCl) и ковалентной полярной (когда электроотрицательность элементов близка (HCl).
Кроме того атомы водорода одой молекулы могут образовывать связь с неподелённой парой электронов другой молекулы, если эта пара принадлежит весьма электроотрицательному элементу (H-F, H20). Кстати, именно из-за этой связи, вода плотнее льда и зимой насквозь реки не промерзают.
136,4 K
не понятно что ты понаписал тут
Комментировать ответ…Комментировать…
Имею естественно научное образование, в юношестве прикипел к литературе, сейчас активно… · 7 февр 2019
Типов всего три – ионная – металл и неметалл, неполярная (атомы одного неметалла) и полярная (атомы разных неметаллов) ковалентные связи, при определении можно пользоваться простой таблицей Читать далее
43,3 K
Комментировать ответ…Комментировать…
Темы кодификатора ЕГЭ: Ковалентная химическая связь, ее разновидности и механизмы образования. Характеристики ковалентной связи (полярность и энергия связи). Ионная связь. Металлическая связь. Водородная связь
Химические связи
Сначала рассмотрим связи, которые возникают между частицами внутри молекул. Такие связи называют внутримолекулярными.
Химическая связь между атомами химических элементов имеет электростатическую природу и образуется за счет взаимодействия внешних (валентных) электронов, в большей или меньшей степени удерживаемых положительно заряженными ядрами связываемых атомов.
Ключевое понятие здесь – ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ. Именно она определяет тип химической связи между атомами и свойства этой связи.
Электроотрицательность χ – это способность атома притягивать (удерживать) внешние (валентные) электроны. Электроотрицательность определяется степенью притяжения внешних электронов к ядру и зависит, преимущественно, от радиуса атома и заряда ядра.
Электроотрицательность сложно определить однозначно. Л.Полинг составил таблицу относительных электроотрицательностей (на основе энергий связей двухатомных молекул). Наиболее электроотрицательный элемент – фтор со значением 4.
Важно отметить, что в различных источниках можно встретить разные шкалы и таблицы значений электроотрицательности. Этого не стоит пугаться, поскольку при образовании химической связи играет роль разность электроотрицательностей атомов, а она примерно одинакова в любой системе.
Если один из атомов в химической связи А:В сильнее притягивает электроны, то электронная пара смещается к нему. Чем больше разность электроотрицательностей атомов, тем сильнее смещается электронная пара.
Если значения электроотрицательностей взаимодействующих атомов равны или примерно равны: ЭО(А)≈ЭО(В), то общая электронная пара не смещается ни к одному из атомов: А : В. Такая связь называется ковалентной неполярной.
Если электроотрицательности взаимодействующих атомов отличаются, но не сильно (разница электроотрицательностей примерно от 0,4 до 2: 0,4<ΔЭО<2), то электронная пара смещается к одному из атомов. Такая связь называется ковалентная полярная.
Если электроотрицательности взаимодействующих атомов отличаются существенно (разница электроотрицательностей больше 2: ΔЭО>2), то один из электронов практически полностью переходит к другому атому, с образованием ионов. Такая связь называется ионная.
Основные типы химических связей — ковалентная, ионная и металлическая связи. Рассмотрим их подробнее.
Ковалентная химическая связь
Ковалентная связь – это химическая связь, образованная за счет образования общей электронной пары А:В. При этом у двух атомов перекрываются атомные орбитали. Ковалентная связь образуется при взаимодействии атомов с небольшой разницей электроотрицательностей (как правило, между двумя неметаллами) или атомов одного элемента.
Основные свойства ковалентных связей
- направленность,
- насыщаемость,
- полярность,
- поляризуемость.
Эти свойства связи влияют на химические и физические свойства веществ.
Направленность связи характеризует химическое строение и форму веществ. Углы между двумя связями называются валентными. Например, в молекуле воды валентный угол H-O-H равен 104,45о, поэтому молекула воды — полярная, а в молекуле метана валентный угол Н-С-Н 109о28′.
Насыщаемость — это способность атомов образовывать ограниченное число ковалентных химических связей. Количество связей, которые способен образовывать атом, называется валентностью.
Полярность связи возникает из-за неравномерного распределения электронной плотности между двумя атомами с различной электроотрицательностью. Ковалентные связи делят на полярные и неполярные.
Поляризуемость связи — это способность электронов связи смещаться под действием внешнего электрического поля (в частности, электрического поля другой частицы). Поляризуемость зависит от подвижности электронов. Чем дальше электрон находится от ядра, тем он более подвижен, соответственно и молекула более поляризуема.
Ковалентная неполярная химическая связь
Существует 2 вида ковалентного связывания – ПОЛЯРНЫЙ и НЕПОЛЯРНЫЙ.
Пример. Рассмотрим строение молекулы водорода H2. Каждый атом водорода на внешнем энергетическом уровне несет 1 неспаренный электрон. Для отображения атома используем структуру Льюиса – это схема строения внешнего энергетического уровня атома, когда электроны обозначаются точками. Модели точечных структур Льюиса неплохо помогают при работе с элементами второго периода.
H. + .H = H:H
Таким образом, в молекуле водорода одна общая электронная пара и одна химическая связь H–H. Эта электронная пара не смещается ни к одному из атомов водорода, т.к. электроотрицательность у атомов водорода одинаковая. Такая связь называется ковалентной неполярной.
Ковалентная неполярная (симметричная) связь – это ковалентная связь, образованная атомами с равной элетроотрицательностью (как правило, одинаковыми неметаллами) и, следовательно, с равномерным распределением электронной плотности между ядрами атомов.
Дипольный момент неполярных связей равен 0.
Примеры: H2 (H-H), O2 (O=O), S8.
Ковалентная полярная химическая связь
Ковалентная полярная связь – это ковалентная связь, которая возникает между атомами с разной электроотрицательностью (как правило, разными неметаллами) и характеризуется смещением общей электронной пары к более электроотрицательному атому (поляризацией).
Электронная плотность смещена к более электроотрицательному атому – следовательно, на нем возникает частичный отрицательный заряд (δ-), а на менее электроотрицательном атоме возникает частичный положительный заряд (δ+, дельта +).
Чем больше различие в электроотрицательностях атомов, тем выше полярность связи и тем больше дипольный момент. Между соседними молекулами и противоположными по знаку зарядами действуют дополнительные силы притяжения, что увеличивает прочность связи.
Полярность связи влияет на физические и химические свойства соединений. От полярности связи зависят механизмы реакций и даже реакционная способность соседних связей. Полярность связи зачастую определяет полярность молекулы и, таким образом, непосредственно влияет на такие физические свойства как температуре кипения и температура плавления, растворимость в полярных растворителях.
Примеры: HCl, CO2, NH3.
Механизмы образования ковалентной связи
Ковалентная химическая связь может возникать по 2 механизмам:
1. Обменный механизм образования ковалентной химической связи – это когда каждая частица предоставляет для образования общей электронной пары один неспаренный электрон:
А. + .В= А:В
2. Донорно-акцепторный механизм образования ковалентной связи – это такой механизм, при котором одна из частиц предоставляет неподеленную электронную пару, а другая частица предоставляет вакантную орбиталь для этой электронной пары:
А: + B= А:В
При этом один из атомов предоставляет неподеленную электронную пару (донор), а другой атом предоставляет вакантную орбиталь для этой пары (акцептор). В результате образования связи оба энергия электронов уменьшается, т.е. это выгодно для атомов.
Ковалентная связь, образованная по донорно-акцепторному механизму, не отличается по свойствам от других ковалентных связей, образованных по обменному механизму. Образование ковалентной связи по донорно-акцепторному механизму характерно для атомов либо с большим числом электронов на внешнем энергетическом уровне (доноры электронов), либо наоборот, с очень малым числом электронов (акцепторы электронов). Более подробно валентные возможности атомов рассмотрены в соответствующей статье.
Ковалентная связь по донорно-акцепторному механизму образуется:
– в молекуле угарного газа CO (связь в молекуле – тройная, 2 связи образованы по обменному механизму, одна – по донорно-акцепторному): C≡O;
– в ионе аммония NH4+, в ионах органических аминов, например, в ионе метиламмония CH3-NH3+;
– в комплексных соединениях, химическая связь между центральным атомом и группами лигандов, например, в тетрагидроксоалюминате натрия Na[Al(OH)4] связь между алюминием и гидроксид-ионами;
– в азотной кислоте и ее солях — нитратах: HNO3, NaNO3, в некоторых других соединениях азота;
– в молекуле озона O3.
Основные характеристики ковалентной связи
Ковалентная связь, как правило, образуется между атомами неметаллов. Основными характеристиками ковалентной связи являются длина, энергия, кратность и направленность.
Кратность химической связи
Кратность химической связи — это число общих электронных пар между двумя атомами в соединении. Кратность связи достаточно легко можно определить из значения валентности атомов, образующих молекулу.
Например, в молекуле водорода H2 кратность связи равна 1, т.к. у каждого водорода только 1 неспаренный электрон на внешнем энергетическом уровне, следовательно, образуется одна общая электронная пара.
В молекуле кислорода O2 кратность связи равна 2, т.к. у каждого атома на внешнем энергетическом уровне есть по 2 неспаренных электрона: O=O.
В молекуле азота N2 кратность связи равна 3, т.к. между у каждого атома по 3 неспаренных электрона на внешнем энергетическом уровне, и атомы образуют 3 общие электронные пары N≡N.
Длина ковалентной связи
Длина химической связи – это расстояние между центрами ядер атомов, образующих связь. Ее определяют экспериментальными физическими методами. Оценить величину длины связи можно примерно, по правилу аддитивности, согласно которому длина связи в молекуле АВ приблизительно равна полусумме длин связей в молекулах А2 и В2:
Длину химической связи можно примерно оценить по радиусам атомов, образующих связь, или по кратности связи, если радиусы атомов не сильно отличаются.
При увеличении радиусов атомов, образующих связь, длина связи увеличится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| H-F | 0,092 |
| H-Cl | 0,128 |
| H-Br | 0,142 |
| H-I | 0,162 |
При увеличении кратности связи между атомами (атомные радиусы которых не отличаются, либо отличаются незначительно) длина связи уменьшится.
Например. В ряду: C–C, C=C, C≡C длина связи уменьшается.
| Связь |
Длина связи, нм |
| С–С | 0,154 |
| С=С | 0,133 |
| С≡С | 0,120 |
Энергия связи
Мерой прочности химической связи является энергия связи. Энергия связи определяется энергией, необходимой для разрыва связи и удаления атомов, образующих эту связь, на бесконечно большое расстояние друг от друга.
Ковалентная связь является очень прочной. Ее энергия составляет от нескольких десятков до нескольких сотен кДж/моль. Чем больше энергия связи, тем больше прочность связи, и наоборот.
Прочность химической связи зависит от длины связи, полярности связи и кратности связи. Чем длиннее химическая связь, тем легче ее разорвать, и тем меньше энергия связи, тем ниже ее прочность. Чем короче химическая связь, тем она прочнее, и тем больше энергия связи.
Например, в ряду соединений HF, HCl, HBr слева направо прочность химической связи уменьшается, т.к. увеличивается длина связи.
Ионная химическая связь
Ионная связь — это химическая связь, основанная на электростатическом притяжении ионов.
Ионы образуются в процессе принятия или отдачи электронов атомами. Например, атомы всех металлов слабо удерживают электроны внешнего энергетического уровня. Поэтому для атомов металлов характерны восстановительные свойства — способность отдавать электроны.
Пример. Атом натрия содержит на 3 энергетическом уровне 1 электрон. Легко отдавая его, атом натрия образует гораздо более устойчивый ион Na+, с электронной конфигурацией благородного газа неона Ne. В ионе натрия содержится 11 протонов и только 10 электронов, поэтому суммарный заряд иона -10+11 = +1:
+11Na )2)8)1 — 1e = +11Na+ )2)8
Пример. Атом хлора на внешнем энергетическом уровне содержит 7 электронов. Чтобы приобрести конфигурацию стабильного инертного атома аргона Ar, хлору необходимо присоединить 1 электрон. После присоединения электрона образуется стабильный ион хлора, состоящий из электронов. Суммарный заряд иона равен -1:
+17Cl )2 )8 )7 + 1e = +17Cl— )2 )8 )8
Обратите внимание:
- Свойства ионов отличаются от свойств атомов!
- Устойчивые ионы могут образовывать не только атомы, но и группы атомов. Например: ион аммония NH4+, сульфат-ион SO42- и др. Химические связи, образованные такими ионами, также считаются ионными;
- Ионную связь, как правило, образуют между собой металлы и неметаллы (группы неметаллов);
Образовавшиеся ионы притягиваются за счет электрического притяжения: Na+Cl—, Na2+ SO42-.
Наглядно обобщим различие между ковалентными и ионным типами связи:
Металлическая химическая связь
Металлическая связь — это связь, которую образуют относительно свободные электроны между ионами металлов, образующих кристаллическую решетку.
У атомов металлов на внешнем энергетическом уровне обычно расположены от одного до трех электронов. Радиусы у атомов металлов, как правило, большие — следовательно, атомы металлов, в отличие от неметаллов, достаточно легко отдают наружные электроны, т.е. являются сильными восстановителями.
Отдавая электроны, атомы металлов превращаются в положительно заряженные ионы. Оторвавшиеся электроны относительно свободно перемещаются между положительно заряженными ионами металлов. Между этими частицами возникает связь, т.к. общие электроны удерживают катионы металлов, расположенные слоями, вместе, создавая таким образом достаточно прочную металлическую кристаллическую решетку. При этом электроны непрерывно хаотично двигаются, т.е. постоянно возникают новые нейтральные атомы и новые катионы.
Межмолекулярные взаимодействия
Отдельно стоит рассмотреть взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия. Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не появляются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами. Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные. Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи. Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь. Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
— фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота), вода H2O (пар, лед, жидкая вода):
— раствор аммиака и органических аминов — между молекулами аммиака и воды;
— органические соединения, в которых связи O-H или N-H: спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение температуры кипения.
Например, как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61оС, как показывает нам прямая линия, а намного больше, +100 оС. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20оС) вода является жидкостью по фазовому состоянию.
Тренировочный тест по теме «Химические связи» — 10 вопросов, при каждом прохождении новые.
342
Создан на
07 января, 2022 От Admin
Тренировочный тест “Химические связи”
1 / 10
Из предложенного перечня выберите два вещества, которые имеют ионную кристаллическую решётку.
1) Na2CO3
2) HBr
3) SO2
4) PCl3
5) (NH4)2SО4
2 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ионная химическая связь.
1) оксид кремния
2) оксид лития
3) фтороводород
4) серная кислота
5) гидроксид натрия
3 / 10
Из предложенного перечня выберите два вещества, которые в твёрдом состоянии имеют немолекулярное строение.
1) графит
2) бром
3) метанол
4) железо
5) аммиак
4 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная химическая связь.
1) оксид бария
2) фторид натрия
3) фторид серы(VI)
4) сульфат магния
5) ромбическая сера
5 / 10
Из предложенного перечня выберите два вещества, которые в состоянии имеют молекулярное строение.
1) глюкоза
2) алмаз
3) оксид цинка
4) аммиак
5) гидроксид натрия
6 / 10
Из предложенного перечня веществ выберите два вещества, которые имеют атомную кристаллическую решётку.
1) цинк
2) алмаз
3) кремнезем
4) угарный газ
5) хлорид калия
7 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная полярная химическая связь.
1) метанол
2) иодид калия
3) белый фосфор
4) ацетат калия
5) оксид калия
8 / 10
Из предложенного перечня выберите два вещества с ковалентной неполярной химической связью, которые имеют немолекулярное строение.
1) пероксид натрия
2) пероксид водорода
3) кремний
4) азот
5) оксид кремния
9 / 10
Из предложенного перечня выберите два вещества, в которых присутствует ковалентная неполярная химическая связь.
1) CaO
2) BaO2
3) C2H6
4) Na2O
5) Na
10 / 10
Из предложенного перечня выберите два вещества, которые имеют ионную кристаллическую решётку.
1) HF
2) KF
3) I2
4) N2О
5) L2O
Запишите в поле ответа номера выбранных веществ.
Ваша оценка
The average score is 42%
Химические связи бывают четырёх типов: ковалентная (полярная и неполярная), ионная, металлическая. Без знания теории их трудно отличать друг от друга, но благодаря данному материалу вы сможете понять тему буквально за 5-7 минут. Приятного изучения!
1. Металлическая связь – связь, в результате возникновения которой происходит образование простых веществ-металлов (Na, Mg, K и т.д).
Исходя из определения можно понять, что во всех простых веществах-металлах (см. по Периодической таблице химических элементов) находится металлическая связь.
2. Неполярная ковалентная связь – связь, в результате возникновения которой образуются простые вещества-неметаллы (алмаз, графит, фуллерен, S₈, N₂, а также исключения: PH₃ – фосфин; H₂O₂, Na₂O₂ и т.д – пероксиды).
3. Ковалентная полярная связь – связь между разными неметаллами (SO₂, NO₂, PCl₅ и т.д, кроме PH₃ – фосфина).
4. Ионная связь – связь между металлом (или катионом аммония NH₄⁺) и неметаллом (KCl, Li₃N, NH₄F и т.д).
Важно! В одном соединении может быть несколько химических связей: NH₄NO₃ – между катионом NH₄⁺ и анионом NO₃⁻ образована ионная связь, а в NO₃⁻ между азотом и кислородом образована ковалентная полярная связь.
Схема для “чайников”:
- Ме – металл
- неМе – неметалл
А теперь практика на задании 5 из ОГЭ.
1. Из предложенного перечня выберите два вещества с ионной связью.
- оксид кремния(IV)
- бромид калия
- магний
- сероводород
- пероксид натрия
1) Оксид кремния(IV) SiO₂ – состоит из неМе’+неМе”, значит в оксиде кремния(IV) – ковалентная полярная связь. Ответ неверный.
2) Бромид калия KBr – состоит из Ме и неМе, связь – ионная. Ответ верный.
3) Магний Mg – состоит из Ме, связь – металлическая. Ответ неверный.
4) Cероводород H₂S – состоит из неМе’+неМе”, связь – ковалентная полярная. Ответ неверный.
5) Пероксид натрия Na₂O₂ (структурная формула Na-O-O-Na) – в соединении имеется два типа связи. Между натрием и кислородом связь ионная, т.к Ме+неМе (ответ правильный). Между атомами кислорода связь ковалентная неполярная.
Ответ: 25
Домашнее задание
1. Из предложенного перечня выберите два вещества с ковалентной неполярной связью.
- O₃
- H₂O
- HCl
- C₇₂
- NaCl
2. Из предложенного перечня выберите два вещества, которые имеют такой же тип химической связи, как и угарный газ.
- углерод
- веселящий газ (N₂O – оксид азота(I))
- нитрид натрия
- кислород
- сернистый газ (SO₂ -оксид серы(IV))
3. Для каждого вещества определите тип химической связи.
- I₂ –
- HBr –
- Na₂O₂ –
- PH₃ –
- HNO₃ –
- (NH₄)₂SO₄ –
- Au –
Ответы на домашнее задание
Задание 1. 14
Задание 2. 25
Задание 3.
- I₂ – ковалентная неполярная
- HBr – ковалентная полярная
- Na₂O₂ – ковалентная неполярная и ионная
- PH₃ – ковалентная неполярная
- HNO₃ – ковалентная полярная
- (NH₄)₂SO₄ – ковалентная полярная и ионная
- Au – металлическая
Если вам понравилась статья, то подписывайтесь, ставьте лайки, пишите комментарии.
Химическая связь – связь между атомами в молекуле или молекулярном соединении, возникающая в результате переноса электронов с
одного атома на другой, либо обобществления электронов для обоих атомов.
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
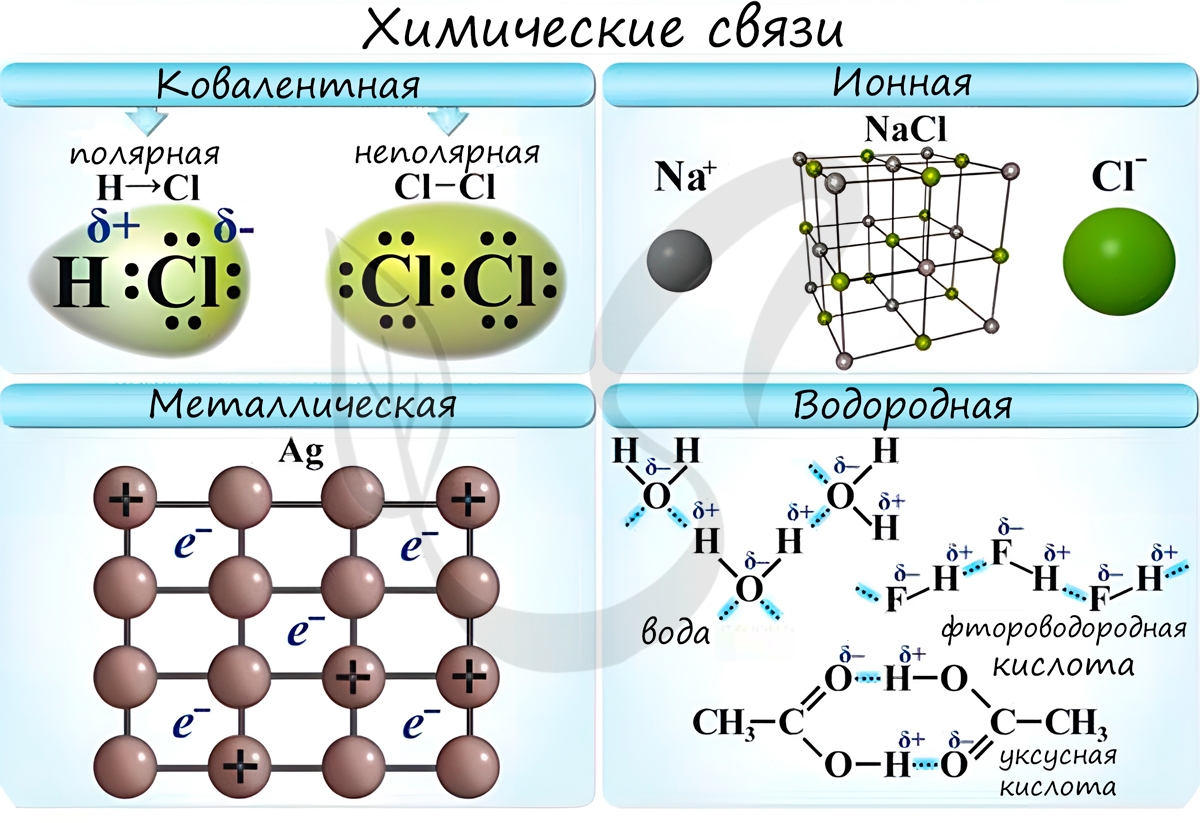
Ковалентная связь ( лат. со – совместно + valens – имеющий силу)
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов
донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2),
а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
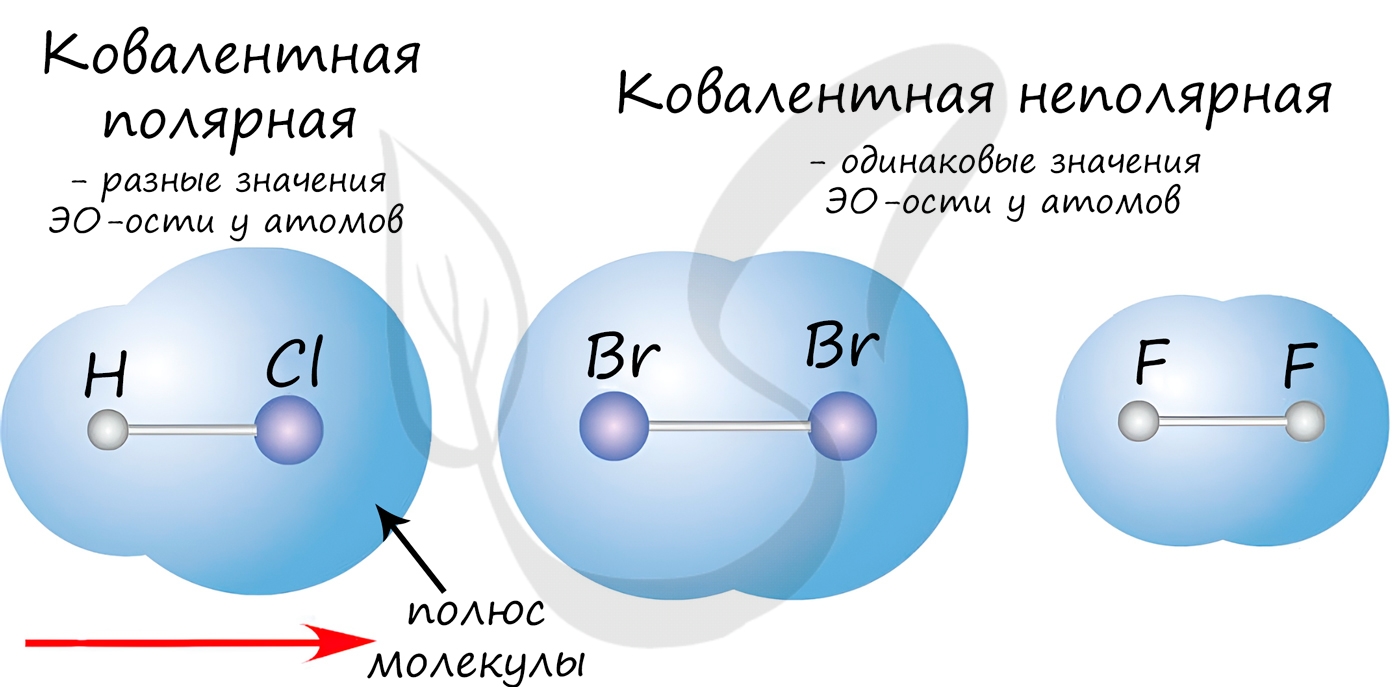
Если атомы, образующие ковалентную связь, имеют одинаковые значения электроотрицательности, то связь между ними называется ковалентной неполярной
связью. В таких молекулах нет “полюса” – электронная плотность распределяется равномерно. Примеры: Cl2, O2, H2,
N2, I2.
Если атомы, образующие ковалентную связь, имеют разные значения электроотрицательности, то связь между ними называется ковалентной полярной.
В таких молекулах имеется “полюс” – электронная плотность смещена к более электроотрицательному элементу. Примеры: HCl, HBr, HI, NH3,
H2O.
Ковалентная связь может быть образована по обменному механизму – обобществлению электронной пары. В таком случае каждый атом “одинаково”
вкладывается создание связи. Например, два атома азота, образующие молекулу N2, отдают по 3 электрона с внешнего уровня для
создания связи.

Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной
электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Рекомендую выучить список веществ, образованных по донорно-акцепторному механизму:
- NH4+ – в ионе аммония
- NH4+Cl, NH4+Br – внутри иона аммония во всех его солях
- NO3– – в нитрат ионе
- KNO3, LiNO3 – внутри нитрат иона во всех нитратах
- O3 – озон
- H3O+ – ион гидроксония
- CO – угарный газ
- K[Al(OH)4], Na2[Zn(OH)4] – во всех комплексных солях есть хотя бы одна ковалентная связь,
возникшая по донорно-акцепторному механизму

Ионная связь
Ионная связь – один из видов химической связи, в основе которого лежит электростатическое взаимодействие между
противоположно заряженными ионами.
В наиболее частом случае ионная связь образуется между типичным металлом и
типичным неметаллом. Примеры:
NaF, CaCl2, MgF2, Li2S, BaO, RbI.
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4.
Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в
соединениях: NH4I, NH4NO3,
(NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой
молекулы.

Металлическая связь
Металлическая связь – вид химической связи удерживающая вместе атомы металла. Этот тип связи выделен отдельно, так как его отличием является
наличие высокой концентрации в металлах электронов проводимости – “электронного газа”. По природе металлическая связь близка к ковалентной.
“Облако” электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности
металлов.

Водородная связь
Водородная связь – вид химической связи, образующийся между некоторыми молекулами, содержащими водород. Одна из наиболее частых
ошибок считать, что в самом газе, водороде, имеются водородные связи – это вовсе не так.
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Необходимо осознать самую важную деталь: водородные связи образуются между молекулами, а не внутри. Они имеются между молекулами:
- H2O
- NH3
- HF
- Органических спиртов: С2H5OH, C3H7OH
- Органических кислот: CH3COOH, C2H5COOH
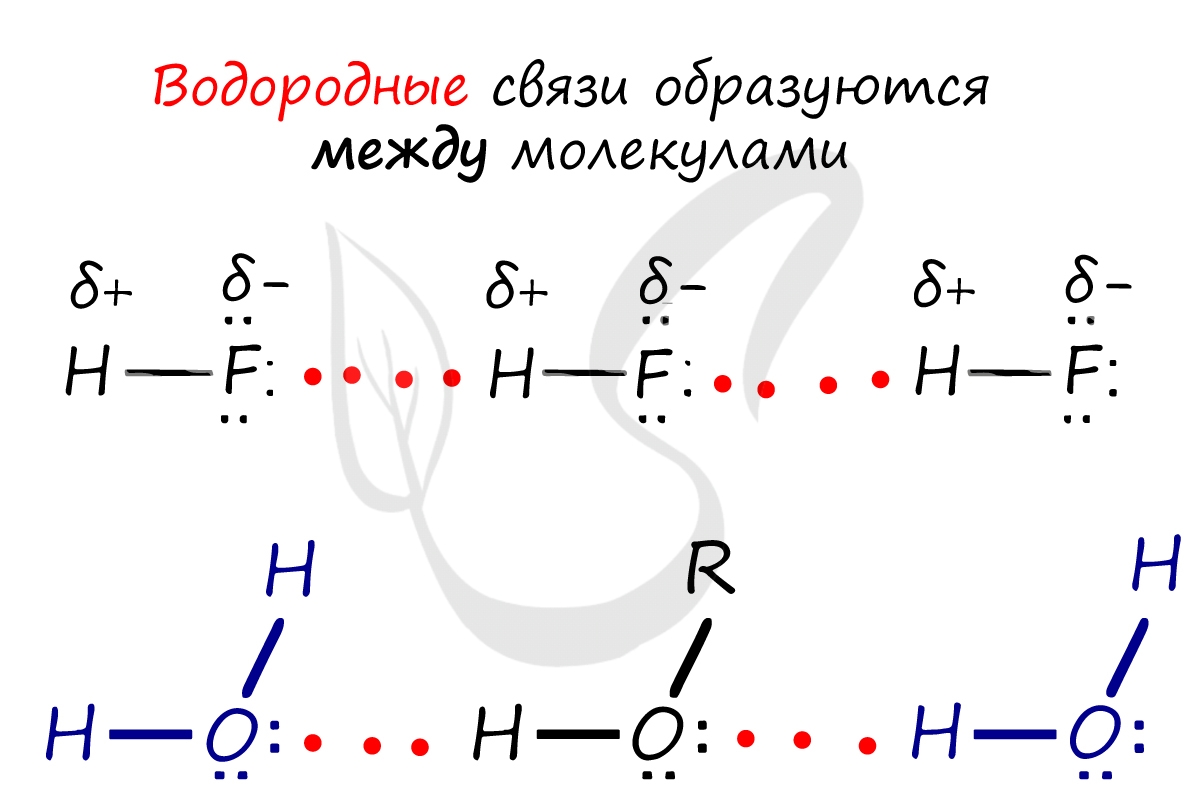
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот:
HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты
отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение
(в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов
без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования,
обратитесь, пожалуйста, к Беллевичу Юрию.
Основные виды химических связей с примерами
Содержание:
-
Химическая связь — определение термина
- Основные понятия, характеристики
-
Типы химических связей, примеры с пояснениями
- Ионная химическая связь
- Водородная химическая связь
- Химическая связь металлов
- Как определить вид химической связи
- Методы описания связей
Химическая связь — определение термина
Одним из важнейших понятий науки химии является, наряду с реакциями, понятие о химической связи. В этой статье будут рассмотрены такие моменты, как определение химической связи, ее типы и методы описания.
Определение
Химическая связь — это взаимодействие между атомами в молекуле и кристаллической решетке, которое возникает благодаря силе притяжения, существующей между атомами, и способствует устойчивости химической молекулы или кристаллической решетки. Получение различных химических соединений происходит из-за существования этой связи.
Первым описал идею подобных связей Э. Франкленд в 1852 году. Он предположил, что каждому элементу для образования связей необходимо определенное количество эквивалентов других элементов, и связал количество этих эквивалентов с понятием валентности. Но еще в 1845 году появилась электрохимическая теория Й. Берцелиуса, которая в то время не была признана большинством ученых. Й. Берцелиус считал все неорганические соединения состоящими из двух противоположно заряженных частей и сохраняющими целостность благодаря силам электрического притяжения.
Классификация типов химической связи содержит четыре ее вида:
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
- ионная;
- водородная;
- ковалентная;
- металлическая.
Основные понятия, характеристики
Атомы, у которых на внешних оболочках находится по восемь электронов, характеризуются повышенной устойчивостью и характерны для инертных газов — радона, неона, криптона, аргона. Из них выделяется гелий — на его оболочках находятся всего два электрона, что делает его еще более устойчивым.
Атомы остальных веществ стремятся к получению такой устойчивости, достигая ее путем отдачи либо присоединения необходимого количества электронов. Например, атому хлора до идеальной конфигурации необходим один электрон, который он стремится приобрести. А атому натрия, на внешних оболочках которого находится всего один электрон, выгоднее его отдать и стать заряженным ионом с электронной конфигурацией газа неона.
Из описанного выше выводится такая характеристика, как электроотрицательность — способность атомов притягивать электроны. Чем эта характеристика сильнее, чем больше элемент притягивает электронов, тем ярче проявляются окислительные свойства вещества.
Химические связи образуются по одному из двух механизмов:
- обменный механизм основан на том, что атомы веществ обобществляют неспаренные электроны;
- донорно-акцепторный механизм основан на том, что атом-донор предоставляет свободную пару электронов, а атом-акцептор — свободную орбиталь, на которую и закрепляются электроны другого вещества.
Другими характеристиками химических связей являются:
- длина — равновесное расстояние между атомами, измеряемое экспериментально;
- энергия — характеристика, описывающая прочность связи, усилие, которое надо приложить, чтобы разорвать ее;
- порядок, или кратность — характеристика, показывающая, сколько электронных пар вступило в реакцию, чем их больше — тем связь сильнее.
Типы химических связей, примеры с пояснениями
Ионная химическая связь
Ионная химическая связь возникает за счет притяжения разных по полярности зарядов ионов.
Определение
Ионы — это заряженные частицы, которые образуются за счет отдачи или приема электронов атомами.
Рассмотрим возникновение ионной связи на примере хлора и натрия.
Электрическое поле ионов действует во всех направлениях, каждый положительный ион окружен отрицательными ионами, поэтому их соединение представляет собой четко структурированную огромную группу. За счет силы ионной связи такие вещества имеют высокие температуры плавления и кипения.
Вещества с ионной связью: пищевая сода, поваренная соль, медный купорос.
Водородная химическая связь
Водородная химическая связь, или Н-связь, возникает между положительно заряженным атомом водорода и отрицательно заряженным атомом другого вещества. Подразделяется на междумолекулярную и внутримолекулярную.
Междумолекулярная возникает между молекулами вещества, а внутримолекулярная — внутри молекулы, между ее составляющими. Водородная связь наблюдается у многоатомных спиртов, белков, углеводов и некоторых других органических соединений.
Понятие и термин «водородная связь» были введены в науку в 1920 году для объяснения высоких температур кипения воды, спиртов и некоторых других соединений В. Латимером и Р. Родебушем.
Н-связи не только увеличивают температуру кипения, но и проявляют себя в строении кристаллической решетки вещества. В качестве примера рассмотрим строение кристаллической решетки льда — оно таково, что расстояние между отдельными атомами довольно велико, за счет чего лед держится на поверхности воды, что влияет на экологию водных ресурсов — рыбы и другие водные жители существуют благодаря этому удивительному свойству водородных связей.
Большую роль играет водородная связь и в биологии, так как знаменитая двойная спираль ДНК имеет между нуклеотидами двух цепочек ДНК аденин-тимин — двойную Н-связь, а гуанин-цитозин — тройную. Это понятно по приведенной ниже схеме.
Химическая связь металлов
Определение
Металлическая связь — это связь, возникающая между положительными ионами и атомами металлов посредством свободных электронов.
Такая связь возможна из-за особенностей строения атомов металлов — у них большие радиусы между орбиталями и сравнительно небольшое количество электронов на внешнем уровне. Электроны легко отрываются, превращая атом в положительно заряженный ион. Потом свободные электроны легко перемещаются к другому иону, прикрепляясь к нему и превращая его в атом. Затем цикл повторяется.
За счет этого все металлы обладают сходными свойствами — твердость, большая тепло- и электропроводность, характерный металлический блеск, ковкость. Этими характеристиками обладают как чистые металлы, такие как железо, медь, золото, алюминий, так и их сплавы — бронза, дюралюминий и другие.
Как определить вид химической связи
Вид определяется по веществам, участвующим в реакции:
- если взаимодействуют два металла, то эта связь металлическая;
- если в реакции участвуют металл и неметалл, то связь будет ионная;
- в случае взаимодействия двух неметаллов связь между ними будет ковалентная.
Методы описания связей
Известно несколько способов описания:
- Метод валентных связей, сокращенно МВС, или теория локализованных электронных пар. Второе название связано с тем, что химическая связь между атомами происходит за счет одной или нескольких электронных пар, располагающихся между ними. Число этих связей определяется валентностью атома. Простейшая химическая связь в МВС всегда двухатомная и двухцентровая, осуществляется за счет валентных электронов.
- Метод молекулярных орбиталей, сокращенно ММО. Этот метод построен на предположении, что состояние электронов в молекуле можно описать как совокупность молекулярных электронных облаков (орбиталей). Для получения молекулярных орбиталей необходимо, чтобы атомные орбитали имели примерно равные энергии, заметно перекрывались и обладали одинаковой симметрией относительно образуемой химической связи.
Имеющиеся методы описания равнозначны и дополняют друг друга.




















