1
H
1,008
1s1
2,2
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
4,0
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,93
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
From Wikipedia, the free encyclopedia

|
|
|
|
| Names | |
|---|---|
| Preferred IUPAC name
Chloroacetic acid |
|
| Systematic IUPAC name
Chloroethanoic acid |
|
| Other names
2-Chloroacetic acid |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
| 3DMet |
|
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.001.072 |
| EC Number |
|
| KEGG |
|
|
PubChem CID |
|
| RTECS number |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
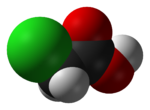
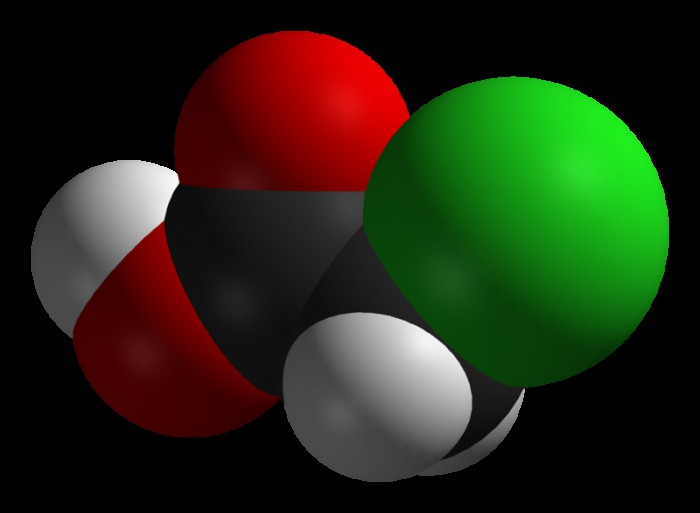
Chemical formula |
C2H3ClO2 |
| Molar mass | 94.49 g·mol−1 |
| Appearance | Colorless or white crystals |
| Density | 1.58 g/cm3 |
| Melting point | 63 °C (145 °F; 336 K) |
| Boiling point | 189.3 °C (372.7 °F; 462.4 K) |
|
Solubility in water |
85.8 g/100 mL (25 °C) |
| Solubility | Soluble in methanol, acetone, diethyl ether, benzene, chloroform, ethanol |
| log P | 0.22 |
| Vapor pressure | 0.22 hPa |
| Acidity (pKa) | 2.86[1] |
|
Magnetic susceptibility (χ) |
−48.1×10−6 cm3/mol |
|
Refractive index (nD) |
1.4351 (55 °C) |
| Structure | |
|
Crystal structure |
Monoclinic |
| Thermochemistry | |
|
Heat capacity (C) |
144.02 J/(K·mol) |
|
Std enthalpy of |
−490.1 kJ/mol |
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
alkylating agent |
| GHS labelling: | |
|
Pictograms |
  
|
|
Signal word |
Danger |
|
Hazard statements |
H301, H311, H314, H331, H400 |
|
Precautionary statements |
P260, P261, P264, P270, P271, P273, P280, P301+P310, P301+P330+P331, P302+P352, P303+P361+P353, P304+P340, P305+P351+P338, P310, P311, P312, P321, P322, P330, P361, P363, P391, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
3 1 0 |
| Flash point | 126 °C (259 °F; 399 K) |
|
Autoignition |
470 °C (878 °F; 743 K) |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
76 mg/kg.[2] |
| Safety data sheet (SDS) | External MSDS |
| Related compounds | |
|
Related compounds |
2-Chloropropionic acid Sodium chloroacetate |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Chloroacetic acid, industrially known as monochloroacetic acid (MCA), is the organochlorine compound with the formula ClCH2CO2H. This carboxylic acid is a useful building block in organic synthesis. It is a colorless solid. Related compounds are dichloroacetic acid and trichloroacetic acid.
Production[edit]
Chloroacetic acid was first prepared (in impure form) by the French chemist Félix LeBlanc (1813–1886) in 1843 by chlorinating acetic acid in the presence of sunlight,[3] and in 1857 (in pure form) by the German chemist Reinhold Hoffmann (1831–1919) by refluxing glacial acetic acid in the presence of chlorine and sunlight,[4] and then by the French chemist Charles Adolphe Wurtz by hydrolysis of chloroacetyl chloride (ClCH2COCl), also in 1857.[5]
Chloroacetic acid is prepared industrially by two routes. The predominant method involves chlorination of acetic acid, with acetic anhydride as a catalyst:
- H
3C−COOH + Cl
2 → ClH
2C−COOH + HCl
This route suffers from the production of dichloroacetic acid and trichloroacetic acid as impurities, which are difficult to separate by distillation:
- H
3C−COOH + 2 Cl
2 → Cl
2HC−COOH + 2 HCl - H
3C−COOH + 3 Cl
2 → Cl
3C−COOH + 3 HCl
The second method entails hydrolysis of trichloroethylene:
- ClHC=CCl2 + 2 H
2O → ClH
2C−COOH + 2 HCl
The hydrolysis is conducted at 130–140 °C in a concentrated (at least 75%) solution of sulfuric acid. This method produces a highly pure product, unlike the halogenation route. However, the significant quantities of HCl released have led to the increased popularity of the halogenation route. Approximately 420,000 tonnes are produced globally per year.[2]
Uses and reactions[edit]
Most reactions take advantage of the high reactivity of the C–Cl bond.
In its largest-scale application, chloroacetic acid is used to prepare the thickening agent carboxymethyl cellulose and carboxymethyl starch.
Chloroacetic acid is also used in the production of phenoxy herbicides by etherification with chlorophenols. In this way 2-methyl-4-chlorophenoxyacetic acid (MCPA), 2,4-dichlorophenoxyacetic acid, and 2,4,5-trichlorophenoxyacetic acid (2,4,5-T) are produced. It is the precursor to the herbicide glyphosate and dimethoate. Chloroacetic acid is converted to chloroacetyl chloride, a precursor to adrenaline (epinephrine). Displacement of chloride by sulfide gives thioglycolic acid, which is used as a stabilizer in PVC and a component in some cosmetics.[2]
Illustrative of its usefulness in organic chemistry is the O-alkylation of salicylaldehyde with chloroacetic acid, followed by decarboxylation of the resulting ether, producing benzofuran.[6][7]
Safety[edit]
Like other chloroacetic acids and related halocarbons, chloroacetic acid is a hazardous alkylating agent. The LD50 for rats is 76 mg/kg.[2]
It is classified as an extremely hazardous substance in the United States as defined in Section 302 of the U.S. Emergency Planning and Community Right-to-Know Act (42 U.S.C. 11002), and is subject to strict reporting requirements by facilities which produce, store, or use it in significant quantities.[8]
See also[edit]
- Fluoroacetic acid
References[edit]
- ^ Dippy, J. F. J.; Hughes, S. R. C.; Rozanski, A. (1959). “498. The dissociation constants of some symmetrically disubstituted succinic acids”. Journal of the Chemical Society. 1959: 2492–2498. doi:10.1039/JR9590002492.
- ^ a b c d Koenig, G.; Lohmar, E.; Rupprich, N. (2005). “Chloroacetic Acids”. Ullmann’s Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a06_537.
- ^ LeBlanc, Félix (1844) “Recherches sur les produits dérivés de l’éther acétique par l’action du chlore, et en particulier sur l’éther acétique perchloruré” (in French), Annales de Chimie et de Physique, 3rd series, 10 : 197–221 ; see especially p. 212.
- ^ Hoffmann, Reinhold (1857) “Ueber Monochloressigsäure” (in German) (On mono-chloroacetic acid), Annalen der Chemie und Pharmacie, 102 (1) : 1–20.
- ^ Wurtz, Adolphe (1857) “Note sur l’aldéhyde et sur le chlorure d’acétyle” (in French) (Note on aldehyde and on acetyl chloride), Annales de chimie et de physique, 3rd series, 49 : 58–62, see p. 61.
- ^ Burgstahler, A. W.; Worden, L. R. (1966). “Coumarone”. Organic Syntheses. 46: 28. doi:10.15227/orgsyn.046.0028.; Collective Volume, vol. 5, p. 251.
- ^ Inglis, J. K. H. (1928). “Ethyl Cyanoacetate”. Organic Syntheses. 8: 74. doi:10.15227/orgsyn.008.0074.
- ^ 40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities (PDF) (1 July 2008 ed.), Government Printing Office, archived from the original (PDF) on 25 February 2012, retrieved 29 October 2011
External links[edit]
- “Monochloroacetic Acid”. CABB. Archived from the original on 6 February 2015. Retrieved 6 February 2015.
- “Monochloroacetic Acid”. IPCS Inchem. Retrieved 20 May 2007.
Хлоруксусная кислота представляет собой уксусную кислоту, в которой один из атомов водорода, находящийся в метильной группе, замещен на свободный атом хлора. Ее получают в результате взаимодействия уксусной кислоты с хлором.
Основным сырьем для получения является уксусная кислота. Хлоруксусная кислота также может быть получена при гидролизе трихлорэтилена.
В результате гидролиза получают химически чистый продукт. Однако данный метод подразумевает использование чистой дистиллированной воды без каких-либо примесей.
Хлоруксусная кислота применяется для получения различного рода красителей, лекарственных препаратов, витаминов и всевозможных пестицидов. Ее также используют в качестве поверхностно-активного вещества (ПАВ).
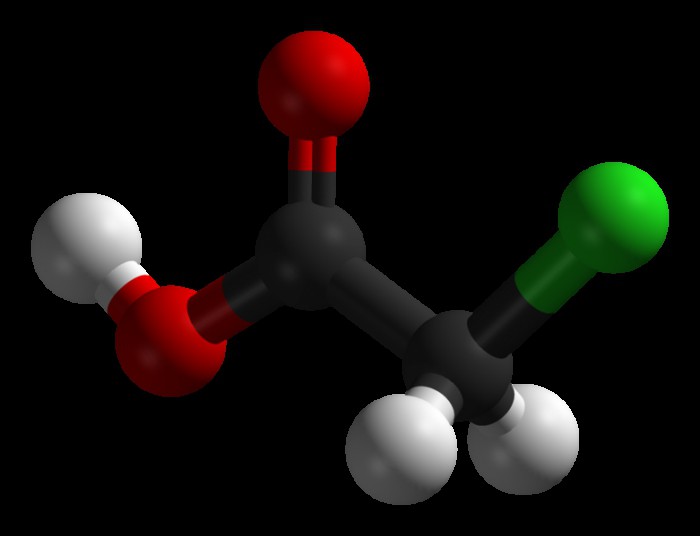
При хлорировании уксусной кислоты в среде неорганических катализаторов (а именно уксусного ангидрида, серы и фосфора) получается хлоруксусная кислота, формула которой CH2Cl-COOH:
CH3-COOH+Cl2↑→=> CH2Cl-COOH+HCl.
Физические свойства
Хлоруксусная кислота представляет собой гигроскопические, прозрачные кристаллы с температурой плавления 61,2°С и температурой кипения 189,5°С. Вещество легкорастворимое (как в спирту, так и в водной среде, а также в ацетоне, бензоле и четыреххлористом углероде).
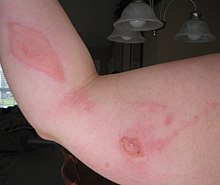
Монохлоруксусная кислота – ядовитое и чрезвычайно опасное вещество, при проглатывании которого довольно часто наблюдается летальный исход. При попадании на кожные покровы хлоруксусная кислота вызывает сильнейшие ожоги, которые длительное время не заживают.
При вдыхании паров кислоты могут наблюдаться воспалительные изменения в легких, а также в верхних и нижних дыхательных путях.
Рабочие производственных цехов по производству монохлоруксусной кислоты страдают нарушением обоняния, хроническими ринофарингитами, шелушением и сухостью кожи.
Также при длительном взаимодействии с агрессивным веществом наблюдаются поражения эпидермиса кожи, выраженные дерматитами в области лица, шеи, верхних и нижних конечностей, в редких случаях – туловища.
Хлоруксусная кислота в человеческом организме превращается в тиодиуксусную кислоту, которая выводиться из организма с калом и мочой.
Основные методы предосторожности при эксплуатации:
– категорически запрещается вдыхать пары, газ, дым и пыль;
– обязательно использовать средства индивидуальной защиты при выполнении работ, связанных с любым контактом с кислотой (непроницаемый комбинезон, защитные очки, резиновые сапоги и перчатки);
– в случае вдыхании паров или попадании кислоты на кожу следует незамедлительно обратиться за квалифицированной помощью в ближайшее медицинское учреждение.

Предельно допустимая и теоретически безопасная концентрация хлоруксусной кислоты в воздухе производственного помещения составляет около одного мг/м3.
При транспортировке кислоты ее упаковывают в полимерную тару (контейнера или бочки), картонные барабаны, а также стальные емкости. Допускается транспортировка любым видом крытого транспорта.
Следует помнить, что монохлоруксусная кислота пожаро- и взрывоопасна. Это вещество легко воспламеняется.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 20 мая 2020 года; проверки требуют 6 правок.
| Монохлоруксусная кислота | ||
|---|---|---|
|
||
| Общие | ||
| Систематическое наименование |
Хлорэтановая кислота | |
| Традиционные названия | Монохлоруксусная кислота | |
| Хим. формула | C2H3ClO2 | |
| Физические свойства | ||
| Молярная масса | 94,50 г/моль | |
| Плотность | 1.58 г/см³ | |
| Термические свойства | ||
| Температура | ||
| • плавления | 63 °C | |
| • кипения | 189 °C | |
| Химические свойства | ||
Константа диссоциации кислоты  |
2,87 | |
| Классификация | ||
| Рег. номер CAS | 79-11-8 | |
| PubChem | 300 | |
| Рег. номер EINECS | 201-178-4 | |
| SMILES |
C(C(=O)O)Cl |
|
| InChI |
InChI=1S/C2H3ClO2/c3-1-2(4)5/h1H2,(H,4,5) FOCAUTSVDIKZOP-UHFFFAOYSA-N |
|
| RTECS | AF8575000 | |
| ChEBI | 27869 | |
| ChemSpider | 10772140 | |
| Безопасность | ||
| Предельная концентрация | 1 мг/м3 | |
| ЛД50 | 76 мг/кг | |
| Токсичность | Класс опасности II | |
| Краткие характер. опасности (H) |
H301+H311+H331, H314, H335, H400 |
|
| Меры предостор. (P) |
P280, P301+P330+P331, P304+P340, P305+P351+P338, P308+P311 |
|
| Сигнальное слово | опасно | |
| Пиктограммы СГС |
|
|
| NFPA 704 |
1 3 0 |
|
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | ||
Монохлоруксусная кислота CH2ClCOOH — уксусная кислота, в которой один атом водорода метильной группы замещён на атом хлора, бесцветные кристаллы.
Физические свойства[править | править код]
tпл 61,2 °C tкип 189,3 °C. Растворима в воде, спирте, ацетоне, эфире.
Применение[править | править код]
Монохлоруксусная кислота — промежуточный продукт в синтезе индиго и многих др. кубовых красителей; её применяют также при получении карбоксиметилцеллюлозы, снотворного средства барбитала, гербицидов (например, солей и эфиров 2,4-дихлорфеноксиуксусной кислоты), витамина B6.
Иллюстрацией её полезности в органической химии является O-алкилирование салицилового альдегида хлоруксусной кислотой с последующим декарбоксилированием образовавшегося эфира, получая бензофуран.
[1]
Большинство реакций используют высокую реакционную способность связи C-Cl. Она прекурсор для гербицида глифосата. Гербицид МХФУК(2-метил-4-хлорофенокси уксусная кислота) был получен алкилированием хлоруксусной кислотой. Хлоруксусную кислоту переводят в хлорацетилхлорид, прекурсор адреналина.
Замещение хлора серой даёт тиогликолевую кислоту, которая используется как стабилизатор ПВХ и иногда как компонент в косметике.
Наибольшее количество хлоруксусной кислоты используется для приготовления загустителя — карбоксиметилцеллюлозы.
Получение[править | править код]
В основном получают монохлоруксусную кислоту хлорированием ледяной уксусной кислоты при катализе уксусным ангидридом:
Другой промышленный метод — гидролиз трихлорэтилена
Гидролиз даёт чистый продукт, тогда как при хлорировании необходимо проводить сложную дистилляцию для отделения моно- би- трихлоруксусных кислот[2].
Годовое производство хлоруксусной кислоты составляет ориентировочно 420 тыс. тонн.
При взаимодействии хлора с уксусной кислотой в присутствии небольшого количества красного фосфора, образуется смесь моно-, ди- и трихлоруксусной кислот.
Безопасность[править | править код]
Как и другие галогенкислоты и галогеналканы, хлоруксусная кислота — потенциально опасный алкилирующий агент. ЛД50 на крысах 76 мг/кг
Примечания[править | править код]
- ↑ Burgstahler, A. W.; Worden, L. R. (1966). «Coumarone Архивная копия от 14 июня 2012 на Wayback Machine.» Org. Synth. 46: 28.
- ↑ Günter Koenig, Elmar Lohmar, Norbert Rupprich «Chloroacetic Acids» in Ullmann’s Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. doi:10.1002/14356007.a06_537
Литература[править | править код]
- Химическая энциклопедия / Редкол.: Зефиров Н.С. и др.. — М.: Большая Российская энциклопедия, 1998. — Т. 5 (Три-Ятр). — 783 с. — ISBN 5-85270-310-9.
Хлоруксусная кислота представляет собой уксусную кислоту, в которой один из атомов водорода, находящийся в метильной группе, замещен на свободный атом хлора. Ее получают в результате взаимодействия уксусной кислоты с хлором.
Основным сырьем для получения является уксусная кислота. Хлоруксусная кислота также может быть получена при гидролизе трихлорэтилена.

В результате гидролиза получают химически чистый продукт. Однако данный метод подразумевает использование чистой дистиллированной воды без каких-либо примесей.
Хлоруксусная кислота применяется для получения различного рода красителей, лекарственных препаратов, витаминов и всевозможных пестицидов. Ее также используют в качестве поверхностно-активного вещества (ПАВ).
Часто, беря в руки очередную неизвестную баночку с кремом или детским питанием, мы стараемся…
При хлорировании уксусной кислоты в среде неорганических катализаторов (а именно уксусного ангидрида, серы и фосфора) получается хлоруксусная кислота, формула которой CH2Cl-COOH:
CH3-COOH+Cl2↑→=> CH2Cl-COOH+HCl.
Физические свойства
Хлоруксусная кислота представляет собой гигроскопические, прозрачные кристаллы с температурой плавления 61,2°С и температурой кипения 189,5°С. Вещество легкорастворимое (как в спирту, так и в водной среде, а также в ацетоне, бензоле и четыреххлористом углероде).

Монохлоруксусная кислота – ядовитое и чрезвычайно опасное вещество, при проглатывании которого довольно часто наблюдается летальный исход. При попадании на кожные покровы хлоруксусная кислота вызывает сильнейшие ожоги, которые длительное время не заживают.
При вдыхании паров кислоты могут наблюдаться воспалительные изменения в легких, а также в верхних и нижних дыхательных путях.
Рабочие производственных цехов по производству монохлоруксусной кислоты страдают нарушением обоняния, хроническими ринофарингитами, шелушением и сухостью кожи.
Также при длительном взаимодействии с агрессивным веществом наблюдаются поражения эпидермиса кожи, выраженные дерматитами в области лица, шеи, верхних и нижних конечностей, в редких случаях – туловища.
Хлоруксусная кислота в человеческом организме превращается в тиодиуксусную кислоту, которая выводиться из организма с калом и мочой.
Основные методы предосторожности при эксплуатации:
– категорически запрещается вдыхать пары, газ, дым и пыль;
– обязательно использовать средства индивидуальной защиты при выполнении работ, связанных с любым контактом с кислотой (непроницаемый комбинезон, защитные очки, резиновые сапоги и перчатки);
– в случае вдыхании паров или попадании кислоты на кожу следует незамедлительно обратиться за квалифицированной помощью в ближайшее медицинское учреждение.

Предельно допустимая и теоретически безопасная концентрация хлоруксусной кислоты в воздухе производственного помещения составляет около одного мг/м3.
При транспортировке кислоты ее упаковывают в полимерную тару (контейнера или бочки), картонные барабаны, а также стальные емкости. Допускается транспортировка любым видом крытого транспорта.
Следует помнить, что монохлоруксусная кислота пожаро- и взрывоопасна. Это вещество легко воспламеняется.





