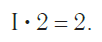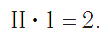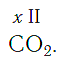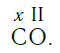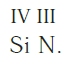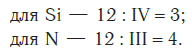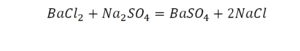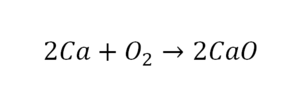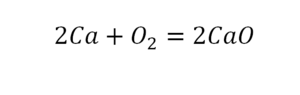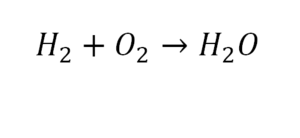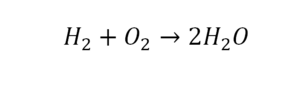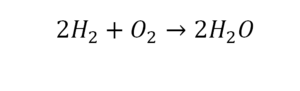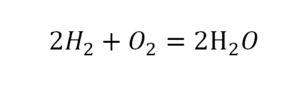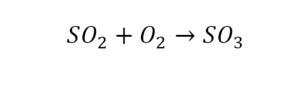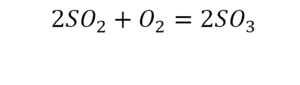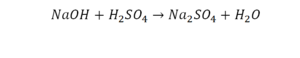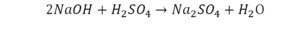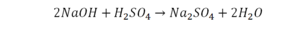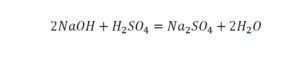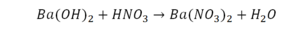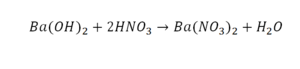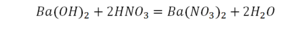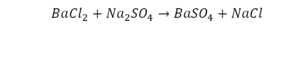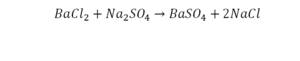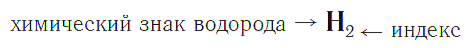Содержание
- Как найти индекс металлов
- Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.
- Формульная единица
- Как определить валентность.
- Как определить валентность по таблице Менделеева.
- Алгоритм определения валентности по формулам химических элементов.
- Индекс металлов и добычи Московской биржи
- Индекс металлов и добычи
- Динамика индекса
- Как заработать с помощью индекса металлов и добычи?
- Как найти индекс металлов
- Как найти индекс металлов
- Индекс – цифра снизу справа от знака химического элемента, указывает на количество атомов данного элемента в веществе.
- Как найти индекс металлов
- Периодический закон
- Структура Периодической системы элементов
- Свойства Периодической системы элементов
- Элементы Периодической таблицы Менделеева
- Щелочные металлы
- Щелочноземельные металлы
- Лантаноиды и актиноиды
- Переходные металлы
- Неметаллы
- Подгруппа углерода
- Подгруппа азота
- Подгруппа кислорода
- Галогены
- Инертные газы
- Интересное по рубрике
- Найдите необходимую статью по тегам
- Подпишитесь на нашу рассылку
- Мы в инстаграм
- Рекомендуем прочитать
- Реальный опыт семейного обучения
Ключевые слова конспекта: химическая формула, индекс, коэффициент, качественный и количественный состав, формульная единица.
Химическая формула — это условная запись состава вещества посредством химических знаков и индексов.

Если требуется обозначить не одну, а несколько молекул (или отдельных атомов), то перед химической формулой (или знаком) ставят соответствующую цифру, которую называют коэффициентом. Например, три молекулы воды обозначаются 3Н2О, пять атомов железа — 5Fe. Индекс 1 в химических формулах и коэффициент 1 перед химическими символами и формулами не пишут.
Представленные на рисунке формулы читаются так: три-купрум-хлор-два, пять-алюминий-два-о-три, три-феррум-хлор-три .
Запись 5Н2О (пять-аш-два-о) следует понимать так: пять молекул воды образованы десятью атомами водорода и пятью атомами кислорода.
ЗАДАНИЕ. Обозначить, используя символы химических элементов
а) три молекулы азота
б) семь молекул сульфида железа
в) четыре атома серы
г) два атома кальция
д) семь молекул воды
е) четыре молекулы кислорода
ж) две молекулы сернистой кислотыОТВЕТ:
а) три молекулы азота — 3N2
б) семь молекул сульфида железа — 7FeS
в) четыре атома серы — S4
г) два атома кальция — Ca2
д) семь молекул воды — 7H2O
е) четыре молекулы кислорода — 4O2
ж) две молекулы сернистой кислоты — 2H2SO3Объяснение: коэффициенты показывают количество молекул, индексы — количество атомов. Формулы молекул простых веществ нужно запомнить. Одноатомные молекулы образуют инертные газы гелий He, неон Ne, аргон Ar и другие. Из двухатомных молекул состоят водород H2, кислород O2, азот N2, галогены F2, Cl2, Br2, I2. Три атома — в молекулах озона O3, четыре — в молекулах белого фосфора P4.
По химической формуле мы можем дать веществу название, определить его качественный и количественный состав, а также подсчитать его относительную молекулярную массу.Химическая формула показывает, из атомов каких элементов состоит вещество (то есть качественный состав вещества); и каково соотношение атомов этих элементов (то есть количественный состав вещества).
Формульная единица
Химические формулы веществ, имеющих немолекулярное строение, например FeS, не описывают состав молекулы; а только показывают соотношение элементов, образующих данное вещество.
Так, кристаллическая решётка поваренной соли — хлорида натрия состоит не из молекул, а из ионов. На каждый положительно заряженный ион натрия в ней приходится один отрицательно заряженный ион хлора. Получается, что отношение индексов в записи NaCl совпадает с отношением; в котором химические элементы соединяются между собой, образуя вещество. По отношению к веществам, имеющим немолекулярное строение, такую запись правильнее называть не формула, а формульная единица.
В таком случае величина Мr должна называться не относительной молекулярной массой, а относительной формульной массой. Тем не менее по традиции выражение «относительная молекулярная масса» используют и по отношению к веществам немолекулярного строения.
Конспект урока «Химическая формула. Индекс и коэффициент. Формульная единица«.
Источник
Как определить валентность.
В этой статье рассмотрим способы и поймем, как определить валентность элементов таблицы Менделеева.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор – одновалентен; H2O, где кислород – двухвалентен; NH3, где азот – трёхвалентен.
Как определить валентность по таблице Менделеева.
Таблица Менделеева содержит в себе химические элементы, которые размещены в ней по определенным принципам и законам. Каждый элемент стоит на месте, который определяется его характеристиками и свойствами и каждый элемент имеет свой номер. Горизонтальные линии называются периодами, которые возрастают от первой строки вниз. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Кроме того, в таблице есть группы, которых всего восемь. Элементы размещаются в столбцах по вертикали. Здесь их размещение неравномерно – с одной стороны больше элементов (главная группа), с другой — меньше (побочная группа).
Валентностью называют способность атома образовывать некоторое количество химических связей с атомами других элементов. Как определить валентность по таблице Менделеева поможет понять знание видов валентности.
Виды валентности
Постоянная (у металлов главных подгрупп)
Переменная (у неметаллов и металлов побочных подгрупп)
Высшая (равна номеру группы)
Низшая (равна разности между числом 8 и номером группы)
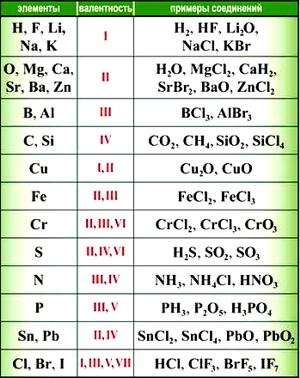
Для элементов побочных подгрупп (а к ним относятся только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений. Или постоянно держать под рукой таблицу валентности элементов.
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
1. Запишем формулу:
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы:
Источник
Индекс металлов и добычи Московской биржи — это ценовой индекс наиболее ликвидных акций крупнейших российских металлургических и горнодобывающих компаний, допущенных к обращению на Московской Бирже. Состав индекса обновляется каждый квартал. На начало 2019 года в него входят 12 бумаг. Наибольший вес составляют акции таких компаний, как Норильский никель, АЛРОСА, Северсталь, НЛМК. Роль металлургической отрасли в экономике России довольно велика, что делает индекс металлов и добычи интересным инструментом. Благодаря этому показателю инвестор может оперативно оценивать состояние отрасли и ее возможные перспективы или риски.
Динамика индекса
Индекс металлов и добычи рассчитывается с декабря 2014 года со стартовой позиции в 1000 пунктов. За весь период существования индекса длительные периоды роста сменяются периодами падения. С середины 2013 года наблюдается постепенный подъем графика: с 1945 пунктов на 13 июня к 6473,45 пунктам на 11 января 2019 года — рост более, чем в 2,3 раза. Эту тенденцию нельзя назвать устойчивой. На протяжении этих 5 лет индекс временами проседал, однако в дальнейшем ему удавалось отыграть свои позиции.
Рассмотренный нами индекс может служить не только показателем общей ситуации в отрасли, но и одним из способов увеличить свои средства. Инвесторы зарабатывают на динамике индексов. Это можно сделать различными способами. Например:
- Купить акции компаний, входящих в индекс через брокера. Для этого необходимо открыть счет и собрать портфель акций, который по составу и структуре будет идентичен индексу. В этом случае вы становитесь акционером металлургических и горнодобывающих компаний, представленных в индексе.
- Для тех инвесторов, которые не хотят приобретать активы, входящие в корзину, существуют производные финансовые инструменты — фьючерсы. Это контракты, которые исполняются путем денежных расчетов. Участники сделки с фьючерсами на индексы обязуются оплатить или получить разницу между ценой сделки и ценой исполнения контракта.
- Другим способом инвестиций в сектор металлов и добычи могут быть вложения в паевые инвестиционные фонды (ПИФы). На сегодняшний день банки предлагают клиентам приобрести паи фондов, динамика которых повторяет динамику любого отраслевого индекса за счет грамотно подобранной корзины.
Более подробную инструкцию для начинающих инвесторов вы можете найти в нашей статье: Первые шаги на фондовом рынке.
Для тех, кто хочет не просто во что-то вкладывать, а понимать, за счет чего деньги могут приумножаться в каждом конкретном вложении, рекомендуем наш курс «Инвестиционный фундамент».
Источник
1) Допустим, вам надо определить, какова формула у оксида серы. Из самого названия вещества следует, что каждая его молекула состоит только из двух элементов: кислорода (О и серы (S). Состав молекулы зависит от величины валентности каждого из этих элементов, то есть от того, какое количество химических связей атом элемента способен образовать с другими атомами.
2)
Кислород в обычном состоянии – газ, сера – твердое вещество. Оба эти элемента имеют ярко выраженные неметаллические свойства. Следовательно, они оба подчиняются правилу: каждый неметалл имеет высшую валентность, соответствующую номеру группы таблицы Менделеева, в которой он расположен, и низшую, соответствующую остатку от вычитания номера этой группы из восьми. То есть поскольку и кислород, и сера расположены в 6-й группе таблицы Менделеева, их высшая валентность равна 6, а низшая — 2.
3)
Теперь надо определить, какую из этих валентностей имеет кислород, а какую – сера. Ведь невозможно, чтобы оба эти элемента в соединении имели одновременно либо высшую, либо низшую валентность. Теперь в действие вступает еще одно правило: «При соединении двух неметаллов тот из них, который находится ближе к верхнему правому углу таблицы Менделеева, имеет низший показатель валентности». Еще раз посмотрите в таблицу. Вы видите, что кислород располагается выше серы, следовательно, он находится ближе к верхнему правому углу. Таким образом, в соединении с серой он будет иметь низшую валентность, равную 2. А сера, соответственно, имеет высшую валентность, равную 6.
4)
Остается последний шаг. Какие индексы будут у каждого из этих элементов? Известно, что произведения величин валентностей элементов, умноженные на их индексы, должны численно совпадать. Валентность серы в три раза больше валентности кислорода, следовательно, индекс кислорода должен быть в три раза больше индекса серы. Отсюда следует: формула соединения SO3.
Источник
Химическая формула – условная запись состава вещества посредством химических знаков и индексов.
Химическая формула отражает качественный и количественный состав вещества.
3 – коэффициент; 2 и 4 — индексы.
(Данная формула читается: три аш два эс о четыре, или 3 молекулы серной кислоты)
Индекс – цифра снизу справа от знака химического элемента, указывает на количество атомов данного элемента в веществе.
Коэффициент – цифра перед формулой вещества, указывающая на количество частиц (атомов, молекул, ионов).
Относительная атомная масса элемента ( Ar ) —
Относительная атомная масса – величина безразмерная, ее значение указано в периодической системе для каждого конкретного элемента.
Относительная молекулярная масса вещества ( Mr ) – сумма относительных атомных масс элементов, составляющих молекулу, с учетом их числа.
Mr (H 2 SO 4 ) = 2 х Ar (H) + 1 х Ar (S) + 4 х Ar (O)
Mr ( H 2 SO 4 ) = 2 х 1 + 1 х 32 + 4 х 16 = 98
Молярная масса вещества ( М ) – масса 1 моля вещества.
Значения молярной массы и относительной молекулярной массы данного вещества численно совпадают.
M ( H 2 SO 4 ) = 2 х 1 + 1 х 32 + 4 х 16 = 98 г/моль
Информация, заключенная в химической формуле.
1. Качественный состав (из каких атомов состоит): водород, сера, кислород.
2. Количественный состав (сколько атомов каждого типа входят в состав молекулы): 2 атома водорода, 1 атом серы, 4 атома кислорода.
3. Тип вещества: сложное вещество.
4. Класс вещества: кислота.
Относительная молекулярная и молярная масса вещества:
Mr (H 2 SO 4 ) = 98; M (H 2 SO 4 ) = 98 г/моль
5. Количество вещества (определяется по коэффициенту) n = 3 моль.
6. Масса данного количества вещества ( m = n х M ):
m ( H 2 SO 4 )= 3моль х 98 г/моль =196г
7 Соотношение массовых долей элементов, составляющих сложное вещество:
w (H) = 2 х Ar(H) / Mr (H 2 SO 4 ); w (H) = 2 х 1 / 98 = 0,02 или 2%
w (S) = 1 х Ar(s) / Mr (H 2 SO 4 ); w (S) = 1 х 32 / 98 = 0,33 или 33%
w (O) = 4 х Ar(S) / Mr (H 2 SO 4 ); w (O) = 4 х 16 / 98 = 0,65 или65%
Источник
Выдающийся русский учёный, химик, физик и энергетик. Самым значимым его вкладом в науку стало открытие периодического закона, графическое выражение которого получило название Периодической системы химических элементов.
Периодический закон
К середине XIX века учёные располагали множеством сведений о физических и химических свойствах разных элементов и их соединений. Появилась необходимость упорядочить эти знания и представить их в наглядном виде. Исследователи из разных стран пытались создать классификацию, объединяя элементы по сходству состава и свойств веществ, которые они образуют. Однако ни одна из предложенных систем не охватывала все известные элементы.
Пытался решить эту задачу и молодой русский профессор Д.И. Менделеев. Он собирал и классифицировал информацию о свойствах элементов и их соединений, а затем уточнял её в ходе многочисленных экспериментов. Собрав данные, Дмитрий Иванович записал сведения о каждом элементе на карточки, раскладывал их на столе и многократно перемещал, пытаясь выстроить логическую систему. Долгие научные изыскания привели его к выводу, что свойства элементов и их соединений изменяются с возрастанием атомной массы, однако не монотонно, а периодически.
Так был открыт периодический закон, который учёный сформулировал следующим образом: «Свойства элементов, а потому и свойства образуемых ими простых и сложных тел, стоят в периодической зависимости от их атомного веса».
Своё открытие Менделеев совершил почти за 30 лет до того, как учёным удалось понять структуру атома. Открытия в области атомной физики позволили установить, что свойства элементов определяются не атомной массой, а зависят от количества электронов, содержащихся в нём. Поэтому современная формулировка закона звучит так:
Свойства химических элементов, а также формы и свойства образуемых ими веществ и соединений находятся в периодической зависимости от величины зарядов ядер их атомов.
Этот принцип Менделеев проиллюстрировал в таблице, в которой были представлены все 63 известных на тот момент химических элемента. При её создании учёный предпринял ряд весьма смелых шагов.
Во-первых, многочисленные эксперименты позволили Менделееву сделать вывод, что атомные массы некоторых элементов ранее были вычислены неправильно, и он изменил их в соответствии со своей системой.
Во-вторых, в таблице были оставлены места для новых элементов, открытие которых учёный предсказал, подробно описав их свойства.
Мировое научное сообщество поначалу скептически отнеслось к открытию русского химика. Однако вскоре были открыты предсказанные им химические элементы: галлий, скандий и германий. Это разрушило сомнения в правильности системы Менделеева, которая навсегда изменила науку. Там, где раньше учёному требовалось провести ряд сложнейших (и даже не всегда возможных в реальности) опытов — теперь стало достаточно одного взгляда в таблицу.
Существует легенда, якобы знаменитая таблица явилась Менделееву во сне. Но сам Дмитрий Иванович эту информацию не подтвердил. Он действительно нередко засиживался над работой до поздней ночи и засыпал, продолжая размышлять над решением задачи, однако факт мистического озарения во сне учёный отрицал: «Я над ней, может быть, двадцать лет думал, а вы думаете, сел и вдруг — готово!».
Теперь расскажем, как устроена Периодическая таблица элементов Менделеева и как ею пользоваться.
Структура Периодической системы элементов
На настоящий момент Периодическая таблица Менделеева содержит 118 химических элементов. Каждый из них занимает своё место в зависимости от атомного числа. Оно показывает, сколько протонов содержит ядро атома элемента и сколько электронов в атоме находятся вокруг него. Атом каждого последующего элемента содержит на один протон больше, чем предыдущий.
Периоды — это строки таблицы. На данный момент их семь. У всех элементов одного периода одинаковое количество заполненных электронами энергетических уровней.
Группы — это столбцы. В группы в Периодической таблице объединяются элементы с одинаковым числом электронов на внешнем энергетическом уровне их атомов. В кратком варианте таблицы, используемой в школьных учебниках, элементы разделены на восемь групп. Каждая из них делится на главную (A) и побочную (B) подгруппы, которые объединяют элементы со сходными химическими свойствами.
Каждый элемент обозначается одной или двумя латинскими буквами. Порядковый номер элемента (число протонов в его ядре) обычно пишется в левом верхнем углу. Также в ячейке элемента указана его относительная атомная масса (сумма масс протонов и нейтронов). Это усреднённая величина, для расчёта которой используются атомные массы всех изотопов элемента с учётом их содержания в природе. Поэтому обычно она является дробным числом.
Чтобы узнать количество нейтронов в ядре элемента, необходимо вычесть его порядковый номер из относительной атомной массы (массового числа).
Свойства Периодической системы элементов
Расположение химических элементов в таблице Менделеева позволяет сопоставлять не только их атомные массы, но и химические свойства.
Вот как они изменяются в пределах группы (сверху вниз):
- Металлические свойства усиливаются, неметаллические ослабевают.
- Увеличивается атомный радиус.
- Усиливаются основные свойства гидроксидов и кислотные свойства водородных соединений неметаллов.
В пределах периодов (слева направо) свойства элементов меняются следующим образом:
- Металлические свойства ослабевают, неметаллические усиливаются.
- Уменьшается атомный радиус.
- Возрастает электроотрицательность.
Элементы Периодической таблицы Менделеева
По положению элемента в периоде можно определить его принадлежность к металлам или неметаллам. Металлы расположены в левом нижнем углу таблицы, неметаллы — в правом верхнем углу. Между ними находятся полуметаллы. Все периоды, кроме первого, начинается щелочным металлом. Каждый период заканчивается инертным газом.
Щелочные металлы
Первая группа главная подгруппа элементов (IA) — щелочные металлы. Это серебристые вещества (кроме цезия, он золотистый), настолько мягкие, что их можно резать ножом. Поскольку на их внешнем электронном слое находится только один электрон, они очень легко вступают в реакции. Плотность щелочных металлов меньше плотности воды, поэтому они в ней не тонут, а бурно реагируют с образованием щёлочи и водорода. Реакция идёт настолько энергично, что водород может даже загореться или взорваться. Эти металлы настолько активно реагируют с кислородом в воздухе, что их приходится хранить под слоем керосина (а литий — под слоем вазелина).
Учите химию вместе с домашней онлайн-школой «Фоксфорда»! По промокоду CHEMISTRY892021 вы получите бесплатный недельный доступ к курсам химии за 8 класс и 9 класс.
Щелочноземельные металлы
Вторая группа главная подгруппа (IIА) представлена щелочноземельными металлами с двумя электронами на внешнем энергетическом уровне атома. Бериллий и магний часто не относят к щелочноземельным металлам. Они тоже имеют серебристый оттенок и легко взаимодействуют с другими элементами, хотя и не так охотно, как металлы из первой группы главной подгруппы. Температура плавления щелочноземельных металлов выше, чем у щелочных. Ионы магния и кальция обусловливают жёсткость воды.
Лантаноиды и актиноиды
В третьей группе побочной подгруппе (IIIB) шестого и седьмого периодов находятся сразу несколько металлов, сходных по строению внешнего энергетического уровня и близких по химическим свойствам. У этих элементов электроны начинают заполнять третий по счёту от внешнего электронного слоя уровень. Это лантаноиды и актиноиды. Для удобства их помещают под основной таблицей.
Лантаноиды иногда называют «редкоземельными элементами», поскольку они были обнаружены в небольшом количестве в составе редких минералов и не образуют собственных руд.
Актиноиды имеют одно важное общее свойство — радиоактивность. Все они, кроме урана, практически не встречаются в природе и синтезируются искусственно.
Переходные металлы
Элементы побочных подгрупп, кроме лантаноидов и актиноидов, называют переходными металлами. Они вполне укладываются в привычные представления о металлах — твёрдые (за исключением жидкой ртути), плотные, обладают характерным блеском, хорошо проводят тепло и электричество. Валентные электроны их атомов находятся на внешнем и предвнешнем энергетических уровнях.
Неметаллы
Правый верхний угол таблицы до инертных газов занимают неметаллы. Неметаллы плохо проводят тепло и электричество и могут существовать в трёх агрегатных состояниях: твёрдом (как углерод или кремний), жидком (как бром) и газообразном (как кислород и азот). Водород может проявлять как металлические, так и неметаллические свойства, поэтому его относят как к первой, так и к седьмой группе Периодической системы.
Подгруппа углерода
Четвёртую группу главную подгруппу (IVА) называют подгруппой углерода. Углерод и кремний обладают всеми свойствами неметаллов, германий и олово занимают промежуточную позицию, а свинец имеет выраженные металлические свойства. Углерод образует несколько аллотропных модификаций — вариантов простых веществ, отличающихся по своему строению, а именно: графит, алмаз, фуллерит и другие.
Большинство элементов подгруппы углерода — полупроводники (проводят электричество за счёт примесей, но хуже, чем металлы). Графит, германий и кремний используют при изготовлении полупроводниковых элементов (транзисторы, диоды, процессоры и так далее).
Подгруппа азота
Пятую группу главную подгруппу (VA) называют пниктогенами или подгруппой азота. В ходе реакций эти элементы могут как отдавать электроны, так и принимать их, завершая внешний энергетический уровень.
Физические свойства элементов подгруппы азота различны. Азот является бесцветным газом. Фосфор, мягкое вещество, образует несколько вариантов аллотропных модификаций — белый, красный и чёрный фосфор. Мышьяк — твёрдый полуметалл, способный проводить электрический ток. Висмут — блестящий серебристо-белый металл с радужным отливом.
Азот — основное вещество в составе атмосферы нашей планеты. Некоторые элементы подгруппы азота токсичны для человека (фосфор, мышьяк, висмут). При этом азот и фосфор являются важными элементами почвенного питания растений, поэтому они входят в состав большинства удобрений. Азот и фосфор также участвуют в формировании важнейших молекул живых организмов — белков и нуклеиновых кислот.
Подгруппа кислорода
Халькогены или подгруппа кислорода — элементы шестой группы главной подгруппы (VIA). Для завершения внешнего электронного уровня атомам этих элементов не хватает лишь двух электронов, поэтому они проявляют сильные окислительные (неметаллические) свойства. Однако, по мере продвижения от кислорода к полонию они ослабевают.
Кислород образует две аллотропные модификации — кислород и озон — тот самый газ, который образует экран в атмосфере планеты, защищающий живые организмы от жёсткого космического излучения.
Кислород и сера легко образуют прочные соединения с металлами — оксиды и сульфиды. В виде этих соединений металлы часто входят в состав руд.
Галогены
Седьмая группа главная подгруппа (VIIA) представлена галогенами — неметаллами с семью электронами на внешнем электронном слое атома. Это сильнейшие окислители, легко вступающие в реакции. Галогены («рождающие соли») назвали так потому, что они реагируют со многими металлами с образованием солей. Например, хлор входит в состав обычной поваренной соли.
Самый активный из галогенов — фтор. Он способен разрушать даже молекулы воды, за что и получил своё грозное имя (слово «фтор» переводится на русский язык как «разрушительный»). А его «близкий родственник» — иод — используется в медицине в виде спиртового раствора для обработки ран.
Инертные газы
Инертные газы, расположенные в последней, восьмой группе главной подгруппе (VIIIA) — элементы с полностью заполненным внешним электронным уровнем. Они практически не способны участвовать в реакциях. Поэтому их иногда называют «благородными», проводя параллель с представителями высшего общества, которые брезгуют контактировать с посторонними.
У инертных газов есть удивительная способность: они светятся под действием электромагнитного излучения, поэтому используются для создания ламп. Так, неон используется для создания светящихся вывесок и реклам, а ксенон — в автомобильных фарах и фотовспышках.
Гелий обладает массой всего в два раза больше массы молекулы водорода, но, в отличие от последнего, не взрывоопасен и используется для заполнения воздушных шаров.
У нас вы сможете учиться в удобном темпе, делать упор на любимые предметы и общаться со сверстниками по всему миру.

Интересное по рубрике
Найдите необходимую статью по тегам
Подпишитесь на нашу рассылку
Мы в инстаграм
Домашняя онлайн-школа
Помогаем ученикам 5–11 классов получать качественные знания в любой точке мира, совмещать учёбу со спортом и творчеством

Рекомендуем прочитать
Реальный опыт семейного обучения
Звонок по России бесплатный
Пишите нам письма
Посмотреть на карте
Если вы не нашли ответ на свой вопрос на нашем сайте, включая раздел «Вопросы и ответы», закажите обратный звонок. Мы скоро свяжемся с вами.
Источник
Ученик
(128),
закрыт
10 лет назад
Дополнен 10 лет назад
Окей. Можно как-то узнать, сколько атомов? Или придется зубрить? Уточню: у меня скоро зачет просто. Учитель будет диктовать соли, а я буду писать. Допустим, она скажет – Фосфат чего-то там. Название эл-та я мейбе и смогу написать, но не индекс.
Янка
Мудрец
(18563)
10 лет назад
Начнем с того, что формула изначально написана неверно! Если хотели записать формулу фосфата натрия, то там 3 атома натрия: Na3PO4/
Если же хотели написать формулу гидрофосфата натрия, тогда где атом водорода? Na2HPO4/
Чтобы узнать, какой индекс должен стоять у элемента в формуле, нужно просто хорошо знать основность кислот (соответственно, будете знать заряд кислотного остатка. Соляная кислота – 1-основная. Это значит, что заряд кислотного остатка = -1, а значит он соединяется только с 1-валентным металлом. Если металл 2-х валентный, то этот металл присоединит 2 кислотных остатка от одноосновной кислоты. Если кислота 2-основная, например, серная кислота H2SO4, то кислотный остаток имеет заряд = -2 . (SO4)-2 Если кислотный остаток требует или 2 1-валентных металла, или 1 2-х валентный металл.
В любом случае нужно помнить, что молекула всегда ЭЛЕКТРОНЕЙТРАЛЬНА! т. е. сколько положительно заряженных частиц в составе молекул, столько же должно быть и отрицательно заряженных частиц.
Когда металл 2- валентен, а кислотный остаток от 3-х основной кислоты, то индекс у металла, умноженный на заряд металла = произведению заряда кислотного остатка на индекс у этого остатка.
Например, Ca3(PO4)2 Считаем: кальция (+2)*3 = +6 Кислотный остаток фосфорной кислоты имеет заряд = -3. (-3)*2= -6. Видите? 6 положительно заряженных частиц = 6 отрицательно заряженных частиц.
Удачи!
Урок 6. Валентность
В уроке 6 «Валентность» из курса «Химия для чайников» дадим определение валентности, научимся ее определять; рассмотрим элементы с постоянной и переменной валентностью, кроме того научимся составлять химические формулы по валентности. Напоминаю, что в прошлом уроке «Химическая формула» мы дали определение химическим формулам и их индексам, а также выяснили различия химических формул веществ молекулярного и немолекулярного строения.
Вы уже знаете, что в химических соединениях атомы разных элементов находятся в определенных числовых соотношениях. От чего зависят эти соотношения?
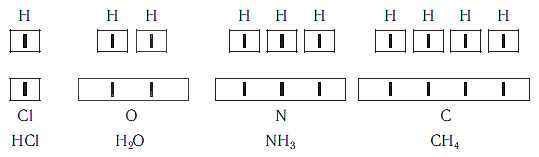
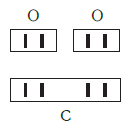
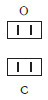
Рассмотрим химические формулы нескольких соединений водорода с атомами других элементов:
Нетрудно заметить, что атом хлора связан с одним атомом водорода, атом кислорода — с двумя, атом азота — с тремя, а атом углерода — с четырьмя атомами водорода. В то же время в молекуле углекислого газа СО2 атом углерода связан с двумя атомами кислорода. Из этих примеров видно, что атомы обладают разной способностью соединяться с другими атомами. Такая способность атомов выражается с помощью численной характеристики, называемой валентностью.
Валентность — численная характеристика способности атомов данного элемента соединяться с другими атомами.
Поскольку один атом водорода может соединиться только с одним атомом другого элемента, валентность атома водорода принята равной единице. Иначе говорят, что атом водорода обладает одной единицей валентности, т. е. он одновалентен.
Валентность атома какого-либо другого элемента равна числу соединившихся с ним атомов водорода. Поэтому в молекуле HCl у атома хлора валентность равна единице, а в молекуле H2O у атома кислорода валентность равна двум. По той же причине в молекуле NH3 валентность атома азота равна трем, а в молекуле CH4 валентность атома углерода равна четырем. Если условно обозначить единицу валентности черточкой |, вышесказанное можно изобразить схематически:
Следовательно, валентность атома любого элемента есть число, которое показывает, со сколькими атомами одновалентного элемента связан данный атом в химическом соединении.
Численные значения валентности обозначают римскими цифрами над символами химических элементов:
Определение валентности
Однако водород образует соединения далеко не со всеми элементами, а вот кислородные соединения есть почти у всех элементов. И во всех таких соединениях атомы кислорода проявляют валентность, равную двум. Зная это, можно определять валентности атомов других элементов в их бинарных соединениях с кислородом. (Бинарными называются соединения, состоящие из атомов двух химических элементов.)
Чтобы это сделать, необходимо соблюдать простое правило: в химической формуле вещества суммарные числа единиц валентности атомов каждого элемента должны быть одинаковыми.
Так, в молекуле воды H2O общее число единиц валентности двух атомов водорода равно произведению валентности одного атома на соответствующий числовой индекс в формуле:
Так же определяют число единиц валентности атома кислорода:
По величине валентности атомов одного элемента можно определить валентность атомов другого элемента. Например, определим валентность атома углерода в молекуле углекислого газа СО2:
Согласно вышеприведенному правилу х ·1 = II · 2 , откуда х = IV .
Существует и другое соединение углерода с кислородом — угарный газ СО, в молекуле которого атом углерода соединен только с одним атомом кислорода:
В этом веществе валентность углерода равна II , так как х ·1 = II · 1 , откуда х = II :
Постоянная и переменная валентность
Как видим, углерод соединяется с разным числом атомов кислорода, т. е. имеет переменную валентность. У большинства элементов валентность — величина переменная. Только у водорода, кислорода и еще нескольких элементов она постоянна (см. таблицу).
Составление химических формул по валентности
Зная валентность элементов, можно составлять формулы их бинарных соединений. Например, необходимо записать формулу кислородного соединения хлора, в котором валентность хлора равна семи. Порядок действий здесь таков.
Еще один пример. Составим формулу соединения кремния с азотом, если валентность кремния равна IV , а азота — III .
Записываем рядом символы элементов в следующем виде:
Затем находим НОК валентностей обоих элементов. Оно равно 12 ( IV·III ).
Определяем индексы каждого элемента:
Записываем формулу соединения: Si3N4.
В дальнейшем при составлении формул веществ не обязательно указывать цифрами значения валентностей, а необходимые несложные вычисления можно выполнять в уме.
Краткие выводы урока:
- Численной характеристикой способности атомов данного элемента соединяться с другими атомами является валентность.
- Валентность водорода постоянна и равна единице. Валентность кислорода также постоянна и равна двум.
- Валентность большинства остальных элементов не является постоянной. Ее можно определить по формулам их бинарных соединений с водородом или кислородом.
Надеюсь урок 6 «Валентность» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Коэффициенты и индексы в химических уравнениях
По коэффициенту можно узнать, сколько всего молекул или атомов принимают участие в реакции. Индекс показывает, сколько атомов входит в молекулу. Уравнением реакции называется запись химического процесса с помощью химических формул и математических знаков.
В такой науке, как химия, такая запись называется схемой реакции. Если возникает знак «=», то называется «уравнение». Давайте расставлять коэффициенты. В Са одна частица, так как коэффициент не стоит. Индекс здесь тоже не написан, значит, единица. Справа уравнения Са тоже один. По Са нам не надо работать. Смотрим следующий элемент. Это кислород.
Индекс говорит о том, что здесь две частицы кислорода, а справа без индексов. То есть слева 2 молекулы, а с правой одна молекула. Что делаем? Никаких дополнительных индексов или исправлений в химическую формулу вносить нельзя, так как она написана правильно.
Коэффициенты
Коэффициенты – это то, что написано перед молекулами. Они уже имеют право меняться. Для удобства саму формулу не переписываем. Справа 1 умножаем на 2, чтобы получить и там 2 частицы кислорода.
После того как мы поставили коэффициент, получилось две частицы кальция. Слева же только одна. Значит, теперь перед кальцием мы должны поставить 2.
Теперь проверяем итог. Если количество молекул элементов равно с обеих сторон, то можем поставить знак «равно».
Следующий пример.
2 водорода слева, и после стрелочки у нас тоже 2 водорода. Смотрим дальше. Два кислорода до стрелочки, а после стрелочки индексов нет, значит, 1 атом. Слева больше, а справа меньше. Выходим из положения и ставим коэффициент 2 перед водой.
Умножили всю формулу на 2, и теперь у нас изменилось количество водорода. Умножаем индекс на коэффициент, и получается 4. А с левой стороны осталось две частицы водорода. Вот чтобы получить 4, мы должны водород умножить на 2.
Проверяем. Если везде одинаково, то ставим «равно».
Последний пример в элементарных реакциях.
Вот как раз случай, когда элемент в одной и в другой формуле с одной стороны до стрелочки. 1 атом серы слева и один — справа. Два атома кислорода да еще плюс два кислорода.
- с левой стороны 4 кислорода;
- с правой же стороны находится 3 кислорода;
То есть с одной стороны получается четное число атомов, а с другой — нечетное. Если же мы умножим нечетное в два раза, то получим четное число. Доводим сначала до четного значения. То есть сначала умножаем на 2 всю формулу после стрелочки. После умножения получаем 6 атомов кислорода, да еще и два атома серы. С левой же стороны имеем 1 атом серы. Уравниваем теперь серу. Ставим с левой стороны уравнения перед серой 2.
Реакция нейтрализации
Второй пример более сложный, так как здесь больше элементов вещества.
Эта реакция называется реакцией нейтрализации. Что здесь надо уравнивать в первую очередь?
- с левой стороны 1 атом натрия;
- с правой же стороны индекс говорит о том, что здесь два атома натрия;
Напрашивается вывод, что надо умножить всю формулу на два.
Теперь дальше смотрим, сколько есть серы. С левой и правой стороны по 1 атому серы. Дальше смотрим на кислород. С левой стороны мы имеем 6 атомов кислорода. С другой стороны – 5. Меньше справа, больше слева. Нечетное количество надо довести до четного значения. Для этого формулу воды умножаем на 2, то есть из одного атома кислорода делаем два.
Теперь с правой стороны уже 6 атомов кислорода. С левой стороны тоже 6. Кислород уравнен. Проверяем водород. Два водорода и еще два водорода будет 4 водорода с левой стороны. Смотрим с другой стороны. Здесь также 4 водорода. Все элементы уравнены. Ставим знак «равно».
Следующий пример:
Он интересен тем, что появились скобки. Скобки говорят о том, что если множитель стоит за скобкой, то каждый элемент, стоящий в скобках, умножается на этот множитель. Здесь надо начать с азота, так как его меньше, чем кислорода и водорода. Слева азот 1, а справа, с учетом скобок, его два.
Справа же 2 атома водорода, а нужно 4. Мы просто выходим из положения и умножаем воду на 2, в результате чего получили 4 водорода. Отлично, водород уравняли. Если все элементы не уравнены, нельзя сказать что-то однозначно. Остался не уравненным кислород. До реакции присутствует 8 атомов кислорода, после – тоже 8.
Отлично, все элементы уравнены, можем ставить «равно».
Смотрим барий. Барий уравнен, его трогать не нужно. До реакции присутствуют два хлора, после — всего 1. Что же нужно сделать? Поставить 2 перед хлором после реакции.
Теперь за счет коэффициента, который только что поставили, после реакции два натрия, до реакции его тоже 2. Отлично, все остальное уравнено.
Видео
Из этого видео вы узнаете, как правильно расставлять коэффициенты в химических уравнениях.
Написание формулы по валентности
Валентность — способность атома присоединять то или иное число других атомов с образованием химической связи (см. «Что такое валентность»).
Для того, чтобы выводить химические формулы веществ по валентности элементов, необходимо знать, как минимум, валентности наиболее часто встречающихся элементов.
Алгоритм написания химической формулы вещества по валентности элементов, входящих в него:
- записать химические знаки элементов, входящих в вещество;
- определить валентность этих элементов;
- найти наименьшее общее кратное для валентностей этих элементов;
- определить индексы для атомов.
Составление формулы оксидов по валентности элементов
В качестве примера составим формулу оксида железа (III).
- В оксид железа входят железо и кислород: Fe O;
- Указываем валентность этих элементов: Fe III O II ;
- Находим наименьшее общее кратное (НОК): 3·2=6;
- Делим НОК на число единиц валентности каждого элемента:
- для Fe — 6:3=2;
- для O — 6:2=3.
- Записываем полученные индексы справа внизу от элемента: Fe2O3.
Составление формулы оснований
Важный нюанс, который неободимо знать — группы атомов могут рассматриваться, как единое целое.
Составление формул оснований по валентности элементов отличается от составления формулы оксидов лишь тем, что вместо атома кислорода в формуле стоит гидроксогруппа OH. В случае, если гидроксогруппа в формуле повторяется несколько раз, она берется в скобки.
В качестве примера составим составим формулу гидроксида магния.
На первом месте в основаниях стоит атом металла, гидроксогруппа — на втором.
Составление формулы солей
В солях «роль» гидроксогруппы OH играют кислотные остатки.
На первом месте в формуле средней соли стоит атом(ы) металла, кислотный остаток — на втором.
В качестве примера составим формулу соли фосфата натрия.
Составление формулы кислот
На первом месте в формуле кислот стоит атом(ы) водорода, кислотный остаток — на втором.
В качестве примера составим формулу серной кислоты.
Потренируемся в решении обратной задачи, когда по готовой формуле надо определить валентность элементов.
Определение валентности по готовой формуле
«Фишка» решения подобных задач заключается в том, что некоторые химические элементы в любых соединениях, в которые они входят, имеют постоянную валентность.
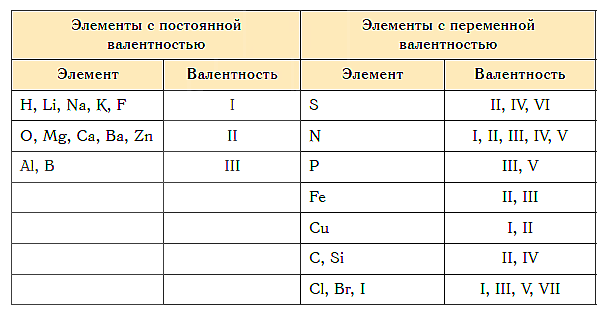
Элементы с постоянной валентностью:
- валентность I: H, F, Li, Na, K, Rb, Cs
- валентность II: O, Mg, Ca, Sr, Ba, Zn
- валентность III: Al
Большинство элементов в различных соединениях могут принимать различную валентность,, т. е., образовывать различное число химических связей.
Для нахождения валентности элементов с переменной валентностью в том или ином соединении используют правило валентности.
| x·m=y·n |
| в бинарных соединениях типа AmBn произведение валнетности элемента A(x) на кол-во его атомов m равно произведению валентности элемента B(y) на число его атомов n |
Определим, используя правило валентности, валентность фософра в соединении P2O5.
Поскольку валентность кислорода равна II, то:
Теперь решим ту же задачу, используя алгоритм, описанный выше для выведения формулы по валентности, который будем применять «сзади-наперёд».
Определим валентность фосфора и кислорода в соединении P2O5.
- P2O5
- валентность кислорода равна двум: P2O5 II
- общее число единиц валентности всех атомов вещества будет равно 2·5=10
- делим общее число единиц валентности (10) на индекс кислорода, валентность которого известна: 10:2=5 — это и будет валентность неизвестного, в нашем случае, фосфора
- P2 V O5 II
Немного усложним задачу и определим валентность элементов в соли кислородсодержащей кислоты Al2(SO4)3.
- решение задачи начинается с элемента с известной валентностью, т. е., с кислорода — определяем кол-во его атомов: 4·3=12
- с учётом того, что валентность кислорода равна 2, находим общее число единиц валентности для кислорода: 12·2=24
- по аналогии вычисляем общее число единиц валентности для атомов алюминия (валентность=3): 2·3=6
- от общего числа единиц валентности кислорода вычитаем общее число единиц валентности алюминия: 24-6=18 — это общее число единиц валентности, которое будет приходиться на серу
- по аналогии с кислородом определяем число атомов серы, валентность которой неизвестна: 1·3=3
- чтобы узнать валентность серы следует разделить разность, найденную в п.4, на число атомов серы: 18:3=6
- Al2 III (S VI O4 II )3
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
источники:
http://liveposts.ru/articles/education-articles/himiya/koeffitsienty-i-indeksy-v-himicheskih-uravneniyah
http://prosto-o-slognom.ru/chimia_primery/001-valentnost.html
В уроке 5 «Химическая формула» из курса «Химия для чайников» дадим определение химическим формулам и их индексам, а также выясним различия химических формул веществ молекулярного и немолекулярного строения. Напоминаю, что в прошлом уроке «Сложные вещества» мы дали определение химическим соединениям, рассмотрели различия органических и неорганических соединений, а также выяснили, что означает качественный и количественный состав.
Состав любого вещества выражается в виде химической формулы.
Химическая формула — это условная запись состава вещества с помощью химических знаков и индексов.
Качественный состав показывается с помощью знаков (символов) химических элементов, а количественный — с помощью индексов, которые записываются справа и чуть ниже знаков химических элементов.
Индекс — число атомов данного химического элемента в формуле вещества.
Например, химическая формула простого вещества водорода записывается так:
и читается «аш-два».
Химические формулы веществ молекулярного строения
Формулы двухатомных молекул: кислорода — О2 («о-два»), хлора — Сl2 («хлор-два»), азота — N2 («эн-два»). Трехатомная молекула озона и восьмиатомная молекула серы обозначаются формулами О3 («о-три») и S8 («эс-восемь»).
Формулы молекул сложных веществ также отображают их качественный и количественный состав. Например, формула воды, как вы уже, наверное, хорошо знаете, Н2О («аш-два-о»), метана — СН4 («це-аш-четыре»), а аммиака — NH3 («эн-аш-три»). Точно так же читаются формулы любых сложных веществ. Например, формула серной кислоты — H2SO4 («аш-два-эс-о-четыре»), а глюкозы — C6H12O6 («це-шесть-аш-двенадцать-о-шесть»).
Химические формулы веществ молекулярного строения (их называют молекулярными формулами) показывают состав элементарных частей, т. е. условных «кирпичиков», из которых состоят эти вещества. Такими элементарными составными частями (элементарными структурными единицами, или просто структурными единицами) в данном случае являются молекулы.
Химические формулы веществ немолекулярного строения
А если вещество имеет немолекулярное строение? Химические формулы простых веществ такого типа (например, металлов) записывают просто знаками соответствующих элементов без индексов (или, вернее, с индексом, равным единице, которая не записывается). Так, формула простого вещества железа — Fe, меди — Cu, алюминия — Al.
Состав сложных веществ немолекулярного строения выражают с помощью формул, которые показывают простейшее соотношение чисел атомов разных химических элементов в этих веществах. Такие формулы называются простейшими. Например, простейшая формула кварца — главной составной части речного песка — SiO2. Она показывает, что в кристалле кварца на один атом кремния приходятся два атома кислорода, т. е. простейшее соотношение чисел атомов кремния и кислорода в этом веществе равно 1:2. Простейшая формула Al2O3 показывает, что в этом соединении простейшее соотношение между числами атомов алюминия и кислорода равно 2:3.
Группа атомов, состав которой соответствует простейшей формуле вещества немолекулярного строения, называется его формульной единицей.
Формульная единица, поваренной соли NaCl («натрий-хлор») — группа из одного атома натрия и одного атома хлора. Формульная единица мела CaCO3 («кальций-це-о-три») — группа из одного атома кальция, одного атома углерода и трех атомов кислорода.
Формулы более сложных соединений немолекулярного строения читаются аналогично. Дополнительно указывается только число групп атомов, заключенных в круглые скобки: Al2(SO4)3 («алюминий-два-эс-о-четыре-трижды»), Mg(NO3)2 («магний-эн-о-три-дважды») и т. д.
Таким образом, структурными единицами веществ молекулярного строения являются молекулы. Структурными единицами веществ немолекулярного строения являются их формульные единицы.
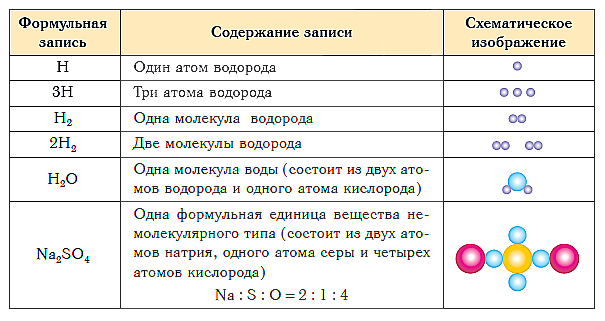
В таблице ниже показаны формульная запись и схематическое изображение состава веществ различного типа.
Краткие выводы урока:
- Качественный и количественный состав вещества выражается с помощью химических формул.
- Химическая формула вещества молекулярного строения показывает состав его молекулы, которая является элементарной структурной единицей данного вещества.
- Химическая формула вещества немолекулярного строения показывает простейшее соотношение атомов в его формульной единице.
Надеюсь урок 5 «Химическая формула» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
Напомню, что в одной из предыдущих частей мы ввели такие понятия как металлические и неметаллические свойства, теперь же пришло время научится отличать металлы от неметаллов по таблице Менделеева.
Многие из Вас, столкнувшись с данным вопросом, могут справедливо заметить, дескать: “Ха, вот глупости. Автор не от мира сего, ведь металлы и неметаллы в таблице Менделеева отмечены разным цветом! Как сейчас помню таблицу Менделеева в учебнике, где неметаллы отмечены красным цветом, а металлы – чёрным и зелёным. Шах и мат.”
Это всё замечательно, отвечу я, да только учащиеся, что приходят на экзамен по химии, получают чёрно-белый вариант таблицы Менделеева и Ваше возможное замечание окажется неуместно.
И прежде чем мы всё-таки ответим на поставленный вопрос, нам необходимо освоить несколько базовых химических понятий, касающихся работы с таблицей Менделеева. Дело в том, что помимо довольно однозначно определяемых периодов и групп, в таблице Менделеева есть место так же и для, так называемым, подгрупп.
С сегодняшнего дня мы начнём различать главную подгруппу (или подгруппу А) и побочную подгруппу (или подгруппу В).
Как же определить к какой подгруппе относится тот или иной химический элемент?
На отношение к той или иной подгруппе химического элемента нам могут указать следующие знаки:
Во-первых, нередко в шапочке, где указан номер группы, к которому относится столбец, есть указание и на подгруппы:
Во-вторых, само положение химического символа химического элемента в ячейке указывает на отношение к подгруппе. Так, если химический символ химического элемента смещён относительно центра ячейки влево, то мы имеем дело с элементом главной подгруппы (подгруппы А), если же вправо – то побочной подгруппы (подгруппы В)
Например, в совершенно случайной чёрно-белой таблице Менделеева мы видим, что фосфор относительно центра ячейки смещён влево, это значит, что фосфор – элемент главной подгруппы (подгруппы А) пятой группы.
Как понятие о подгруппах поможет нам отличать металлы от неметаллов?
А вот как: дело в том, что все элементы побочных подгрупп – это металлы!
А через элементы главных подгрупп мы можем провести одну особенную диагональ, которая “отсечёт” металлы от неметаллов.
Данная диагональ проходит через такие неметаллы, как бор (B) – кремний (Si) – мышьяк (As) – теллур (Te) – астат (As).
Таким образом все элементы главных подгрупп, что лежат ниже и левее данной диагонали являются металлами, а все, что лежат выше и правее – неметаллами.
Однако нельзя не заметить, что деление на металлы (Ме) и неметаллы (неМе) всё же несколько условно, а некоторые таблицы, Менделеева, которые Вы можете найти в сети, игнорируют указанные мной правила работы с подгруппами.
В следующей части мы выделим закономерности, согласно которым металлические и неметаллические свойства изменяются в пределах рассматриваемой Периодической системы Менделеева и разберёмся, какое отношение к этому имеет атомный радиус. А на этом у меня всё.
Спасибо. Пока.




.jpg)

.jpg)

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)