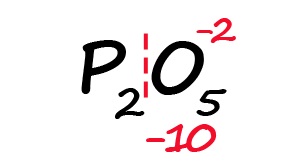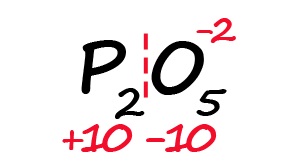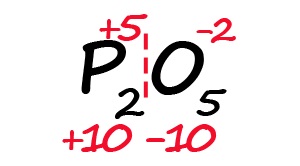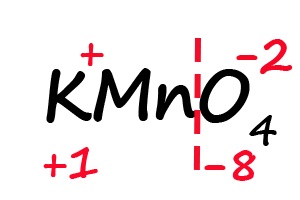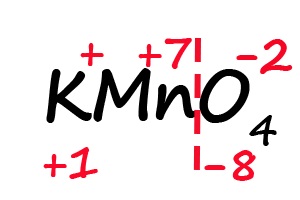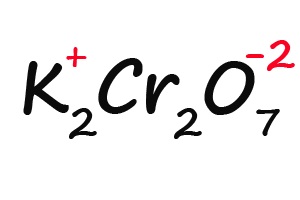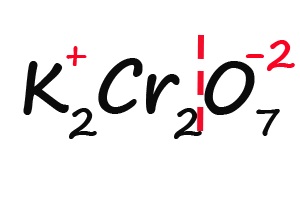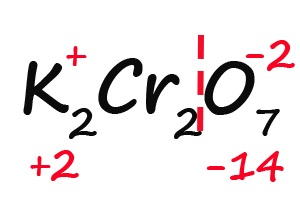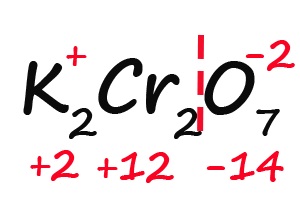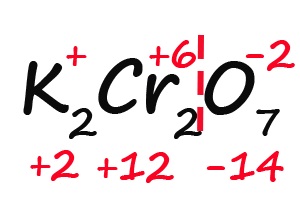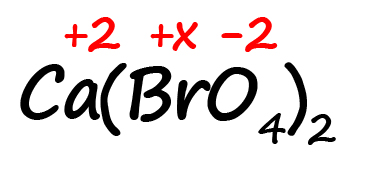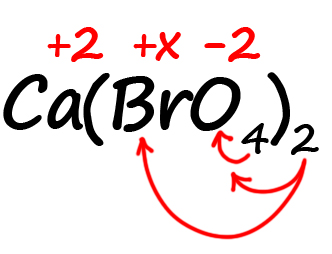Как определить степень окисления
Материал по химии
Что такое степень окисления?
Степень окисления – это условная величина, отражающая количество принятых или отданных электронов при образовании заряженной частицы из электронейтрального атома при условии, что электроны переходят от одного атома к другому полностью.
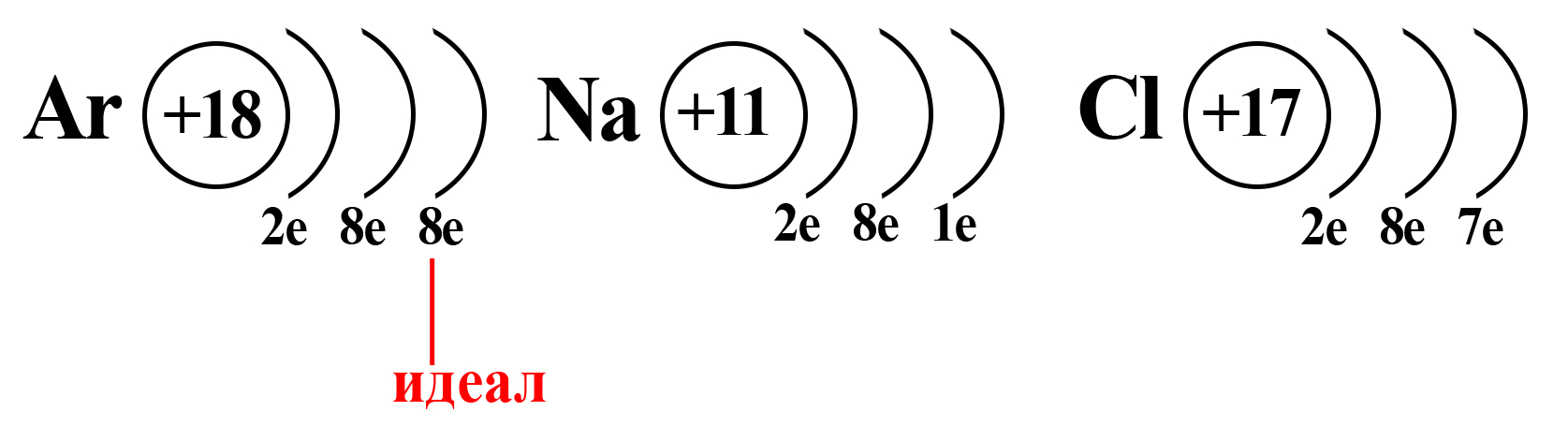
Вспомним, что идеальное количество электронов на внешнем электронном уровне атома равно восьми. Такую конфигурацию внешнего слоя имеют атомы большинства благородных газов (кроме гелия). И к такой электронной конфигурации стремятся атомы других элементов.
Как определить степень окисления
Конфигурация благородного газа
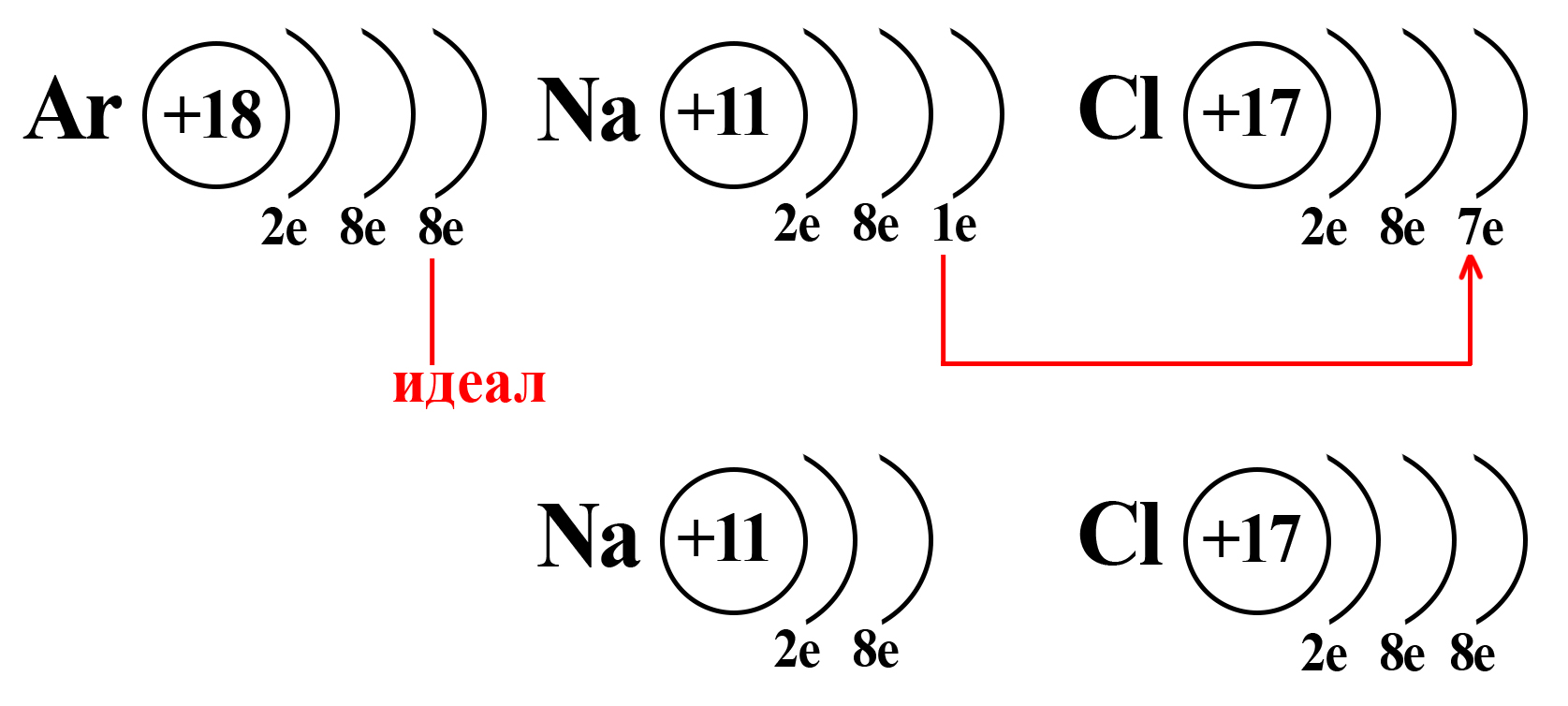
Натрий и хлор не так далеки от «идеала», как может показаться. Если атомы этих элементов столкнуться, внешний электрон натрия притянется на внешний электронный уровень хлора (из-за большей электроотрицательности хлора):
Таким образом, натрий и хлор как будто вступают в симбиоз: натрию, для приобретения «благородной» конфигурации необходимо избавиться от внешнего электрона (при потере внешнего электрона теряется и внешний уровень, а предвнешний уровень, имеющий идеальное количество электронов, становится внешним), тогда как хлору необходимо получить один электрон, чтобы завершить внешний энергетический уровень.
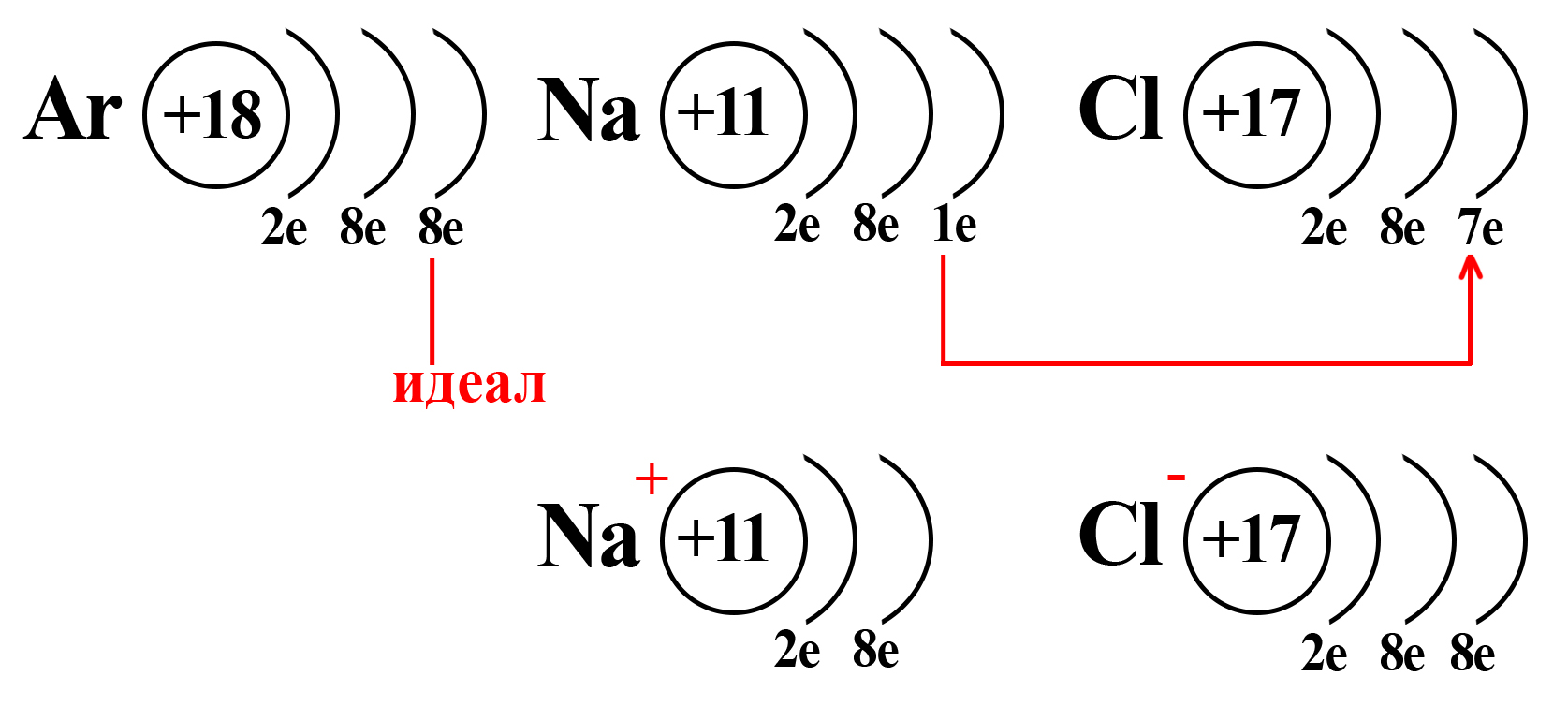
Потеряв один электрон, натрий приобретает положительный заряд, становится катионом (положительно заряженной частицей). Это объясняется тем, что ядро натрия по-прежнему имеет 11 протонов, а вот электронная оболочка, после взаимодействия с хлором, содержит 10 электронов. Таким образом, натрий будет иметь 11 положительно заряженных частиц и 10 отрицательно заряженных частиц. По простейшему уравнению: +11 – 10 = +1, становится ясно, откуда взялся положительный заряд.
Аналогичный расчет можно привести и для хлора. После взаимодействия с натрием ядро атома хлора не изменяется, оно содержит 17 положительно заряженных частиц (протонов), а оболочка – 18 отрицательно заряженных частиц (электронов). +17 – 18 = ‒1.
Полученные заряды и являются степенями окисления.
Также степень окисления можно выразить количеством электронов, которые иону нужно получить или отдать для того, чтобы стать электронейтральным атомом. Так, катион натрия, имеющий заряд «+1», должен получить 1 электрон, чтобы превратиться в атом натрия: Na+ +1ē = Na0. А анион хлора (хлорид-ион), имеющий заряд «‒1» должен отдать один электрон: Cl– -1ē = Cl0.
Для упрощения понятие «степень окисления» применяется не только для веществ с ионным строением (металл + неметалл), но и для веществ с ковалентными полярными связями. Несмотря на то, что в таком типе связи полного перехода электронов от одного атома к другому не происходит, полученные частичные заряды превращаются в целые.
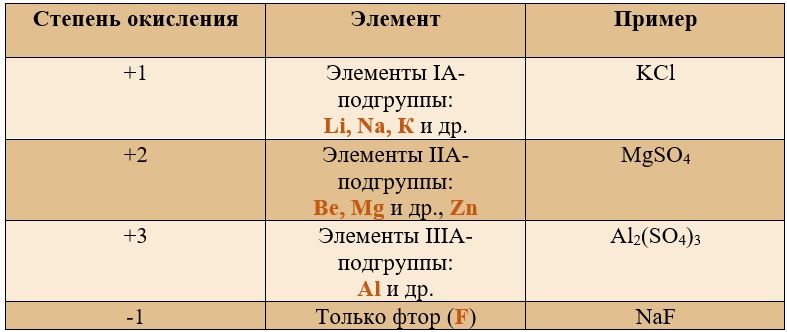
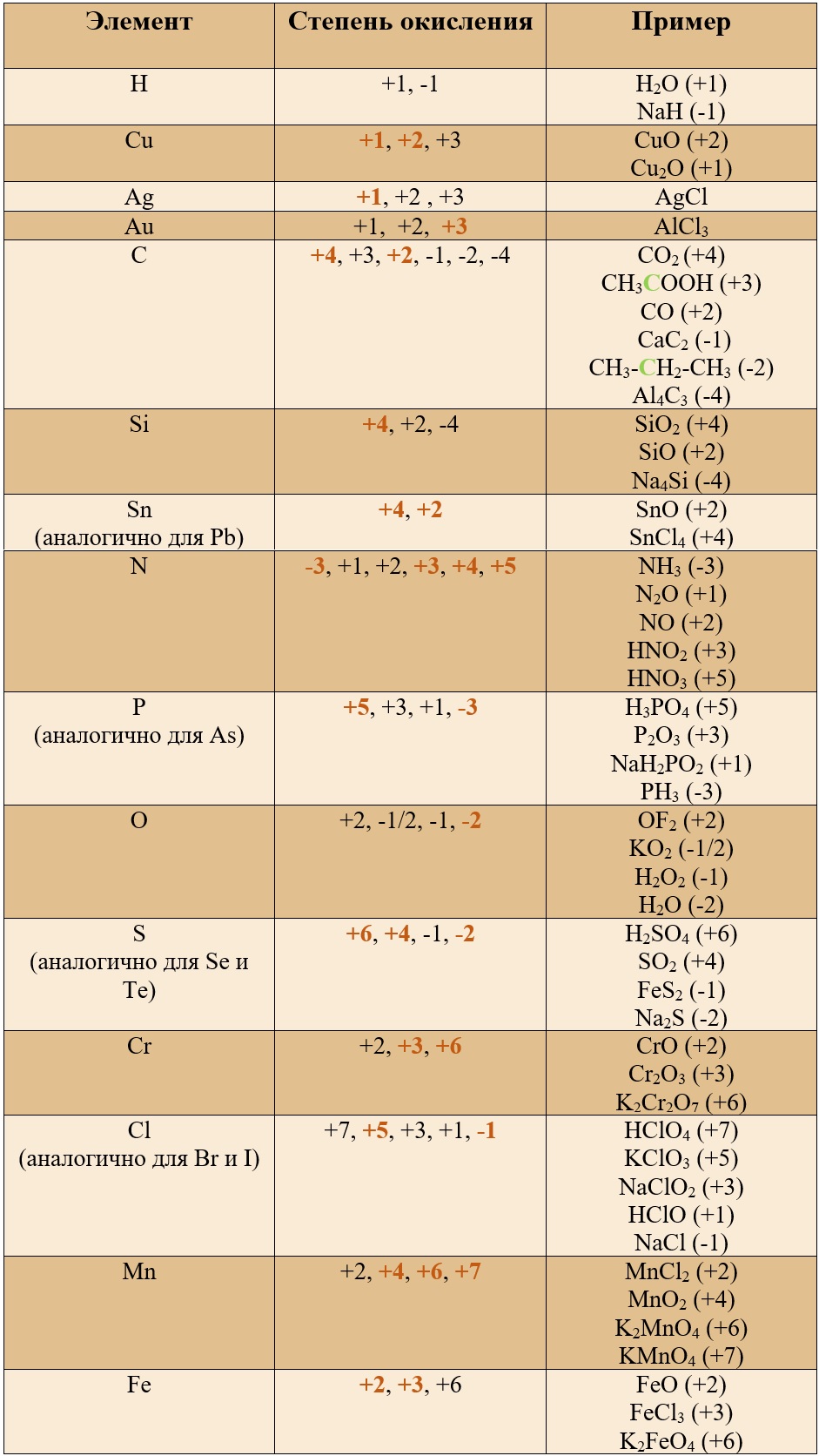
Постоянные степени окисления.
Знания этой простой, базовой темы помогут Вам решать не только тестовые задания. Одно из самых сложных заданий ЕГЭ – расстановка коэффициентов с помощью электронного баланса – не решается без знания степеней окисления.
Таблица «Элементы, имеющие постоянную степень окисления»
Таблица «Наиболее популярные степени окисления у остальных элементов» (Выделены бурым)*
*В таблице указаны не все возможные степени окисления.
Таким образом, медь, серебро, золото и железо не проявляют высшей степени окисления, равной номеру группы, у остальных же элементов высшая степень окисления равна номеру группы.
Для определения степени окисления не нужно учить всю таблицу, и тем более все степени окисления. Они приведены для справки, наиболее важными являются:
Определение степеней окисления в бинарных соединениях
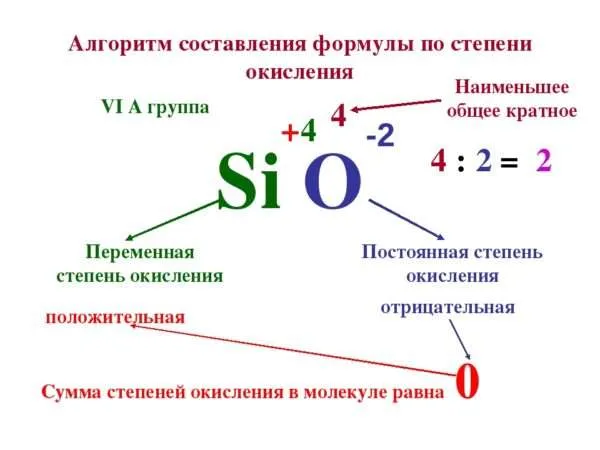
Для примера возьмём оксид фосфора (P2O5)
- Определим степень окисления известного элемента (в нашем случае это кислород).
- Условно разделим молекулу на две части: чаще всего первая часть молекулы положительная, а вторая – отрицательная (искл: NH3 и PH3).
- Индекс после кислорода указывает на, что в молекуле содержится пять атомов кислорода, каждый из них имеет степень окисления «-2», поэтому общее количество отрицательных зарядов будет равно «-10».
- Молекула должна быть электронейтральной, то есть количество положительных и отрицательных зарядов должны быть равными. Из этого следует, что все атомы фосфора в данной молекуле в сумме должны иметь десять положительных зарядов.
- Индекс «2» после фосфора означает, что в молекуле содержится два атома фосфора, между которыми поровну нужно разделить общий положительный заряд (+10:2=+5)
Аналогичным образом происходит определение степени окисления в более сложных веществах, для примера возьмём перманганат калия (KMnO4):
- Подпишем степени окисления для элементов, имеющих постоянные их значения:
- Разделим молекулу на положительный и отрицательный «полюс» (в соединениях, состоящих из атомов трех элементов, чаще всего первые два являются положительными, а третий – отрицательным).
- Посчитаем общее количество положительных и отрицательных зарядов с учетом индексов:
- Ответим на вопрос: какого количества плюсов не хватает, что бы положительные и отрицательные заряды имели одинаковое значение? До +8 не хватает семи положительных зарядов, откуда следует, что степень окисления марганца равна «+7».
Ну и напоследок разберем степени окисления элементов в дихромате калия (K2Cr2O7):
- Подписываем известные степени окисления:
- Делим молекулу на положительную и отрицательную части:
- Считаем общее количество «плюсов» и «минусов»:
- Подсчитываем, сколько положительных зарядов не достает для того, чтобы молекула стала электронейтральной (т. е. такой молекулой, в которой количество положительных и отрицательных зарядов было одинаковым):
- Так как молекула содержит два атома хрома, двенадцать положительных зарядов должны распределиться между ними поровну, то есть, каждый хром имеет заряд +6:
Как быть, если в формуле встретились скобки? Например, как посчитать степень окисления брома в пербромате кальция?
- Для начала определим все известные степени окисления, как делали в предыдущих примерах:
- Посчитаем сумму положительных и отрицательных зарядов. Важно учесть все индексы. Помните, что индекс. Расположенный за атомом действует только на этот атом, а индекс, расположенный за скобкой, действует на всё содержимое скобок:
Таким образом, в пербромате кальция содержится: один атом кальция, два атома брома и 8 атомов кислорода (индексы, относящиеся к одному и тому же атому перемножаются).
Следовательно, мы имеем два положительных заряда от кальция и шестнадцать отрицательных от кислорода. Так как индекс «2» за скобками действует и на бром, его заряд можно выразить как 2х.
Получаем уравнение:
2 + 2х ‒ 16 = 0
2х = 14
х = 7
Степень окисления брома в пербромате кальция равна «+7».
Просмотров 8.5к. Опубликовано 04.09.2022
Простые вещества, такие как Cl2и О2 в этом случае не происходит сдвига электронов и степень окисления равна нулю.
Качественная характеристика окислительно-восстановительных реакций
Окислительно-восстановительные реакции являются наиболее распространенными химическими реакциями в природе. К ним относятся, например, фотосинтез, метаболизм и биологические процессы, а также сжигание топлива, производство металлов и многие другие реакции.
Реакции восстановления давно и успешно используются человечеством для самых разных целей, но сама теория электронов в окислительно-восстановительных процессах возникла совсем недавно, т.е. в начале 20 века.
Для того чтобы перейти к современной теории окислительно-восстановительных процессов, необходимо ввести различные понятия, такие как сила, степень окисления и структура электронной оболочки атома. Мы уже сталкивались с этими понятиями при изучении таких модулей, как периодический закон Менделеева, основные принципы атомной структуры элементов, химическая связь и молекулярная структура. Давайте теперь рассмотрим их более подробно.
Валентность
Живучесть — это сложное понятие, которое возникает с понятием химической связи и определяется как свойство атома соединяться с определенным количеством атомов другого элемента или вытеснять их, т.е. способность атома образовывать химические связи в соединении.
Изначально валентность определялась по водороду (считался как 1) или кислороду (валентность 2).
Впоследствии были выделены положительные и отрицательные значения. Количественно, положительная валентность — это число электронов, поставляемых атомом, а отрицательная валентность — это число электронов, которые должны быть присоединены к атому для выполнения правила октавы (т.е. для завершения внешнего энергетического уровня).
Совсем недавно в понятие жизненной силы стали включать природу химических связей, образующихся при объединении людей.
Как правило, наибольшая интенсивность данных соответствует номеру группы в периодической таблице.
Однако, как и во всех правилах, есть исключения.
Например, медь и золото находятся в первой группе периодической таблицы, и их интенсивность должна быть равна номеру группы, т.е. 1, тогда как на практике медь имеет максимальную интенсивность 2, а золото — 3.
Степень окисления
Степень окисления, иногда называемая окислительным числом, электрохимической валентностью или состоянием окисления, является относительным понятием.
Например, при расчете степеней окисления большинство соединений вообще не являются ионными, а молекулами считаются только ионы.
Количественно, степень окисления атомов элемента в соединении определяется числом электронов, присоединенных к атомам или смещенных с них.
Таким образом, если смещения электронов не происходит, степень окисления будет равна нулю, отрицательной — если электроны смещены в сторону конкретного атома, и положительной — если они смещены в сторону от конкретного атома.
Нахождение степени окисления химического вещества — простое занятие, требующее лишь внимания и знания основных правил и исключений. Для того чтобы разобраться в исключениях и использовать специальные таблицы, не требуется много времени.
Как расставлять и как определить степень окисления элементов
Атомы и молекулы играют важную роль в химических процессах, а их свойства определяют последствия химических реакций. Одним из важных свойств атомов является их число окисления. Это упрощает метод расчета переноса электронов на частицы. Как определить степень окисления или типичный заряд частицы и какие правила для этого нужно знать?
Все химические реакции происходят в результате взаимодействия атомов различных веществ. Свойства мелких частиц определяют процесс реакции и ее последствия.
Термин окисление в химии относится к реакции, в которой группа атомов или один из них теряет или приобретает электрон. В случае усиления реакция называется «восстановлением».
Состояние окисления — это количественная мера перераспределения электронов в реакции. Другими словами, в процессе окисления электроны внутри атома уменьшаются или увеличиваются и перераспределяются между другими взаимодействующими частицами, а степень окисления показывает, как именно они реорганизуются. Это понятие тесно связано с электроотрицательностью частиц, т.е. их способностью притягивать и отталкивать свободные ионы.
Это интересно! Что такое алканы: структура и химические свойства
Определение степени окисления зависит от свойств и характеристик каждого вещества, поэтому процесс расчета нельзя однозначно охарактеризовать как простой или сложный, но результаты помогают документировать процесс обычных окислительно-восстановительных реакций. Важно понимать, что результаты расчета являются следствием переноса электронов, не имеют физического смысла и не представляют фактический заряд ядра.
Важно знать! Обратите внимание, что в неорганической химии термин валентность часто используется вместо состояния окисления элемента, что не является ошибкой, но второй термин более распространен.
Понятия и правила расчета движения электронов лежат в основе классификации химических веществ (номенклатуры), описания их свойств и синтеза типов связей. Однако часто этот термин используется для описания и проведения окислительно-восстановительных реакций.
Правила определения степени окисления
Как узнать состояние окисления? Имея дело с окислительно-восстановительными реакциями, важно знать, что типичный заряд частицы всегда равен численно выраженному значению электрона. Эта специфика обусловлена предположением, что электронная пара, образующая связь, всегда полностью смещается к наиболее отрицательной частице. Если мы говорим об ионной связи, то следует понимать, что в случае реакций ковалентной связи электроны поровну распределяются между одними и теми же частицами.
Число окисления может иметь как положительное, так и отрицательное значение. Важно отметить, что во время реакции атомы должны стать нейтральными. Для этого необходимо добавить электрон, если ион положительный, или удалить его, если он отрицательный. Чтобы указать на это значение при записи типа, принято писать арабскую цифру с соответствующим символом над названием предмета. Например, или и т.д.
Следует отметить, что заряд металла всегда положительный и в большинстве случаев его можно определить с помощью таблицы Менделеева. Существует несколько характеристик, которые необходимо учитывать для правильного определения цены
Как определить степень окисления
- У простых элементов всегда равна нулю: или .
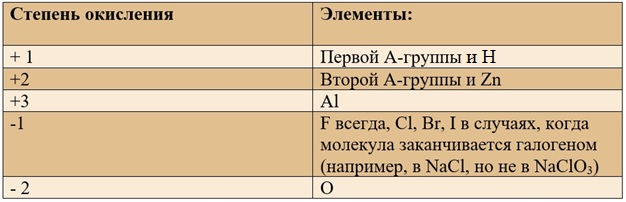
- У фтора всегда будет равна -1.
- Как и у металлов, у элементов из групп IA, IIA и IIIA групп всегда одинаковая – это номер группы, в которой они расположены.
- У кислорода в любой связи равна -2, кроме связей с пероксидами (Н2О2), когда значение равно -1 и оксидом фтора (O+2F2-1, O2+1F2-1), когда она равна +2.
- У водорода всегда +1, кроме его взаимодействия с гидридами (Na+H- и связями по типу C+4H4-1).
- У простого вещества без связей с другими элементами всегда равна нулю.
- У простого иона с одним атомом равна числу его электрона (Na+, Ca+2).
- Если рассматривается связь двух веществ различной природы (металл и неметалл), то отрицательное окислительное число будет наблюдаться у вещества, которое обладает большей электроотрицательностью (H+F-, Cu+Br-), а положительное, соответственно, у элемента с электроотрицательностью больше нуля.
- У щелочных металлов, таких как литий, натрий, калий и прочих, всегда +1.
- У металлов из главной подгруппы II (магний, барий, кальций и стронций) равна +2.
- У алюминия всегда одинаковое значение +3.
Запомнив эти свойства, очень легко определить номер окисления элемента, независимо от его атомной сложности или количества уровней.
Полезное видео: определение степени окисления
Регулярные таблицы Менделеева содержат практически всю информацию, необходимую для работы с химическими веществами. Например, студенты используют их только для описания химических реакций. Например, чтобы определить максимальные положительные и отрицательные числа окисления, им нужно проверить названия химических веществ в таблице.
- Максимально положительное – это номер группы, в которой находится элемент.
- Максимально отрицательная степень окисления – это разница между максимально положительной границей и числом 8.
Поэтому очень легко найти стандартные пределы погрузки для того или иного товара. Такие действия можно выполнить с помощью расчетов, основанных на таблице Менделеева.
Это важно знать! Элемент может одновременно иметь множество различных значений окисления.
Существует два основных способа определения уровня окисления. Примеры приведены ниже. Первый метод требует знания и умения применять химические законы. Как с помощью этого метода можно определить степень окисления?
Правила определения состояния окисления.
- Определить, является ли данное вещество элементарным и находится ли оно вне связи. Если да, то его окислительное число будет равно 0, независимо от состава вещества (отдельные атомы или многоуровневые атомные соединения).
- Определить, состоит ли рассматриваемое вещество из ионов. Если да, то степень оксидации будет равна их заряду.
- Если рассматриваемое вещество металл, то посмотреть на показатели других веществ в формуле и вычислить показания металла путем арифметических действий.
- Если все соединение имеет один заряд (по сути это сумма всех частиц представленных элементов), то достаточно определить показатели простых веществ, затем вычесть их от общей суммы и получить данные металла.
- Если связь нейтральная, то общая сумма должна быть равна нулю.
Это интересно! Курс химии: что такое галоген?
В качестве примера рассмотрим соединение ионов алюминия с общим зарядом, равным нулю. Правила химии подтверждают тот факт, что число окисления иона Cl равно -1, и в этом случае в соединении их три. Поэтому, чтобы нейтрализовать все соединение, ион al должен иметь значение +3.
Этот метод очень хорош тем, что, суммируя все уровни окисления вместе, всегда можно контролировать точность раствора.
Второй метод можно применять без знания химических законов.
- Найти данные частиц, по отношению к которым нет строгих правил и точное количество их электронов неизвестно (можно путем исключения).
- Выяснить показатели всех прочих частиц и после из общей суммы путем вычитания найти нужную частицу.
Рассмотрим второй метод на примере вещества Na2SO4, где отдельные S не определены.
Это интересно! Курс химии: катионы и анионы — что это такое?
Для того чтобы все степени окисления были одинаковыми, необходимо
- Найти известные элементы, помня о традиционных правилах и исключениях.
- Ион Na = +1, а каждый кислород = -2.
- Умножить количество частиц каждого вещества на их электроны и получить степени оксидации всех атомов, кроме одного.
- В Na2SO4 состоят 2 натрия и 4 кислорода, при умножении получается: 2 X +1 = 2 – это окислительное число всех частиц натрия и 4 X -2 = -8 – кислородов.
- Сложить полученные результаты 2+(-8) =-6 – это общий заряд соединения без частицы серы.
- Представить химическую запись в виде уравнения: сумма известных данных + неизвестное число = общий заряд.
- Na2SO4 представлено следующим образом: -6 + S = 0, S = 0 + 6, S = 6.
С ионом NH4 + ион, вид азотной нагрузки — x + (+1) x 4 = 1. Ясно, что x = -3, т.е. степень окисления азота равна -3.
Таблица окисления химических элементов
Таблицы химического окисления используются для определения состояния загрузки индивида в реакции окисления. В зависимости от качества индивида элемент может иметь положительное или отрицательное состояние окисления.
Что такое степень окисления
Элементарная нагрузка элемента в композитном материале называется его состоянием окисления. Величина нагрузки индивидуума регистрируется в окислительно-восстановительной реакции, чтобы понять, какие элементы восстанавливаются и какие окислители восстанавливаются.
Степень окисления связана с электричеством и указывает на способность человека принимать или отдавать электроны. Чем выше значение электронов, тем больше способность человека потреблять электроны в реакции.
Рисунок 1. Ряд электрических свойств.
Для состояния окисления существует три значения.
- нулевое – атом находится в состоянии покоя (все простые вещества имеют степень окисления 0);
- положительное – атом отдаёт электроны и является восстановителем (все металлы, некоторые неметаллы);
- отрицательное – атом принимает электроны и является окислителем (большинство неметаллов).
Например, степень окисления в реакции между натрием и хлором составляет
В реакциях с неметаллическими металлами металл всегда является восстановителем, а неметалл — окислителем.
Как определить
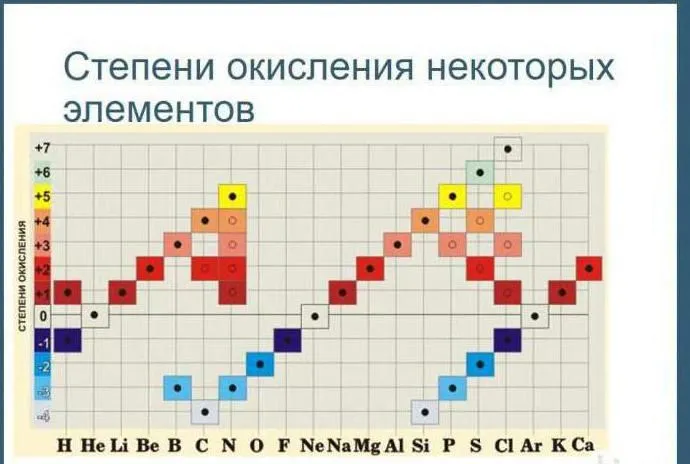
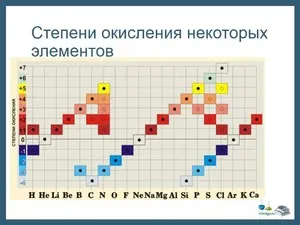
Существует таблица, показывающая все возможные состояния окисления элементов.
Состояние окисления
В качестве альтернативы используйте эту версию таблицы в уроке.
Рисунок 2.Таблица окисления.
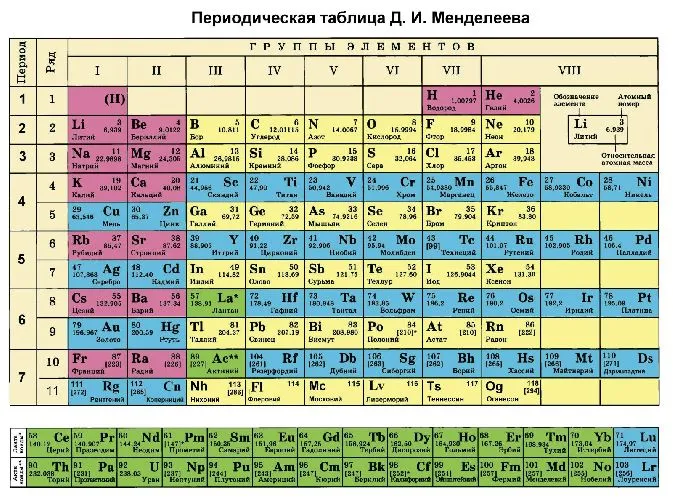
В качестве альтернативы, степень окисления химического элемента можно определить по периодической таблице Менделеева.
- высшая степень (максимально положительная) совпадает с номером группы;
- для определения минимального значения степени окисления из номера группы вычитается восемь.
Рисунок 3. Таблица Менделеева.
Большинство неметаллов имеют положительную и отрицательную степень окисления. Например, кремний относится к группе IV и имеет максимальную степень окисления +4 и минимальную -4. К неметаллическим соединениям (так3co2, sic) окислительные среды — это неметаллы с отрицательной степенью окисления или высшей электризуемостью. Например, в Союзе PCL3Фосфор имеет степень окисления +3, а хлор -1. Электроны фосфора составляют 2,19, а хлора — 3,16.
Второе правило не применяется к щелочным и щелочноземельным металлам, которые всегда имеют положительную степень окисления, равную номеру группы. Исключение составляют магний и бериллий (+1 и +2). Состояние окисления также является постоянным.
Другие металлы не имеют стабильного состояния окисления. В большинстве реакций они выступают в качестве восстановителей. В редких случаях это могут сделать окислители с отрицательной степенью окисления.
Фтор является сильнейшим окислителем. Его степень окисления всегда равна -1.
Для соединений определяется, состоят ли они из ионов. Для многоатомных ионов сумма всех степеней окисления равна их нагрузке. Найдите эту сумму из таблицы растворителей и приравняйте ее к известному числу окисления.
Как расставлять степень окисления в солях
Соль состоит из металла и одного или нескольких кислотных остатков. Метод определения такой же, как и для кислых кислот.
Металл, непосредственно образующий соль, находится в главной подгруппе, и его степень равна номеру группы. Это означает, что они всегда остаются стабильными.
В качестве примера рассмотрим расположение степеней окисления нитрата натрия. Соль образована элементами главной подгруппы в группе 1, поэтому ее степень окисления положительна и равна 1. В нитрате кислород имеет значение -2. Чтобы получить числовое значение, сначала строится уравнение с неизвестными, учитывающее все отрицательные и положительные значения, +1 +x-6 = 0. Решив уравнение, можно прийти к тому, что число положительное и равно + 5. Такова цена азота. Таблица является ключом к расчету степени окисления.
Сте́пень окисле́ния (окислительное число[1]) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций. Она указывает на состояние окисления отдельного атома молекулы и представляет собой лишь удобный метод учёта переноса электронов: она не является истинным зарядом атома в молекуле (см. #Условность).
Представления о степени окисления элементов положены в основу и используются при классификации химических веществ, описании их свойств, составлении формул соединений и их международных названий (номенклатуры). Но особенно широко оно применяется при изучении окислительно-восстановительных реакций.
Понятие степень окисления часто используют в неорганической химии вместо понятия валентность.
Определение[править | править код]
Степень окисления атома равна численной величине электрического заряда, приписываемого атому в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов (то есть исходя из предположения, что соединение состоит только из ионов). В случае ковалентной связи между одинаковыми атомами электроны делят поровну между атомами.
Степень окисления соответствует числу электронов, которое следует присоединить к положительному иону, чтобы восстановить его до нейтрального атома, или отнять от отрицательного иона, чтобы окислить его до нейтрального атома:
Описание[править | править код]
В научной литературе для обозначения степени окисления элемента используется метод Штока[2]. Степень окисления указывается после названия либо символа элемента римскими цифрами в круглых скобках, причём пробел перед открывающей скобкой не ставится: железо(III), Ni(II).
Степень окисления также может указываться арабскими цифрами сверху над символом элемента: 


Степень окисления (в отличие от валентности) может иметь нулевое, отрицательное и положительное значения, которые обычно ставятся над символом элемента сверху: 
Правила вычисления степени окисления:
- Степень окисления атома любого элемента в свободном (несвязанном) состоянии (простое вещество) равна нулю, так, например, атомы в молекулах имеют нулевую степень окисления:
- Степень окисления любого простого одноатомного иона соответствует его заряду, например: Na+ = +1, Ca2+ = +2, Cl− = −1.
- Степень окисления водорода в любом неионном соединении равна +1. Это правило применимо к подавляющему большинству соединений водорода, таких, как H2O, NH3 или CH4. (Определение через электротрицательность даёт исключение для некоторых веществ:
). Для ионных гидридов металлов, например NaH, степень окисления водорода −1.
- Степень окисления кислорода равна −2 во всех соединениях, где кислород не образует простой ковалентной связи O—O, то есть в подавляющем большинстве соединений — оксидах. Так, степень окисления кислорода равна −2 в H2O, H2SO4, NO, CO2 и CH3OH; но в пероксиде водорода, H2O2 (HO—OH), она равна −1 (другими исключениями из правила, согласно которому кислород имеет степень окисления −2, являются
, а также свободные радикалы, например
).
- В соединениях неметаллов, не включающих водород и кислород, неметалл с большей электроотрицательностью считается отрицательно заряжённым. Степень окисления такого неметалла полагается равной заряду его наиболее распространённого отрицательного иона. Например, в CCl4 степень окисления хлора −1, а углерода +4. В CH4 степень окисления водорода +1, а углерода −4. В SF6 степень окисления фтора −1, а серы +6, но в CS2 степень окисления серы −2, а степень окисления углерода +4.
- Алгебраическая сумма степеней окисления всех атомов в формуле нейтрального соединения всегда равна нулю:


- Алгебраическая сумма степеней окисления всех атомов в комплексном ионе (катионе либо анионе) должна быть равна его общему заряду (см. также выше 2-й пункт). Так, в ионе NH4+ степень окисления N должна быть равной −3 и, следовательно, −3 + 4 = +1. Поскольку в ионе SO42− сумма степеней окисления четырёх атомов кислорода равна −8, сера должна иметь степень окисления, равную +6, чтобы полный заряд иона оказался равным −2.
- В химических реакциях должно выполняться правило сохранения алгебраической суммы степеней окисления всех атомов. Именно это правило делает понятие степени окисления столь важным в современной химии. Если в ходе химической реакции степень окисления атома повышается, говорят, что он окисляется, если же степень окисления атома понижается, говорят, что он восстанавливается. В полном уравнении химической реакции окислительные и восстановительные процессы должны точно компенсировать друг друга.
- Максимальная положительная степень окисления элемента обычно численно совпадает с номером его группы в периодической системе (классического короткого варианта таблицы). Максимальная отрицательная степень окисления элемента равна максимальной положительной степени окисления минус восемь (например, для халькогена S положительная степень окисления +6, макс. отрицательная 6 − 8 = −2).
Исключение составляют фтор, кислород, благородные газы (кроме ксенона), а также железо, кобальт, родий и элементы подгруппы никеля: их высшая степень окисления выражается числом, значение которого ниже, чем номер группы, к которой они относятся. Иридий имеет высшую степень окисления +9[4]. У элементов подгруппы меди, наоборот, высшая степень окисления больше единицы, хотя они и относятся к I группе. У лантаноидов степени окисления не превышают +4 (в особых условиях зафиксирована степень окисления +5 для празеодима[5]); у актиноидов зафиксированы степени окисления вплоть до +7.
Правило о равенстве числу восемь суммы абсолютных величин степеней окисления элемента (R) по кислороду (RO) и по водороду (HR; то есть положительных и отрицательных степеней окисления) соблюдается лишь для p-элементов IV—V—VI—VII групп таблицы ПСХЭ. - Элементы-металлы в соединениях обычно имеют положительную степень окисления. Однако встречаются соединения, где степень окисления металлов нулевая (нейтральные карбонилы и некоторые другие комплексы) и отрицательная (алкалиды, ауриды, анионные карбонилы, фазы Цинтля)[6][7].
Понятие степени окисления вполне применимо и для нестехиометрических соединений (КС8, Mo5Si3, Nb3B4 и др.).
Условность[править | править код]
Следует помнить, что степень окисления является сугубо условной величиной, не имеющей физического смысла, но характеризующей образование химической связи межатомного взаимодействия в молекуле.
Степень окисления в ряде случаев не совпадает с валентностью. Например, в органических соединениях углерод всегда четырёхвалентен, а степень окисления атома углерода в соединениях метана CH4, метилового спирта CH3OH, формальдегида HCOH, муравьиной кислоты HCOOH и диоксида углерода CO2, соответственно, равна −4, −2, 0, +2 и +4.
Степень окисления зачастую не совпадает с фактическим числом электронов, которые участвуют в образовании связей. Обычно это молекулы с различными электрондефицитными химическими связями и делокализацией электронной плотности. Например, в молекуле азотной кислоты степень окисления центрального атома азота равна +5, тогда как ковалентность равна 4, а координационное число — 3. В молекуле озона, имеющей сходное с SO2 строение, атомы кислорода характеризуется нулевой степенью окисления (хотя часто говорят, что центральный атом кислорода имеет степень окисления +4).
Степень окисления в большинстве случаев не отражает также действительный характер и степень электрической поляризации атомов (истинного заряда атомов, определённых экспериментальным путём). Так, и в HCl, и в NaCl степень окисления хлора принимается равной −1, тогда как на самом деле поляризация его атома (относительный эффективный заряд δ−) в этих соединениях различна:
δCl(HCl) = −0,17 единицы заряда,
δCl(NaCl) = −0,9 единицы заряда (абсолютного заряда электрона); водорода и натрия — соответственно +0,17 и +0,90[8].
А в кристаллах сульфида цинка ZnS заряды атомов цинка и серы равны соответственно +0,86 и −0,86, вместо степеней окисления +2 и −2[9].
На примере хлорида аммония удобно затронуть существующее в современной химии перекрещивание различных понятий. Так, в NH4Cl атом азота имеет степень окисления −3, ковалентность IV, электровалентность (формальный заряд по Льюису) +1 {аммоний-катион имеет заряд также 1+}, и общую валентность (структурную; общее координационное число) 5, а для его эффективного заряда предлагалось значение −0,45[10].
Проблемы[править | править код]
Применение понятия степени окисления проблематично для следующих классов соединений[11]:
- Соединения, содержащие ковалентные связи между атомами близкой электроотрицательности, например: PH3, Cl3N. В этом случае использование различных шкал электроотрицательности даёт различные результаты. В 2014 году ИЮПАК дал рекомендацию пользоваться шкалой электроотрицательности Аллена, поскольку другие шкалы используют понятия валентного состояния атома (что усложняет определение условной величины) или его степени окисления (что создаёт порочный круг)[12].
- Соединения, содержащие делокализованные ковалентные связи и являющиеся промежуточными между резонансными структурами, где степени окисления атомов различны. Например, в молекуле N2O крайний атом азота имеет степень окисления от −1 до 0, средний — от +2 до +3. В случае, когда атомы одного элемента в структуре равноправны, им приписывают среднее из возможных значений степени окисления, которое может быть дробным. Например:
. В уравнениях окислительно-восстановительных реакций часто используют средние (в том числе дробные) значения степени окисления даже в том случае, когда атомы неравноправны, например
(по строгому определению
).
- Соединения, содержащие полностью делокализованные электроны (металлическая связь). Например, дикарбид лантана LaC2 состоит из ионов La3+, C22− и делокализованных электронов. Наличие в соединении ионов C22− позволяет считать степень окисления лантана равной +2; с другой стороны, бо́льшая длина связи C≡C по сравнению с CaC2, объясняемая взаимодействием делокализованных электронов с антисвязывающими орбиталями, позволяет считать степень окисленния углерода равной −3/2. Третья возможность — рассматривать такие соединения как электриды, то есть не приписывать делокализованные электроны ни одному из атомов. В случае, когда все элементы в соединении — металлы (см. Интерметаллиды), их степени окисления обычно считают равными нулю.
Пример составления уравнения окислительно-восстановительной реакции[править | править код]
Составляем электронные уравнения:
Найденные коэффициенты проставляем в схему процесса, заменяя стрелку на знак равенства:
(то есть в электронных реакциях (методе электронного баланса) железо с дробной степенью окисления записывается только с коэффициентом 3).
На самом деле, в растворе нет ионов Fe2+, Fe3+ (и уж тем более Fe+8/3), также как и Cr6+, Mn7+, S6+, а есть ионы CrO42−, MnO4−, SO42−, а равно и малодиссоциированные «электролиты» Fe3O4 (FeO•Fe2O3). Именно поэтому следует отдать предпочтение методу полуреакций (ионно-электронным методам) и применять его при составлении уравнении всех окислительно-восстановительных реакций, протекающих в водных растворах. То есть мы можем воспользоваться готовой реакцией стандартного электродного потенциала:
Fe3O4 + 8H+ + 8e− = 3Fe + 4H2O, E° = −0,085 В.
См. также[править | править код]
- Валентность
- Координационное число
Примечания[править | править код]
- ↑ Окислительное число // Большая советская энциклопедия : [в 30 т.] / гл. ред. А. М. Прохоров. — 3-е изд. — М. : Советская энциклопедия, 1969—1978.
- ↑ Справочник химика. Под ред. Б. П. Никольского, Л: Химия, 1971. С. 13.
- ↑ Эту фиктивную зарядность в молекулах с ковалентными связями правильнее называть степенью окисления элемента, иначе, его окислительным числом. Для отличия от положительной или отрицательной зарядности (например,
,
) знаки при степени окисления (окислительном числе) меняют на обратные (например,
). Адекватны этой формуле и изображения: H→F и Hδ+—Fδ−. Агафошин Н.П. Периодический закон и периодическая система хим. элементов Д. И. Менделеева. — 2-е изд. — М.: Просвещение, 1982. — с. 56
- ↑ Guanjun Wang, Mingfei Zhou, James T. Goettel, Gary J. Schrobilgen, Jing Su, Jun Li, Tobias Schlöder, Sebastian Riedel. Identification of an iridium-containing compound with a formal oxidation state of IX (англ.) // Nature. — 2014. — Vol. 514. — P. 575—577. — doi:10.1038/nature13795.
- ↑ Qingnan Zhang, Shu‐Xian Hu, Hui Qu, Jing Su, Guanjun Wang, Jun‐Bo Lu, Mohua Chen, Mingfei Zhou, Jun Li. Pentavalent Lanthanide Compounds: Formation and Characterization of Praseodymium(V) Oxides (англ.) // Angewandte Chemie International Edition. — 2016. — Vol. 55. — P. 6896–6900. — ISSN 1521-3773. — doi:10.1002/anie.201602196.
- ↑ John E. Ellis. Adventures with Substances Containing Metals in Negative Oxidation
States (англ.) // Inorganic Chemistry. — 2006. — Vol. 45. — P. 3167—3186. — doi:10.1021/ic052110i. - ↑ Metalle in negativen Oxidationszuständen (нем.). Дата обращения: 14 марта 2015. Архивировано 29 марта 2015 года.
- ↑ Степень окисления не следует путать с истинным эффективным зарядом атома, который практически всегда выражается дробным числом.
Рассмотрим для наглядности ряд соединений хлора:В HCl хлор отрицательно одновалентен.
В молекуле Cl2, к примеру, ни один из атомов не оттягивает электронов больше другого, следовательно, заряд [а равно и степень окисления] равен нулю. В Cl2O хлор снова одновалентен, но уже положительно. В Cl2O7 хлор положительно семивалентен:
Определяемые подобным образом электрохимические валентности (степени окисления) отдельных атомов могут не совпадать с их обычными (структурными) валентностями. Например, в молекуле Cl2 (Cl-Cl) каждый атом хлора электрохимически нуль-валентен (точнее, степень окисления = 0), но структурно он одновалентен (валентность = I).
Некрасов Б.В. Основы общей химии. — 3-е изд., испр. и доп. — М.: Химия, 1973. — Т. I. — стр. 285—295
см. также Эффективный заряд. - ↑ Угай Я. А. Валентность, химическая связь и степень окисления — важнейшие понятия химии Архивная копия от 13 апреля 2014 на Wayback Machine // Соросовский образовательный журнал. — 1997. — № 3. — С. 53-57
- ↑ Некрасов Б.В. Основы общей химии. — 3-е изд., испр. и доп. — М.: Химия, 1973. — Т. I. — стр. 395
- ↑ Pavel Karen, Patrick McArdle, Josef Takats. Toward a comprehensive definition of oxidation state (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2014. — Vol. 86, no. 6. — P. 1017—1081. — ISSN 1365-3075. — doi:10.1515/pac-2013-0505.
- ↑ P. Karen, P. McArdle, J. Takats. Comprehensive definition of oxidation state (англ.) // Pure Appl. Chem.. — 2015. — 16 December. Архивировано 2 февраля 2017 года.