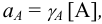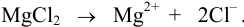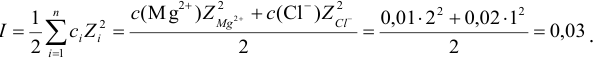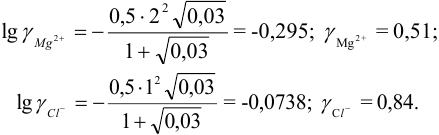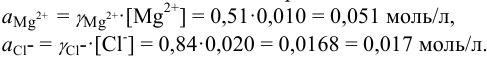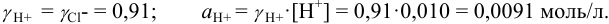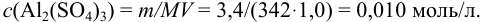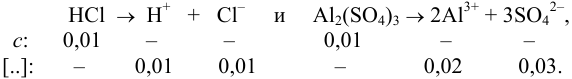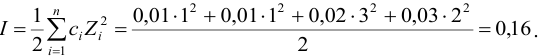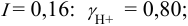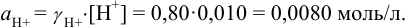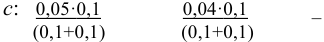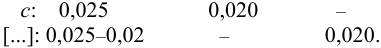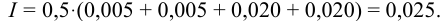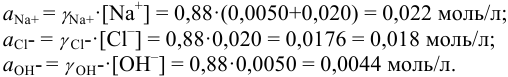Равновесия в растворах
Чтобы не усложнять термодинамические
соотношения, выведенные для идеальных
растворов, Льюис предложил использовать
в термодинамических соотношениях вместо
концентрации активность.
Активность компонента связана с его
концентрацией в растворе через коэффициент
активности :.
Для растворов электролитов коэффициент
активности связан с величиной ионной
ассоциации. Чем сильнее ионная ассоциация
в растворе, тем ниже коэффициент
активности. Ионная ассоциация усиливается
с ростом концентрации электролита в
растворе и с увеличением заряда ионов.
Если между ионами нет химического
взаимодействия, то степень ассоциации
ионов определяется ионной силой раствора.
Ионной силой называют полусумму
произведений моляльных концентраций
всех ионов в растворе на квадраты их
зарядов:
.
(1.1)
Чем выше ионная сила раствора, тем ниже
коэффициент активности. При этом в
растворах с одинаковой ионной силой
среднеионные коэффициенты активности
в первом приближении совпадают. В
предельно разбавленном растворе ионная
ассоциация отсутствует и коэффициент
активности равен единице, т.е. активность
равна концентрации.
В рамках теории Дебая-Хюккеля для расчета
среднеионного коэффициента активности
вещества в водном растворе применяется
одно из двух уравнений:
(1.2)
при ионной силе раствора менее 0,05 моль/кг
и
(1.3)
при ионной силе раствора от 0,05 до
0,5 моль/кг, где
и
– заряд катиона и аниона.
Теория Дебая-Хюккеля предполагает
возможность расчета коэффициента
активности отдельного иона по уравнениям
(1.4)
при ионной силе раствора менее 0,05 моль/кг
и
(1.5)
при ионной силе раствора от 0,05 до
0,5 моль/кг, где
– заряд отдельного иона.
Примеры решения задач Пример 1.
Вычислить ионную силу раствора сульфата
натрия концентрацией 0,1 моль/кг и его
среднеионный коэффициент активности.
Решение.1. Составить уравнение
диссоциации соли:
.
2. Согласно уравнению диссоциации
концентрация катионов натрия
,
концентрация сульфат-ионов.
3. Вычислить ионную силу раствора:
4. Вычислить среднеионный коэффициент
активности сульфата натрия:
.
Задачи для решения
1. – 60. Вычислить ионную силу раствора
заданной концентрации.
|
№ |
Вещество |
Концентрация |
d, |
|
1 |
Al2(SO4)3 |
0,15 экв/л |
1,009 |
|
2 |
AlCl3 |
0,55 % |
1,007 |
|
3 |
Al(NO3)3 |
5,47 |
1,01 |
|
4 |
Al2(SO4)3 |
0,9 |
1,009 |
|
5 |
Al(NO3)3 |
1,05 % |
1,01 |
|
6 |
BaCl2 |
1,69 моль/л |
1,28 |
|
7 |
Ba(NO3)2 |
0,525моль/л |
1,092 |
|
8 |
CaCl2 |
2,2 % |
1,01 |
|
9 |
Ca(NO3)2 |
2% |
1,01 |
|
10 |
CdCl2 |
0,5 |
1,08 |
|
11 |
Cd(NO3)2 |
0,5 |
1,04 |
|
12 |
CrCl3 |
0,6 |
1,022 |
|
13 |
Cr2(SO4)3 |
0,3 |
1,021 |
|
14 |
Cr(NO3)3 |
3% |
1,02 |
|
15 |
CuSO4 |
1,037 |
1,206 |
|
16 |
CuCl2 |
0,04 |
1,009 |
|
17 |
Cu(NO3)2 |
1,037 |
1,20 |
|
18 |
FeCl3 |
1,9 моль/л |
1,234 |
|
19 |
FeSO4 |
0,3 экв/л |
1,02 |
|
20 |
Fe2(SO4)3 |
0,3 моль/л |
1,03 |
|
21 |
Fe(NO3)3 |
0,3 % |
1,0 |
|
22 |
H2SO4 |
1,56 |
1,095 |
|
23 |
H2SO4 |
3,4 |
1,109 |
|
24 |
H2SO4 |
5,9 |
1,18 |
|
25 |
H3PO4 |
2,79 моль/л |
1,115 |
|
26 |
H3PO4 |
7,3 |
1,181 |
|
27 |
H3PO4 |
3 мол. |
1,08 |
|
28 |
HCl |
0,4 мол. % |
1,002 |
|
29 |
HCl |
1,17 |
1,05 |
|
30 |
HCl |
2% |
1,01 |
|
31 |
HCl |
17,4 |
1,149 |
|
32 |
Hg(NO3)2 |
0,25 |
1,174 |
|
33 |
HNO3 |
5,1 |
1,03 |
|
34 |
HNO3 |
6 |
1,01 |
|
35 |
K2Cr2O7 |
0,18 |
1,033 |
|
36 |
KMnO4 |
0,25 экв/л |
1,027 |
|
37 |
KOH |
3 мол. % |
1,073 |
|
38 |
KOH |
34 |
1,336 |
|
39 |
KOH |
6,3 |
1,147 |
|
40 |
KOH |
8,107 |
1,336 |
|
41 |
KOH |
0,12 моль/кг |
1,0 |
|
42 |
MgSO4 |
20 |
1,219 |
|
43 |
MgCl2 |
2 |
1,02 |
|
44 |
Mg(NO3)2 |
0,05 моль/л |
1,01 |
|
45 |
MnCl2 |
10 |
1,086 |
|
46 |
MnSO4 |
1 |
1,0 |
|
47 |
Na2CO3 |
0,39 моль/л |
1,019 |
|
48 |
Na2CO3 |
4,1 % |
1,019 |
|
49 |
NaBr |
5,8 мол. % |
1,21 |
|
50 |
NaBr |
26 % |
1,21 |
|
51 |
NaCl |
7,1 мол. % |
1,147 |
|
52 |
NaCl |
15 % |
1,109 |
|
53 |
NaCl |
4,5% |
1,03 |
|
54 |
NaOH |
13 % |
1,142 |
|
55 |
NaOH |
1,3 % |
1,042 |
|
56 |
NaOH |
1,48 г/л |
1,0 |
|
57 |
NaOH |
0,37 экв/л |
1,142 |
|
58 |
Pb(NO3)2 |
30 % |
1,328 |
|
59 |
ZnSO4 |
1,374 экв/л |
1,107 |
|
60 |
ZnSO4 |
87 г/л |
1,084 |
61. Для осаждения в виде хлорида всего
серебра, содержащегося в 100 мл раствора
нитрата серебра, потребовалось 50 мл
0,2 н. раствора соляной кислоты. Какова
нормальность раствора нитрата серебра,
какая масса хлорида серебра выпала в
осадок? Найти ионную силу конечного
раствора.
62. На нейтрализацию 31 мл 0,16 н.
раствора щелочи требуется 217 мл
раствора серной кислоты. Чему равна
нормальность раствора серной кислоты?
Найти ионную силу раствора после смешения
кислоты и щелочи.
63. Какой объем 0,3 н. раствора серной
кислоты требуется для нейтрализации
раствора содержащего 0,32 г гидроксида
натрия в 40 мл? Найти ионную силу
раствора после реакции.
64. На нейтрализацию одного литра
раствора, содержащего 1,4 г гидроксида
калия, требуется 50 мл раствора
фосфорной кислоты. Вычислить нормальность
раствора кислоты и ионную силу.
65. Какая масса азотной кислоты
содержалась в 0,5 л раствора, если на
нейтрализацию его потребовалось 35 мл
0,4 н. раствора гидроксида натрия?
Вычислить ионную силу раствора после
нейтрализации.
66. Сколько миллилитров 1 н. раствора
едкого натра потребуется для полной
нейтрализации 300 мл 0,1 М раствора
серной кислоты? Вычислить ионную силу
раствора после нейтрализации.
67. Сколько миллилитров 0,1 н. едкого
натра (NaOH) потребуется для осаждения
меди в виде гидроксида из 20 мл раствора
сульфата меди, в 1 л которого содержится
10 г меди? Вычислить ионную силу
раствора после реакции.
68. Сколько миллилитров 10 % соляной
кислоты плотностью 1,047 г/ см3потребуется для нейтрализации раствора,
содержащего 8,5 г гидроксида бария?
Вычислить ионную силу раствора после
реакции.
69. Сколько миллилитров раствора соды,
содержащего в 1 л 21,2 г соли, надо
добавить к 30 мл 0,2 н. раствора
хлорида кальция для полного осаждения
кальция в виде карбоната? Вычислить
ионную силу раствора после реакции.
70. Сколько граммов гидроксида железа
выпадет в осадок, если к 500 мл 0,2 н.
раствора хлорида железа (III) (плотность
1,03 г/см3) добавить 5 г гидроксида
натрия? Вычислить ионную силу раствора
после реакции.
71. В каком объемном отношении надо
смешать растворы гидроксида бария с
концентрацией 95,5 г/л и 0,5 н. соляной
кислоты для получения раствора с
нейтральной средой? Вычислить ионную
силу раствора после реакции.
72. На нейтрализацию 20 мл раствора
едкого кали потребовалось 13 мл 0,2 н.
раствора соляной кислоты. Сколько
граммов едкого кали содержится в 1 л
раствора? Вычислить ионную силу раствора
после реакции.
73. Сколько миллилитров раствора
нитрата серебра, содержащего 5 г/л
серебра, надо добавить к 10 мл 0,2 н.
раствора хлорида натрия, чтобы полностью
удалить из раствора ионы хлора? Вычислить
ионную силу раствора после реакции.
74. Сколько миллилитров 2 н. серной
кислоты потребуется для превращения
1,56 г гидроксида алюминия в сульфат
алюминия? Вычислить ионную силу раствора
после реакции.
75. Сколько граммов карбоната кальция
можно растворить в 100 мл 20 % соляной
кислоты плотностью 1,1 г/см3?
Вычислить объем, который займет
выделившийся газ при нормальных условиях
и ионную силу полученного раствора.
76. К 5 г цинка прибавили 100 мл
10,2 % соляной кислоты (плотность
раствора 1,05 г/см3). Какое вещество,
и в каком количестве осталось в избытке?
Вычислить объем выделившегося водорода
при 20ºС и 750 мм рт. ст. и ионную
силу полученного раствора.
77. На нейтрализацию 20 мл 5,66 %
раствора гидроксида калия плотностью
1,053 г/см3пошло 12,1 мл раствора
серной кислоты плотностью 1,052 г/см3.
Определить концентрацию (%) раствора
серной кислоты и ионную силу конечного
раствора.
78. Какое количество миллилитров
0,5 н. раствора сульфата натрия надо
прилить к 100 мл 16 % раствора хлорида
бария плотностью 1,156 г/см3, чтобы
полностью осадить сульфат-ион? Определить
ионную силу конечного раствора.
79. На нейтрализацию 50 мл раствора
фосфорной кислоты плотностью 1,01 г/см3израсходовано 31,2 г 1 н. раствора
гидроксида натрия плотностью 1,04 г/см3.
Определить концентрацию (%) фосфорной
кислоты и ионную силу конечного раствора.
80. 10 г сплава меди с цинком обработали
соляной кислотой (объем раствора 1,5 л,
концентрация 0,02 н.). При этом выделилось
570 мл водорода, измеренных при
температуре 27ºС и давлении 1 атм.
Определить состав сплава и выразить
его в массовых и мольных долях. Вычислить
ионную силу раствора после реакции.
81. При растворении 15 г сплава
серебра с алюминием раствором едкого
натра объемом 0,5 л и концентрацией
1,25 г/л выделилось 13 мл водорода
измеренного при температуре 57ºС и
давлении 15105Па.
Определить состав сплава и выразить
его в массовых и мольных долях. Вычислить
ионную силу раствора после реакции.
82. Растворили в 100 мл 0,05 н. азотной
кислоты 5 г сплава меди и золота. При
этом выделилось 0,99 мл оксида азота (II),
измеренных при температуре 37ºС и давлении
1,2105Па.
Определить состав сплава и выразить
его в массовых и мольных долях. Вычислить
ионную силу раствора после реакции.
83. Для нейтрализации 20 мл 0,1 н.
раствора соляной кислоты потребовалось
8 мл раствора гидроксида натрия.
Сколько граммов NaOH содержит 1 л этого
раствора? Вычислить ионную силу раствора
после реакции.
84. Какой объем 0,2 н. раствора кислоты
требуется для нейтрализации раствора,
содержащего 0,51 г гидроксида калия в
30 мл? Вычислить ионную силу раствора
после реакции.
85. Сколько и какого вещества останется
в избытке, если к 150 мл 0,4 н. раствора
соляной кислоты прибавить 250 мл 0,2 н.
раствора гидроксида натрия? Вычислить
ионную силу раствора после реакции.
86. Определить эквивалентную массу
кислоты, если на нейтрализацию раствора,
содержащего 0,63 г
кислоты, израсходовано 20 мл
0,5 н. раствора щелочи. Вычислить ионную
силу раствора щелочи.
87. На нейтрализацию раствора,
содержащего 4,05 г кислоты, израсходовано
40 мл раствора едкого натра (NaOH)
концентрацией 10 % плотностью
1,109 г/см3. Определить эквивалентную
массу кислоты. Вычислить ионную силу
раствора щелочи.
88. К 50 л раствора фосфорной кислоты
концентрацией 8 % плотностью 1,042 г/см3прибавили 2 л фосфата натрия
концентрацией 5 г/л. Рассчитать
молярную концентрацию фосфат-иона в
полученном растворе и его ионную силу.
89. На нейтрализацию 10 мл раствора
серной кислоты концентрацией 22 %
плотностью 1,155 г/см3потребовалось
50 мл раствора щелочи концентрацией
41,6 г/л. Определить из этих данных
эквивалентную массу щелочи и ионную
силу конечного раствора.
90. Смешали 4 мл серной кислоты
концентрацией 40 % (плотность 1,303 г/см3)
и 200 мл серной кислоты, концентрацией
0,001 моль/л. Рассчитать нормальную
концентрацию и ионную силу полученного
раствора.
91. Смешали 8 л раствора соляной
кислоты концентрацией 4 моль/л и 11 л
раствора ее же концентрацией 2 г/л.
Рассчитать концентрацию полученного
раствора (г/л) и его ионную силу .
92. К 1,2 л 1,8 н. раствора сульфата
хрома (III) добавили 3 л
1 % раствора гидроксида аммония
(плотность равна 1 г/см3).
Рассчитать ионную силу полученного
раствора.
93. К раствору объемом 30 мл, содержащему
10 г серной кислоты в 100 мл раствора,
прибавили 40 мл раствора NaOH, содержащего
9 г гидроксида натрия в 100 мл
раствора. Найти молярную концентрацию
того вещества, которое останется в
избытке и ионную силу полученного
раствора.
94. Смешали раствор нитрата серебра,
концентрацией 1 % плотностью 1,01 г/см3и раствор соляной кислоты концентрацией
5 % (плотность 1,02 г/см3) в
соотношении 3:4. Рассчитать молярную
концентрацию нитрат-иона в полученном
растворе и ионную силу полученного
раствора.
95. Какой объем раствора серной кислоты
концентрацией 10 % (плотность 1,07 г/см3)
потребуется для полной нейтрализации
0,5 л раствора NaOH концентрацией 16 г/л?
Вычислить ионную силу конечного раствора.
96. Смешали 10 мл раствора HCl
концентрацией 10 % (плотность 1,047 г/см3)
и 10 мл раствора HCl концентрацией 6 %
(плотность 1,028 г/см3). Рассчитать
массовую долю и молярную концентрацию
соляной кислоты в полученном растворе
и его ионную силу.
97. Из раствора нитрата серебра
концентрацией 2 % (плотность 1,015 г/см3)
по реакции с хлоридом натрия образуется
14,35 г. хлорида серебра. Вычислить
исходный объем раствора нитрата серебра
и ионную силу конечного раствора.
98. Сколько миллилитров 0,5 н. раствора
сульфата натрия нужно прилить к 100 мл
раствора хлорида бария концентрацией
16 % (плотность 1,156 г/см3), чтобы
полностью осадить сульфат-ионы? Найти
ионную силу конечного раствора.
99. Металл вытеснил из 100 мл соляной
кислоты 348 мл водорода, измеренного
при 20°С и 99,5 кПа. Рассчитать нормальную
концентрацию хлорида металла в полученном
растворе и его ионную силу.
100. К 30 мл горячего 10 %-ного водного
раствора сульфата алюминия (плотность
1,1 г/см3) прилили 20 мл горячего
10 %-ного водного раствора карбоната
натрия (плотность 1,15 г/см3).
Смесь оставили на сутки на воздухе.
Определить ионную силу конечного
раствора.
101. К 20 мл горячего 20 %-ного водного
раствора хлорида хрома (плотность
1,1 г/см3) прилили 20 мл горячего
10 %-ного водного раствора сульфида
натрия (плотность 1,15 г/см3).
Смесь оставили на сутки. Определите
ионную силу конечного раствора.
102. К 20 мл горячего 20 %-ного водного
раствора хлорида железа (III)
(плотность 1,2 г/см3) прилили
15 мл горячего 20 %-ного водного
раствора силиката натрия (плотность
1,2 г/см3). Смесь оставили на сутки
на воздухе. Определите ионную силу
конечного раствора.
103. К 40 мл горячего 10 %-ного водного
раствора сульфата хрома (III)
(плотность 1,1 г/см3) прилили
10 мл горячего 20 %-ного водного
раствора карбоната натрия (плотность
1,2 г/см3). Смесь оставили на сутки
на воздухе. Определите ионную силу
конечного раствора.
104. К 25 мл горячего 10 %-ного водного
раствора сульфата железа (III)
(плотность 1,1 г/см3) прилили
20 мл горячего 20 %-ного водного
раствора карбоната натрия (плотность
1,2 г/см3). Смесь оставили на сутки
на воздухе. Определите ионную силу
конечного раствора.
105. К 30 мл горячего 10 %-ного водного
раствора сульфата алюминия (плотность
1,1 г/см3) прилили 20 мл горячего
10 %-ного водного раствора сульфида
натрия (плотность 1,15 г/см3).
Смесь оставили на сутки на воздухе.
Определите ионную силу конечного
раствора.
106. К 20 мл горячего 20 %-ного водного
раствора хлорида хрома (III)
(плотность 1,1 г/см3) прилили
20 мл горячего 10 %-ного водного
раствора карбоната натрия (плотность
1,15 г/см3). Смесь оставили на
сутки на воздухе. Определите ионную
силу конечного раствора.
107. К 20 мл горячего 20 %-ного водного
раствора хлорида хрома (III)
(плотность 1,1 г/см3) прилили
20 мл горячего 10 %-ного водного
раствора силиката натрия (плотность
1,2 г/см3). Смесь оставили на сутки
на воздухе. Определите ионную силу
конечного раствора.
108. К 20 мл горячего 20 %-ного водного
раствора хлорида железа (III)
(плотность 1,2 г/см3) прилили
20 мл горячего 10 %-ного водного
раствора сульфида натрия (плотность
1,15 г/см3). Смесь оставили на
сутки на воздухе. Определите ионную
силу конечного раствора.
109. К 40 мл горячего 10 %-ного водного
раствора сульфата алюминия (плотность
1,1 г/см3) прилили 20 мл горячего
20 %-ного водного раствора силиката
натрия (плотность 1,2 г/см3). Смесь
оставили на сутки на воздухе. Определите
ионную силу конечного раствора.
110. В раствор, содержащий нитрат калия,
нитрат серебра и нитрат меди (II)
массой 250 г поместили железные опилки,
массой 1,25 г. Какие металлы и в каком
количестве выделятся из раствора, если
содержание солей металлов в исходном
растворе следующее: нитрат калия 0,5 %,
нитрат меди 0,94 %, нитрат серебра
1,021 %? Вычислить ионную силу конечного
раствора.
111. К 20 мл 0,1 М раствора нитрата
свинца (II) прилили 20 мл
0,15 н. раствора иодида калия. Найти
массу образовавшегося осадка и вычислить
ионную силу конечного раствора.
112. К 200 мл раствора, содержащего
0,3 г сульфида калия прибавили 300 мл
0,1 % раствора серной кислоты (плотность
– 1,0 г/см3). Найти объем
выделившегося газа (Т= 25°С,Р=
1 атм.) и ионную силу конечного раствора.
113. Смешали 200 мл 4 % раствора
сульфата меди (II)
(плотность 1,04 г/см3) и 400 мл
1 % раствора гидроксида натрия
(плотностью 1 г/см3). Определить
массу осада и ионную силу конечного
раствора.
114. 5 г карбоната кальция растворили
в 150 мл 4 % соляной кислоты (плотность
1,02 г/см3). Найти объем выделившегося
углекислого газа и ионную силу конечного
раствора.
115. Смешали 200 мл 0,1 н. раствора
бромида алюминия и 120 мл 0,15 н.
раствора нитрата серебра. Определить
ионную силу конечного раствора и массу
образовавшегося осадка.
116. К 5 г судбфида натрия прилили
500 мл 0,1 н. раствора серной кислоты.
Определить объем сероводорода и ионную
силу конечного раствора.
117. К 50 мл 1,5 % раствора гидроксида
бария (плотность 1,008 г/см3)
прилили 300 мл 2 % раствора соляной
кислоты (плотность 1,01 г/см3).
Вычислить ионную силу конечного раствора.
118. 1,546 г гидроксида железа (III)
растворили в 300 мл азотной кислоты,
концентрацией 10,5 г/л. Определить
концентрацию нитрата железа (III)
в полученом растворе и ионную силу этого
раствора.
119. Смешали растворы хлорида железа (III)
и гидроксида калия в объемном соотношении
1:1 (по 2 литра) и одинаковой концентрацией
1 г/л. Определить ионную силу полученного
раствора.
120. К 150 мл 0,1 н. нитрата бария
прилили 100 мл 0,1 н. раствора сульфата
натрия. Определить массу сульфата бария
и ионную силу получившегося раствора.
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 18 июня 2016 года; проверки требуют 9 правок.
Ионная сила раствора — мера интенсивности электрического поля, создаваемого ионами в растворе. Полусумма произведений из концентрации всех ионов в растворе на квадрат их заряда. Формула впервые была выведена Льюисом с ассистентом М. Рендаллом[en][1]:

где ci — молярные концентрации отдельных ионов (моль/л), zi – заряды ионов
Суммирование проводится по всем типам ионов, присутствующих в растворе. Если в растворе присутствуют два или несколько электролитов, то вычисляется общая суммарная ионная сила раствора.
Например, для раствора NaCl с концентрацией 0,001 моль/л, в котором присутствуют два вида однозарядных ионов Na+ и Cl− с концентрациями также равными 0,001 моль/л, ионная сила будет вычисляться следующим образом:
- I(NaCl) = 0,5(z²(Na+)•c(Na+) + z²(Cl−)•c(Cl−)) = 0,5(1²•c(NaCl) + (-1)²•c(NaCl)) = c(NaCl)
И ионная сила соответственно будет равна концентрации раствора:
- I = 0.5(1²•0,001 моль/л + (-1)²•0,001 моль/л) = 0.5(0,001 моль/л + 0,001 моль/л) = 0,001 моль/л
| Тип электролита | (+z)(-z) | (+1)(-1) | (+1)(-2) или (+2)(-1) | (+2)(-2) | (+1)(-3) или (+3)(-1) | (+3)(-3) | (+2)(-3) или (+3)(-2) |
| Ионная сила I | 
|
c | 3c | 4c | 6c | 9c | 15c |
Это верно для раствора любого сильного электролита, состоящего из однозарядных ионов. Для электролитов, в которых присутствуют многозарядные ионы, ионная сила обычно превышает молярность раствора.
Применение[править | править код]
Ионная сила раствора имеет большое значение в теории сильных электролитов Дебая — Хюккеля. Основное уравнение этой теории (предельный закон Дебая — Хюккеля) показывает связь между коэффициентом активности иона ze и ионной силы раствора I в разбавленных растворах (для электролита при С < 0,01 М) в виде:
| Допущения | |||
| Первое приближение | 
|

|
при  в воде в воде 
|
| Второе приближение | 
|

|
a — среднеэффективный диаметр ионов
B — параметр, связанный с радиусом ионной атмосферы в воде |
| Третье приближение | 
|

|
С — параметр, учитывающий поляризацию молекул |
где γ — коэффициент активности, А — постоянная, не зависящая от заряда иона и ионной силы раствора, но зависящая от диэлектрической постоянной растворителя и температуры.
См. также[править | править код]
- Коэффициент активности
- Расчет ионной силы раствора электролита
Примечания[править | править код]
- ↑ Lewis G. N., Randall M. The Activity Coefficient of Strong Electrolytes (англ.) // Journal of the American Chemical Society. — 1921. — Vol. 43, no. 5. — P. 1112—1154.
Влияние электростатических взаимодействий на поведение ионов в растворе. Ионная сила раствора. Коэффициент активности
Характеристикой электростатического поля в растворе и мерой электростатических взаимодействий ионов является ионная сила раствора I, связанная с концентрацией ионов 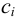
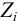
Ионной силой раствора определяется коэффициент активности иона 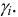
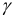
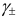
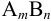
Например, для 0,01 М раствора 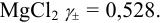
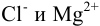
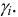
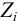
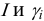
В практических расчетах для оценки коэффициентов активности используют ряд постулатов, упрощающих расчеты:
- Коэффициенты активности ионов равного заряда, независимо от знака и размера, приблизительно равны.
- Растворы, содержащие только нейтральные молекулы, можно считать идеальными
.
- Разбавленные растворы электролитов (особенно — слабых!) приближаются к идеальным
.
Поэтому при расчете величины 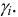
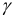
Коэффициент активности является мерой отклонения реальной системы от идеальной. Он связывает концентрацию иона и его активность 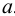
где [А] — равновесная концентрация иона А. Активность имеет размерность концентрации (моль/л).
Следует помнить, что при расчетах любого из четырех видов химических равновесий с применением табличных (термодинамических) констант равновесия получают значения активностей частиц, а не их равновесные концентрации. Расчет равновесных концентраций при I > 0 проводится с учетом у с использованием уравнения (2.11), связывающего различные константы.
Пример 2.1.
Вычислить ионную силу, коэффициенты активности и активность ионов в 0,010 М растворе 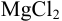
Решение:
Уравнение диссоциации сильного электролита
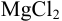
Начальная концентрация (моль/л) с: 0,010
Равновесные концентрации (моль/л) […]: — 0,010 0,020.
По формуле (2.1) вычисляют ионную силу раствора:
Коэффициенты активности можно найти в табл. 1 приложения: при / = 0,03 для двухзарядного иона 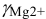
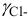
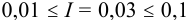
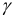
Активности ионов соответственно равны:
Пример 2.2.
Во сколько раз изменится активность ионов водорода в 0,010М растворе 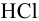
Решение:
Для 0,010 М раствора 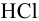
Молярная концентрация раствора 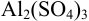
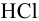
В полученном растворе сильных электролитов устанавливаются равновесия:
В величину I (формула 2.1) вносят вклад все ионы, находящиеся в растворе:
При
Отношение полученных активностей (0,0091/0,0080) показывает, что при введении в раствор 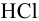
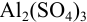
Пример 2.3.
Вычислить ионную силу и активности ионов в растворе, полученном при сливании по 100 мл 0,050 М раствора 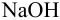
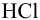
Решение:
При сливании растворов протекает реакция нейтрализации с образованием достаточно слабого электролита — воды, диссоциацией которой пренебрегаем. Данные указывают на избыток взятой щелочи.
С учетом разбавления
и после расчета
В растворе присутствуют ионы 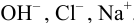
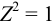
Соответственно 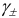
Проверкой решения может быть выполнение принципа электронейтральности раствора в целом:
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Решение задач по аналитической химии
Возможны вам будут полезны эти страницы:
The concentration or quantity of the ions in a particular solution is termed as ionic strength of that solution. The ionic strength of an ionic compound can only be measured in the solution form and we know that an ionic compound dissociates into positive and negative ions in the water. The ionic strength of a solution is expressed using the symbol ‘I’. Randall and Lewis were the first to give the concept of ionic strength in 1921. Some properties of ionic strength are as follows:
- Higher the concentration of the ionic compound or electrolyte in the solution, higher the dissociation constant of the solution.
- Higher the ionic strength, higher the electrical conductivity of the solution.
- Lower the ionic strength, lower will be the conductivity of the solution.
- The ionic strength also denotes the amount of interionic attractions and repulsions in the solution.
Ionic Strength Definition
Thus, we can say that the ionic strength of an ionic compound can be calculated as half of the sum of products of the molar concentration of the ions and the square of their respective charges. The factor of 1/2 comes from the fact that the ionic compound dissociates into cations and anions. We can see that the ionic strength is directly proportional to the square of the charge on the atom and thus the ionic strength of a solution increases rapidly with the increase in charge of the ion.
Ionic Strength Unit
The ionic strength is expressed in Moles per litre (molL-1) or Moles per kg (mol kg-1) depending upon the units taken for the concentration of the ions.
Ionic Strength Formula
The ionic strength formula is as follows
where,
C is the molar concentration expressed in moles per litre
Z refers to the charge on the particular ionExample: The charge on OH– ion is -1, so the value of Z for hydroxide ion is -1.
Importance of Ionic Strength
Ionic strength is of great importance in chemistry such as:
- It is very important in Debye Huckle’s theory. The deviations in the ionic strength of a solution from the ideal solution is clearly explained by the Debye-Huckle theory.
- Double layer theory, electroacoustic and electrokinetic phenomena are also explained with the help of ionic strength.
- The square root of ionic strength is inversely proportional to the Debye length.
- From the ionic strength formula, it is evident that if the concentration or charge of the ions increases then the electrical conductivity of the solution increases rapidly to a great extent.
- The ionic strength of a solution is impacted by the dissolved salts in a solution.
- The strength of a buffer solution can also be determined by using the ionic strength formula.
Read, More
- Ionic Equilibrium
- Ionic Bonds and Ionic Compounds
- Strength of Acids
Solved Examples on Ionic Strength Formula
Example 1: Calculate the ionic strength of NaOH solution with a concentration of 5 mol/L.
Solution:
NaOH ——> Na+ + OH–
Given,
Concentration (C) = 5 (for both Na+ and OH– ions)
For NaOH,
Z= 1 for Na+
Z =-1 for OH–We know that Ionic strength I can be calculated using,
= 10 / 2 = 5
Thus the Ionic strength of the given solution is 5
Example 2: Calculate the ionic strength of a CaCl2 solution with a concentration of 2 mol/kg.
Answer:
CaCl2 ——> Ca+2 + Cl–
Given,
C = 2 for both the ions,
Z = +2 for Ca+2 ions
Z = -1 for Cl– ions
Using ionic strength formula,
I =10 / 2 = 5
Thus, the Ionic strength of the solution is 5.
Example 3: Calculate the concentration of the solution of KCl if the ionic strength of the solution is 20 mol/L.
Answer:
KCl ——-> K+ + Cl–
Given, I = 20,
Z = +1 for K+
Z= -1 for Cl–
Using ionic strength formula,
20 = 2C / 2
20 = C
Thus the concentration of the solution of KCl is 20 moles per litre
Example 4: Compare the ionic strength of 6 mol/l of K2SO4 solution and 10 mol/l solutions of NaCl.
Answer:
For K2SO4
Given, C = 6,
Z= +1 for K+ ions
Z= -2 for SO4-2 ions
Using ionic strength formula,
= 26 / 13 = 2
For Nacl,
Given C = 10,
Z= +1 for Na+ ions
Z = -1 for Cl- ions
Using Ionic Strength Formula,
= 20 / 2 =10
As 13>10, we can say that the
which means that the ionic strength of potassium sulphate solution is more than the sodium chloride solution in this case.
Example 5: Calculate the ionic strength of the solution containing 4N H2SO4 and 2M HCl.
Answer:
Here there are two acids dissolved in the solution. Thus the net ionic strength of the solution will be the sum of two ions.
For H2SO4
Given, C = 4N
Normality = Molarity × n-factor (n = 2 for sulphuric acid)
C = 2M
=5
For HCl
Given, C = 2M
=2
Thus net ionic strength is calculated as,
FAQs on Ionic Strength
Question 1: What is ionic strength?
Answer:
The concentration or quantity of the ions in a particular solution is termed as ionic strength of that solution. Ionic strength of an ionic compound can only be measured in the solution form and we know that an ionic compound dissociates into positive and negative ions in the water.
Question 2: What are the SI units of ionic strength?
Answer:
The SI unit of ionic strength is Moles per litre or Moles per kg depending upon the units taken for the concentration of the ions
Question 3: What are the properties of ionic strength?
Answer:
Properties of ionic strength are,
- Higher the concentration of the ionic compound or electrolyte in the solution, higher is the dissociation constant of the solution.
- Higher the ionic strength, higher is the electrical conductivity of the solution.
Question 4: Why do seawater and saltwater have negligible ionic strength?
Answer:
Saltwater and seawater have negligible ionic strength because of the presence of other dissolved salts in the solution which reduces the ionic strength of the solution
Question 5: What is the importance of ionic strength?
Answer:
Importance of Ionic Strength are as follows,
- It is very important in Debye Huckle theory. The deviations of the ionic strength if a solution from the ideal solution is clearly explained by the Debye Huckle theory.
- Double layer theory, electroacoustic and electrokinetic phenomena are also explained with the help of ionic strength.
Last Updated :
23 Feb, 2023
Like Article
Save Article
Ионная сила раствора
Ульяна Власова
Эксперт по предмету «Химия»
Задать вопрос автору статьи
Понятие ионной силы и формула ее расчета
Определение 1
Ионная сила раствора (I) – это мера интенсивности электрического поля, создаваемого ионами в растворе.
Ионная сила представляет собой полусумму произведений концентрации каждого иона на квадрат его заряда.
$mathrm {I = frac {1}{2} sumlimits_{i=1}^n С_iZ_i^{2}}$
Здесь:
- $mathrm {С_i}$ – концентрация ионов,
- $mathrm {Z_i}$ – заряд ионов
Закон ионной силы и коэффициент активности иона
Опытным путём был установлен закон ионной силы Льюиса и Рендела. Он заключается в том, что коэффициент активности электролита, а следовательно, и коэффициенты активности его ионов зависят от ионной силы, но не зависят от вида остальных ионов в данном растворе.
Сдай на права пока
учишься в ВУЗе
Вся теория в удобном приложении. Выбери инструктора и начни заниматься!
Получить скидку 3 000 ₽
То есть ионная сила определяет коэффициент активности иона $mathrm {gamma_i}$. Пользуются средним коэффициентом активности, так как величину активности индивидуального иона определить невозможно.
$mathrm {gamma_{pm}^{m+n} = gamma_A^{m} cdot gamma_B^{n}}$
Рассмотрим некоторые эмпирические уравнения для расчета коэффициентов активности:
-
Закон Дебая-Хюккеля:
$mathrm {lggamma_i = -0,5Z_i^{2}sqrt{I}}$ при $mathrm {I leq 0,01 ммоль/л}$
-
Расширенное уравнение Дебая-Хюккеля:
$mathrm {lggamma_i = – frac {0,5Z_i^{2}sqrt{I}}{1+sqrt{I}}}$ при $mathrm {I leq 0,1 ммоль/л}$
-
Уравнение Дэвиса:
$mathrm {lggamma_i = – frac {0,5Z_i^{2}sqrt{I}}{1+sqrt{I}} + 0,1Z_i^{2}I}$
Находи статьи и создавай свой список литературы по ГОСТу
Поиск по теме
Дата последнего обновления статьи: 14.09.2022



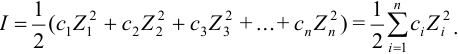
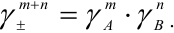
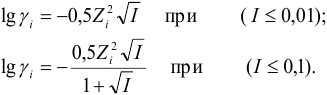
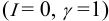 .
.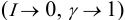 .
.