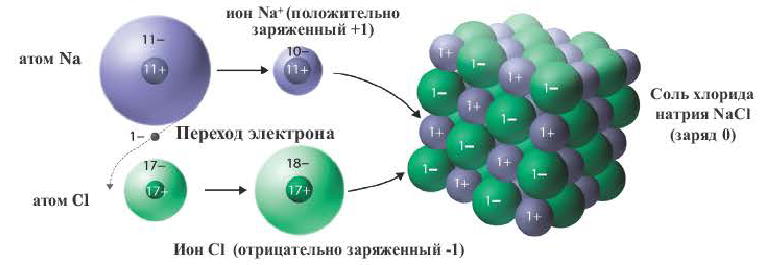
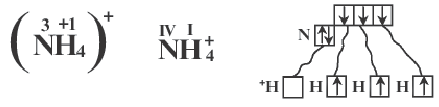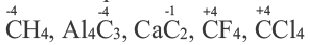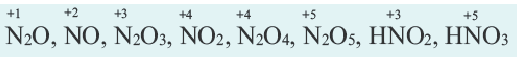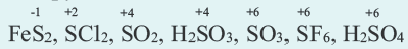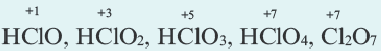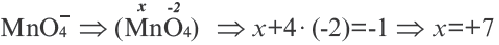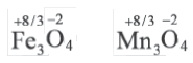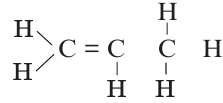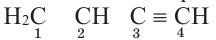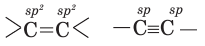Представим, что встретились два атома: атом щелочного металла и атом галогена. У атома металла на внешнем энергетическом уровне — единственный электрон, а атому неметалла как раз не хватает одного электрона, чтобы завершить свой внешний уровень.
Атом металла легко отдаст свой слабо связанный с ядром валентный электрон атому неметалла, который предоставит ему свободное место на внешнем энергетическом уровне. Оба в результате получат заполненные внешние уровни.
Атом металла при этом приобретёт положительный заряд, а атом галогена превратится в отрицательно заряженную частицу. Такие частицы называются ионами.
Ионы — заряженные частицы, в которые превращаются атомы в результате отдачи или принятия электронов.
Образовавшиеся разноимённо заряженные ионы притягиваются друг к другу, и возникает химическая связь, которая называется ионной.
Ионная связь — связь между положительно и отрицательно заряженными ионами.
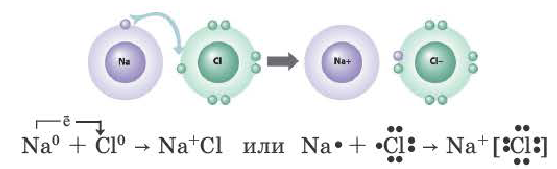
Рассмотрим механизм образования ионной связи на примере взаимодействия натрия и хлора.
Na0+Cl0→Na++Cl−→Na+Cl−
Такое превращение атомов в ионы происходит всегда при взаимодействии атомов типичных металлов и типичных неметаллов, электроотрицательности которых резко различаются.
Ионная связь образуется в сложных веществах, состоящих из атомов металлов и неметаллов.
Рассмотрим другие примеры образования ионной связи.
Пример:
Взаимодействие кальция и фтора
1. Кальций — элемент главной подгруппы второй группы. Ему легче отдать два внешних электрона, чем принять недостающие.
2. Фтор — элемент главной подгруппы седьмой группы. Ему легче принять один электрон, чем отдать семь.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2). Определим число атомов фтора, которые примут два электрона от атома кальция: (2) (:) (1) (=) (2).
4. Составим схему образования ионной связи:
Пример:
Взаимодействие натрия и кислорода
1. Натрий — элемент главной подгруппы первой группы. Он легко отдаёт один внешний электрон.
2. Кислород — элемент главной подгруппы шестой группы. Ему легче принять два электрона, чем отдать шесть.
3. Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно (2) (:) (1) (=) (2). Определим число атомов натрия, которые отдадут два электрона атому кислорода: (2).
4. Составим схему образования ионной связи:
С помощью ионной связи образуются также соединения, в которых имеются сложные ионы:
.
Значит, ионная связь существует также в солях и основаниях.
Обрати внимание!
Соли аммония
NH4NO3,NH4Cl,NH4SO42
не содержат металла, но образованы ионной связью.
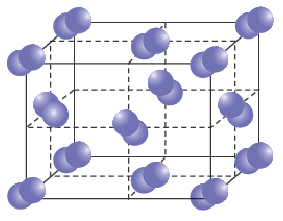
Ионы создают вокруг себя электрическое поле, действующее во всех направлениях. Поэтому каждый ион окружён ионами противоположного знака. Такое соединение представляет собой огромную группу положительных и отрицательных частиц, расположенных в определённом порядке.
Рис. (1). Ионный кристалл
Притяжение между ионами довольно сильное, поэтому ионные вещества имеют высокие температуры кипения и плавления.
Обрати внимание!
Все ионные соединения при обычных условиях — твёрдые вещества.
Примеры веществ с ионной связью:
|
|
|
 |
|
Рис. (2). Питьевая сода |
Рис. (3). Железный купорос |
Рис. (4). Поваренная соль |
Источники:
Рис. 1. Ионный кристалл https://upload.wikimedia.org/wikipedia/commons/e/eb/Sodium_chloride_crystal.png
Рис. 2. Питьевая сода https://pixabay.com/images/id-768950/ 8.06.2021
Рис. 3. Железный купорос https://upload.wikimedia.org/wikipedia/commons/thumb/a/ab/Iron%28II%29-sulfate-heptahydrate-sample.jpg/1280px-Iron%28II%29-sulfate-heptahydrate-sample.jpg
Рис. 4. Поваренная соль https://upload.wikimedia.org/wikipedia/commons/9/93/Chlorid_sodn%C3%BD.JPG
Прежде,
чем узнать, что такое ионная связь и как она образуется, побываем в одной
удивительной стране.
Народ
этой страны был беден, но беспечен. Хотя в карманах у большинства из них не
было ни одной свободной монеты (а «валюта» в этой стране называлась электронами),
никто не горевал по этому поводу. Напротив, если у них заводился хоть один
лишний электрон, то характер их портился, они становились агрессивными и даже
опасными, потому скорее хотели от него избавиться, чтобы стать опять добрыми и
веселыми.
Надо
сказать, что «высшая знать» этой страны отличалась от простых граждан своей
скупостью. Свою «электронную валюту» они неохотно одалживали, и, наоборот, при
малейшей возможности стремились забрать еще.
Давайте
теперь разберёмся, кто же такие были «простые жители», а кем бала «знать».
Речь
в истории шла об элементах металлах и неметаллах. Разберёмся почему.
У
атомов металлов на внешнем уровне всегда мало
электронов (от одного до трех), естественно, что им легче отдать
электроны для завершения энергетического уровня, а для неметаллов, у
которых более трех электронов, легче присоединить электроны для
завершения энергетического уровня.
Главной
характеристикой атома является заряд его ядра, от которого зависит и радиус
атома. Чтобы определить число электронов на внешнем уровне достаточно знать
номер группы.
Теперь,
составим логическую цепочку: радиус атома зависит от заряда ядра, числа
электронов на внешнем уровне, числа электронных слоев.
Рассмотрим,
как изменяются металлические и неметаллические свойства по периодам и
группам периодической системы.
В
периодах слева направо увеличивается заряд ядра, радиус
атома постепенно уменьшается, увеличивается число электронов на внешнем уровне,
которые сильнее притягиваются к положительно заряженному ядру, и атомам
становится легче присоединить электроны до завершения уровня, чем отдать их,
поэтому металлические свойства ослабевают, а увеличиваются неметаллические.
В
Периодической таблице каждый период начинается металлом IA
группы
(это типичные металлы) и заканчивается неметаллом, в VIIA
группе
уже находятся типичные неметаллы.
В
пределах одной группы главной подгруппы, сверху вниз
увеличивается заряд ядра атома, увеличиваются радиусы атомов, число электронов
на внешнем уровне остается постоянным, но увеличивается число энергетических
уровней, и электроны будут удаляться от ядра, поэтому атомам их легче отдать,
чем присоединить до завершения внешнего уровня, следовательно, металлические
свойства будут увеличиваться, а неметаллические ослабевать. Поэтому атомы
элементов, расположенные внизу в пределах одной группы, будут проявлять более
металлические свойства, нежели которые находятся вверху.
Элементы
VIIIА группы
называют благородными или инертными газами. У всех этих атомов завершен
энергетический уровень, для любого атома – это устойчивое состояние.
Поэтому они не отдают и не присоединяют электроны. Они практически не
соединяются с другими атомами и друг с другом, т.е. они инертны.
Представьте
себе, встречается элемент IA
группы, у которого 1 электрон, и элемент VIIA
группы, у которого 7 электронов. Пусть это будут Na
и Cl. У натрия один
единственный электрон, а хлору как раз не хватает одного электрона для
завершения внешнего уровня. Если натрий отдаст свой электрон, то он
приобретет положительный заряд, а когда атом хлора заберет этот
электрон, он превратится в отрицательно заряженную частицу. Эти заряженные
частицы, называются ионами. Из курса физики известно, что разноименные
заряды притягиваются, поэтому ион натрия и хлора соединятся и между
ними возникнет химическая связь. Эта связь и будет называться ионной.
В результате этого взаимодействия образуется ионное соединение. Для
выражения этих ионных соединений пользуются формульными единицами, т.е.
говорят не молекула NaCl, а формульная
единица NaCl.
Ионная
связь образуется между типичным металлом и типичным неметаллом.
Схема
образования ионной связи между атомами кальция и хлора
Кальций
расположен во IIA группе, значит, на
внешнем энергетическом уровне у него два электрона, которые легче отдать, чем
присоединить шесть до завершения энергетического уровня. После чего он
становится положительным ионом.
Са0
– 2ē → Са2+
Атому
хлора, у которого на внешнем уровне 7 электронов, легче присоединить 1 электрон
до завершения уровня, чем отдать 7 электронов. После присоединения 1 электрона,
атом хлора становится отрицательным ионом.
Cl0
+ 1ē → Cl–
Найдём
наименьшее общее кратное между образовавшимися ионами. Оно равно двум.
Следовательно, нужно взять 1 атом кальция и 2 атома хлора. Это схематично можно
показать так:
Ca0
+ 2Cl0
→ Ca2+Cl2–.
Цифра
2, стоящая перед атомом хлора, называется коэффициентом. Коэффициент
обычно показывает число атомов, молекул или формульных единиц, а цифра 2
после иона хлора, называется индексом. Индекс показывает число атомов
в молекуле или ионов в формульной единице.
Возвращаясь
истории, нетрудно догадаться теперь, почему «простыми» жителями были металлы, а
«знатью» неметаллы.
Как определять ионную связь?
Ксения Б.
19 октября 2018 · 14,5 K
ОтветитьУточнить
Анастасия BonneFee2,1 K
Препод-IT-шник. · 27 янв 2019
Ионная связь – это связь катиона и аниона.
Популярные катионы:
- металлы (Na, Fe, Ca и еще половина таблицы Менделеева)
- H
- NH4
Анионами являются обычно неметалические элементы и их комбинации:
Сl, OH, CO2, …..
Итого, если вы видите соединение, где есть катион + анион, то это соединение с ионной связью.
Примеры таких соединений:
NaSO4, HCl, Ca(OH)2
4,0 K
Комментировать ответ…Комментировать…
Вы знаете ответ на этот вопрос?
Поделитесь своим опытом и знаниями
Войти и ответить на вопрос
скрыт(Почему?)
Содержание:
Ионная связь:
Ионы образуются в результате отдачи или присоединения электронов атомами. Атомы, отдающие свои валентные электроны, превращаются в положительно заряженные ионы, а атомы, принимающие эти электроны в отрицательно заряженные ионы. Ионы это заряженные частицы. Положительно заряженные ионы называются катионами, а отрицательно заряженные ионы анионами. Катионы в основном образуются от металлов и ионов аммония. Неметаллы в одиночку не образуют катионов (кроме H+). Из курса физики известно, что положительно и отрицательно заряженные ионы взаимно притягивают друг друга. Следовательно, между положительно и отрицательно заряженными ионами существуют взаимные силы притяжения.
Химическая связь, образованная между ионами в результате действия электростатических сил притяжения, называется ионной связью. Полученное при этом соединение носит название ионного или гетерополярного соединения. Ионная связь образуется между металлами и неметаллами, т.е. между атомами элементов с резко отличающимися электроотрицательностями. Самая сильная ионная связь возникает в солях кислородсодержащих и бескислородных кислот (например, между металлами (щелочные и щелочноземельные металлы) и галогенами), в основаниях. Следовательно, молекула хлорида натрия состоит из ионов натрия (Na+) и хлорид-ионов (Cl).
Свойства ионной связи
Ионной связи присущ целый ряд характерных свойств:
- В соединениях с ионной связью кристаллы состоят не из молекул, а из множества ионов с противоположными зарядами.
- В обычных условиях бывают в твердом состоянии, не проводят электрический ток.
- Расплавы и водные растворы ионных соединений проводят электрический ток.
- Соединения с ионной связью хорошо растворяются в полярных растворителях, легко вступают в химические реакции.
В солях, образованных щелочными металлами с одинаковыми галогенами, по мере возрастания порядкового номера металла, ионная связь усиливается, что объясняется активностью металла (например, в ряду LiF, NaF, K.F, RbF, CsF ). В различных галогенидах одних и тех же металлов по мере возрастания порядкового номера галогена, ионная связь ослабляется (например, NaF, NaCl, NaBr, NaI). Это объясняется ослаблением окислительных способностей (неметаллических свойств) галогена. В солях аммония также между ионом аммония (NH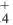
В соединениях с ионной связью число ионных связей равно произведению числа катионов на валентность.
В солях, в составе которых содержится кислород и ион аммония, в том числе и в основаниях, имеются как ионная, так и полярная ковалентная связи.
В основаниях число полярных ковалентных связей равно числу гидроксильных групп.
В нормальных солях число полярных ковалентных связей равно произведению валентности центрального элемента на его индекс. В кислых же солях число полярных ковалентных связей равно произведению суммы валентности центрального элемента и количества H на индекс кислотного остатка.
Если в соединениях разница электроотрицательностей элементов больше 1,7, то это соединение с ионной связью, а если меньше 1,7, с ковалентной связью.
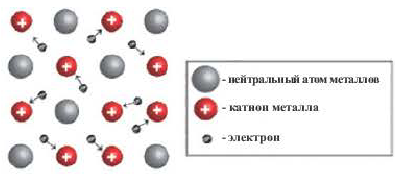
Металлическая связь
Химическая связь, образованная между положительно заряженными ионами металлов и относительно свободными электронами кристаллических решеток, называется металлической связью. Атомы металлов легко отдают свои валентные электроны и превращаются в положительно заряженные ионы. Огносительно свободные электроны, оторвавшись от атомов, движутся между положительными ионами металлов, образуя металлическую связь, те. электроны словно цементируют положительные ионы кристаллической решетки металлов.
Металлическая связь обладает целым рядом характерных свойств:
- При образовании металлической связи валентные электроны относятся не к двум атомам, а ко всему кристаллу.
- Высокая электро- и теплопроводность металлов, их плавление при высокой температуре и способность отражать свет объясняются металлической связью.
- Металлическая связь характерна для металлов и их расплавов.
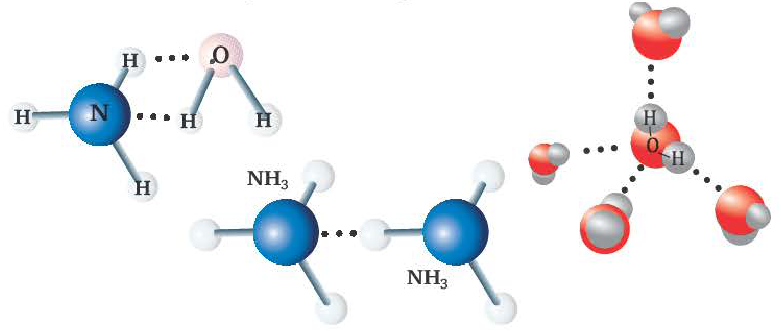
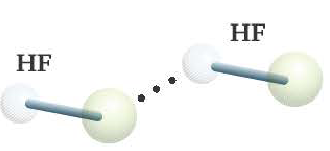
Водородная связь
Химическая связь, образованная между атомом водорода одной молекулы и атомом более сильного электроотрицательного элемента (O,N,F) другой или же аналогичной молекулы, называется водородной связью.
Характерные свойства водородной связи:
- Водородная связь обозначается 3-мя точками.
- Водородная связь в 15 20 раз слабее ковалентной связи.
- Образуется в таких веществах, как NH3, Н2O, HF, в том числе между органическими веществами, содержащими группы ОН, NH2 COOH и др.
- Водородная связь может быть как межмолекулярной, так и внутримолекулярной.
Вода, HF, спирты, водные растворы спиртов образуют межмолекулярные водородные связи. Для белков и многих органических соединений характерна внутримолекулярная водородная связь.
Радиус атома водорода очень маленький и при перемещении или отдаче своего единственного электрона другому атому он становится положительно заряженным. За счет этого водород одной молекулы взаимодействует с находящимися в составе других молекул (HF, Н2О) атомами электроотрицательных элементов с частично отрицательным зарядом.
Образование водородной связи
За счет водородной связи действительная формула воды имеет следующий вид: (H2O)n
При переходе того или иного вещества, образующего водородную связь, из жидкого состояния в газообразное состояние, водородная связь разрывается, а в обратном процессе вновь восстанавливается.
Вода, находясь в твердом (лед) и жидком состояниях, образует водородную связь. При переходе же в газообразное состояние водородная связь разрывается.
При 1 и 2 превращениях водородная связь сохраняется, при третьем состоянии -разрывается, а при четвертом – восстанавливается. Увеличение объема воды при понижении температуры (т.е. объем льда бывает больше объема жидкой воды одинаковой массы, а плотность – меньше) объясняется наличием водородной связи. Эго связано с тем, что при понижении температуры происходит образование более упорядоченной структуры молекул и в результате их «упаковочная» плотность уменьшается.
Одна из причин того, что фтористая кислота является слабой кислотой, заключается в ассоциации друг с другом молекул HF посредством водородной связи. Вот почему действительная формула фтороводородной кислоты следующая: (HF)n.
Типы кристаллических решеток
Кристаллические и аморфные вещества:
При механическом раздроблении кусочка хлорида натрия или другого твердого вещества образуются кристаллы определенной формы. Такие вещества называют кристаллическими веществами. Однако существуют и такие твердые вещества (стекло, куски смолы), которые при раздроблении под действием удара образуют осколки неопределенной формы. Такие вещества называют аморфными, т.е. бесформенными веществами.
Частицы (атомы, ионы и т.д.) твердых веществ, располагаясь в строгом порядке, образуют различного типа кристаллические решетки. Точки, в которых размещены частицы, называются узлами кристаллической решетки.
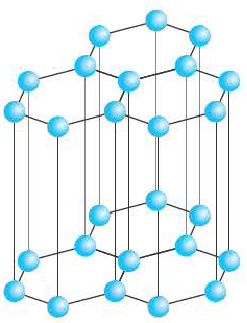
В графите атомы углерода на одной плоскости расположены близко друг к другу, а на разных плоскостях на отдаленном расстоянии друг от друга. Расположение атомов углерода, находящихся на разных плоскостях, в отдалении друг от друга приводит к расслоению графита на чешуйки. Свидетельством тому являются оставленные карандашом следы на бумаге (чешуйки графита).
В зависимости от вида частиц, расположенных в узлах кристаллической решетки, и характера связи между ними, различают четыре типа кристаллической решетки.
В отличие от кристаллических веществ, в аморфных веществах частицы расположены не в такой закономерности, а неупорядоченно.
 |
Профессор Худу Мамедов (1927 1988) являлся член корреспондентом НАНА, доктором геолого минералогических наук, почетным членом Коралевской Академии Великобритании. Его основные научные труды от носятся к области ристаллохимии. Исследовал молекулярное и кристаллическое строения более 50 ти органических комплексных соединений слигандами. |
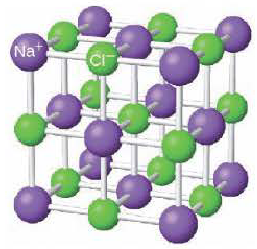
Ионная кристаллическая решетка. Кристаллические решетки, в узлах которых содержатся соединенные ионными связями положительно и отрицательно заряженные ионы, называются ионными кристаллическими решетками. Ионные кристаллические решетки характерны для оксидов металлов, оснований и солей: NaCl, KCl, NaBr, KBr, N2CO3, Na2SO4, Fe2O3, Ca(OH)2 и др.
Строение кристаллической решетки поваренной соли
Строение кристаллической решетки графита
Из-за сильного притяжения между ионами веществ с ионной кристаллической решеткой, эти вещества отличаются относительной тугоплавкостью, малой летучестью и определенной твёрдостью.
Атомные кристаллические решетки
Кристаллические решетки, в узлах которых содержатся отдельные атомы, связанные друг с другом ковалентной связью, называются атомными кристаллическими решетками.
В атомных кристаллических решетках атомы, как и ионы, располагаются в пространстве в различных положениях, образуя в результате различной формы кристаллы. Например, в узлах кристаллической решетки как алмаза, так и графита содержатся атомы углерода. Однако вследствие их различного расположения, кристаллы алмаза обладают формой тетраэдра, а кристаллы графита слоистой формой.
| Аллотропические видоизменения углерода | Состояния гибридизации углерода | Xимический cocтав | Тип кристаллической решетки | Cтроение кристаллической решетки |
| Алмаз | sp3 | Одинаковый (C) | Атомный | тетраэдрическое |
| Графит | sp2 | слоистое | ||
| Карбин | sp | линейное |
Хотя тип кристаллической решетки аллотропических видоизменений углерода и одинаковый, однако у них различное строение. Примерами веществ, образующих атомную кристаллическую решетку, являются В, С, Si, SiC (карборунд), SiO2, красный и черный фосфор.
Так как в атомных кристаллических решетках этих веществ ковалентные связи между атомами обладают прочностью, для них характерны большая твердость и высокая температура плавления.
Хотя SiC и SiOi обладают атомной кристаллической решеткой, связь между их атомами образована посредством полярной ковалентной связи.
Молекулярная кристаллическая решетка
Кристаллические решетки, в узлах которых содержатся полярные и неполярные молекулы, связанные между собой межмолекулярными силами, называются молекулярными кристаллическими решетками. Молекулярные вещества образуют кристаллические решетки молекулярного типа.
Строение кристаллической решетки йода
Вещества, находящиеся при комнатной температуре в твердом состоянии и образованные только посредством ковалентной связи, в обычных условиях имеют молекулярную кристаллическую решетку, а газообразные, жидкие вещества образуют молекулярную кристаллическую решетку лишь в определенных условиях. В качестве примера веществ с молекулярными кристаллическими решетками в обычных условиях можно привести белый фосфор (Р4), кристаллическую серу (S8), Н3РО4, иод (I2), НРО3, Р2О5, глюкозу (C6H12O6), сахарозу (C12H22O11) и др.
В молекулярных кристаллических решетках веществ с неполярными ковалентными связями (H2, N2, О2, О3, F2, Сl2, Вr2, l2, Р4, S8) связи между молекулами создаются лишь слабыми межмолекулярными силами. В веществах с неполярной ковалентной связью межмолекулярное притяжение слабое. Вследствие этого они обладают очень низкой температурой плавления.
В кристаллических решетках веществ с полярной ковалентной связью (кроме SiC и SiO2) действуют межмолекулярные и электростатические силы притяжения. Значит, только вещества, образованные посредством полярной ковалентной и неполярной ковалентной связи, создают молекулярную кристаллическую решетку. Например, H2O, HCl, HBr, HI, CO2, HNO3, H2SO4, большинство органических веществ и др.
Металлические кристаллические решетки
Кристаллические решетки, в узлах которых содержатся отдельные атомы или ионы металлов, связанные общими электронами, называются металлическими кристаллическими решетками. Большинство металлов (Na, Ca, Fe, Al, Cu и др.), а также расплавов, образуют металлические кристаллические решетки.
Многие свойства металлов электрическая проводимость, теплопроводность, ковкость и др. объясняются свободным движением электронов, образующих металлическую связь.
Некоторые физические свойства веществ зависят от типов кристаллических решеток. В этой связи существует такая закономерность: при известном строении веществ можно заранее предсказать их свойства, и наоборот, если известны свойства веществ, то можно определить их строение.
Вещества, обладающие молекулярной кристаллической решеткой, называются молекулярными (состоят из молекул), а обладающие ионной, атомной и металлической кристаллическими решетками немолекулярными (состоят из атомов или ионов) веществами.
Валентность
Валентность элементов относится к основным понятиям химии.
Валентность — это свойство атомов элементов присоединять или замещать определенное число атомов других элементов. Понятие валентности было введено в науку в 1852 году Эдуардом Франклендом.
Данное определение валентности носит несколько формальный характер, так как не дает представления о природе, свойствах вещества. C развитием учения о химической связи содержание понятия «валентность» в настоящее время обычно выражается так:
Валентность это свойство атомов элементов создавать определенное число ковалентных химических связей.
Валентность определяется числам ковалентных связей, посредством которых в соединениях один атом связывается с другими атомами.
Согласно представлениям о ковалентной связи, независимо от способа образования общих электронных пар, валентность определяется числом общих электронных пар, связывающих атомы в молекуле.
Как вам известно, числовое значение валентности связано с положением элемента в периодической системе химических элементов Д.И.Менделеева. Высшая валентность элемента по числовому значению равна номеру его группы в периодической системе. Некоторые элементы не подчиняются этой закономерности (например, N, О, F). Это связано с тем, что из-за отсутствия в их атомах незаполненных орбиталей, они не могут возбуждаться. Максимальная валентность в соответствующем соединении того или иного элемента определяется числом орбиталей, участвующих в образовании связей в его атоме.
Образование связи в соответствии с валентностью элемента
В образовании иона аммония (NH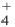
Степень окисления
Степень окисления это условный заряд, который приходится на долю каждого атома в молекуле. Степень окисления может принимать отрицательные, нулевые, положительные и дробные значения. Значение степени окисления определяется числом электронов, отданных атому другого элемента или полученных от атома данного элемента.
| Элементы | Степень окисления, проявляемая в соединениях |
| Li, Na, К, Rb, Cs | + 1 |
| Be, Mg, Ca, Sr, Ba, Ra, Zn | +2 |
| Al | +3 |
| F | -1 |
Для определения степени окисления каждого элемента в соединениях используются нижеприведенные данные. В таблице даны элементы с постоянной степенью окисления в соединениях.
Степень окисления у других элементов бывает переменной.
Степень окисления водорода в его соединениях с металлами и кремнием равна 1 (например: ВН3, SiH4, NaH, CaH2 и др.), а во всех других соединениях+1.
Вот почему в периодической таблице водород записан как в подгруппе 1А, так и в подгруппе VIIA.
Степень окисления кислорода в пероксидах равна 1 (H2O2, Na2O2, CaO2 и др), в супероксидах 1 /2 (КО2), фтористых соединениях (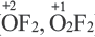
Углерод в своих соединениях проявляет степень окисления -4 ÷ +4.
Степень окисления азота в его соединениях с металлами (например, в нитридах Na3N, AIN, Ca3N2 и др.), аммиаке (NH3) равна -3, а в кислородсодержащих соединениях от +1 ÷ +5.
Степень окисления фосфора в его соединениях с металлами, фосфидах (Na3P, K3P, Ca3P2, AlP и др.), фосфине (PH3) равна -3, а в других соединениях +3 и +5 (P2S3, P2O3, P2O5, PCl5, HPO3, H3PO3, H3PO4 и др.).
Степень окисления серы в сульфидах равна -2 (H2S, Na2S, FeS, P2S3, P2S5, CS2, и др.), а в других соединениях -1 ÷ +6 .
Из галогенов хлор, бром и йод только в соединениях с металлами проявляют степень окисления 1, а в кислородсодержащих соединениях +l÷+-7.
Степень окисления элементов в простых веществах всегда равна нулю.
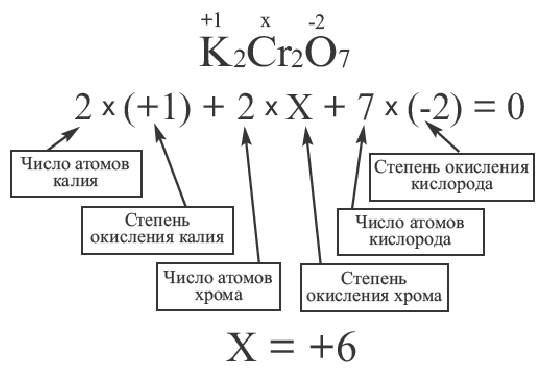
Алгебраическая сумма значений степени окисления элементов в сложных веществах всегда равна нулю. Следуя этому правилу, можно легко вычислить степень окисления любого химического элемента, если известны степень окисления других химических элементов в соединении. Неизвестная степень окисления элемента всегда принимается за х.
В сложных ионах алгебраическая сумма степеней окисления элементов равна заряду иона. Неизвестная степень окисления элемента в сложном ионе принимается за х. Записав в скобках формулу иона, за скобками (справа сверху) отмечают его заряд.
У большинства элементов самая высокая степень окисления соответствует номеру группы, в которой данный элемент размещается (кроме F, О, Fe, Си, Ag, Au). Самая низкая степень окисления любого неметалла (кроме H и В) определяется путем вычитания числа 8 от номера группы, где он расположен.
| Группа | VI | VII | V | IV |
| Элемент | S | Cl | N | C |
| Самая низкая степень окисления | 6 8=-2 | 7 8=-1 | 5 8=-3 | 4 8=-4 |
Металлы никогда не проявляют отрицательной степени окисления. Самая низкая степень окисления у них равна нулю.
В большинстве случаев степень окисления элемента по своему численному значению совпадает с его валентностью. Но такое бывает не всегда. Например: углерод трехвалентный только в угарном газе (СО), во всех остальных соединениях он четырехвалентный. Кислород трехвалентный только в ионе гидроксония (Н3О+) и угарном газе, во всех остальных соединениях он двухвалентный. В таких соединениях, как Аl4С3, CO2, CCl4, CF4, CS2, численные значения степени окисления и валентности у углерода совпадают.
При определении степени окисления посредством общего баланса отданных и полученных электронов ее среднее значение иногда может быть выражено дробным числом.
При разных степенях окисления атомов одного элемента в соединении степени окисления выражаются дробными числами. Среднее значение вычисляется способом электронного баланса.
Значение степени окисления, в отличие от заряда иона, проставляется над химическим знаком элемента (вначале ставится знак заряда, а затем число).
| Степень окисления | +2 Fe |
+3 Fe |
-2 S |
+6 S |
| Заряд иона | Fe2+ | Fe3+ | S2- | S6+ |
Пример №1
Сколько процентов от числа валентных электронов азота (7N 2s22p3) создают связь по механизму обмена?
Решение: В атоме азота из 5-ти валентных электронов 3 одиночные.
Значит, (3/5) ∙ 100%=60% участвуют в механизме обмена.
Каждая электронная пара, образующая химическую связь, обозначается по одной валентной линии, формулы молекул изображаются графически.
Пример №2
Определите отношения между а, b, с.
| Соли | Число донорно-акцепторных связен |
| (NH4)2SO4 | а |
| NH4Cl | b |
| (NH4)3PO4 | c |
Решение: Число донорноакцепторных связей в солях аммония равно числу ионов аммония.
Тогда: a=2; b=l; с=3
Ответ: b
Пример №3
Определите количество а) полярных ковалентных и b) неполярных ковалентных связей в молекуле соединения:
Решение: Полярная ковалентная связь образуется между атомами двух разных неметаллов. В таком случае, в данном соединении N(пол.ков.связь) N(C Н)связь N(H) 6
А неполярная ковалентная связь образуется между атомами одного вида (в представленном соединении это линии между атомами углерода). Тогда N(κeпoл.ков.связь.) = 3
Ответ: а=6; b=3
Пример №4
Определите общее число орбиталей, участвующих в образовании химических связей в соединении Н3С CH2 СН3.
Решение: Кроме угарного газа (СО), во всех соединениях углерода все 4 орбитали внешнего электронного слоя участвуют в образовании связи. Поскольку атом H имеет 1 орбиталь, его орбиталь тоже участвует в образовании связи. В таком случае, общее число орбиталей, участвующих в образовании связи: N(оpб.)o6щ. N(C) • 4 + N(H) 3•4 + 8 20
Пример №5
Определите в данном соединении гибридное состояние углерода.
Решение:
- Химические реакции
- Теория электролитической диссоциации
- Электролиты и неэлектролиты в химии
- Металлы в химии
- Периодический закон Д. И. Менделеева
- Химические связи
- Ковалентная связь
- Валентность и степень окисления